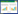2. 浙江大学医学院附属儿童医院PICU, 杭州 310056
中毒性休克综合征(toxic shock syndrome, TSS)是一种革兰阳性菌感染导致多系统受累、危及生命的危重症,属于脓毒症的特殊类型[1],1978年被首次报道[2]。主要由金黄色葡萄球菌和A组化脓性链球菌(Group A Streptococcal, GAS)感染后产生的外毒素超抗原(Superantigen, SAg)引起的[3]。其他病原包括B、C和G组链球菌,表皮葡萄球菌,假结核耶尔森菌,索氏梭菌等也有病例报道[4]。据报道[5],金葡菌TSS的年发病率约为0.5/10万,病死率为5%~22%,链球菌TSS的年发病率约为0.4/10万,病死率为30%~70%,大部分死亡发生在发病后72 h内,脏器功能支持和替代是TSS救治成功的关键。国内缺少统计学数据,对该疾病也少有报道,现就体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)联合连续性血液净化(continuous blood purification, CBP)成功救治链球菌TSS 1例报道如下。
1 病例资料患儿女,2岁10月,因“咳嗽1周,发热4 d,皮疹伴抽搐2 d”入浙大儿童医院PICU。患儿1周前无明显诱因下出现咳嗽,起初不剧烈,后渐加重,阵发性连声咳,有痰,4 d前出现发热,体温最高40℃,布洛芬口服可退热,体温波动在38~40℃之间,2 d前就诊当地医院,诊断“支气管炎”先后予“阿奇霉素3 d、甲泼尼龙2 d、舒普深1 d静滴”,仍持续高热不退,并出现抽搐1次,抽搐时神志不清、双眼上翻、口唇发绀、四肢僵直抖动,持续约2 min左右,“鲁米那”肌注后未反复,但神志一直不清,抽搐后患儿胸前有密集分布的针尖大小红色皮疹,1 d前出现气促,尿量减少,皮疹加重蔓延至全身。今因病情危重,由120转运至浙江大学医学院附属儿童医院。入急诊室时,呼吸35次/min、血压75/38 mmHg(1 mmHg=0.133 kPa),心率200次/min,四肢冷,毛细血管再灌注时间(capillary reperfusion time, CRT)大于3 s,面罩吸氧下氧饱和度96%,予生理盐水20 mL/kg扩容后血压仍低,加肾上腺素针0.1 µg/(min·kg)静脉持续泵注,诊断脓毒性休克,收PICU住院。既往史、个人史、家族史: 无。
体格检查:体温38.8℃,心率205次/min,呼吸频率32次/min,血压77/39 mmHg,体重14 kg,身高90 cm,面罩吸氧下SPO2 95%,格拉斯哥昏迷评分(Glasgow coma scale, GCS)9分,咽充血,眼结膜充血,有杨梅舌,扁桃体Ⅰ°肿大,未见脓性分泌物,三凹征明显,双肺可闻及湿罗音,左侧呼吸音偏低,心音稍偏低,心律齐,腹部稍膨隆,无肌紧张,肝肋下2 cm、剑突下1 cm,质地中,脾肋下未及,头颈无抵抗,布氏征、克氏征、巴氏征阴性,肌张力正常,颈部淋巴结未见肿大,全身可见密集分布的粟粒样红色丘疹(图 1),直径1~2 mm左右,互不融合,压之褪色,无皮肤破溃糜烂,肢端凉,CRT 4 s。
|
| 图 1 患儿全身可见密集分布的粟粒样红色丘疹 |
|
|
辅助检查:当地医院检查血常规:白细胞计数9.8×109/L,中性粒细胞百分比67.4%,血小板计数234×109/L,血红蛋白112 g/L,C反应蛋白(C-reactive protein, CRP)3.55 mg/L。降钙素原(procaicitonin, PCT):39.67 ng/mL。心肌损伤标志物:氨基末端脑利钠肽前体 > 35 000 pg/mL,余正常。生化:肝肾功能正常。入院时血常规:基本同前,但炎症指标明显增高:CRP 173.3 mg/L,PCT > 1 000 ng/mL,肝素结合蛋白:> 300 µg/L,细胞因子:IL-6 22 811.8 pg/mL,IL-10 14 953.3 pg/mL,IFN-γ 251.1 pg/mL。血沉67 mm/h。生化:肌酐138 µmol/L,铁蛋白1 438.9 µg/L。血气分析:pH 7.351,PaO2 105 mmHg,PaCO2 34.3 mmHg,Na+ 125 mmol/L,K+ 4.5 mmol/L,乳酸3.1 mmol/L,HCO3- 18.5 mmol/L,葡萄糖2.8 mmol/L。胸水常规:颜色血性,浑浊,李凡他实验+,有核细胞计数3 355×106/L,多核比例96%,红细胞计数15 000×106/L。胸水生化:总蛋白34.9 g/L,腺苷脱氨酶140.9 U/L,乳酸脱氢酶10 780 U/L,葡萄糖1 mmol/L。脑脊液常规、生化、培养无特殊。气道分泌物抗原检测:新冠病毒阳性,偏肺病毒阳性。胸部CT:双肺多发感染性病变,左肺为主,左侧胸腔积液伴左肺部分膨胀不全。头颅CT:未见明显异常。
入院后治疗过程:入院时中心静脉压6 cmH2O(1 cmH2O=0.098 kPa),床边超声下腔静脉变异率55%,无创心排量指数1.8 L/(min·m2),外周血管阻力2 360 s/(cm2·m2),予以美罗培南加利奈唑胺静滴抗感染治疗;第1小时分三次予以生理盐水60 mL/kg,上调血管活性药肾上腺素针至0.3 µg/(min·kg)静脉泵注,血压仍低,加去甲肾上腺素0.2 µg/(min·kg),入院2 h左右血压和氧饱和度持续下降后,出现心跳呼吸骤停,立即予以胸外按压,气管插管人工呼吸机应用,1∶10 000肾上腺素0.1 mL/kg推注,抢救5 min后心搏恢复,有自主呼吸,呼吸机SIMV模式,FiO2 100%,PEEP 10 cmH2O,VT 6 mL/kg,MAP 15 cmH2O情况下,复查血气分析:pH 6.978,PaO2 30.2 mmHg,PaCO2 87.8 mmHg,Lac 5.7 mmol/L,HCO3- 19.5 mmol/L,BE -16 mmol/L,葡萄糖11.4 mmol/L。氧合指数(OI)50。复查血常规,血小板计数11×109/L; 凝血功能凝血酶原时间24 s、活化部分凝血活酶时间63 s、纤维蛋白原0.8 g/L、D-二聚体12 mg/L。予以输注血浆10 mL/kg。胸片提示双肺弥漫性渗出,白肺样表现。考虑急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS),上调呼吸机参数,PEEP至15 cmH2O,下调潮气量至5 mL/kg,氧饱和度85%左右,复苏成功后4 h再次复查血气,pH 7.101,PaO2 55 mmHg,PaCO2 64.3 mmHg,Na+ 135 mmol/L,K+ 4.2 mmol/L,乳酸6.7 mmol/L,BE -16 mmol/L,查床边心超提示心室收缩能力减低,心脏射血分数47%。逐步上调血管活性药肾上腺素针至0.3 µg/(min·kg)静脉泵注,去甲肾上腺素0.4 µg/(min·kg),同时加垂体后叶素,0.0001 U/(min·kg)静脉泵注,考虑TSS导致ARDS和心功能衰竭,在呼吸机及多种血管活性药物应用5 h后血压仍低,乳酸仍进行性升高,立即启用V-A ECMO,半小时后成功建立ECMO,转速3 300 r/min,流速1.4 L/min[6]。复查肌酐167 µmol/L,尿量0.34 mL/(kg·h),肝脏肋下4 cm,存在急性肾损伤和容量负荷过重,进行CBP,连接在ECMO管路上,采用膜后泵前的持续静脉-静脉血液滤过(CVVH)模式、置换液选择前稀释[7],血流速度100 mL/min,超滤60 mL/h。4 h后血压缓慢上升,血压87/56 mmHg,复查血气有好转,pH 7.311,PaO2 94 mmHg,PaCO2 36.7 mmHg,乳酸3.8 mmol/L,BE -8.2 mmol/L。治疗过程中予以丙种球蛋白1 g/kg和甲基强的松龙10 mg/kg静滴一次控制炎症反应。采取头部亚低温,甘露醇和浓钠泵注降颅压。
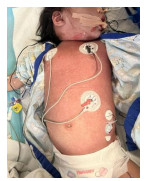
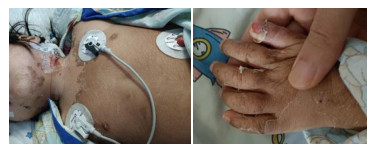
入院后19 h,血压恢复正常,心率下降至102次/min,四肢逐渐转温,CRT缩短至2 s,尿量增多至1.6 mL/(kg·h)。复查血肌酐69 µmol/L。持续ECMO联合CBP 50 h后予以撤离。入院第3天头颅CT:脑灰白质境界欠清。2 d后头颅MRI平扫:脑萎缩征象;双侧侧脑室体后部白质、双侧小脑半球异常信。床边脑电图:持续性弥漫性高幅δ活动。入院第5天GCS评分12分,皮疹有所消退,血培养提示耐克林霉素的GAS生长,单用利奈唑胺抗感染。第7天出现脱皮(图 2),以头颈和四肢为主,部分糜烂。入院第8天炎症指标明显好转,血常规: 白细胞计数11.84×109/L,中性粒细胞71%,血小板计数89×109/L,血红蛋白95 g/L,CRP 1.7 mg/L。PCT 0.435 ng/mL。细胞因子:IL-6 279.6 pg/mL,IL-10 37.9 pg/mL。新冠病毒抗体:阴性。胸水常规:颜色淡血性,有核细胞423×106/L,多核50%。生化:肝肾功能正常。心脏超声:心脏射血分数62%,无冠状动脉扩张。心肌酶谱:NT-proBNP 1 228.6 pg/mL,余正常。第10天肺部CT:肺炎伴左肺部分实变和坏死,左肺下叶多发囊腔形成,对照前片两肺实变明显改善,左侧胸腔积液较前吸收。复查凝血功能正常。转普通病房,1周后转至浙江大学医学院附属第一医院进行皮肤修复和脑康复治疗。最后诊断:中毒性休克综合征、脓毒性休克、ARDS、急性肾损伤、凝血功能障碍、脓毒性脑病、坏死性肺炎伴胸腔积液。
|
| 图 2 患儿第7天出现脱皮,以头颈和四肢为主,部分糜烂 |
|
|
TSS是主要由SAg诱导T细胞过度增殖而诱发炎症风暴,导致难治性脓毒性休克和多脏器功能障碍[8]。SAg绕过抗原提呈细胞的正常抗原加工,直接通过抗原提呈细胞上的主要组织相容性复合体Ⅱ类分子与T细胞受体连锁,刺激T细胞增殖。大量T细胞增殖产生大量的细胞因子,即细胞因子风暴。侵袭性GAS感染患儿中TSS的发病率达33%,坏死性筋膜炎中TSS的发病率约为50%,但多达45%的链球菌TSS患者中并未发现侵入部位[9]。临床表现常以高热为首发症状,约一半的患者会出现神志改变[10],约10%的患者会出现弥漫性猩红热样红斑。链球菌TSS大多在轻微创伤基础上,24~72 h发生坏死性筋膜炎。约占20%无软组织感染表现者,可表现为肺炎、心肌炎、心包炎、腹膜炎、胆囊炎、肝周围炎、盆腔炎性疾病或眼内炎[11]。几乎所有患者都会在48~72 h内发生肾功能障碍。40%~50%的病例在出现低血压前发生血清肌酐浓度升高[12]。低血压、肌红蛋白尿或血红蛋白尿(由于毒素诱导溶血)可进一步促进急性肾衰竭的发生。链球菌TSS血培养GAS阳性率约为60%[13]。诊断标准[14]:发热,皮疹(1周左右脱皮),低血压,包含至少2个器官受累。确诊:满足上述临床标准,并从无菌的部位分离出GAS。拟诊断为:满足上述标准,但未从无菌的部位分离出GAS。
该患儿以肺部炎症为首发表现,新冠病毒和偏肺病毒阳性,提示病毒是引起肺部感染的主要病原,后继发化脓性链球菌感染,出现高热、全身充血性皮疹、抽搐、难以纠正的休克及多脏器功能障碍(肾、肺、心、血液等),炎症指标明显增高,血培养GAS阳性,所以链球菌TSS诊断明确。TSS需要与川崎病休克综合征、儿童多系统炎症反应综合征(multisystem inflammatory syndrome in children, MIS-C)及巨噬细胞活化综合征(macrophage activation syndrome, MAS)进行鉴别。该患儿有发热、皮疹、球结膜充血、杨梅舌,血常规白细胞、CRP和血沉增高,后出现休克和脱皮,都符合川崎病休克综合征,但患儿炎症因子明显增高,血小板无进行性升高,心脏超声无冠状动脉扩张,基本可以排除;患儿新冠抗原阳性,炎症指标增高,血小板下降,出现多系统功能障碍,需要考虑MIS-C,但新冠病毒抗体阴性,冠状动脉无扩张,血培养GAS阳性,基本不考虑MIS-C;患儿发热,血小板、血色素下降,凝血功能异常,细胞因子增高,血清铁蛋白升高明显,纤维蛋白原下降,多器官功能障碍,需要考虑MAS,但无明显肝脾肿大,患儿经过抗炎和器官功能支持治疗可以很快改善,不支持MAS。
对于TSS的治疗原则[15]:及时使用强有力抗菌素,经验性治疗原则:万古霉素+酶复合制剂/头孢吡肟/美罗培南+克林霉素。后根据药敏进行个体化治疗:克林霉素敏感:青霉素+克林霉素。克林霉素耐药:青霉素+利奈唑胺。GAS对β-内酰胺类抗生素非常敏感,采用青霉素单药治疗时并发症发生率和病死率较高,通常需要联合应用克林霉素,克林霉素可以抑制毒素释放,减少治疗后炎症反应的发生。其他治疗包括静脉用丙种球蛋白有助于增强机体免疫,抑制T细胞增殖,抑制TNF-α和IL-6等炎症细胞因子。早期激素治疗有利于抑制炎症风暴。TSS容易出现多脏器功能障碍,脏器保护和支持非常重要。该患儿入院后予以美罗培南加利奈唑胺抗感染,后出现休克经常规扩容和血管活性药物难以纠正,乳酸进一步增高,心功能进行性下降,肺部出现弥漫性水肿,呼吸机应用下氧合难以纠正,氧合指数OI超过40,达到ECMO治疗指征,并出现血肌酐升高、液体正平衡和无尿,立即予以ECMO和CBP联合治疗[16],通过V-A ECMO来替代心肺功能,采用高流量来改善微循环,通过CBP清除炎症因子、肌酐和水分,保持内环境稳定,24 h内病情明显改善,50 h就成功撤离ECMO和CBP。患儿因细胞因子风暴,出现全身皮肤剥脱和脓毒性脑病,虽然经过药物外涂保护皮肤,头部亚低温、降颅压等治疗还是出现皮肤糜烂和脑萎缩,但后经整形美容中心皮肤修复和康复科高压氧治疗逐步好转,最终皮肤无留下疤痕,神志完全转清。
TSS是阳性菌引起的感染性休克,起病呈爆发性,进展快,大部分在发病24 h内死亡,临床上对于高热、皮疹、炎症指标明显增高,难以纠正休克并出现多器官功能障碍的患儿,要考虑TSS可能性,早识别、积极纠正休克、及时控制感染和脏器功能支持和替代是救治成功的关键。
利益冲突 所有作者声明无利益冲突
| [1] | Atchade E, De Tymowski C, Grall N, et al. Toxic shock syndrome: a literature review[J]. Antibiotics (Basel), 2024, 13(1): 96. DOI:10.3390/antibiotics13010096 |
| [2] | Findlay RF, Odom RB. Toxic shock syndrome[J]. Int J Dermatol, 1982, 21(3): 117-121. DOI:10.1111/j.1365-4362.1982.tb02052.x |
| [3] | Takia L, Lodha R. Toxic shock syndrome: a diagnostic and therapeutic challenge![J]. Indian J Pediatr, 2023, 90(4): 321-322. DOI:10.1007/s12098-023-04478-z |
| [4] | Sendi P, El Hay MA, Brandt CM, et al. Group B streptococcal toxic shock syndrome and covR/S mutations revisited[J]. Emerg Infect Dis, 2017, 23(1): 150-152. DOI:10.3201/eid2301.161063 |
| [5] | Wilkins AL, Steer AC, Smeesters PR, et al. Toxic shock syndrome–the seven Rs of management and treatment[J]. J Infect, 2017, 74: S147-S152. DOI:10.1016/S0163-4453(17)30206-2 |
| [6] | Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J]. Intensive Care Med, 2017, 43(3): 304-377. DOI:10.1007/s00134-017-4683-6 |
| [7] | Xu JL, Sun YF, Zhang WF, et al. The efficacy and safety of continuous blood purification in neonates with septic shock and acute kidney injury: a two-center retrospective study[J]. Eur J Pediatr, 2024, 183(2): 689-696. DOI:10.1007/s00431-023-05336-y |
| [8] | Hansen NS, Leth S, Nielsen LT. Toxic shock syndrome[J]. Ugeskr Laeger, 2020, 182(20): V11190673. |
| [9] | Gvozdenovic L, Pasternak J, Milovanovic S, et al. Streptococcal toxic shock syndrome[J]. Med Pregl, 2010, 63(7/8): 550-553. DOI:10.2298/mpns1008550g |
| [10] | Gottlieb M, Long B, Koyfman A. The evaluation and management of toxic shock syndrome in the emergency department: a review of the literature[J]. J Emerg Med, 2018, 54(6): 807-814. DOI:10.1016/j.jemermed.2017.12.048 |
| [11] | Polat M, Atay Ünal N, Kara Ulu N, et al. Streptococcal toxic shock syndrome following influenza A infection in two children[J]. Pediatr Infect Dis J, 2023, 42(5): e182-e183. DOI:10.1097/INF.0000000000003846 |
| [12] | Cortés-Penfield N, Ryder JH. Should linezolid replace clindamycin as the adjunctive antimicrobial of choice in group A streptococcal necrotizing soft tissue infection and toxic shock syndrome?A focused debate[J]. Clin Infect Dis, 2023, 76(2): 346-350. DOI:10.1093/cid/ciac720 |
| [13] | Bartoszko JJ, Elias Z, Rudziak P, et al. Prognostic factors for streptococcal toxic shock syndrome: systematic review and meta-analysis[J]. BMJ Open, 2022, 12(12): e063023. DOI:10.1136/bmjopen-2022-063023 |
| [14] | Gvozdenovic L, Pasternak J, Milovanovic S, et al. Streptococcal toxic shock syndrome[J]. Med Pregl, 2010, 63(7/8): 550-553. DOI:10.2298/mpns1008550g |
| [15] | Annane D, Clair B, Salomon J. Managing toxic shock syndrome with antibiotics[J]. Expert Opin Pharmacother, 2004, 5(8): 1701-1710. DOI:10.1517/14656566.5.8.1701 |
| [16] | 石玉沄, 杨子浩, 夏姗姗, 等. 体外膜肺氧合联合血液净化成功救治丙泊酚输注综合征患儿1例[J]. 中华急诊医学杂志, 2024, 6(3): 781-783. DOI:10.3760/cma.j.issn.1671-0282.2024.06.009 |
 2025, Vol. 34
2025, Vol. 34