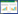2. 福州市第一总医院健康体检中心,福州 350004
2. Department of Health Examination, Fuzhou First General Hospital, Fuzhou 350004, China
术后肠梗阻(postoperative ileus,POI)是指腹部或其他手术后出现的胃肠动力障碍疾病,其典型表现为腹胀、恶心呕吐、进食不耐受及肛门排气排便延迟[1-2]。POI的发病机制比较复杂,至今尚未完全阐明,肠道炎症反应在其发生发展中起关键作用[3]。p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38MAPK)和核因子κB(nuclear factor kappa-B, NF-κB)是炎症反应中最重要的激酶之一,参与炎症反应的发生、发展并发挥调控作用。孤核受体NR4A1(nuclear receptor subfamily 4,group A-1)作为一种响应蛋白在信号传导的早期发挥作用,其通过对靶基因调控区的特异性识别和结合发挥转录调控作用,参与细胞增殖、分化及炎症应激等生理病理过程[4-5]。现有研究表明,NR4A1在炎症性肠病中通过抑制抑制NF-κB的激活和促炎细胞因子的产生发挥抗炎作用[6-7],但其在POI炎症反应中的调控机制尚未见报道。本研究以大鼠为研究对象,探讨NR4A1调控POI炎症反应的机制,为阐明POI的发病机制提供新的理论依据。
1 材料与方法 1.1 实验动物及分组24只Sprague Dawley健康雄性大鼠,8周龄,180~200 g,SPF级,购于斯贝福(北京)生物技术有限公司,饲养条件(普通饲料饲养,温度20~26℃,湿度40%~70%)。适应性喂养1周后,将大鼠随机(随机数字法)分为假手术组(sham组)、模型组(model组)、激动剂组(model+stimulator组)、拮抗剂组(model+antagonist组),每组6只。本研究已获得福建医科大学实验动物委员会批准(IACUC FJMU 2023-Y-0966)。各组大鼠年龄、体重比较,差异均无统计学意义(P > 0.05)。
1.2 实验试剂和仪器CytosporoneB、DIM-C-pPhCO2Me购自美国MedChemexpress生物科技公司,Anti NR4A1、Anti p-p65、Anti P38MAPK购自江苏Affinity公司,P38、NR4A1、Anti NF-KB p65购自武汉三鹰生物技术有限公司,Rat Monoclonal Anti-GAPDH、苏木精染液购自中杉金桥生物技术有限公司,TUNEL细胞凋亡检测试剂盒购自北京索莱宝科技有限公司,大鼠白细胞介素4(IL-4)试剂盒、白细胞介素6(IL-6)试剂盒购自上海酶联免疫公司,Occludin购自英国abcam公司,P-P38购自北京博奥森生物技术有限公司。
1.3 建立模型及处理大鼠造模前禁食12 h,可饮水。2%戊巴比妥钠(50 mg/kg)腹腔麻醉。进腹轻轻取出全部小肠外置于两层湿纱布之间,用盐水湿纱布由小肠末端子下而上轻轻擦拭肠管至幽门环,反复6次左右,时间共约10 min。然后将肠管放回腹腔、关腹。清醒后禁食不禁水。各组大鼠于术前1 h进行给腹腔注射药处理,model+stimulator组给予CytosporoneB(13 mg/kg)、model+antagonist组给予DIM-C-pPhCO2Me(2 mg/kg)、sham组和model组给予PBS(磷酸缓冲盐溶液)。各组大鼠建模后24 h予1 mL墨汁灌胃处理,30 min后处死,取血清和回肠组织样本。
1.4 小肠推进率分析各组取出整段小肠(保留胃、盲肠),测量小肠长度L1及幽门到墨汁最远处的距离L2,计算小肠推进率:小肠推进率=(L2/L1)×100%。
1.5 免疫组织化学分析石蜡切片烤片、脱蜡、水化、修复、洗涤、一抗NR4A1 (1:100)磷酸盐缓冲液浸洗玻片,辣根酶标记山羊抗兔IgG(H+L)(1;100),磷酸盐缓冲液充分淋洗。DAB显色、苏木精复染、盐酸酒精分化、返蓝、脱水、透明、封片、镜检。
1.6 组织病理学检查将肠组织固定于4%甲醛溶液,乙醇脱水、石蜡包埋、切片,苏木精一伊红(hematoxylin and eosin,H-E)染色。采用光学显微镜观察肠道组织的病理改变。根据肠组织的炎症细胞浸润的程度和范围、黏膜结构和上皮细胞方面进行病理评分[8-9]。
1.7 Tunel检测石蜡切片预处理准备、烤片、脱蜡、水化、修复、洗涤,加TUNEL检测液、封片镜检。
1.8 免疫荧光检测将石蜡组织切片置于APES载玻片上,经脱蜡、晾干、抗原修复,加入目标抗体,进行免疫荧光染色,以DAPI染核。应用共聚焦荧光显微镜观察染色,采用Image-Pro Plus(IPP)图像分析软件,对各组免疫荧光染色图片测量平均吸光度值和对蛋白共定位情况进行半定量分析。
1.9 Western blot检测取50 mg回肠组织样品,加入1 mL的裂解液,置于液氮预冷后的碾磨仪充分研磨,离心吸取上清液,利用BCA试剂盒进行蛋白浓度测定。蛋白变性、上样、电泳、湿法转膜、孵育一抗溶液、室温孵育二抗、滴加ECL曝光液,用“Image Pro”软件分析各抗体条带灰度值。
1.10 ELISA检测血清和回肠组织中白细胞介素-4(IL-4)、白细胞介素-6(IL-6)水平采用酶联免疫吸附试验试剂盒,按照生产厂家说明书进行检测。
1.11 统计学方法应用SPSS 25.0统计软件进行统计分析,计量资料若服从正态分布则以均数±标准差(x±s)表示,多组间比较采用单因素方差分析(one-way ANOVA);不符合方差齐性则用秩转换的非参数检验,利用Graphpad prism 8.5作图,以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠肠组织病理和NR4A1表达情况如图 1A所示,sham组肠黏膜结构完整形态正常,肠绒毛排列紧密整齐,肠组织无炎症细胞浸润;与sham组相比,model组肠黏膜出现明显的损伤,肠绒毛顶端不成形,固有层崩解,肠组织有明显炎症细胞浸润,差异有统计学意义(P < 0.05);与model组比较,model+stimulator组可见肠黏膜损伤、炎症细胞浸润明显减轻,差异有统计学意义(P < 0.05);model+antagonist组中肠黏膜组织排列较紊乱,肠组织有大量炎症细胞浸润。
|
| 注:(A)肠组织中病理评价(200×);(B)肠组织中NR4A1表达(200×);aP < 0.05,bP < 0.01;Intestinal histopathological score为肠组织病理评分;NR4A1 positive rate为NR4A1阳性率 图 1 大鼠POI肠组织病理和NR4A1表达 Fig 1 Pathological changes and NR4A1 expression in intestinal tissues of rats with POI |
|
|
如图 1B所示,sham组中可见大量棕黄色的NR4A1蛋白表达;与sham组相比,model组NR4A1蛋白表达明显减少,差异有统计学意义(P < 0.05);与model组相比,model+stimulator组NR4A1蛋白表达明显增多,差异有统计学意义(P < 0.05);与model组相比,model+antagonist组NR4A1蛋白表达减少。
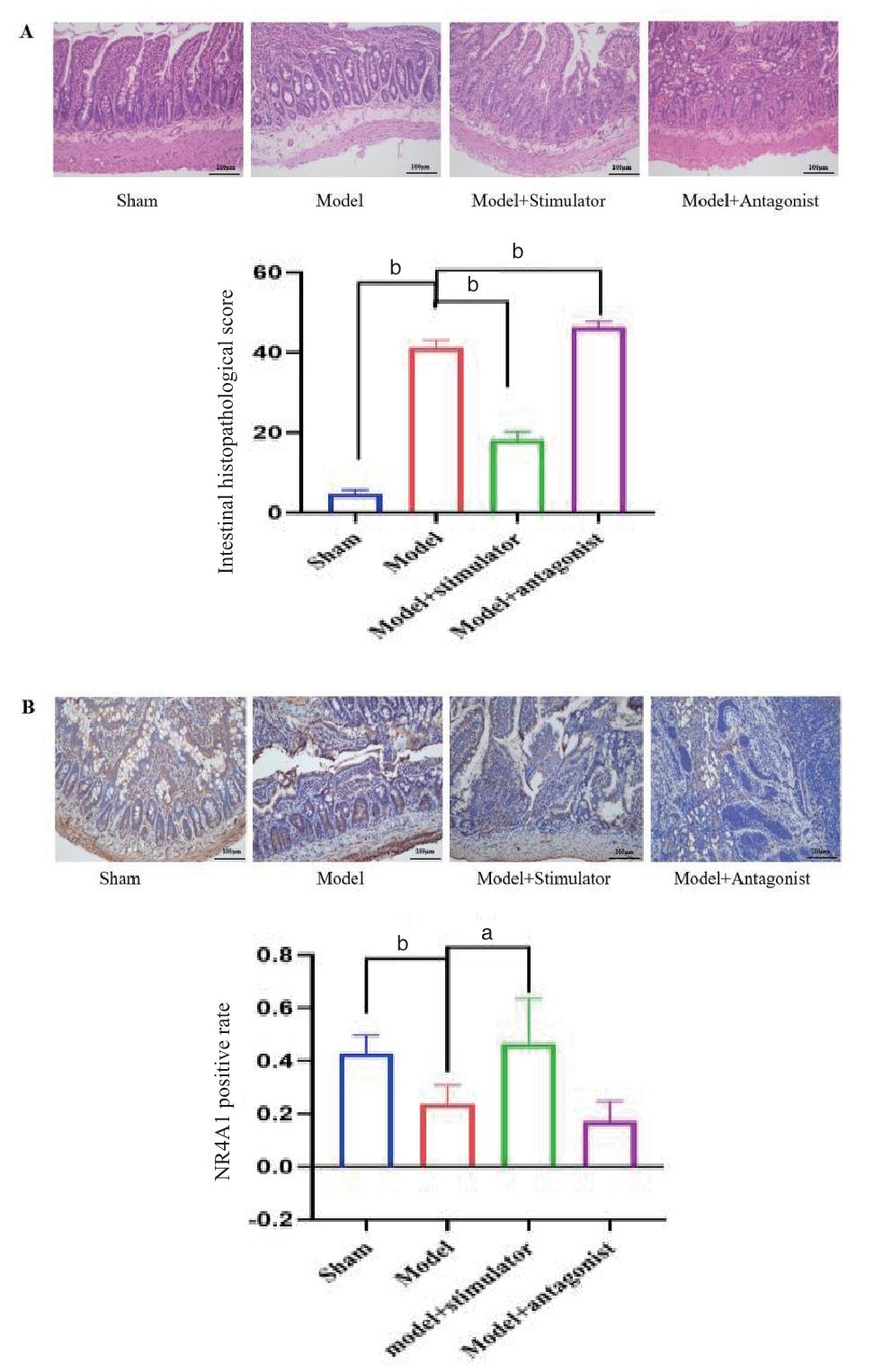
2.2 各组大鼠肠上皮细胞凋亡和肠黏膜occludin蛋白表达情况如图 2A所示,与sham组相比,model组肠上皮细胞凋亡数量明显增加,差异有统计学意义(P < 0.05);与model组相比,model+stimulator组肠上皮细胞凋亡数量明显减少,差异有统计学意义(P < 0.05);与model组相比,model+antagonist组肠上皮细胞凋亡数量增加。
|
| 注:(A)肠上皮细胞凋亡;(B)Occludin蛋白表达;aP < 0.01,bP < 0.001,Occludin relative protein expression为Occludin相对蛋白表达;IOD/area为积分吸光度 图 2 肠上皮细胞凋亡和Occludin蛋白表达情况 Fig 2 Apoptosis of intestinal epithelial cells and Occludin protein expression |
|
|
如图 2B所示,与sham组相比,model组肠黏膜occludin蛋白表达水平显著减少,差异有统计学意义(P < 0.05);与model组相比,model+stimulator组肠黏膜occludin蛋白表达水平显著增多,而model+antagonist组肠黏膜occludin蛋白表达水平显著降低,差异有统计学意义(均P < 0.05)。激活NR4A1表达对POI肠黏膜屏障有保护作用。
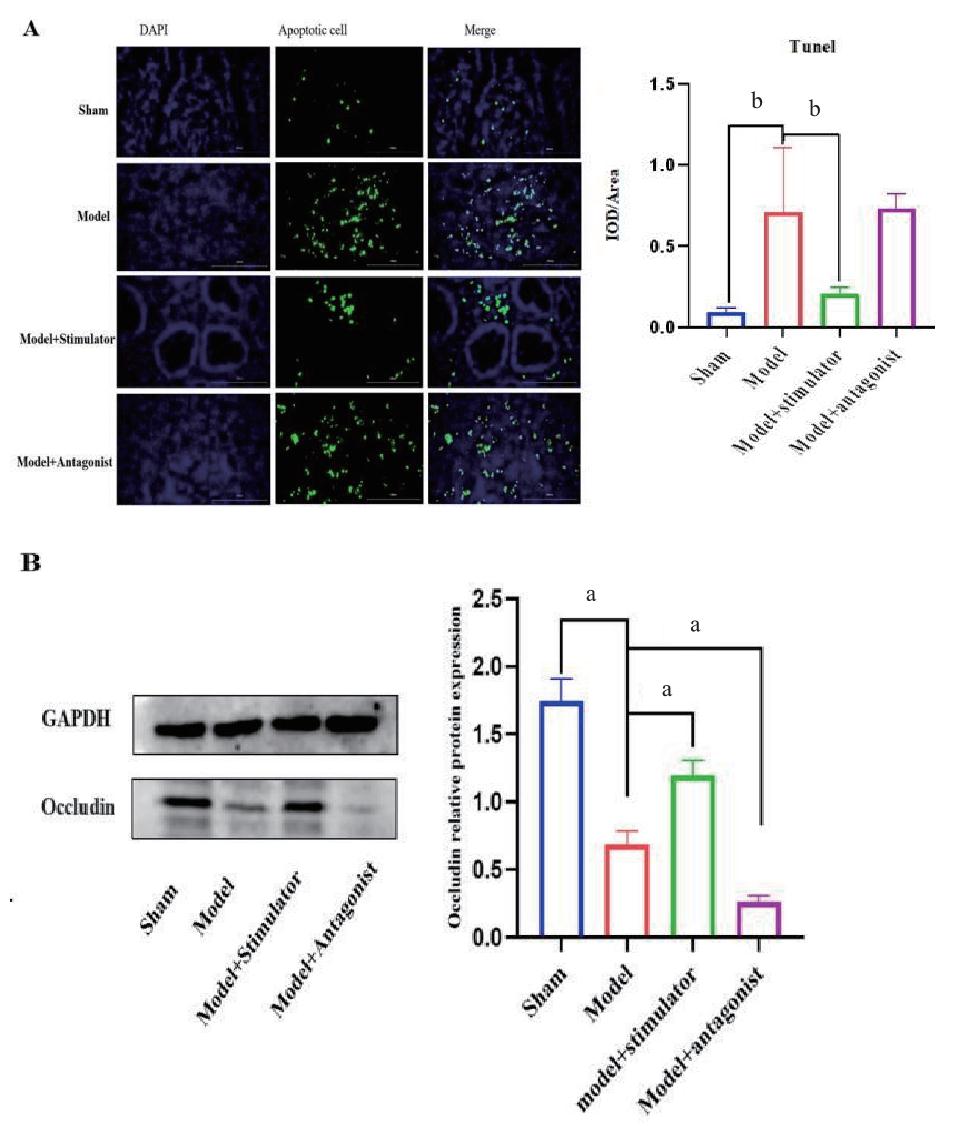
2.3 各组大鼠小肠运输能力情况如图 3所示,与sham组相比,model组小肠推进率明显降低,差异有统计学意义(P < 0.05);与model组相比,model+stimulator组小肠推进率显著升高,差异有统计学意义(P < 0.05),model+antagonist组小肠推进率降低,表明激活NR4A1表达可以改善POI的小肠运输能力。
|
| 注:Intestinal propulsive rate为小肠推进率,a P < 0.01 图 3 各组大鼠小肠推进率情况 Fig 3 Small intestinal propulsion rate in each group of rats |
|
|
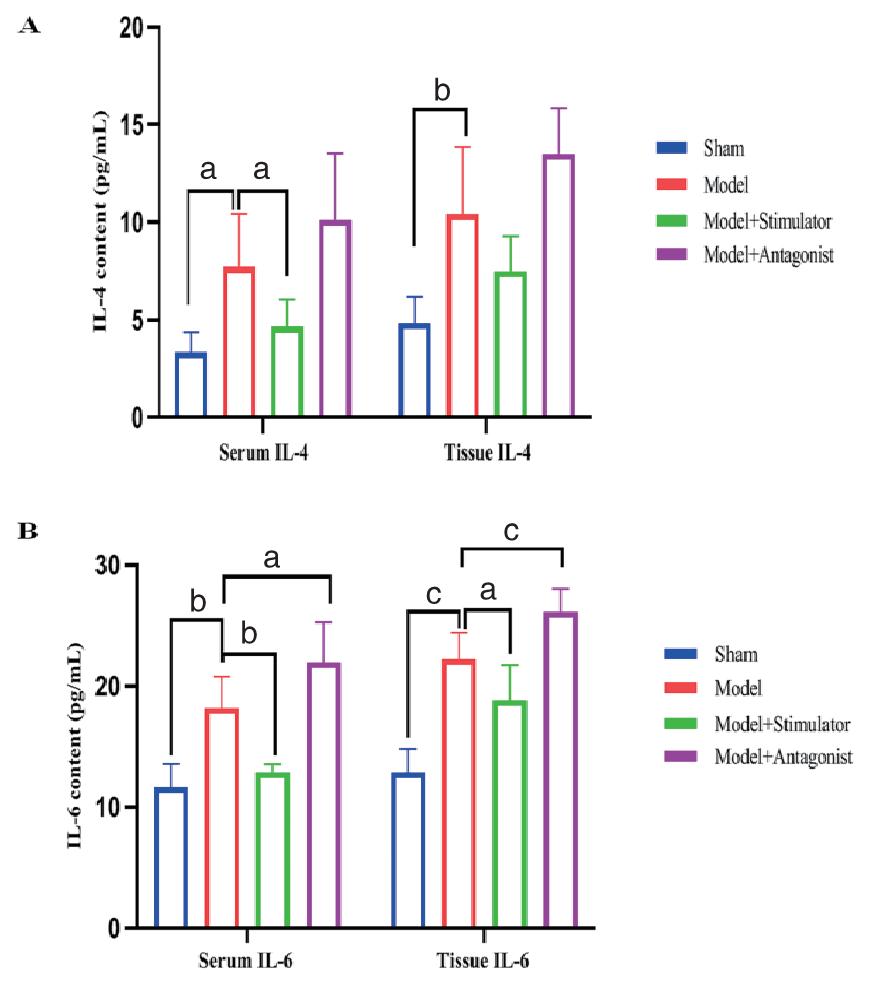
如图 4所示,与sham组相比,model组血清和肠组织IL-4、IL-6水平明显升高,差异有统计学意义(P < 0.05);与model组相比,model+stimulator组血清和肠组织IL-6水平、血清IL-4水平明显降低,差异有统计学意义(P < 0.05),肠组织IL-4水平呈下降趋势;与model组相比,model+antagonist组血清和肠组织IL-6水平显著升高,差异有统计学意义(P < 0.05),血清和肠组织IL-4水平呈升高趋势。
|
| 注:(A)血清和肠组织IL-4水平;(B)血清和肠组织IL-6水平;数据以均数±标准差表示,a P < 0.05,b P < 0.01,c P < 0.001,IL-4 content为IL-4水平,IL-6 content为IL-6水平,serum为血清,tissue为组织 图 4 血清和肠组织炎症因子情况 Fig 4 Inflammatory cytokine levels in serum and intestinal tissues |
|
|
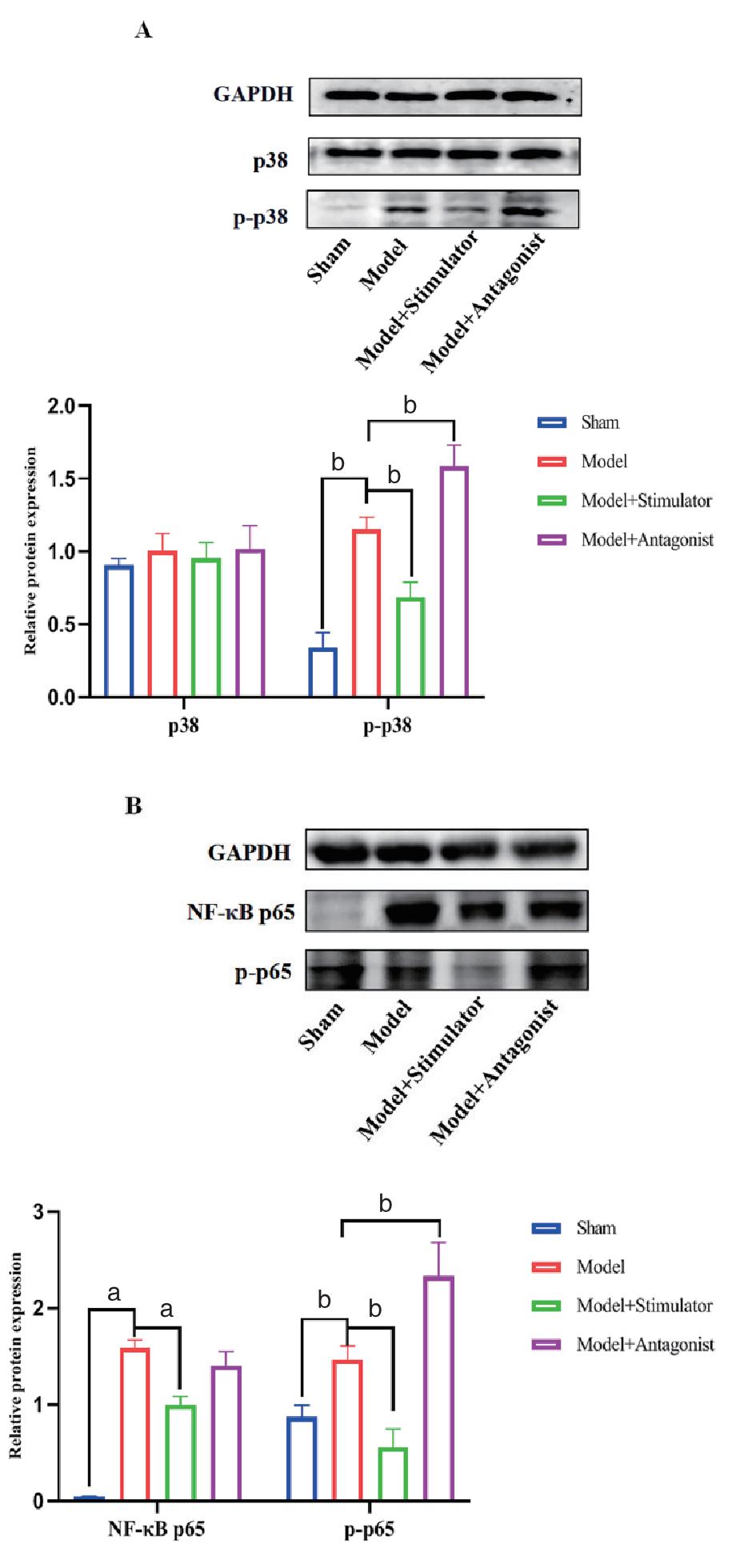
与sham组相比,model组磷酸化p38(p-p38)蛋白表达显著升高,差异有统计学意义(P < 0.05);与model组相比,model+stimulator组p-p38蛋白表达显著降低,而model+antagonist组p-p38蛋白表达显著升高,差异有统计学意义(均P < 0.05)。见图 5A。与sham组相比,model组p65和磷酸化p65(p-p65)蛋白表达显著升高,差异有统计学意义(P < 0.05);与model组相比,model+stimulator组p65和p-p65蛋白表达显著降低,而model+antagonist组p-p65蛋白表达显著升高,差异有统计学意义(均P < 0.05)。见图 5B。
|
| 注:(A) p38和p-p38蛋白表达;(B) NF-κB p65和p-p65蛋白表达;数据以均数±标准差表示,aP < 0.01,bP < 0.001;Relative protein expression为相对蛋白表达 图 5 肠组织中p38MAPK和NF-κB蛋白表达 Fig 5 Expression of p38MAPK and NF-κB proteins in intestinal tissues |
|
|
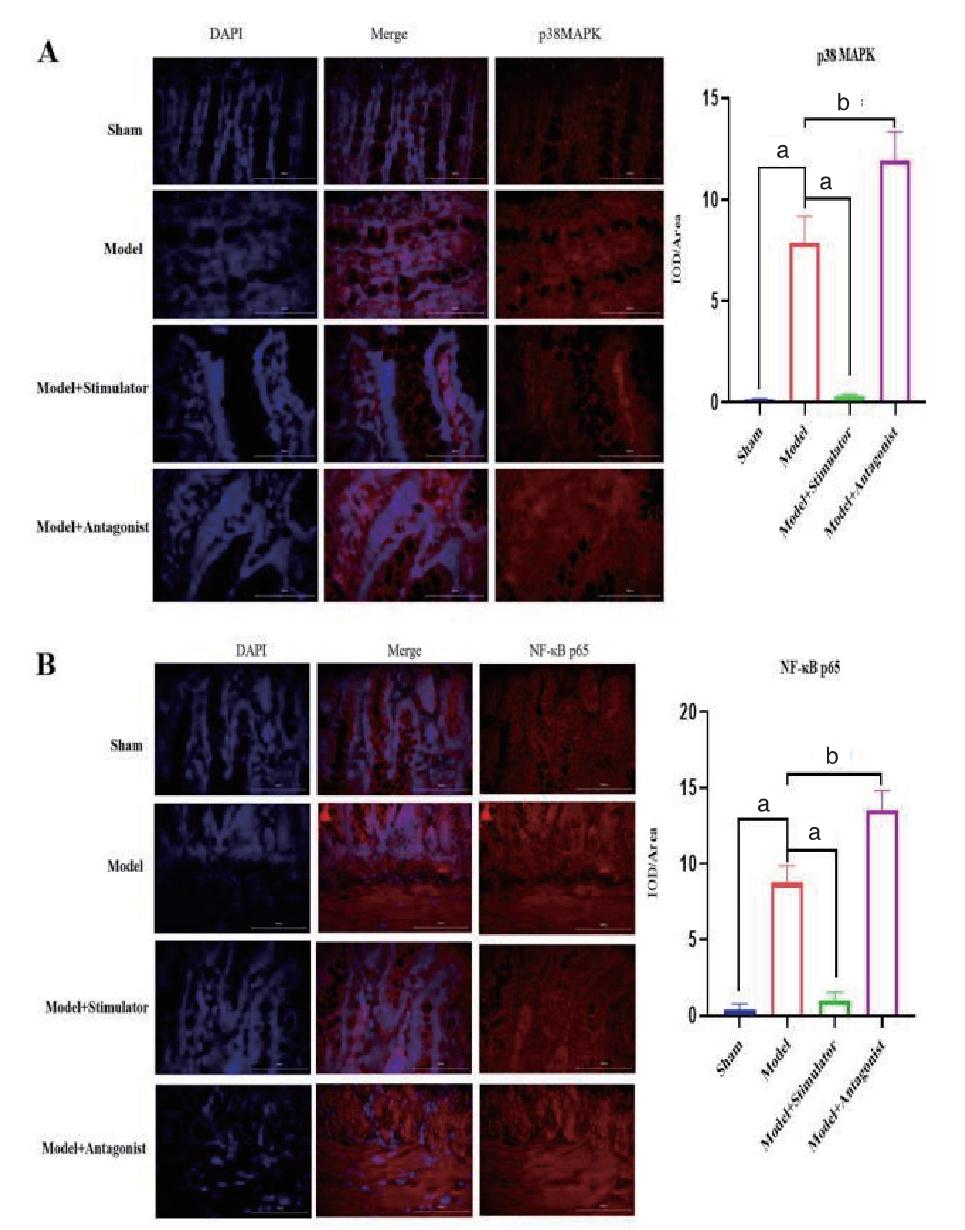
与sham组相比,model组p38MAPK和NF-κBp65蛋白显著上调,差异有统计学意义(P < 0.05);与model组相比,model+stimulator组p38MAPK和NF-κB p65蛋白显著下调,而model+antagonist组p38MAPK和NF-κB p65蛋白显著上调,差异有统计学意义(均P < 0.05)。表明过表达NR4A1可以抑制p38MAPK和NF-κB信号通路的活化,抑制NR4A1可以激活p38MAPK和NF-κB信号通路。见图 6。
|
| 注:(A) p38MAPK蛋白表达;(B)NF-κB p65蛋白表达;数据以均数±标准差表示,aP < 0.01,bP < 0.001;IOD/area为积分吸光度 图 6 肠组织中p38MAPK和NF-κB信号通路变化 Fig 6 Changes in p38MAPK and NF-κB signaling pathways in intestinal tissues |
|
|
术后肠梗阻(postoperative ileus,POI)是外科手术后常见的并发症,其发生不仅延缓患者康复进程,还会增加住院时间和医疗费用,给患者及其家庭带来沉重的经济和心理负担[2, 10]。尽管目前临床已采取多种预防措施,如选择腹腔镜手术、局部麻醉、加速康复外科策略、口服阿片受体拮抗剂和其他药物干预等,但目前尚未出现公认最有效的治疗手段可应用于临床[11-12]。本研究通过建立大鼠POI模型,旨在探讨NR4A1是否可以通过p38MAPK和NF-κB信号通路,减轻肠道炎症反应,进而改善小肠动力功能障碍的作用机制。
POI的病理生理学机制复杂,涉及手术创伤、炎症反应、组织水肿及神经功能紊乱等多种因素[13-14]。其中,最重要的机制是肠管暴露和手术操作引起的肠道局部无菌性炎症反应。研究表明,手术刺激可在1 h内激活胃肠道细胞内ERK1、p38MAPK、NF-κB等炎症相关信号通路,进而触发级联反应,促使肠道巨噬细胞和肥大细胞的活化,并上调核转录因子的表达。这一过程促使大量促炎细胞因子(如IL-6、IL-1β、TNF-α)和趋化因子释放,进一步募集并激活中性粒细胞,最终导致肠壁炎症反应、组织水肿及渗出[15-16]。这些病理变化可影响肠道平滑肌收缩及神经调控功能,使肠蠕动减弱,最终诱发POI。近年来研究证实,通过抑制p38MAPK和NF-κB信号通路,可有效减轻肠道炎症反应,改善POI症状[17-18]。
孤核受体NR4A1受体可被多种化学和物理刺激快速诱导表达,并在炎症调控中发挥重要作用[19-20]。研究表明,在巨噬细胞和单核细胞中,NR4A1表达下调可导致促炎因子(如IL-1β、IL-6)水平升高[21-22]。Deng等[23]发现GPA肽可通过上调肠上皮细胞NR4A1表达,对DSS诱导的结肠炎发挥保护作用。Zhang等[24]报道NR4A1可通过抑制LOX-1表达改善腹主动脉瘤局部炎症微环境。Hamers等[25]发现在结肠炎小鼠模型中敲除NR4A1可加重炎症反应,而激活其表达则可缓解症状。然而,NR4A1在POI发生发展中的作用尚未明确。本研究结果显示,大鼠POI模型肠组织中NR4A1表达显著减少,肠组织中炎症细胞明显浸润,IL-6、IL-4等炎症因子水平明显升高,小肠运输能力下降。
p38MAPK和NF-κB信号通路是调控炎症反应的关键通路,参与多种疾病的发生发展[26-27]。Zhang等[28]研究发现,脱氧雪腐镰刀菌烯醇可通过激活p38MAPK和Erk1/2信号通路诱导IPEC-J2细胞的炎症反应。Li等[29]证实6-姜辣素能通过抑制p38 MAPK和NF-κB信号通路,减轻肠道组织中的炎症反应,进而保护肠道缺血-再灌注损伤。Jiang等[30]报道大鼠ARDS模型中肺组织NR4A1的表达明显降低,NR4A1激动剂CytosporoneB可通过抑制p38MAPK/NF-κB通路降低内皮素-1水平,从而缓解ARDS的炎症反应和损伤。本研究发现,NR4A1可通过抑制p38MAPK/NF-κB通路活化,显著减轻POI大鼠肠道炎症反应,保护肠黏膜屏障,并改善小肠运输能力。
利益冲突 所有作者声明无利益冲突
作者贡献声明 上官新昌:实验操作、数据收集及整理、论文撰写;魏永:研究设计、论文指导与修改;叶锦、陈先强:实验操作、统计分析、作图;张俊榕、刘佳文:实验操作
| [1] | Khawaja ZH, Gendia A, Adnan N, et al. Prevention and management of postoperative ileus: a review of current practice[J]. Cureus, 2022, 14(2): e22652. DOI:10.7759/cureus.22652 |
| [2] | Wattchow D, Heitmann P, Smolilo D, et al. Postoperative ileus-an ongoing conundrum[J]. Neurogastroenterol Motil, 2021, 33(5): e14046. DOI:10.1111/nmo.14046 |
| [3] | Wang Z, Stakenborg N, Boeckxstaens G. Postoperative ileus-Immune mechanisms and potential therapeutic interventions[J]. Neurogastroenterol Motil, 2024: e14951. DOI:10.1111/nmo.14951 |
| [4] | Lith SC, de Vries CJM. Nuclear receptor Nur77: its role in chronic inflammatory diseases[J]. Essays Biochem, 2021, 65(6): 927-939. DOI:10.1042/EBC20210004 |
| [5] | Liu XD, Wang Y, Lu HP, et al. Genome-wide analysis identifies NR4A1 as a key mediator of T cell dysfunction[J]. Nature, 2019, 567(7749): 525-529. DOI:10.1038/s41586-019-0979-8 |
| [6] | Hamers AAJ, van Dam L, Teixeira Duarte JM, et al. Deficiency of nuclear receptor Nur77 aggravates mouse experimental colitis by increased NFκB activity in macrophages[J]. PLoS One, 2015, 10(8): e0133598. DOI:10.1371/journal.pone.0133598 |
| [7] | Wu H, Li XM, Wang JR, et al. NUR77 exerts a protective effect against inflammatory bowel disease by negatively regulating the TRAF6/TLR-IL-1R signalling axis[J]. J Pathol, 2016, 238(3): 457-469. DOI:10.1002/path.4670 |
| [8] | Erben U, Loddenkemper C, Doerfel K, et al. A guide to histomorphological evaluation of intestinal inflammation in mouse models[J]. Int J Clin Exp Pathol, 2014, 7(8): 4557-4576. |
| [9] | 弥亮钰, 吴自谦, 潘新亭, 等. PARP-1通过NF-κB信号通路对重症急性胰腺炎致肠黏膜屏障损伤的作用机制[J]. 中华急诊医学杂志, 2020, 29(05): 675-681. DOI:10.3760/cma.j.issn.1671-0282.2020.05.013 |
| [10] | Iskander O. An outline of the management and prevention of postoperative ileus: a review[J]. Medicine (Baltimore), 2024, 103(24): e38177. DOI:10.1097/MD.0000000000038177 |
| [11] | Bragg D, El-Sharkawy AM, Psaltis E, et al. Postoperative ileus: Recent developments in pathophysiology and management[J]. Clin Nutr, 2015, 34(3): 367-376. DOI:10.1016/j.clnu.2015.01.016 |
| [12] | Venara A, Neunlist M, Slim K, et al. Postoperative ileus: pathophysiology, incidence, and prevention[J]. J Visc Surg, 2016, 153(6): 439-446. DOI:10.1016/j.jviscsurg.2016.08.010 |
| [13] | Vather R, O'Grady G, Bissett IP, et al. Postoperative ileus: mechanisms and future directions for research[J]. Clin Exp Pharmacol Physiol, 2014, 41(5): 358-370. DOI:10.1111/1440-1681.12220 |
| [14] | Stoffels B, Hupa KJ, Snoek SA, et al. Postoperative ileus involves interleukin-1 receptor signaling in enteric Glia[J]. Gastroenterology, 2014, 146(1): 176-187. DOI:10.1053/j.gastro.2013.09.030 |
| [15] | Buscail E, Deraison C. Postoperative ileus: a pharmacological perspective[J]. Br J Pharmacol, 2022, 179(13): 3283-3305. DOI:10.1111/bph.15800 |
| [16] | De Backer O, Elinck E, Blanckaert B, et al. Water-soluble CO-releasing molecules reduce the development of postoperative ileus via modulation of MAPK/HO-1 signalling and reduction of oxidative stress[J]. Gut, 2009, 58(3): 347-356. DOI:10.1136/gut.2008.155481 |
| [17] | Liu T, Xu M, Shi ZY, et al. Shenhuang plaster ameliorates the Inflammation of postoperative ileus through inhibiting PI3K/Akt/NF-κB pathway[J]. Biomed Pharmacother, 2022, 156: 113922. DOI:10.1016/j.biopha.2022.113922 |
| [18] | Wehner S, Straesser S, Vilz TO, et al. Inhibition of p38 mitogen-activated protein kinase pathway as prophylaxis of postoperative ileus in mice[J]. Gastroenterology, 2009, 136(2): 619-629. DOI:10.1053/j.gastro.2008.10.017 |
| [19] | Safe S. Natural products and synthetic analogs as selective orphan nuclear receptor 4A (NR4A) modulators[J]. Histol Histopathol, 2024, 39(5): 543-556. DOI:10.14670/HH-18-689 |
| [20] | Safe S, Karki K. The paradoxical roles of orphan nuclear receptor 4A (NR4A) in cancer[J]. Mol Cancer Res, 2021, 19(2): 180-191. DOI:10.1158/1541-7786.MCR-20-0707 |
| [21] | Pei LM, Castrillo A, Chen MY, et al. Induction of NR4A orphan nuclear receptor expression in macrophages in response to inflammatory stimuli[J]. J Biol Chem, 2005, 280(32): 29256-29262. DOI:10.1074/jbc.M502606200 |
| [22] | Li XM, Lu XX, Xu Q, et al. Nur77 deficiency leads to systemic inflammation in elderly mice[J]. J Inflamm (Lond), 2015, 12: 40. DOI:10.1186/s12950-015-0085-0 |
| [23] | Deng Z, Zheng LF, Xie XW, et al. GPA peptide enhances Nur77 expression in intestinal epithelial cells to exert a protective effect against DSS-induced colitis[J]. FASEB J, 2020, 34(11): 15364-15378. DOI:10.1096/fj.202000391RR |
| [24] | Zhang HY, Geng N, Sun LY, et al. Nuclear receptor Nur77 protects against abdominal aortic aneurysm by ameliorating inflammation via suppressing LOX-1[J]. J Am Heart Assoc, 2021, 10(15): e021707. DOI:10.1161/JAHA.121.021707 |
| [25] | Hamers AAJ, van Dam L, Teixeira Duarte JM, et al. Deficiency of nuclear receptor Nur77 aggravates mouse experimental colitis by increased NFκB activity in macrophages[J]. PLoS One, 2015, 10(8): e0133598. DOI:10.1371/journal.pone.0133598 |
| [26] | Li T, Wu YN, Wang H, et al. Dapk1 improves inflammation, oxidative stress and autophagy in LPS-induced acute lung injury via p38MAPK/NF-κB signaling pathway[J]. Mol Immunol, 2020, 120: 13-22. DOI:10.1016/j.molimm.2020.01.014 |
| [27] | O'Sullivan AW, Wang JH, Redmond HP. NF-kappaB and p38 MAPK inhibition improve survival in endotoxin shock and in a cecal ligation and puncture model of sepsis in combination with antibiotic therapy[J]. J Surg Res, 2009, 152(1): 46-53. DOI:10.1016/j.jss.2008.04.030 |
| [28] | Zhang H, Deng XW, Zhou C, et al. Deoxynivalenol induces inflammation in IPEC-J2 cells by activating P38 mapk and Erk1/2[J]. Toxins (Basel), 2020, 12(3): 180. DOI:10.3390/toxins12030180 |
| [29] | Li YL, Xu B, Xu M, et al. 6-Gingerol protects intestinal barrier from ischemia/reperfusion-induced damage via inhibition of p38 MAPK to NF-κB signalling[J]. Pharmacol Res, 2017, 119: 137-148. DOI:10.1016/j.phrs.2017.01.026 |
| [30] | Jiang YJ, Zeng Y, Huang X, et al. Nur77 attenuates endothelin-1 expression via downregulation of NF-κB and p38 MAPK in A549 cells and in an ARDS rat model[J]. Am J Physiol Lung Cell Mol Physiol, 2016, 311(6): L1023-L1035. DOI:10.1152/ajplung.00043.2016 |
 2025, Vol. 34
2025, Vol. 34