心房颤动(房颤)是所有持续性心律失常中最常见的,截止至2019年全球的心房颤动包括心房扑动的病例数将达到5 970万例,与1990年相比增加了一倍左右[1]。心房颤动产生的危害包括:(1)脑卒中和血栓栓塞;(2)心力衰竭;(3)心肌梗死;(4)认知功能的下降和痴呆;(5)肾功能损伤;(6)生活质量及功能状况[2]。有研究表明心房颤动可能在疾病的早期阶段引起心脏重塑和功能障碍,导致心力衰竭的发展[3]。因此早期发现心房颤动患者心脏重塑和功能障碍就变得尤为重要。根据最新的研究结果,高密度脂蛋白胆固醇(HDL-C)的升高会导致动脉粥样硬化性心血管疾病的发病率显著增加[4]。同时HDL-C水平与一般人群的全因死亡率、心血管事件死亡率相关,并且过高和过低的HDL-C水平都会导致死亡风险增加[5]。最新研究表明高水平的HDL-C与新发心房颤动风险降低相关[6-7]。本研究对心房颤动患者的临床资料进行分析,探讨HDL-C对心房颤动患者左心室重塑和收缩功能影响,为早期识别发生左心室重塑和功能障碍的心房颤动患者提供指导策略。
1 资料与方法 1.1 研究对象收集北京朝阳医院2020年1月至2021年12月急诊科收治的321例诊断为房颤患者进行分析。入选标准:所有患者的心电图被诊断为心房颤动。排除标准:(1)既往心肌梗死病史的患者; (2)既往射频消融史的患者; (3)既往先天性心脏病病患者; (4)伴有细菌或病毒感染的患者; (5)资料不全的患者。研究中使用的所有临床信息都是从每位患者的住院记录系统中回顾性收集的。由于该研究为回顾性设计,已通过免除患者知情同意审查。
1.2 观测指标从住院记录系统收集以下基线数据:性别、年龄、身高、体重、体重指数、糖尿病史、高血压、冠心病、心力衰竭和用药史。实验室数据记录患者入院后第2天采集的空腹静脉血检测的总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、C反应蛋白(CRP)和N末端亲B型利钠肽(NT-proBNP)的水平。超声心动图记录左心房直径(LAD)、左心室射血分数(LVEF)、左心室舒张直径(LVDd)、舒张期室间隔壁厚度(IVSTd)和舒张期左心室后壁厚度(LVPWTd)。根据美国超声心动图学会推荐的左心室质量指数(LVMI)和相对壁厚(RWT)公式计算如下:LVMI= LVM/BSA; LVM=0.8×1.04×[(LVDd+LVPWTd+IVSTd)3-(LVDd)3]+0.6; BSA=0.006×身高(cm)+ 0.0128 ×重量(kg)– 0.1529;RWT =(2 × LVPWTd)/(LVDd), 其中LVM定义为左心室质量,BSA定义为体表面积[8]。
1.3 统计学方法分别使用SPSS(版本27.0)进行数据分析和GraphPad Prism(版本9.5.1)进行图形绘制。根据HDL-C水平将患者分为四分位数(Q1:第一个四分位数;Q2:第二个四分位数;Q3:第三个四分位数;Q4:第四个四分位数)。正态分布的连续变量以平均值±标准差表示,并通过单因素方差分析进行比较; 非正态性分布的连续性变量显示为中位数和四分位距,通过Kruskal-Wallis检验进行比较。数字和百分比表示分类变量,分类变量的χ2检验用于比较基线特征。Spearman秩相关性被使用分析HDL-C与LAD、LVEF、LVMI、RWT、CRP和NT-proBNP的相关性。线性回归分析HDL-C与LAD、LVEF、LVMI和RWT之间的关系。首先将HDL-C设置为自变量,同时将超声心动图参数设置为因变量,使用单因素线性回归分析其相关性(模型1)。其次,在调整混杂因素后,分析了两个多元线性回归模型(模型2和模型3)。模型2根据年龄,性别,BMI,吸烟史和饮酒史进行了调整,模型3针对2型糖尿病,高血压病史,冠状动脉粥样硬化性心脏病(冠心病)病史和房颤类型进行了额外调整。
2 结果 2.1 一般临床资料比较各组间年龄、身高、体重、BMI、持续性房颤患者数、糖尿病、高血压、冠心病、心力衰竭史、吸烟、饮酒情况差异无统计学意义(P > 0.05)。在各组性别差异有统计学意义(P < 0.05), 见表 1。
| 项目 | HDL-C | P值 | |||
| 1 | 2 | 3 | 4 | ||
| 四分位数 | ≤0.91 | 0.91~1.05 | 1.05~1.20 | >1.20 | - |
| 例数(n) | 85 | 80 | 76 | 80 | - |
| 年龄(岁,x±s) | 69.72±13.06 | 67.43±11.88 | 69.63±11.62 | 67.13±13.00 | 0.390 |
| 男性[例数(%)] | 52(61.2) | 45(56.3) | 50(65.8) | 35(43.8) | 0.033 |
| 身高(cm,x±ss) | 166.61±8.32 | 167.69±8.03 | 168.32±8.55 | 165.51±8.07 | 0.154 |
| 体重(kg,x±s) | 74.48±13.61 | 75.29±11.39 | 73.70±12.14 | 71.74±10.74 | 0.282 |
| BMI(kg/m2,x±s) | 26.77±4.30 | 26.73±3.23 | 26.01±3.79 | 26.19±3.53 | 0.475 |
| 持续性心房颤动(n, %) | 47(55.3) | 38(47.5) | 41(53.9) | 36(45.0) | 0.494 |
| 糖尿病(n, %) | 28(32.9) | 19(23.8) | 20(26.3) | 20(25.0) | 0.547 |
| 高血压(n, %) | 54(63.5) | 47(58.8) | 50(65.8) | 39(48.8) | 0.130 |
| 冠心病(n, %) | 46(54.1) | 38(47.5) | 41(53.9) | 33(41.3) | 0.305 |
| 心力衰竭(n, %) | 15(17.6) | 13(16.3) | 14(18.4) | 12(15.0) | 0.943 |
| ACEI/ARB/ARNI(n, %) | 24(28.2) | 31(38.8) | 26(34.2) | 25(31.2) | 0.526 |
| β受体阻滞剂(n, %) | 23(27.0) | 21(26.2) | 25(32.9) | 21(26.2) | 0.757 |
| 钙离子通道阻滞剂(n, %) | 21(24.7) | 22(27.5) | 21(27.6) | 29(36.3) | 0.929 |
| 利尿剂(n, %) | 7(8.2) | 12(15.0) | 11(14.5) | 13(16.3) | 0.429 |
| 吸烟(n, %) | 18(21.2) | 25(31.3) | 15(19.7) | 16(20.0) | 0.252 |
| 饮酒(n, %) | 13(15.3) | 18(22.5) | 13(17.1) | 15(18.8) | 0.674 |
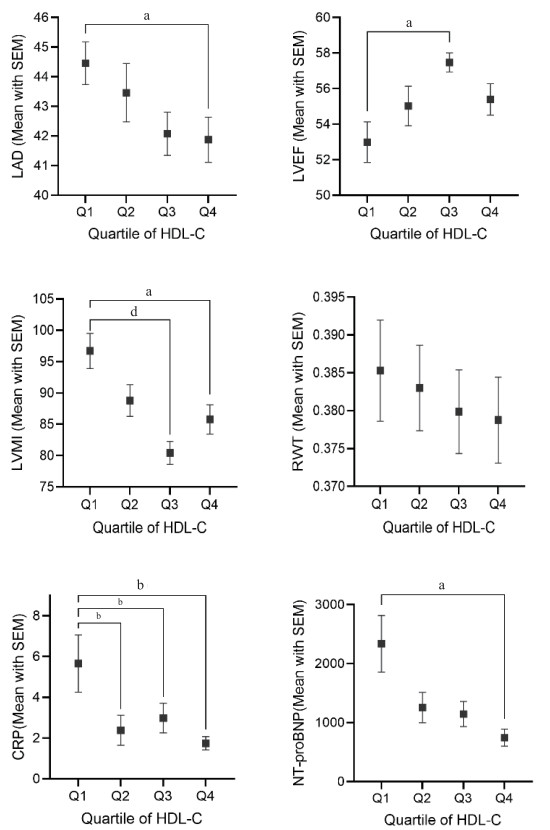
根据HDL-C四分位数的超声心动图结构和功能参数,LAD和LVMI随着HDL-C水平的增加而显著降低; 随着HDL-C水平的增加,LVEF显着增加(Q4 vs. Q1 Adjusted P =0.025 for LAD; Q3 vs. Q1 Adjusted P < 0.001, Q4 vs. Q1 Adjusted P < 0.023 for LVMI; Q3 vs. Q1 Adjusted P =0.036 for LVEF)。从Q1到Q4,RWT差异无统计学意义。CRP和NTpro-BNP也随着HDL-C水平的增加而降低(Q4 vs. Q1 Adjusted P=0.003,Q3 vs. Q1 Adjusted P=0.010,Q2 vs. Q1 Adjusted P =0.001 for CRP; Q4 vs. Q1 Adjusted P=0.04 for NT-proBNP)(图 2)。
|
| 注:a为经过Bonferroni法调整后(Adjusted)P < 0.05; b为Adjusted P < 0.01; c为Adjusted P < 0.001; d为Adjusted P < 0.0001 图 1 按HDL-C水平四分位数分组的患者的LAD、LVEF、LVMI、RWT、CRP和NT-proBNP参数 |
|
|
|
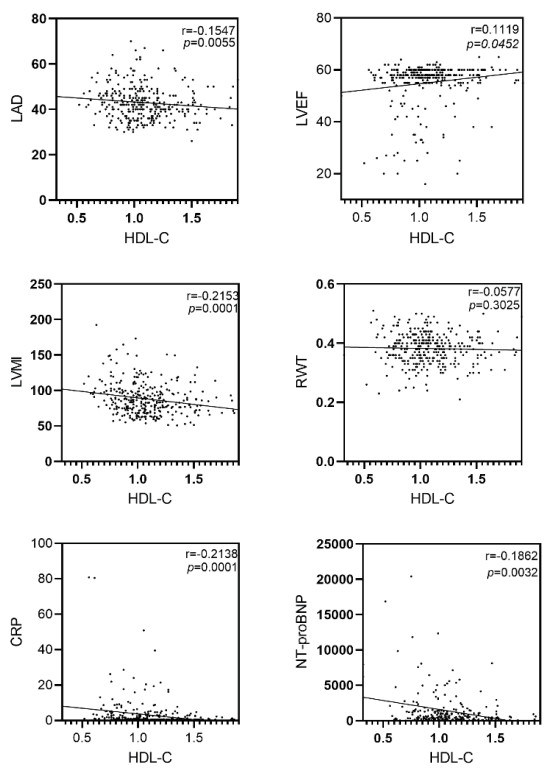
| 图 2 Spearman分析HDL-C与LAD、LVEF、LVMI、RWT、CRP和NT-proBNP的相关性 |
|
|
在房颤患者中,HDL-C与LAD(r=-0.1547, P=0.0055)、LVMI(r=-0.2153, P=0.0001)、CRP(r=-0.2138, P=0.0001)和NT-proBNP(r=-0.1862, P=0.0032)之间观察到显著负相关(图 2)。HDL-C与LVEF(r=0.1119, P=0.0452)之间观察到显著正相关(图 2)。
2.4 单因素和多因素线性回归单因素线性回归(模型1)分析表明,HDL-C与LVMI(P < 0.001)和LAD(P=0.023)呈负相关,与LVEF(P=0.007)呈正相关(表 2)。在调整年龄、性别、BMI、吸烟史和饮酒史(模型2)后,HDL-C与LVMI(P < 0.001)和LVEF(P=0.008)之间的相关性仍有统计学意义,但与LAD相关性不再显著(P > 0.05)(表 2)。进一步调整2型糖尿病病史、高血压病史、冠心病病史和心房颤动类型(模型3),HDL-C与LVMI(P < 0.001)和LVEF(P=0.009)之间的相关性依然存在,提示该关联具有一定独立性(表 2)。
| 变量 | model1 | model2 | model3 | ||||||||
| β | SE | P值 | β | SE | P值 | β | SE | P值 | |||
| 左心室结构 | |||||||||||
| LVMI | -18.35 | 4.69 | < 0.001 | -17.04 | 4.66 | < 0.001 | -16.51 | 4.68 | < 0.001 | ||
| RWT | -0.01 | 0.01 | 0.521 | -0.01 | 0.01 | 0.596 | -0.01 | 0.01 | 0.689 | ||
| 左心室收缩功能 | |||||||||||
| LVEF | 4.98 | 1.82 | 0.007 | 4.95 | 1.860 | 0.008 | 4.84 | 1.83 | 0.009 | ||
| 左心房结构 | |||||||||||
| LAD | -3.52 | 1.55 | 0.023 | 2.52 | 1.50 | 0.093 | -1.90 | 1.37 | 0.167 | ||
心脏重塑在临床上主要表现为心脏损伤引起的心脏大小、形状和功能的变化, 在概念上主要指基因组表达、分子、细胞和间质的变化[9]。房颤的患病率在心脏重塑患者中增加,房颤也会进一步促进心脏重塑的发展[10-11]。有研究表明,相比于对照组,房颤患者的LAD显著升高、LVEF显著降低;且相比于阵发性心房颤动组,持续性心房颤动组患者LVEF显著降低[12]。Noirclerc等[11]分析了175名阵发性房颤患者和175名匹配的对照受试者,超声心动图显示阵发性心房颤动患者的LVMI较高。本研究表明,在房颤患者中HDL-C水平与LAD、LVMI呈负相关,与LVEF呈正相关。心脏重塑和功能障碍不仅会导致心力衰竭的发生,最近的几项研究也表明,心脏重塑患者的心血管事件发生率和全因死亡率显着增加[13-15]。大量研究证实导管消融术是恢复和维持心房颤动患者窦性心律的主要措施,可显著改善房颤患者症状和生活质量[2]。研究证实导管消融术不仅可以恢复和维持窦性心律也可以逆转房颤患者的心室重塑。Okada等[16]对左心室收缩功能障碍患者的376例房颤患者进行导管消融术,术后进行回顾性调查显示,306例患者在随访3个月后发生了左心室逆向重塑。
HDL-C的功能特性主要是抗动脉粥样硬化; 其中研究最充分的是它能够在反向胆固醇转运的过程中促进动脉粥样硬化斑块去除多余的胆固醇[17]。然而,除了反向胆固醇转运之外,HDL-C还被证明具有多种其他效应,例如提高NO生物利用度的能力、抗氧化应激和抗炎症的能力,以及减少内皮黏附标志物表达和跨内皮单核细胞迁移的能力[18]。在本研究中,CRP水平随着HDL-C水平升高而降低,这证实了高水平的HDL-C与房颤患者的炎症水平降低相关。NT-proBNP是B型利钠肽的N末端片段,由心肌细胞分泌,作为对心肌压力、心脏容量负荷以及心肌细胞张力等多种刺激的反应[19]。在临床工作中主要被广泛用作心力衰竭和心功能不全的诊断生物标志物。NT-proBNP还能预测2型糖尿病患者的心血管事件的发生率和死亡率和预测心力衰竭患者死亡率和再入院事件的发生率[20-21]。研究表明,随着NT-proBNP水平升高心房颤动的发生率也随之升高,同时在与健康人群的对比中,心房颤动患者的利钠肽明显升高[22-23]。在急性心肌梗死后左心室重塑的研究中,发现左心室重塑患者NT-proBNP水平显著升高[24]。在本研究中,房颤患者HDL-C水平与NT-proBNP水平显著相关,并且随着HDL-C水平升高NT-proBNP水平显著降低。
综上所述,在房颤患者中,低水平高密度脂蛋白与左心室重塑和收缩功能受损存在显著相关性,提示HDL可能参与房颤相关心脏重构的病理生理过程,但其作为生物标志物的临床应用价值仍需通过前瞻性研究和基础研究进一步验证。仅纳入住院患者和单一中心小样本研究是本研究的主要局限性。HDL-C结果受血液样本收集,储存和测量误差的影响。本研究是一项回顾性、横断面病例对照研究; 需要前瞻性研究来进一步验证结果。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王福军对该论文进行论文设计、数据收集、数据分析和论文撰写。梅雪对该论文重要的知识内容对其进行了批判性修改
| [1] | Roth GA, Mensah GA, Johnson CO, et al. Global burden of cardiovascular diseases and risk factors, 1990-2019: update from the GBD 2019 study[J]. J Am Coll Cardiol, 2020, 76(25): 2982-3021. DOI:10.1016/j.jacc.2020.11.010 |
| [2] | 中华医学会心电生理和起搏分会, 中国医师协会心律学专业委员会, 中国房颤中心联盟心房颤动防治专家工作委员会. 心房颤动: 目前的认识和治疗建议(2021)[J]. 中华心律失常学杂志, 2022, 26(1): 15-88. DOI:10.3760/cma.j.cn113859-20211224-00264 |
| [3] | Qin DX, Mansour MC, Ruskin JN, et al. Atrial fibrillation-mediated cardiomyopathy[J]. Circ Arrhythm Electrophysiol, 2019, 12(12): e007809. DOI:10.1161/CIRCEP.119.007809 |
| [4] | Ouimet M, Barrett TJ, Fisher EA. HDL and reverse cholesterol transport: basic mechanisms and their roles in vascular health and disease[J]. Circ Res, 2019, 124(124): 1505-1518. |
| [5] | Zhong GC, Huang SQ, Peng Y, et al. HDL-C is associated with mortality from all causes, cardiovascular disease and cancer in a J-shaped dose-response fashion: a pooled analysis of 37 prospective cohort studies[J]. Eur J Prev Cardiol, 2020, 27(11): 1187-1203. DOI:10.1177/2047487320914756 |
| [6] | Tajik B, Tuomainen TP, Jarroch R, et al. Lipid levels, apolipoproteins, and risk of incident atrial fibrillation in men: a report from the Kuopio Ischaemic Heart Disease Risk Factor Study (KIHD)[J]. J Clin Lipidol, 2022, 16(4): 447-454. DOI:10.1016/j.jacl.2022.04.003 |
| [7] | Yao YS, Liu F, Wang YY, et al. Lipid levels and risk of new-onset atrial fibrillation: a systematic review and dose-response meta-analysis[J]. Clin Cardiol, 2020, 43(9): 935-943. DOI:10.1002/clc.23430 |
| [8] | Mitchell C, Rahko PS, Blauwet LA, et al. Guidelines for performing a comprehensive transthoracic echocardiographic examination in adults: recommendations from the American Society of Echocardiography[J]. J Am Soc Echocardiogr, 2019, 32(1): 1-64. DOI:10.1016/j.echo.2018.06.004 |
| [9] | Cohn JN, Ferrari R, Sharpe N. Cardiac remodeling: concepts and clinical implications: a consensus paper from an international forum on cardiac remodeling. behalf of an international forum on cardiac remodeling[J]. J Am Coll Cardiol, 2000, 35(3): 569-582. DOI:10.1016/s0735-1097(99)00630-0 |
| [10] | Seko Y, Kato T, Haruna T, et al. Association between atrial fibrillation, atrial enlargement, and left ventricular geometric remodeling[J]. Sci Rep, 2018, 8(1): 6366. DOI:10.1038/s41598-018-24875-1 |
| [11] | Noirclerc N, Huttin O, de Chillou C, et al. Cardiac remodeling and diastolic dysfunction in paroxysmal atrial fibrillation[J]. J Clin Med, 2021, 10(17): 3894. DOI:10.3390/jcm10173894 |
| [12] | 孙婷婷, 陈梦宇, 吴大鹏, 等. 老年高血压合并不同类型心房颤动患者心脏结构变化及其相关因素分析[J]. 中华老年心脑血管病杂志, 2021, 23(8): 803-806. DOI:10.3969/j.issn.1009-0126.2021.08.006 |
| [13] | Li T, Li GX, Guo XF, et al. Echocardiographic left ventricular geometry profiles for prediction of stroke, coronary heart disease and all-cause mortality in the Chinese community: a rural cohort population study[J]. BMC Cardiovasc Disord, 2021, 21(1): 238. DOI:10.1186/s12872-021-02055-w |
| [14] | Butcher SC, Pio SM, Kong WKF, et al. Left ventricular remodelling in bicuspid aortic valve disease[J]. Eur Heart J Cardiovasc Imaging, 2022, 23(12): 1669-1679. DOI:10.1093/ehjci/jeab284 |
| [15] | Malyala R, Rapi L, Nash MM, et al. Pre-transplant left ventricular geometry and major adverse cardiovascular events after kidney transplantation[J]. Ann Transplant, 2019, 24: 100-107. DOI:10.12659/AOT.913649 |
| [16] | Okada M, Tanaka N, Oka T, et al. Clinical significance of left ventricular reverse remodeling after catheter ablation of atrial fibrillation in patients with left ventricular systolic dysfunction[J]. J Cardiol, 2021, 77(5): 500-508. DOI:10.1016/j.jjcc.2020.11.007 |
| [17] | Chiesa ST, Charakida M. High-density lipoprotein function and dysfunction in health and disease[J]. Cardiovasc Drugs Ther, 2019, 33(2): 207-219. DOI:10.1007/s10557-018-06846-w |
| [18] | Besler C, Lüscher TF, Landmesser U. Molecular mechanisms of vascular effects of High-density lipoprotein: alterations in cardiovascular disease[J]. EMBO Mol Med, 2012, 4(4): 251-268. DOI:10.1002/emmm.201200224 |
| [19] | Di Castelnuovo A, Veronesi G, Costanzo S, et al. NT-proBNP (N-terminal pro-B-type natriuretic peptide) and the risk of stroke[J]. Stroke, 2019, 50(3): 610-617. DOI:10.1161/STROKEAHA.118.023218 |
| [20] | Malachias MVB, Jhund PS, Claggett BL, et al. NT-proBNP by itself predicts death and cardiovascular events in high-risk patients with type 2 diabetes mellitus[J]. J Am Heart Assoc, 2020, 9(19): e017462. DOI:10.1161/JAHA.120.017462 |
| [21] | McCallum W, Tighiouart H, Kiernan MS, et al. Relation of kidney function decline and NT-proBNP with risk of mortality and readmission in acute decompensated heart failure[J]. Am J Med, 2020, 133(1): 115-122. DOI:10.1016/j.amjmed.2019.05.047 |
| [22] | Weiss NS, Perez Trejo E, Kronmal R, et al. Incidence of atrial fibrillation in persons with very high serum levels of N-terminal pro-B-type natriuretic peptide: the multi-ethnic study of atherosclerosis[J]. Clin Epidemiol, 2021, 13: 265-272. DOI:10.2147/CLEP.S303560 |
| [23] | Sramko M, Wichterle D, Melenovs.y V, et al. Independent effect of atrial fibrillation on natriuretic peptide release[J]. Clin Res Cardiol, 2019, 108(2): 142-149. DOI:10.1007/s00392-018-1332-1 |
| [24] | Xie YT, Dang Y, Zhang FF, et al. Combination of serum TIMP-3, CA125, and NT-proBNP in predicting ventricular remodeling in patients with heart failure following acute myocardial infarction[J]. Cardiovasc Diagn Ther, 2020, 10(5): 1184-1191. DOI:10.21037/cdt-20-399 |
 2025, Vol. 34
2025, Vol. 34