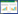2. 桐乡市第一人民医院院感公卫科,桐乡 314500;
3. 桐乡市疾病预防控制中心,桐乡 314500;
4. 桐乡市第一人民医院急诊科,桐乡 314500
汉坦病毒属于布尼亚病毒目汉坦病毒科的正汉坦病毒属,遍及全球[1-2]。根据最新数据,估计全球每年发生超过2万例汉坦病毒所致疾病,其中大部分发生在亚洲[1]。人类感染该病毒后常引起两种急性发热性疾病,肾综合征出血热(hemorrhagic fever with renal syndrome,HFRS)和汉坦病毒心肺综合征(hantavirus cardiopulmonary syndrome,HCPS)[3]。我国HFRS发病率最高,占全球已知病例的40% ~ 50%[4]。汉坦病毒的主要宿主和传染源是鼠类啮齿动物[1]。既往发现猫、狗也对这种病毒易感,也是汉坦病毒的宿主[5-6],但至今未报道致人显性感染的临床病例。
1 病例资料1例29岁的的男子,既往体健,无已知既往病史,以“持续发热、头痛和腰痛5 d”主诉入院。患者入院前10 d刚开始在宠物店工作,期间一直在宠物店,宠物店只有猫狗(均为家养)。患者有接触动物粪便、尿液、唾液等。入院前患者最高体温40.3℃,在院外接受左氧氟沙星治疗2 d后体温降至正常。患者就诊时,神志清楚,体温正常(36.7℃),测心率108次/min、呼吸16次/min、血压102/73 mmHg,头痛、腰痛明显,少尿(< 200 mL/d)。查体患者双眼结膜充血,双肾区叩痛阳性,但没有眼眶痛,颜面、颈部以及上胸部无潮红的体征,全身无出血点。
辅助检查显示:白细胞计数升高[22.6×109/L,N:(3.5~9.5)×109/L],血细胞比容降低(36.00%,N:40.00%~50.00%),血小板减少[48.0×109/L,N:(100.0~300.0)×109/L],异性淋巴细胞10%,降钙素原(prcalcition, PCT)升高(9.23 ng/mL,N:0.00~0.065 ng/mL)和C反应蛋白升高(60.4 mg/L,N:<10.0 mg/L)。血清白蛋白降低(28.4 g/L,N:40.0~55.0 g/L),血清肌酐升高(387 μmol/L,N:64~104 μmol/L),低钠血症(128.9 mmol/L,N:137.0~147.0 mmol/L)和低氯血症(92 mmol/L,N:99~110 mmol/L)。天门冬氨酸氨基转移酶(AST,26 U/L,N:5~40 U/L)和丙氨酸氨基转移酶(ALT,35 U/L,N:5~50 U/L)未升高。心肌酶谱示:肌酸激酶同工酶升高(26 U/L,N:0~24 U/L)、乳酸脱氢酶升高(522.1 U/L,N:120.0~250.0 U/L),肌酸激酶未升高。全腹部CT平扫示:双肾肾周筋膜增厚渗出明显,提示炎症考虑(图 1)。
|
| 图 1 入院时腹部CT提示双肾肾周筋膜增厚渗出明显(红色箭头) |
|
|
患者收住至本院EICU,入院诊断:脓毒症急性肾盂肾炎?急性肾功能不全血小板减少低钠血症低氯血症低蛋白血症。入院SOFA评分7分,予哌拉西林钠舒巴坦钠抗感染等治疗。住院治疗第1天患者出入量基本平衡,尿量增至(> 3 000 mL/d)。住院第3天,患者白细胞计数进一步升高(25.7×109/L),血小板计数进一步降低(35.0×109/L)。低蛋白血症较入院时加重(从28.4 g/L降至23.8 g/L),天门冬氨酸氨基转移酶升高(AST,61 U/L)。他的肾功能较前恶化,血肌酐(从387 μmol/L升至455 μmol/L)。该患者低钠血症和低氯血症得到改善。
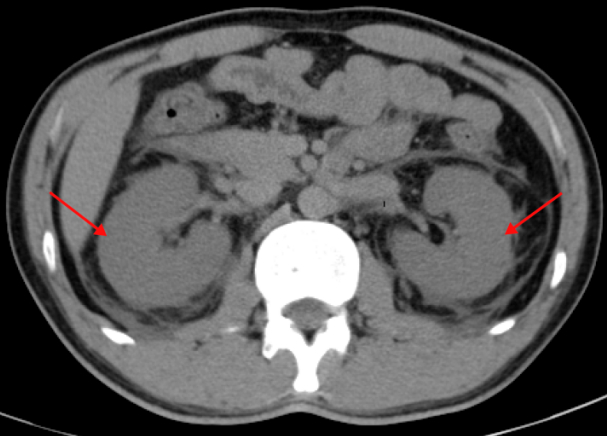
患者入院后进行的新型冠状病毒核酸检测、肥达氏试验(伤寒、副伤寒),大便培养(包括霍乱弧菌、大肠埃希菌、沙门菌、志贺菌、副溶血弧菌)、血培养(需氧菌、厌氧菌)、布氏杆菌病虎红平板凝集试验均为阴性。登革热病毒血清学检测也呈阴性。入院第3天,抽取患者的外周血进行宏基因组二代测序(metagenomic next-generation sequencing,mNGS)检查。第4天患者转至上级医院就诊,出院当天mNGS结果表明,该患者感染了汉坦病毒(hantavirus)(图 2)。进一步应用RT-PCR检出血清致病性汉坦病毒RNA阳性,测定其CT值为30.23。
|
| 图 2 患者外周血mNGS检查结果 |
|
|
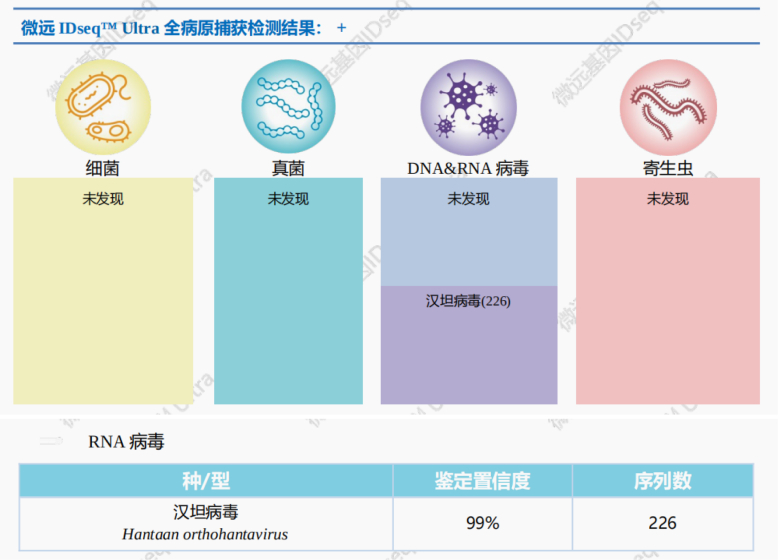
外院复查全腹CT平扫:胆囊壁水肿。腹膜、网膜稍增厚渗出,腹盆腔少量积液;两侧腹盆壁、腰背部皮下软组织水肿。两肾饱满。查肺部CT:两肺炎症,部分肺组织实变;右侧叶间裂及两侧胸腔积液伴两肺下叶萎陷。附见:心包少量积液。患者先后接受美罗培南及厄他培南抗感染治疗。转院后第4天,患者的白细胞计数基本降至正常(12.19×109/L),血小板计数恢复到正常范围。转氨酶高、低蛋白和血清肌酐(从455 μmol/L降至144 μmol/L)同时改善。转院后第5天,患者出院,功能恢复良好。患者住院期间相关指标变化见图 3。患者最终诊断为肾综合征出血热、脓毒症、急性肾功能不全、肺炎、血小板减少、低钠血症、低氯血症、低蛋白血症。
|
| 图 3 患者住院期间相关指标变化情况 |
|
|
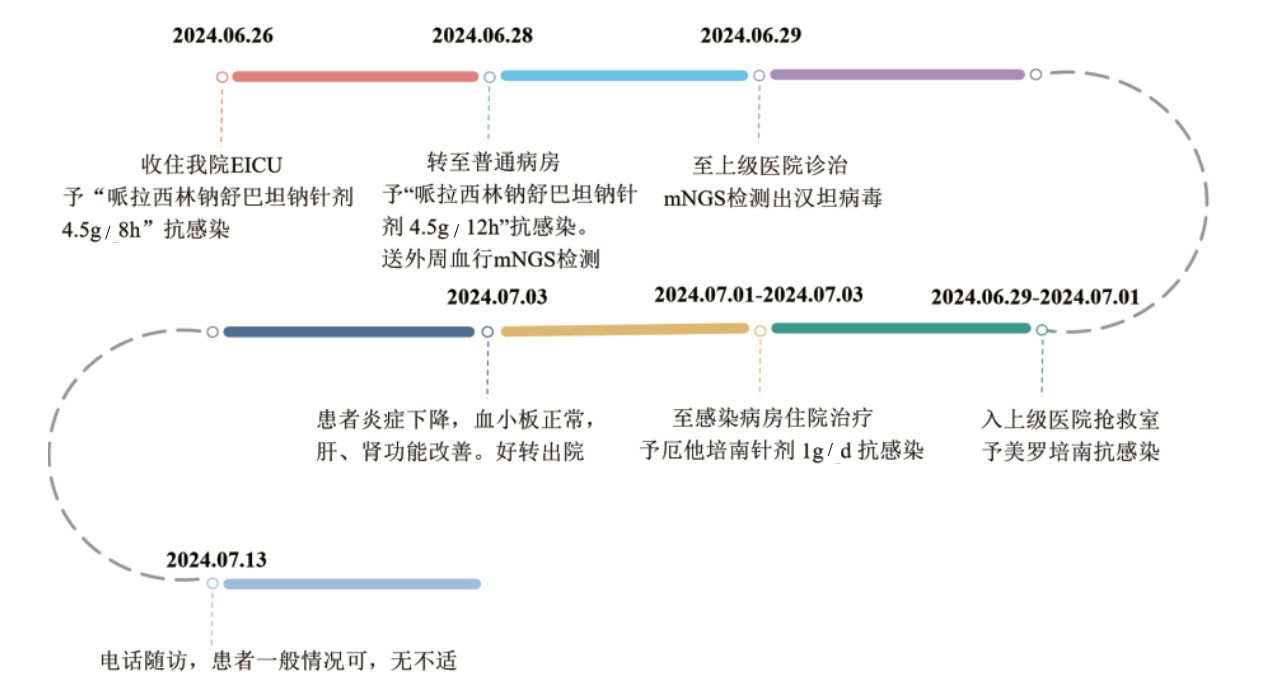
|
| 图 4 患者诊疗时间轴 |
|
|
患者出院后完成电话随访,随访时间为半年,患者自述无明显不适,肝肾功能、血常规均正常。
2 讨论HFRS是由汉坦病毒引起的,以鼠类啮齿动物为主要传染源的自然疫源性疾病。也在新的宿主中被发现,如鼩鼱、鼹鼠、蝙蝠、仓鼠、螨虫和猫狗等非啮齿动物都是汉坦病毒的宿主[1, 5-6]。汉坦病毒通过宿主的持续感染而维持在环境中。人类可通过吸入藏在受感染动物排泄物、唾液和尿液中被病毒污染的气溶胶而感染汉坦病毒[7]。目前以猫、狗为致病性汉坦病毒宿主引起人HFRS的病例暂未见报道。携带病毒的鼠尿、粪、唾液等形成尘埃或气溶胶被易感者吸入,这是传播的主要方式,还可通过消化道、接触传播[2]。人对汉坦病毒普遍易感,但感染后仅少数人发病,大部分人呈隐性感染状态[2]。在本案例中,患者没有直接接触鼠类啮齿动物的病史,但他自诉是至宠物店工作后发病。患者有吸入和直接接触猫狗粪便、尿液及唾液的可能。汉坦病毒的潜伏期范围一般为4~45 d,多为7~14 d[2]。在该病例中,患者潜伏期5 d处于典型潜伏期范围,与汉坦病毒感染的流行病学特征一致。猫狗的排泄物及唾液可能携带致病性病毒。
在该病例中,最初的鉴别诊断非常具有挑战性,因为患者没有眼眶痛,皮肤潮红和出血点,宠物店也没有老鼠活动的痕迹。患者发热、血小板减少、异常淋巴细胞和腰痛的表现提示要寻找感染原因。尽管腹部CT扫描显示肾周炎症,但尿液分析正常,以及所有其他常规微生物学检测也为阴性。细菌感染导致的脓毒症也可以表现为发热、头痛、腰痛、血小板减少、肾功能障碍等,但该患者结膜充血、PCT和C反应蛋白升高程度不匹配、异常淋巴细胞升高等难以用细菌感染来解释。
之前的研究表明,在区分细菌感染与非感染事件以及区分细菌感染与病毒感染时,PCT水平是更准确的细菌感染标志物[8]。在病毒感染的情况下,其浓度保持在正常范围内或仅略有增加。与先前证明PCT升高与细菌感染而非病毒感染相关的研究结果相反,Jereb等[9]研究发现,55%的汉坦病毒感染患者血清PCT浓度升高。之后的研究也表明,在与汉坦病毒相关的HFRS中,PCT水平显著升高[10-13],而且PCT的升高和HRFS的严重程度以及病死率相关[12-13]。PCT升高的原因和肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、白介素6(interleukin-6, IL-6)等细胞因子的刺激以及合并细菌感染后内毒素的升高有关[13]。Fan等[13]的研究发现HFRS患者住院期间继发细菌感染的比例达到59.6%,而且继发细菌感染后PCT会显著升高(2 ng/mL vs. 0.94 ng/mL, P=0.016,相较于未继发细菌感染)。本病例中,患者入院时PCT浓度升高至9.23 ng/mL,与上述研究中HFRS患者的PCT变化特征一致。本病例属于轻中型感染,相较于既往文献中轻症组的PCT值1.39(0.59,3.32)[12]、0.81(0.03,23.39)[13]明显升高,结合患者肺部CT渗出改变,需考虑继发细菌感染,故治疗上予抗生素抗感染治疗。抗生素的选择需避免氨基糖苷类,以免加重肾损害[14]。结合本地区细菌耐药情况和本例患者的病情,考虑继发肺部革兰阴性杆菌感染,故本例患者选用了碳青霉烯类抗生素进行抗感染治疗。因此,笔者考虑患者存在不典型病原体汉坦病毒感染可能,因为在发病前5 d,有与猫狗宿主动物和其排泄物的直接接触史;血液常规化验出现“三高一低”,即外周血白细胞计数增高,异型淋巴细胞比率增高,血红蛋白增高和血小板计数减低;具有热退病重的特点。
传统可用于确诊HFRS的检测方法包括:血清特异性IgM抗体、IgG抗体滴度、标本中分离到汉坦病毒或标本中检出汉坦病毒RNA,但容易漏诊、误诊,导致诊断困难[15]。mNGS在诊治感染性疾病的准确性和时效性方面显示出了一定的优势,正越来越广泛地被应用于临床实践[2]。王海旭等[15]研究表明,mNGS可作为传统检测手段的有效补充,提高HFRS明确诊断率,减少漏诊与误诊事件。而目前临床上使用mNGS技术检测汉坦病毒仅有少量个案报道。幸运的是,通过mNGS直接在患者血液中检测到汉坦病毒,未发现其他细菌、真菌、寄生虫等,并通过RT-PCR进一步分析证实。或许,这是首次报道了以猫、狗为致病性汉坦病毒宿主引起人显性感染的病例。
mNGS通过对临床样本中直接提取的DNA和(或)RNA进行高通量测序,再经过数据库比对与生物信息学分析,可一次性完成细菌、真菌、病毒和寄生虫等多种病原体检测,实现感染性疾病的精准诊断[16]。在本例患者的血液样本中通过mNGS检测出汉坦病毒,并在随后的RT-PCR进行验证,帮助我们尽早识别感染类型,尽快制定有效的治疗方案,并尽可能准确地判断患者可能的预后。如果没有考虑采用mNGS方法,该病例可能诊断为急性肾盂肾炎,并接受经验性治疗。因此,mNGS适用于常规检测结果为阴性的不明原因感染患者。当遇到困难、危重、复杂的感染患者时,可以尽快将mNGS与其他检测同时进行,使mNGS技术成为感染性病原体诊断的重要组成部分和补充,并与其他传统病原体检测方法形成“快速诊断体系”。
综上,本文报道了一例诊断基于mNGS和RT-PCR检测, 以猫、狗为致病性汉坦病毒宿主致人显性感染的临床确诊病例。本报道强调了在有接触动物粪便、尿液、唾液的病史和血小板减少的发热患者中怀疑汉坦病毒感染的重要性,尽管没有皮肤和黏膜的出血表现以及无皮肤潮红的体征。本病例表明,mNGS有助于早期识别病原体,是病原体检测的有力工具,尤其是在症状不典型的患者中。在未来,需要更多的实践来评估mNGS在临床应用中的价值。同时,本文也证明了PCT血清浓度升高不仅是细菌感染的标志物,也可能是汉坦病毒感染的结果,这与以往的报道一致[9-11]。然而,为了明确排除或广泛接受PCT作为汉坦病毒感染患者的实验室诊断试验,需要在更大的人群中开展明确定义的前瞻性研究。不足的是,在本病例中,没有留取猫、狗血液样本用于血清学和分子检测以进一步证明,这是本研究的主要局限性。
利益冲突 所有作者声明无利益冲突
| [1] | Jiang H, Zheng XY, Wang LM, et al. Hantavirus infection: a global zoonotic challenge[J]. Virol Sin, 2017, 32(1): 32-43. DOI:10.1007/s12250-016-3899-x |
| [2] | 中华预防医学会感染性疾病防控分会, 中华医学会感染病学分会. 肾综合征出血热防治专家共识[J]. 中华传染病杂志, 2021, 39(05): 257-265. DOI:10.3760/cma.j.cn311365-20210224-00067 |
| [3] | Wang W, Zhang Y, Li Y, et al. Dysregulation of the β3 integrin-VEGFR2 complex in Hantaan virus-directed hyperpermeability upon treatment with VEGF[J]. Arch Virol, 2012, 157(6): 1051-1061. DOI:10.1007/s00705-012-1245-7 |
| [4] | Sehgal A, Mehta S, Sahay K, et al. Hemorrhagic fever with renal syndrome in Asia: history, pathogenesis, diagnosis, treatment, and prevention[J]. Viruses, 2023, 15(2): 561. DOI:10.3390/v15020561 |
| [5] | 罗兆庄, 王以银, 丁一新, 等. 家猫作为流行性出血热传染源的研究[J]. 安徽医学, 1990(2): 41-44. |
| [6] | 张云, 沈建中, 张炳根, 等. 从狗肺中分离到流行性出血热病毒[J]. 病毒学杂志, 1989, 4(1): 76-79. |
| [7] | Jiang W, Wang PZ, Yu HT, et al. Development of a SYBR Green Ⅰ based one-step real-time PCR assay for the detection of Hantaan virus[J]. J Virol Methods, 2014, 196: 145-151. DOI:10.1016/j.jviromet.2013.11.004 |
| [8] | Gendrel D, Raymond J, Coste J, et al. Comparison of procalcitonin with C-reactive protein, interleukin 6 and interferon-alpha for differentiation of bacterial vs. viral infections[J]. Pediatr Infect Dis J, 1999, 18(10): 875-881. DOI:10.1097/00006454-199910000-00008 |
| [9] | Jereb M, Lunaček NK, Kotar T, et al. Procalcitonin in hantavirus infections[J]. Scand J Clin Lab Invest, 2011, 71(4): 287-291. DOI:10.3109/00365513.2011.560675 |
| [10] | Bunz H, Weyrich P, Peter A, et al. Urinary Neutrophil Gelatinase-Associated Lipocalin (NGAL) and proteinuria predict severity of acute kidney injury in Puumala virus infection[J]. BMC Infect Dis, 2015, 15: 464. DOI:10.1186/s12879-015-1180-9 |
| [11] | Latus J, Kitterer D, Segerer S, et al. Determination of procalcitonin levels in patients with nephropathia epidemica - a useful tool or an unnecessary diagnostic procedure?[J]. Kidney Blood Press Res, 2015, 40(1): 22-30. DOI:10.1159/000368479 |
| [12] | 段小霞, 刘军芳, 杨琴琴, 等. 肾综合征出血热患者实验室指标对重症患者的预警价值及模型构建[J]. 中华急诊医学杂志, 2024, 33(7): 1006-1010. DOI:10.3760/cma.j.issn.1671-0282.2024.07.020 |
| [13] | Fan XD, Deng H, Sang J, et al. High serum procalcitonin concentrations in patients with hemorrhagic fever with renal syndrome caused by hantaan virus[J]. Front Cell Infect Microbiol, 2018, 8: 129. DOI:10.3389/fcimb.2018.00129 |
| [14] | 黄长形, 姜泓, 白雪帆. 肾综合征出血热诊疗陕西省专家共识[J]. 陕西医学杂志, 2019, 48(3): 275-288. DOI:10.3969/j.issn.1000-7377.2019.03.001 |
| [15] | 王海旭, 赵颖颖, 闫浩, 等. 宏基因二代测序在肾综合征出血热重症患者中的诊断价值探讨[J]. 中华急诊医学杂志, 2023, 32(11): 1525-1529. DOI:10.3760/cma.j.issn.1671-0282.2023.11.018 |
| [16] | Gu W, Miller S, Chiu CY. Clinical metagenomic next-generation sequencing for pathogen detection[J]. Annu Rev Pathol, 2019, 14: 319-338. DOI:10.1146/annurev-pathmechdis-012418-012751 |
 2025, Vol. 34
2025, Vol. 34