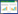2. 浙江省心脏功能重建重点实验室,杭州 310009
2. State Key Laboratory of Transvascular Implantation Devices, Hangzhou 310009, China
近年来,我国急性心肌梗死(acute myocardial infarction, AMI)患者病死率显著上升[1-2]。AMI可引发多种并发症,已成为主要致死原因之一[3-7]。AMI早期可出现心肌壁破裂,晚期则因心脏重构导致纤维化[8-9]。在AMI发生后,受损心肌组织启动修复机制以防止室壁破裂[10]。早期纤维化通过分泌胶原维持心脏结构稳定,但中晚期过度纤维化则可引起不良心室重构,甚至发展为心力衰竭[11-12]。因此,合理干预心脏纤维化的过程对于AMI后有效修复至关重要。目前关于胰岛素样生长因子结合蛋白5(insulin-like growth factor binding protein 5, IGFBP5)在AMI后心脏纤维化中的作用研究较少。IGFBP5表达上调是内皮样成纤维细胞导致心脏功能障碍的关键介质[13]。通过生物信息学分析发现,IGFBP5在人类长期缺血组织及小鼠心梗组织中的表达显著高于正常组织[14-15],提示其可能与心脏纤维化密切相关。本研究拟通过建立AMI模型,结合免疫荧光、免疫印迹、Elisa等检测方法,来探讨IGFBP5在AMI后对心脏重构的影响。
1 材料与方法 1.1 小鼠AMI模型建立选用20只清洁级雄性C57BL/6小鼠(8~10周龄),购自上海斯莱克实验动物有限公司,饲养在浙江大学医学院附属第二医院实验动物中心屏障环境中。随机分为两组:假手术组(sham)和AMI组。sham组仅行麻醉、开胸与关胸操作;AMI组则通过结扎冠状动脉左前降支建立AMI模型。实验严格遵循《中华人民共和国实验动物管理条例》,并获伦理委员会批准[(2024年度)第(224)号]。
1.2 主要仪器与试剂主要仪器包括小动物超声影像系统(富士,加拿大);正置荧光显微镜及石蜡切片机(徕卡,德国);细胞培养箱(Thermo Fisher,美国);化学发光成像系统(思拓凡,美国)等。
主要试剂包括磷酸盐缓冲溶液(PBS)(森瑞生物科技有限公司,中国);高糖DMEM培养基(Gibco,美国);新生胎牛血清(BI,以色列);纤连蛋白[fibronectin、α-平滑肌肌动蛋白(α-SMA)]及心肌肌钙蛋白(cardiac troponin,cTnI,Abcam,美国);骨膜蛋白(Periostin,R&D,美国);原代心肌细胞分离试剂盒(美天旎,美国);转化生长因子-β(transforming growth factor-β, TGF-β)(R&D,美国);IGFBP5 ELISA试剂盒(上海酶联生物科技有限公司,中国);转染试剂(lipofectamine RNAiMax)和小干扰RNA(small interfering RNA, siRNA,Santa Cruz,美国)。
1.3 实验分组在体内实验中,动物分为3组:sham组(n=6),AMI早期组(AMI后第3天,n=7),AMI晚期组(AMI后第28天,n=7)。
在体外实验中,细胞实验分为4组:(1)WT+nc组,正常细胞+IGFBP5阴性对照;(2)WT+si组,正常细胞+IGFBP5干扰表达;(3)TGFβ+nc组,TGFβ+IGFBP5阴性对照;(4)TGFβ+si组,TGFβ+IGFBP5干扰表达。
1.4 体内实验检测方法 1.4.1 超声评估心功能各组小鼠麻醉后使用40 Hz探头进行超声检测,通过VevoLAB (v5.7.1) 分析每组M模式下的左室心脏收缩功能[射血分数(ejection fraction, EF)]。
1.4.2 心肌组织纤维化相关蛋白及IGFBP5表达检测分别取各小鼠梗死区域心肌组织裂解,BCA蛋白定量;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测心脏纤维化相关蛋白(fibronectin、Periostin、α-SMA及IGFBP5)表达。用7.5% SDS-PAGE分离、转膜、封闭后分别稀释一抗,4 ℃过夜于第2天显影,用Image Lab v6.0分析相应蛋白灰度值。
1.4.3 血清IGFBP5检测取不同时间点小鼠外周血,室温离心10 min后,取血清并分装、保存。按照试剂盒说明书,检测IGFBP5浓度。设置标准品梯度:5 000 pg/mL至156.25 pg/mL倍比稀释。
1.4.4 免疫荧光染色观察IGFBP5在心肌组织中的表达梗死区域心肌组织经4%甲醛固定、石蜡切片后,用IGFBP5(1∶200)和cTNI(1∶400)抗体共染,荧光二抗标记后显微镜拍照,Image Pro Plus 6.1分析。
1.5 体外实验检测方法分离小鼠心肌成纤维细胞,6孔板接种2×105细胞/孔,转染si-IGFBP5或阴性对照质粒,TGFβ刺激后裂解细胞,Western blot检测纤维化相关蛋白。
1.6 统计学方法数据以均数±标准差(x±s),使用GraphPad Prism(v.9.0)统计。两组间正态分布独立样本t检验、多组间比较采用单因素方差分析及Tukey事后多重比较检验;不符合正态分布数据采用Kruskal-Wallis分析差异。以P < 0.05为差异有统计学意义。
2 结果 2.1 体内实验结果术后因呼吸抑制和感染,心梗早期组和晚期组小鼠各死亡1只和2只,最终各组存活小鼠分别为6、6和5只。
2.1.1 心脏收缩功能AMI小鼠在各时间点EF%均显著低于假手术组(P < 0.0001),表明建模成功(图 1)。AMI后第3天,sham组EF为(73.97±12.95)%,AMI组为(39.85±13.71)% (P=0.0002);AMI后第28天,sham组EF为(74.37±10.99)%,AMI组为(39.52±5.21)% (P=0.0002)。
|
| 注:A为各组小鼠心梗前基线、心梗后3 d及心梗后28 d心脏收缩功能;B为各组小鼠不同时间点左室射血分数;sham组(n=6),心梗3 d (n=6),心梗28 d (n=5);EF%为心脏射血分数(代表小鼠心脏收缩功能) 图 1 不同时间小鼠心脏收缩功能对比 Fig 1 Comparison of cardiac contraction function after myocardial infarction in mice at different times |
|
|
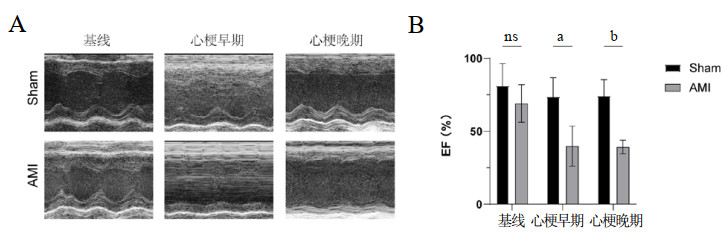
与Sham组相比,AMI后第3天,IGFBP5和α-SMA表达显著升高(P=0.0391, P=0.0019);与第3天相比,第28天时Fibronectin、Periostin和IGFBP5表达进一步升高(P=0.0013, P=0.0056, P=0.015)(图 2)。
|
| 注:A为不同目蛋白表达情况,每组小鼠数量4只;B~E为不同蛋白条带相对表达量对比分析,与Sham组相比,aP < 0.05,与AMI早期组相比,bP < 0.05,与Sham组相比,AMI晚期cP < 0.05 图 2 各组小鼠在心梗不同时间点纤维化蛋白及IGFBP5表达 Fig 2 Expression of fibrotic proteins and IGFBP5 in different time points of myocardial infarction in various groups of mice |
|
|
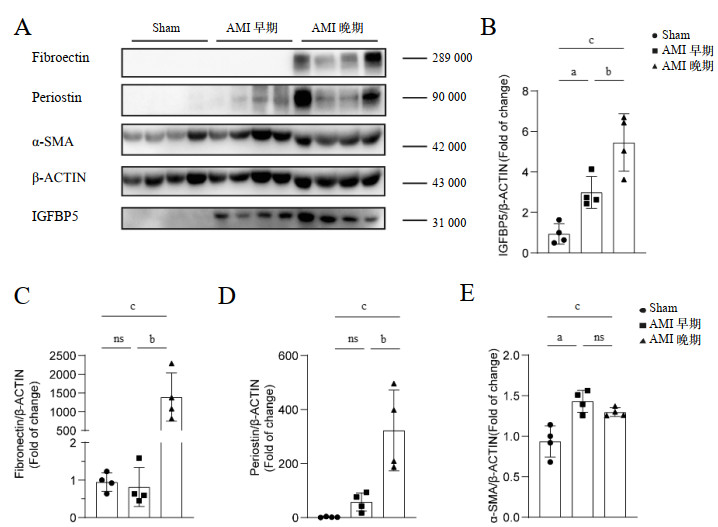
免疫荧光显示心梗后28 d梗死周边区IGFBP5阳性细胞相较于心梗后3 d明显升高(349.68±111.46 vs. 70.16±16.76, P=0.0017),表明心梗晚期中IGFBP5表达显著增高(图 3)。
|
| 注:A为不同时间段小鼠心脏梗死周边区荧光结果,其中IGFBP5表示红色荧光,cTNI为心肌肌钙蛋白,为心肌组织特异性分子标记表示为绿色荧光,DAPI为表示为细胞核;B为IGFBP5在组织中表达量对比;AMI 3 d组4只,心梗28 d组5只;与AMI早期组相比,aP < 0.05 图 3 IGFBP5在心梗周边区不同时间点表达情况 Fig 3 The expression of IGFBP5 in the peripheral area of myocardial infarction at different stages |
|
|
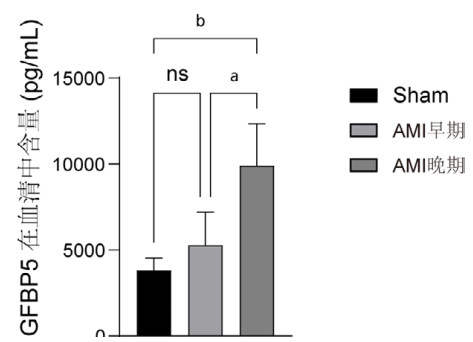
小鼠AMI后不同时间点血清中IGFBP5含量与蛋白表达一致。与sham组相比,AMI后第3天血清中IGFBP5含量有上升趋势,但差异无统计学意义[(3 811.01±15.98) pg/mL vs. (5 287.63±1 923.34) pg/mL, P=0.6916]。与sham组以及AMI后第3天相比,AMI后第28 d血清中IGFBP5含量明显升高(9 918.55±2 424.43 pg/mL)(P < 0.01)(图 4)。
|
| 注:假手术组(n=6),心梗3 d组(n=9),心梗28 d组(n=11) 图 4 小鼠心梗前后不同时期血清中IGFBP5含量 Fig 4 The content of IGFBP5 in serum of mice at different stages after myocardial infarction |
|
|
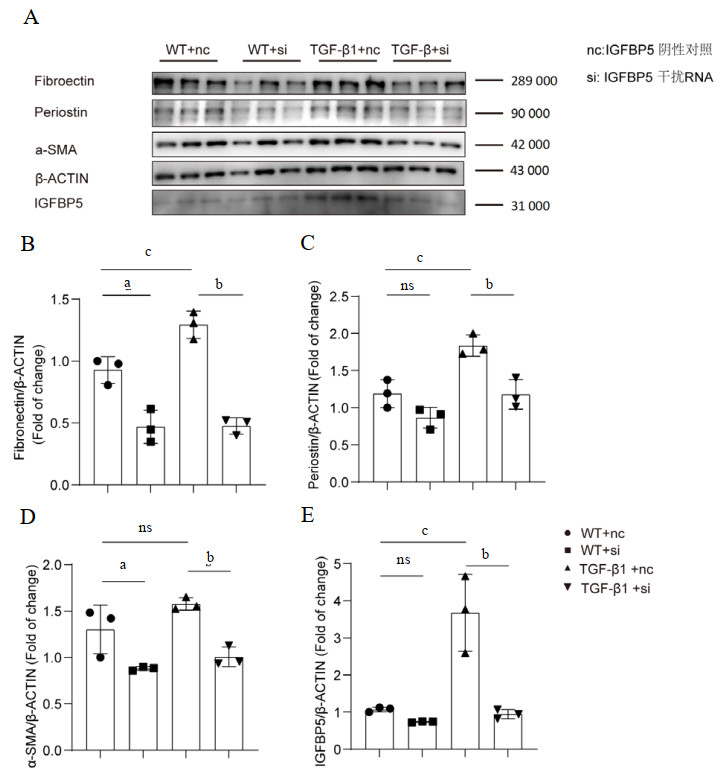
在心肌成纤维细胞中,与WT+nc组相比,TGFβ1+nc组纤维化相关蛋白均明显升高(P分别等于0.0131,0.0071,0.0021和0.0013),表明TGFβ促进成纤维细胞转分化;与WT+nc组相比,WT+si组Fibronectin(P=0.0035)和α-SMA(P=0.0458)的表达显著减少,IGFBP5(P=0.8627)和Periostin(P=0.1692)有下降趋势;与TGFβ+si组相比,TGFβ+nc组Fibronectin(P < 0.0001)、Periostin(P=0.0065)、α-SMA(P=0.0004)及IGFBP5(P=0.0010)显著下降,表明干扰IGFBP5表达能够抑制体外模拟的心肌成纤维细胞纤维化(图 5)。
|
| 注:A为不同目蛋白表达情况;每组4只;B~E为不同蛋白条带相对表达量对比分析;ns为差异无统计学意义;a为WT+nc对比WT+si;b为TGFβ+nc对比TGFβ+si;c为WT+nc对比TGFβ+nc 图 5 IGFBP5干扰减缓乳鼠心肌成纤维细胞体外转分化 Fig 5 IGFBP5 interference expression attenuated the trans-differentiation of neonatal mice cardiac fibroblasts induced in vitro |
|
|
我国AMI发病率呈持续上升趋势[16-17]。尽管当前治疗手段可一定程度缓解症状,但部分治疗可能造成心肌进一步损伤[18]。因此,在AMI早期进行靶向干预,乃至预防心梗发生尤为重要。
本研究前期通过对比临床样本数据库及小鼠心梗区域单细胞转录组组学数据库发现,IGFBP5在因长期缺血导致心脏患者的心肌组织及细胞中高表达,同时也在小鼠心梗长期缺血区域高表达,预测其可能影响心梗后纤维化。小鼠心梗中证明,IGFBP5在AMI中随心梗的进展表达持续升高,同时诱导了细胞外机制和促纤维化蛋白的表达,血清与组织表达变化趋势一致,然而,关于促进纤维化是由IGFBP-5直接介导还是通过IGFBP-5下游的其他促纤维化因子介导的问题仍需进一步研究证实。已有研究指出,IGFBP5可能通过调控心肌细胞修复延缓心室重构[19],同时促进成纤维细胞活化和纤维化。TGFβ激活纤维化相关基因(如α-SMA、胶原蛋白)表达,驱动肌成纤维细胞分化,加剧心肌纤维化[20-21]。此外,IGFBP5作为潜在预后生物标志物,其升高与AMI不良预后(如心衰、死亡)显著相关,提示其可能通过促进纤维化和心室重构影响患者结局[22]。IGFBP5还可能通过炎症反应与氧化应激途径,进一步加重心梗后纤维化[23]。由于心梗的发展是一个极其复杂的过程,涉及多细胞类型(如巨噬细胞、成纤维细胞、心肌细胞及内皮细胞等)交互作用及多信号通路的动态调控,明确IGFBP5在心梗中通过哪些转录因子激活纤维化信号通路,是否与心梗发展的炎症与免疫调控或氧化应激与细胞死亡,机械应力或表观遗传学重编程都需要明确。
本研究探讨了IGFBP5在AMI进展中的作用,对于IGFBP5治疗AMI还需进一步在体内验证。后续可通过干扰IGFBP5表达及IGFBP5过表达等实验对IGFBP5在心梗的干预作用进行验证。另外IGFBP5对于心梗发展干预的时间及干预的手段还需要深入挖掘,纤维化作为一把双刃剑在心梗不同时期起到不同的作用,后续研究可以通过纳米载体靶向递送小分子药物等手段,通过不同时期的干预观察心梗小鼠终末期的心脏收缩功能,或者与其他药物的协同作用减缓心梗后纤维化,同时结合翻译后修饰等其他手段进一步明确IGFBP5在抑制心肌纤维化治疗心梗中的作用。
综上所述,本研究创新点在于证实IGFBP5表达随AMI发生时间及心梗面积增大升高,心脏收缩功能降低逐步升高。体外干预IGFBP5表达可以抑制成纤维细胞转分化及胶原分泌,推测IGFBP5是心梗后心室重构和纤维化关键介质。后续深入研究IGFBP5的调控机制及靶向干预策略,有望为心梗防治提供新思路,降低高病死率。
利益冲突 所有作者声明无利益冲突
作者贡献声明 赵菁:研究设计、实验操作、论文撰写、修改;陈其名:实验技术指导;洪婷婷:数据收集、整理及统计学分析
| [1] | Teng XH, Sun YR, Zhao LD, et al. Study on the management effect of chronic disease intelligent information management platform in post percutaneous coronary intervention patients[J]. Technol Health Care, 2024, 32(6): 4475-4484. DOI:10.3233/THC-240621 |
| [2] | Sun XY, Chen JP, Shang JJ, et al. Traditional chinese medicine injections with activating blood circulation, equivalent effect of anticoagulation or antiplatelet, for acute myocardial infarction: a systematic review and meta-analysis of randomized clinical trials[J]. Complement Ther Med, 2024, 82: 103039. DOI:10.1016/j.ctim.2024.103039 |
| [3] | Matteucci M, Ronco D, Corazzari C, et al. Surgical repair of postinfarction ventricular septal rupture: systematic review and meta-analysis[J]. Ann Thorac Surg, 2021, 112(1): 326-337. DOI:10.1016/j.athoracsur.2020.08.050 |
| [4] | Toufic El Hussein M, Mikhail M. Evidence-based recommendations: management of left ventricular Thrombus post-acute myocardial infarction[J]. Dimens Crit Care Nurs, 2022, 41(6): 313-320. DOI:10.1097/DCC.0000000000000553 |
| [5] | Zhu LL, Liu YY, Wang KK, et al. Regulated cell death in acute myocardial infarction: Molecular mechanisms and therapeutic implications[J]. Ageing Res Rev, 2025, 104: 102629. DOI:10.1016/j.arr.2024.102629 |
| [6] | Liao B, Han ZY. Roflumilast reduces myocardial ischemia reperfusion injury in vivo and in vitro by activating the AMPK signaling pathway[J]. Exp Ther Med, 2023, 25(6): 302. DOI:10.3892/etm.2023.12001 |
| [7] | Schnur A, Rav Acha M, Loutati R, et al. Incidence of ventricular fibrillation and sustained ventricular tachycardia complicating non-ST segment elevation myocardial infarction[J]. J Clin Med, 2024, 13(8): 2286. DOI:10.3390/jcm13082286 |
| [8] | Wu QY, Song JL, Liu WY, et al. Recent advances in positron emission tomography for detecting early fibrosis after myocardial infarction[J]. Front Cardiovasc Med, 2024, 11: 1479777. DOI:10.3389/fcvm.2024.1479777 |
| [9] | Zha YF, Luo XY, Ge ZW, et al. KIAA1199/CEMIP knockdown attenuates cardiac remodeling post myocardial infarction by activating TSP4 pathway in mice[J]. Biochim Biophys Acta Mol Basis Dis, 2024, 1870(8): 167473. DOI:10.1016/j.bbadis.2024.167473 |
| [10] | Gil H, Goldshtein M, Etzion S, et al. Defining the timeline of periostin upregulation in cardiac fibrosis following acute myocardial infarction in mice[J]. Sci Rep, 2022, 12(1): 21863. DOI:10.1038/s41598-022-26035-y |
| [11] | Künzel SR, Winter L, Hoffmann M, et al. Investigation of mesalazine as an antifibrotic drug following myocardial infarction in male mice[J]. Physiol Rep, 2023, 11(17): e15809. DOI:10.14814/phy2.15809 |
| [12] | Park S, Park SJ, Park DW. Percutaneous coronary intervention for left main coronary artery disease present status and future perspectives[J]. JACC Asia, 2022, 2(2): 119-138. DOI:10.1016/j.jacasi.2021.12.011 |
| [13] | Li Y, Ni SH, Liu X, et al. Crosstalk between endothelial cells with a non-canonical EndoMT phenotype and cardiomyocytes/fibroblasts via IGFBP5 aggravates TAC-induced cardiac dysfunction[J]. Eur J Pharmacol, 2024, 966: 176378. DOI:10.1016/j.ejphar.2024.176378 |
| [14] | Li GH, Ni C, Wang JC, et al. Dynamic molecular atlas of cardiac fibrosis at single-cell resolution shows CD248 in cardiac fibroblasts orchestrates interactions with immune cells[J]. Nat Cardiovasc Res, 2025, 4(4): 380-396. DOI:10.1038/s44161-025-00617-1 |
| [15] | Amrute JM, Luo X, Penna V, et al. Targeting immune-fibroblast cell communication in heart failure[J]. Nature, 2024, 635(8038): 423-33. DOI:10.1038/s41586-024-08008-5 |
| [16] | Zhou Y, Wu XL, Qin CT, et al. Effect of cardiac rehabilitation nursing on patients with myocardial infarction[J]. Altern Ther Health Med, 2025, 31(1): 452-458. |
| [17] | Yang M, Huang YT, Hu XW, et al. Effect of cardiac rehabilitation care after coronary intervention on cardiac function recovery and negative mood in patients with myocardial infarction[J]. World J Clin Cases, 2024, 12(1): 59-67. DOI:10.12998/wjcc.v12.i1.59 |
| [18] | Sanchez-Fernandez E, Guerra-Ojeda S, Suarez A, et al. Histone deacetylase inhibitors as a promising treatment against myocardial infarction: a systematic review[J]. J Clin Med, 2024, 13(24): 7797. DOI:10.3390/jcm13247797 |
| [19] | Zhu QQ, Lu XY, Chen ML, et al. IGFBP5 affects cardiomyocyte survival and functional recovery in mice following myocardial ischemia[J]. Commun Biol, 2024, 7(1): 1594. DOI:10.1038/s42003-024-07304-0 |
| [20] | Zhao QW, Shao TH, Huang S, et al. The insulin-like growth factor binding protein-microfibrillar associated protein-sterol regulatory element binding protein axis regulates fibroblast-myofibroblast transition and cardiac fibrosis[J]. Br J Pharmacol, 2024, 181(15): 2492-2508. DOI:10.1111/bph.16314 |
| [21] | 苏强李浪. miRNA-125b在心脏疾病中的研究进展[J]. 中华急诊医学杂志, 2018, 27(7): 718-720. DOI:10.3760/cma.j.issn.1671-0282.2018.07.003 |
| [22] | Zhu QQ, Cheang I, Guo QX, et al. Serum IGFBP5 as a predictor of major adverse cardiac events in patients with acute myocardial infarction[J]. Int J Cardiol, 2024, 411: 132268. DOI:10.1016/j.ijcard.2024.132268 |
| [23] | Ma XX, Meng QS, Gong SY, et al. IL-27 promotes cardiac fibroblast activation and aggravates cardiac remodeling post myocardial infarction[J]. Heliyon, 2023, 9(6): e17099. DOI:10.1016/j.heliyon.2023.e17099 |
 2025, Vol. 34
2025, Vol. 34