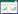食管胃底静脉曲张破裂出血(esophageal and gastric varices rupture bleeding, EGVB)是肝硬化门静脉高压症患者的一种严重急性并发症,具有较高的病死率和再出血率。全球范围内,EGVB的发病率和死亡率均较高,尤其是在亚洲和非洲地区,由于乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)的流行,肝硬化患者数量庞大,EGVB的发生率更是居高不下。在中国,随着生活方式的改变和人口老龄化,EGVB的发病率也在逐年上升,给社会和家庭带来了沉重的负担。传统的治疗方法包括药物治疗、内镜下治疗和手术治疗。药物治疗效果有限,且不能解决已经破裂的静脉曲张。内镜下治疗,如硬化剂注射和套扎术,虽然能够直接封闭破裂的静脉曲张,但存在操作复杂、并发症多和再出血率高等问题。手术治疗虽然效果确切,但创伤大、风险高,且不适用于所有患者[1]。
随着内镜技术的飞速发展,超声引导下内镜治疗(EUS-guided therapy)作为一种新兴的治疗手段,因其精准、微创的特点而受到广泛关注。EUS-SVD(endoscopic ultrasound guided selective variceal devascularization)通过超声内镜引导,能够精确定位静脉曲张,并在直视下进行精准治疗,有效减少了传统内镜治疗的局限性[1-2]。EUS-SVD不仅能够减少出血和再出血的风险,还能降低并发症的发生率,提高患者的生存质量[3]。因此,EUS-SVD的研究和应用对于改善EGVB患者的预后具有重要的临床意义。本研究旨在评估EUS-SVD在EGVB治疗中的疗效及安全性,为临床治疗提供更多的科学依据。
1 资料与方法 1.1 研究对象本研究纳入了2021年1月至2023年12月期间,本院收治的食管胃底静脉曲张破裂出血患者。纳入标准包括:(1)经内镜确诊的食管胃底静脉曲张破裂出血患者;(2)年龄在18岁以上;(3)Child-Pugh分级B或C级的肝硬化患者;(4)无内镜治疗禁忌证。排除标准包括:(1)合并有其他严重消化道出血原因的患者;(2)严重心肺功能障碍无法耐受内镜治疗的患者;(3)凝血功能障碍或正在使用抗凝药物的患者;(4)既往接受过食管胃底静脉曲张破裂出血治疗的患者。所有患者均签署了知情同意书,研究方案得到了医院伦理委员会的批准(2025(研)-109-01)。
1.2 治疗方法EUS-SVD的具体操作流程如下:首先,患者接受术前的全面评估,包括血常规、凝血功能、肝功能、肾功能等实验室检查,以及心电图、胸部X线等辅助检查。在内镜室,患者取左侧卧位,经口插入超声内镜至胃内,利用超声内镜的多普勒功能识别并避开血管,精确定位静脉曲张。然后,使用EUS引导下的穿刺针穿刺至目标静脉曲张,注射适量的硬化剂或组织胶,直至静脉曲张闭塞。技术要点包括:(1)精确的静脉曲张定位;(2)避免穿刺过程中的血管损伤;(3)控制注射剂量,防止过度注射导致的并发症。
传统胃镜治疗组:传统胃镜治疗组采用硬化剂注射联合组织胶注射治疗。具体操作为:在内镜直视下,使用硬化剂注射针直接穿刺静脉曲张,注射适量硬化剂,随后注射组织胶以闭塞静脉曲张。操作过程中注意避免注射针误入血管外组织,减少并发症的发生。
1.3 疗效评估治疗效果的评估包括出血控制、再出血率和并发症等几个方面。出血控制时间、完全止血时间和住院时间作为治疗有效率主要的临床指标进行比较。止血后再出血率定义为内镜治疗后3个月内再次出现静脉曲张破裂出血的比例。并发症包括异位栓塞、感染、穿孔等,通过临床症状、实验室检查和影像学检查进行评估。所有患者的随访时间为6个月至1年,以评估长期疗效和安全性。
2 结果本研究共纳入了43例肝硬化食管胃底静脉曲张患者,其中22例接受了EUS-SVD治疗,21例接受了传统胃镜下硬化剂组织胶注射治疗。以下是详细的统计数据和对比分析:根据上述表格和图表,EUS-SVD治疗组在术后3个月内再出血率显著低于传统胃镜治疗组(P=0.025),显示出EUS-SVD治疗在控制再出血方面的优越性。此外,EUS-SVD治疗组的胃底排胶溃疡发生率也明显低于传统胃镜治疗组(P=0.011),表明EUS-SVD治疗能够减少术后并发症的发生。这些结果表明,EUS-SVD治疗是一种安全、有效的食管胃底静脉曲张治疗方法,能够减少再出血和并发症的风险。
| 指标 | EUS-SVD治疗组(n=22) | 传统胃镜治疗组(n=21) | P值 |
| 年龄(岁) | 51.3±8.5 | 52.1±8.2 | 0.64 |
| 性别(男/女) | 17/5 | 15/6 | 0.75 |
| Child-Pugh分级(B/C) | 13/9 | 11/10 | 0.78 |
| 食管静脉曲张分级 | 1.9±0.5 | 1.8±0.3 | 0.49 |
| 指标 | EUS-SVD治疗组(n=22) | 传统胃镜治疗组(n=21) | P值 |
| 硬化剂用量(mL) | 7.34±2.90 | 7.47±3.10 | 0.96 |
| 组织胶用量(mL) | 1.32±0.52 | 1.35±0.63 | 0.85 |
| 术后2个月内食管静脉曲张治疗有效率(%) | 62.6 | 51.3 | 0.44 |
| 术后3个月内再出血率(%) | 4.8 | 30.4 | 0.025 |
| 并发症 | EUS-SVD治疗组(n=22) | 传统胃镜治疗组(n=21) | P值 |
| 术后疼痛(%) | 13.0 | 18.8 | 0.36 |
| 发热(%) | 9.0 | 12.3 | 0.47 |
| 恶心呕吐(%) | 14.6 | 19.1 | 0.56 |
| 术后72小时内再出血率(%) | 0 | 0 | 1.00 |
| 胃底排胶溃疡(%) | 9.0 | 42.8 | 0.011 |
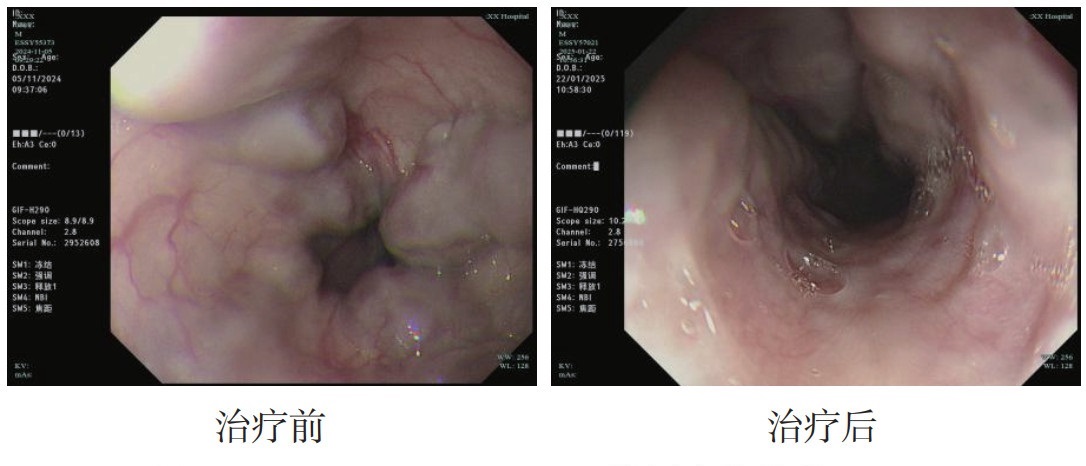
|
| 图 1 EUS-SVD治疗前后食管胃底静脉曲张变化 |
|
|
治疗阶段
静脉曲张直径变化(mm)
静脉曲张等级
治疗前
10
3
治疗后
5
1
本研究旨在评估超声引导下内镜治疗(EUS-SVD)在食管胃底静脉曲张破裂出血(EGVB)中的疗效及安全性。本研究结果显示,EUS-SVD治疗组在术后3个月内再出血率显著低于传统胃镜治疗组,EUS-SVD在控制再出血方面具有显著优势。EUS-SVD能够通过超声内镜实时精准定位静脉曲张及其穿通支血管,准确注射硬化剂或组织胶,闭塞曲张静脉及穿通支血管,从而有效减少再出血的风险[1-2]。EUS-SVD治疗组的胃底排胶溃疡发生率显著低于传统胃镜治疗组(9.0% vs. 42.8%,P=0.011)。这表明EUS-SVD在减少术后并发症方面具有明显优势。传统胃镜治疗中,组织胶注射可能导致胃黏膜下层、固有肌层及食管胃腔外的注射,从而引起胃底排胶溃疡、食管贲门狭窄、穿孔、感染等并发症[3]。而EUS-SVD通过超声引导,能够精确定位并控制注射剂量,减少组织胶误入非目标区域的风险,从而降低术后并发症的发生率。
EUS-SVD的主要技术优势在于其精准性和微创性。通过超声内镜的多普勒功能,EUS-SVD能够清楚显示深层的胃壁内外穿通支血管,测量血管腔直径,从而实现精准穿刺和药物注射。这种“超声可视化”的注射过程不仅可以有效避免普通内镜直视下“盲目”注射可能发生的血管外注射,还可以实时监测曲张静脉的管腔闭塞与血流消失情况,能减少组织胶用量、实时评价治疗效果等优点。然而,EUS-SVD也存在一些局限性。首先,超声内镜设备成本较高,如不慎损伤超声内镜,维修费用较高。其次,超声内镜在寻找胃底穹窿部曲张静脉较直视困难,需要耗费较多时间,如患者肝功能或其他脏器功能衰竭患者,无法耐受较长时间诊治[4]。此外,EUS-SVD技术在国内报道尚少,需要进一步行前瞻性随机对照研究,取得更多循证学依据,进一步评估EUS-SVD术中及术后异位栓塞、食管狭窄、出血、感染、穿孔并发症发生情况及组织胶用量。
与现有文献和研究比较,均显示EUS-SVD在治疗食管胃底静脉曲张中的有效性及安全性[5-8]。此外,本研究也支持了EUS-SVD在减少术后溃疡及再出血发生方面的优势[9-10]。然而,本研究为回顾性研究,可能存在选择偏倚和信息偏倚;也面临样本量较小,随访时间有限等限制,这些因素可能影响结果的普遍性和长期疗效的评估。
本研究通过对比EUS-SVD与传统内镜治疗在食管胃底静脉曲张破裂出血中的疗效和安全性,得出以下结论:①疗效显著:EUS-SVD治疗组在术后3个月内再出血率明显低于传统胃镜治疗组(4.8% vs. 30.4%),显示出EUS-SVD在控制再出血方面的显著优势。此外,EUS-SVD能够清楚显示深层的胃壁内外穿通支血管,准确注射组织胶,闭塞曲张静脉及穿通支血管,减少术后溃疡及再出血的发生。②安全性高:EUS-SVD治疗组在术后并发症如胃底排胶溃疡发生率(9.0% vs. 42.8%)明显低于传统胃镜治疗组,表明EUS-SVD具有较高的安全性。术中及术后未发生异位栓塞、食管贲门狭窄、败血症、大出血、穿孔等严重并发症。③技术优势:EUS-SVD能实时观察胃底曲张静脉及壁内外穿通支血管,实现精准穿刺血管与精准药物用量,术后的排胶溃疡及再出血明显减少,提高了疗效与安全性。④生活质量改善:所有患者在EUS-SVD术后6 h即可开放流质饮食并下床活动,生活质量明显改善。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王秀芳:临床操作、论文撰写;王银娟,董柳云:数据收集及整理、统计学分析;胡剑浩:研究设计、论文修改
| [1] | 王治虹, 时晨, 曾壮, 等. 超声内镜引导下曲张静脉精准断流术治疗食管胃底静脉曲张有效性及安全性的初步研究[J]. 中华消化内镜杂志, 2024, 41(7): 543-549. DOI:10.3760/cma.j.cn321463-20230419-00219 |
| [2] | 金震东, 蒋斐. 超声内镜穿刺和介入治疗的发展现状和前沿趋势[J]. 中华消化杂志, 2019, 39(6): 366-369. DOI:10.3760/cma.j.cn321463-20190318-00175 |
| [3] | 张延娟, 吴广迎, 卢艳丽, 等. 不同术式治疗危险性EGVB患者远期生存状况比较及其影响因素分析[J]. 临床急诊杂志, 2023, 24(9): 476-482. DOI:10.13201/j.issn.1009-5918.2023.09.007 |
| [4] | Xu XY, Tang CW, Linghu EQ, et al. Guidelines for the management of esophagogastric variceal bleeding in cirrhotic portal hypertension[J]. J Clin Transl Hepatol, 2023, 11(7): 1565-1579. DOI:10.14218/JCTH.2023.00061 |
| [5] | Bazarbashi AN, Wang TJ, Thompson CC, et al. Endoscopic ultrasound-guided treatment of gastric varices with coil embolization and absorbable hemostatic gelatin sponge: a novel alternative to cyanoacrylate[J]. Endosc Int Open, 2020, 8(2): E221-E227. DOI:10.1055/a-1027-6708 |
| [6] | Kouanda A, Binmoeller K, Hamerski C, et al. Safety and efficacy of EUS-guided coil and glue injection for the primary prophylaxis of gastric variceal hemorrhage[J]. Gastrointest Endosc, 2021, 94(2): 291-296. DOI:10.1016/j.gie.2021.01.025 |
| [7] | Tapper EB, Parikh ND. Diagnosis and management of cirrhosis and its complications: a review[J]. JAMA, 2023, 329(18): 1589-1602. DOI:10.1001/jama.2023.5997 |
| [8] | Jakab SS, Garcia-Tsao G. Evaluation and management of esophageal and gastric varices in patients with cirrhosis[J]. Clin Liver Dis, 2020, 24(3): 335-350. DOI:10.1016/j.cld.2020.04.011 |
| [9] | 赵蕊, 张丽瑶, 吴云海, 等. 45例多学科协作抢救急性上消化道大出血患者的临床分析[J]. 中华急诊医学杂志, 2014, 23(11): 1268-1270. DOI:10.3760/cma.j.issn.1671-0282.2014.11.019 |
| [10] | 王慧群, 叶超, 许朝, 等. 肝硬化食管胃底静脉曲张破裂出血内镜治疗后再出血的5年随访研究[J]. 实用医学杂志, 2024, 40(22): 3155-3159. DOI:10.3969/j.issn.1006-5725.2024.22.006 |
 2025, Vol. 34
2025, Vol. 34