2. 云南大学附属医院呼吸与危重症医学科,云南省教育厅呼吸疾病研究重点实验室,昆明 650021;
3. 云南省第一人民医院/昆明理工大学附属医院呼吸与危重症医学科,昆明 650032;
4. 云南省第一人民医院/昆明理工大学附属医院重症医学科,昆明 650032;
5. 开远市人民医院重症医学科,开远 661699
作为患者入住重症监护室(intensive care unit, ICU)的最常见病因,自20世纪90年代起便受到了广泛关注。最初由美国胸科医师学会和重症监护医学会(Society of Critical Care Medicine,SCCM)界定为全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)引起的一种状态[1]。2016年,欧洲重症医学会以及SCCM更新了脓毒症的定义,强调了由于宿主对感染的反应不平衡和失调,可能导致威胁生命的多器官功能障碍[2]。全球卫生计量与评估研究所(IHME)的调查数据显示,2017年全球估计有4 890万脓毒症患者,以及1 100万例相关死亡案例[3-4]。这些统计数据充分说明脓毒症对全球健康造成重要负担。
肺是脓毒症最常累及的器官之一,其最严重的并发症是ARDS[5]。虽然脓毒症诱导ARDS的病死率从2005年的38.8%下降到2019年的35%[6],但该疾病的高病死率仍然引起了医学界的高度重视。脓毒症诱导ARDS的发病机制涉及多个方面,包括炎症反应、氧自由基产生、肺泡上皮细胞和血管内皮细胞损伤等多个层面,最终导致肺泡-毛细血管屏障完整性被破坏,蛋白质富集的液体渗漏,并伴有中性粒细胞与巨噬细胞在肺泡间隙积累,形成透明膜。这些过程不仅影响肺部的换气功能,而且通过细胞因子的激活和炎症介质的释放进一步促使肺部损伤和炎症的扩散,从而加剧ARDS的进程[7-9]。此外,细胞的凋亡、自噬及增殖等生物学过程也被发现参与了脓毒症诱导ARDS的发病过程[10-12]。
近年来,线粒体自噬作为调节细胞能量和功能的关键机制,尤其是在脓毒症诱导的肺损伤中发挥重要作用,被认为是潜在的治疗靶点[13]。线粒体自噬,即细胞利用自噬机制选择性清除受损或丧失功能的线粒体以保证细胞内线粒体质量的控制,对维持细胞内环境稳定至关重要[14]。有关线粒体自噬在脓毒症诱导ARDS中的作用及其机制的研究成为该领域的焦点。本综述旨在探讨线粒体自噬在脓毒症诱导肺损伤中的作用及其机制,以期为脓毒症及其并发症的治疗和预防提供科学依据和新的治疗思路。
1 脓毒症诱导的肺损伤肺是脓毒症中最早也是最易受累的器官[9]。脓毒症导致肺损伤的原因包括肺内和肺外因素,肺内因素主要是由肺部感染引起,最先损伤的是肺泡上皮细胞。而肺外因素包括非呼吸道感染引起的脓毒症、胸部外创伤、胰腺炎、重度烧伤、药物反应、输血反应及器官移植等,这些因素通常先损伤肺毛细血管内皮细胞[15-16]。这些肺内和肺外因素的共同后果是脓毒症诱导的急性呼吸窘迫综合征(sepsis-induced ARDS),其特点是进行性低氧血症和难以纠正的呼吸窘迫[17]。当细菌、真菌、病毒等病原体入侵时,机体的炎症反应失衡会导致脓毒症发生。炎症反应失衡是脓毒症发展中的一个连续过程,机体对病原体初期急性反应会促进大量细胞因子和炎症介质(TNF、IL-1、IL-6等)的释放[18],这些因子不仅相互作用,还激活机体的先天免疫和适应性免疫,进一步触发炎症风暴,形成一种正反馈机制[19-20]。这一炎症过程直接或间接损伤肺泡-毛细血管屏障完整性,导致肺水肿并最终引起ARDS[15, 21]。ARDS是一种临床上常见的、起病急、病死率高的危重疾病,是重症患者死亡的主要原因之一[22],与其他原因引起的ARDS相比,脓毒症诱导的ARDS具有更高的发生率和病死率[23]。因此,脓毒症诱导ARDS的发病机制研究,对于临床上的诊断、治疗及预后评估具有重要意义。
2 脓毒症诱导ALI/ARDS的发病机制在脓毒症中,肺不仅承担气体交换的基本功能,还作为一个关键的免疫器官发挥作用[24]。在各种病原体如细菌、病毒、真菌等入侵时,病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)首先激活先天性免疫系统[15, 25]。此外,损伤相关分子模式(damage-associated molecular patterns,DAMPs)是在组织损伤后从细胞中释放出来的非微生物分子,可作为免疫系统的强效激活剂,引发非感染性炎症反应,导致全身炎症、器官损伤和死亡[26-27]。适应性免疫则在控制感染和调节组织病理反应间起着关键的调控作用[28]。免疫系统的有效激活有助于抵抗感染,但过度或失调的激活可能导致肺泡损伤,从而促进ARDS的发展[29]。中性粒细胞作为先天性免疫的主要效应器,在ARDS过程中最早被招募到炎症部位的白细胞之一,中性粒细胞细胞外陷阱(neutrophil extracellular traps,NETs)的形成有利于捕获病原体,而PAMPs的暴露则会引起补体C3a和C5a的产生[30]。C5a是一种强效的促炎肽,能够作为白细胞的趋化剂和炎症反应的放大器,推动中性粒细胞的募集和活化,并促进NETs的形成,过度的NETs释放可直接损伤肺泡上皮细胞,并促进血栓形成,触发弥散性血管内凝血(disseminated intravascular coagulation,DIC)[31-32]。有研究表明,DIC及中性粒细胞和血小板的聚集是介导脓毒症引起肺损伤的关键过程之一[33],如图 1。
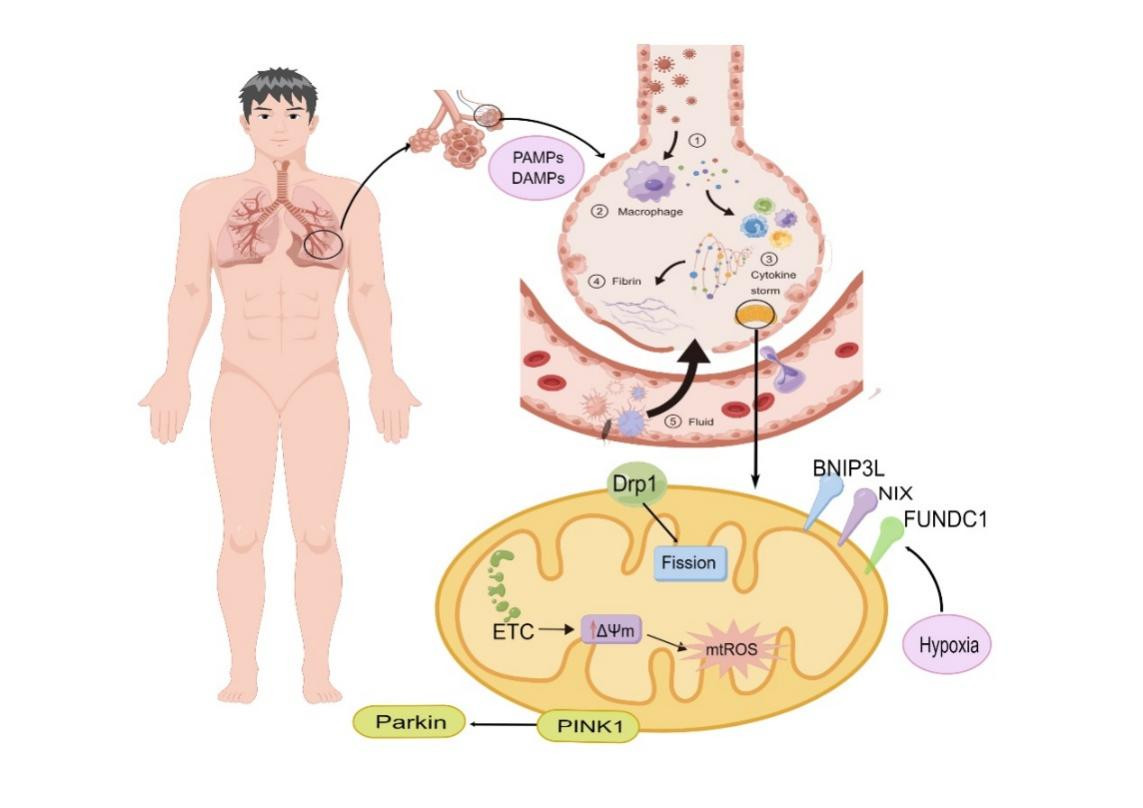
|
| 注:病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)导致肺损伤:①病原体入侵肺部;②以巨噬细胞为主的免疫细胞识别病原体并释放细胞因子;③细胞因子激活免疫系统形成正反馈环,导致细胞因子风暴损害肺泡上皮细胞;④纤维蛋白生成损伤肺泡上皮细胞;⑤肺泡-毛细血管屏障受损导致肺损伤。线粒体自噬:炎症介质过度释放导致线粒体电子传递链受损,mtROS过量产生;缺氧等损伤导致线粒体氧化磷酸化障碍,BNIP3L、NIX、FUNDC1等受体蛋白与受损线粒体结合,启动线粒体自噬,动力相关蛋白1(Drp1)介导线粒体裂解,同时激活PINK1/Parkin通路 图 1 脓毒症诱导ARDS发病机制及线粒体自噬调控作用(Figdraw绘制) |
|
|
在ARDS的发展过程中,中性粒细胞通过趋化因子的引导,在炎症部位附近通过血管内皮进行跨内皮细胞迁移(transendothelial cell migration,TEM)。在特定情况下,中性粒细胞可能发生反向跨内皮迁移(reverse transendothelial migration,rTEM),即从感染部位返回血液,这一过程增加了血管内皮的通透性,并可能介导远隔器官对肺的损伤[34-35]。在脓毒症期间,大多数免疫细胞往往会发生凋亡形成免疫抑制环境,而中性粒细胞则会延迟凋亡,并通过释放过度的细胞因子、活性氧(reactive oxygen species,ROS)和NETs,刺激内皮细胞的促炎和促血管生成反应,从而导致免疫系统进一步失调[36]。这些机制总体上导致脓毒症期间肺泡-毛细血管屏障完整性受损,免疫失衡,从而促进了肺损伤的发展。
3 线粒体自噬在脓毒症诱导ARDS中的调控作用 3.1 线粒体自噬与线粒体质量控制线粒体是真核细胞中具有双层膜结构的重要细胞器,负责能量生产、蛋白质合成以及分解代谢,同时也是细胞内ROS的主要来源,在细胞的发展、增殖和死亡过程中发挥着核心作用[37]。在正常生理状态下,细胞通过精细的调控机制维持线粒体稳态,如线粒体受损、衰老或丧失功能时,细胞通过自噬机制选择性地清除这些线粒体,该机制称为线粒体质量控制,主要包括线粒体生物发生、线粒体动力学和线粒体自噬[14]。线粒体自噬是一个特定的自然清除过程,其中功能失调的线粒体被自噬体包裹并最终与溶酶体融合降解,这一过程是维持线粒体动态平衡的重要防御机制,并且对于脓毒症诱导ARDS的发展具有决定性的影响[38]。
线粒体自噬的作用途径分为受体介导途径和非受体介导途径。其中,PINK1/Parkin通路是非受体介导途径的经典通路,在调节线粒体自噬中起关键作用[39]。当线粒体受损时,PINK诱导激酶1(PTEN induced putative kinase 1,PINK1)被激活并稳定定位于线粒体外膜上,募集并激活Parkin。此后,Parkin作为一种活化的E3连接酶,通过介导受损线粒体上的蛋白(如LC3、P62)泛素化,触发线粒体自噬过程[40-41]。受体介导途径依赖于线粒体外膜锚定蛋白完成,主要包括BCL2/腺病毒E1B相互作用蛋白(BCL2/adenovirus E1B 19kDa interacting protein-3,BNIP3)、nip3样蛋白X/BNIP3样受体(Nip3-like protein X/BNIP3 like,Nix/BNIP3L)、含FUN14结构域的蛋白1(FUN14 domain-containing 1,FUNDC1),这些线粒体外膜蛋白都具有相同的N端LIR序列,通过改变其N端LIR序列磷酸化水平调节与LC3结构域的结合强度,从而介导线粒体自噬发生[42]。其中,FUNDC1可被ULK1磷酸化,增强LC3的结合能力[43];而BNIP3不仅能通过直接与LC3结合后将受损线粒体锚定至自噬体包裹降解,其BH3结构域还能竞争性与Bcl-2结合,释放BECN1,从而激活PI3KC3复合物,促进自噬体形成,启动自噬[44]。
线粒体自噬与线粒体动力学紧密相关,通过清除线粒体中过量的ROS(mtROS)、线粒体DNA(mtDNA)和其他损伤因子,有效地确保细胞对应激的生理反应[45-46]。Kraft等[47]在一项针对肺泡水平的组织病理学病例对照研究中发现,线粒体质量控制的激活显著促进了受损线粒体的功能恢复,并进一步促进了肺损伤的修复。也有观点认为,过度的自噬会使自噬体大量积累、线粒体过度清除,导致肺泡上皮细胞能量耗竭,将细胞保护反应切换为有害刺激,从而加剧炎症反应,促使ALI进展[48]。Guo等[49]研究表明,IRGM基因通过调控AKT/mTOR通路介导的自噬过度激活,促进脓毒症相关肺损伤进展。尽管线粒体自噬在脓毒症诱导ALI的初始阶段发挥保护作用,但长期和过度自噬会损害线粒体,加重细胞损伤,这种双重调节机制可能与疾病的发展阶段、自噬程度和细胞类型有关,本文主要对线粒体自噬的保护机制进行综述。这些发现提示线粒体自噬在维持线粒体质量及调控脓毒症诱导ARDS中发挥重要作用,提供了对这一复杂疾病机制更深入的理解,并为开发新的治疗策略提供了理论基础。通过精准调控线粒体自噬的激活可抑制炎症反应,有效保护肺功能,为脓毒症诱导ALI的治疗提供新思路。
3.2 线粒体自噬与炎症调节脓毒症通常以剧烈的炎症反应和细胞因子风暴为特征,其早期表现为过度炎症,而晚期则可能转向免疫抑制状态,导致宿主易于二次感染,并显著增加死亡风险。目前,脓毒症的治疗策略主要集中在抑制早期的过度炎症和改善晚期的免疫抑制上[50]。肺泡巨噬细胞(alveolar macrophages,AMs)是肺部最丰富的先天免疫细胞,它们在限制中性粒细胞募集和炎症放大方面起着关键作用,从而有助于控制感染,作为抵御外来入侵因子的第一道防线,在脓毒症诱导ARDS中发挥重要功能[51]。线粒体自噬在调节肺泡巨噬细胞中的炎症反应方面至关重要。这种机制通过抑制炎性小体(NOD-, LRR- and pyrin domain-containing protein 3,NLRP3)的激活起作用,该小体通过caspase-1诱导前IL-1β和前IL–18的激活,释放出活性形式的细胞因子,引发显著的免疫反应。这一过程最终导致DAMPs的释放,进而诱发caspase-1依赖的细胞焦亡,释放过多的促炎介质并加剧邻近组织的炎症反应[52-53]。线粒体自噬通过及时清除受损的线粒体,消除了NLRP3激活的关键信号源,降低IL-1β的产生,从而有效减轻炎症反应[54-55]。有研究证实,肺泡巨噬细胞的线粒体自噬增强会抑制NLRP3激活,因此对LPS引起的肺损伤具有保护作用[56]。在脓毒症模型中,已有研究显示,增强肺泡巨噬细胞线粒体自噬可以抑制NLRP3炎症小体激活,并对由LPS诱导的急性肺损伤具有保护作用。此外,该研究还表明,Tim-3通过PINK1/Parkin通路介导,促进线粒体自噬,从而抑制NLRP3炎症小体的活化,为治疗脓毒症急性肺损伤提供了一种潜在机制[57](如图 1)。
根据内共生学说,受损的线粒体可以被视为细胞内的“病原体”,它们在重度感染中可能引起远端炎症反应。线粒体功能障碍时,ATP生成减少,线粒体膜的渗漏性增加,导致促凋亡分子如ROS、mtDNA,以及细胞色素C释放到细胞质中[58-59],线粒体自噬在这一阶段被激活,以清除这些促凋亡分子及受损线粒体,从而有效减轻炎症反应。在脓毒症的病理过程中,内源性病原体作用的DAMPs包括线粒体DNA(mtDNA)、n -甲酰基肽(nFPs)、线粒体转录因子(TFaM)起着关键作用。这些被称为线粒体DAMPs (mtDAMPs)的分子通过激活炎症信号通路,加剧线粒体损伤,进而触发更多mtDAMPs的释放,这可能导致肠道屏障功能障碍,并随着肠道菌群移位及代谢毒物的释放,加剧炎症反应[60]。在ARDS的发展过程中,受损的内皮细胞和上皮细胞内的功能失调线粒体产生大量mtDNA。这些过量的mtDNA增加内皮细胞的通透性,损害肺泡毛细血管屏障功能,从而加重肺损伤[61]。mtDNA作为一种细胞毒性化合物,含有仅在细菌中发现的成分,已成为近年来研究的焦点。其主要通过两种机制引发细胞毒性:一是通过激活NLRP3炎症小体,并与之相互作用;二是通过激活TLR9,识别具有细菌样特征的mtDNA,从而共同诱导肺损伤[62]。线粒体自噬在调节炎症反应中起着至关重要的作用,通过多种机制介入脓毒症诱导ARDS的病理过程,为开发新的治疗策略提供了理论基础和实验支持。
3.3 线粒体自噬与氧化磷酸化线粒体外膜上装配有跨膜蛋白,能够转运小分子,而其内膜通过嵴的折叠提供了丰富的表面积,装载有参与氧化磷酸化过程的酶和分子。在正常情况下,线粒体内膜上的电子传递链主要由五个氧化磷酸化复合体(Ⅰ-Ⅴ)组成。电子从复合体Ⅰ传递至复合体Ⅱ-Ⅳ,推动复合体Ⅴ (ATP合成酶)合成三磷酸腺苷(ATP)。氧化磷酸化过程中,当O2异常还原为H2O2时,通常在复合体Ⅳ上产生过量的超氧化物。这些超氧化物一般由含锰超氧化物歧化酶(Mn-SOD)转化为过氧化氢(H2O2),进而由过氧化氢酶(CAT)转化为H2O。在脓毒症状态下,SOD与CAT比例失衡,无论是由于CAT的抑制还是SOD的过表达,均可导致氧化应激水平的升高。这种改变激活氧化还原途径,损害电子传递链,并可能通过激活磷酸化转录活性核因子-κ B (NF-κ B)引起炎症反应,从而增加脓毒症患者的发病率[63]。
此外,ROS是超氧化物、过氧化氢(H2O2)、羟基自由基及其反应产物的总称,是氧化应激损伤的核心因素[64]。线粒体氧化磷酸化是产生ROS的主要途径,其产生与清除由一套严格的机制调控。在脓毒症诱导的ARDS中,这种动态平衡被打破,导致肺泡上皮细胞产生过量的线粒体ROS (mtROS)。这些mtROS损害肺血管内皮和肺泡上皮的屏障功能,促进中性粒细胞等免疫细胞浸润和多种细胞毒性物质的分泌,引发急性肺损伤。同时,增加的mtROS可诱导线粒体自噬启动,这一过程可以迅速清除过量的mtROS,从而减轻氧化应激并缓解肺部损伤[65-67](如图 1)。而线粒体自噬的启动受到哺乳动物雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)的严格负向调控,mTOR是一种高度保守的丝氨酸/苏氨酸蛋白激酶,其需要与其他蛋白结合形成两种功能不同的复合物mTORC1和mTORC2从而发挥作用[68]。mTOR(尤其是mTORC1)可通过磷酸化并抑制关键自噬起始蛋白如ULK1、Beclin-1、UVRAG和TFEB,阻断自噬体的形成和溶酶体生物合成,从而抑制线粒体自噬[69]。一项通过盲肠结扎穿刺(cecal ligation and puncture,CLP)诱导的小鼠脓毒症肺损伤模型的实验表明,使用自噬激活剂雷帕霉素(rapamycin,RAPA)可上调自噬水平并减轻肺损伤,而使用自噬抑制剂巴佛洛霉素A1(bafilomycin A1)则降低自噬水平且加重肺损伤[70]。表明增强线粒体自噬可能是肺损伤早期的保护机制,并可能成为肺损伤治疗的新策略。
总之,脓毒症诱导ARDS的主要机制是炎症介质和细胞因子风暴引发的机体免疫失衡,最终导致严重的肺损伤。在这一过程中,线粒体自噬发挥着关键的调节作用,通过减轻炎症反应、调节细胞凋亡和保护靶细胞,以免受进一步损害。然而,目前对线粒体自噬在脓毒症诱导ARDS中的具体作用机制和调控路径仍然认知有限。未来的研究可聚焦于线粒体自噬在脓毒症诱导ARDS中的分子机制,特别是如何调控炎症途径和凋亡过程。此外,探索线粒体自噬与细胞其他自噬形式的相互作用,可能揭示新的调控网络,这将对理解其在脓毒症及其并发症中的角色提供深入见解。深入研究这些机制不仅能够丰富我们对脓毒症诱导ARDS病理生理的理解,还可能为开发针对性的治疗策略提供理论基础,从而开辟治疗脓毒症及其导致的ARDS的新途径。
利益冲突 所有作者声明无利益冲突
| [1] | American college of chest physicians/society of critical care medicine consensus conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis[J]. Crit Care Med, 1992, 20(6): 864-874. |
| [2] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [3] | Fleischmann-Struzek C, Mellhammar L, Rose N, et al. Incidence and mortality of hospital-and ICU-treated sepsis: results from an updated and expanded systematic review and meta-analysis[J]. Intensive Care Med, 2020, 46(8): 1552-1562. DOI:10.1007/s00134-020-06151-x |
| [4] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017:analysis for the Global Burden of Disease Study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [5] | Mohsin M, Tabassum G, Ahmad S, et al. The role of mitophagy in pulmonary sepsis[J]. Mitochondrion, 2021, 59: 63-75. DOI:10.1016/j.mito.2021.04.009 |
| [6] | Lorencio Cárdenas C, Yébenes JC, Vela E, et al. Trends in mortality in septic patients according to the different organ failure during 15 years[J]. Crit Care, 2022, 26(1): 302. DOI:10.1186/s13054-022-04176-w |
| [7] | Sun MF, Yang QQ, Hu CL, et al. Identification and validation of autophagy-related genes in sepsis-induced acute respiratory distress syndrome and immune infiltration[J]. J Inflamm Res, 2022, 15: 2199-2212. DOI:10.2147/JIR.S355225 |
| [8] | Chen Y, Qiu CH, Cai WR. Identification of key immune genes for sepsis-induced ARDS based on bioinformatics analysis[J]. Bioengineered, 2022, 13(1): 697-708. DOI:10.1080/21655979.2021.2012621 |
| [9] | Matthay MA, Zemans RL, Zimmerman GA, et al. Acute respiratory distress syndrome[J]. Nat Rev Dis Primers, 2019, 5(1): 18. DOI:10.1038/s41572-019-0069-0 |
| [10] | Cao YY, Wang Z, Yu T, et al. Sepsis induces muscle atrophy by inhibiting proliferation and promoting apoptosis via PLK1-AKT signalling[J]. J Cell Mol Med, 2021, 25(20): 9724-9739. DOI:10.1111/jcmm.16921 |
| [11] | Pei CX, Wang F, Huang DM, et al. Astragaloside IV Protects from PM2.5-Induced Lung Injury by Regulating Autophagy via Inhibition of PI3K/Akt/mTOR Signaling in vivo and in vitro[J]. J Inflamm Res, 2021, 14: 4707-4721. DOI:10.2147/JIR.S312167 |
| [12] | Li ST, Jiang Y, Wang J, et al. HO-1/autophagic flux axis alleviated sepsis-induced acute lung injury via inhibiting NLRP3 inflammasome[J]. Cell Signal, 2022, 100: 110473. DOI:10.1016/j.cellsig.2022.110473 |
| [13] | Shen MJ, Sun LC, Liu XY, et al. Trichostatin A improves the inflammatory response and liver injury in septic mice through the FoxO3a/autophagy signaling pathway[J]. World J Emerg Med, 2022, 13(3): 182-188. DOI:10.5847/wjem.j.1920-8642.2022.056 |
| [14] | Zhu JH, Wang KZQ, Chu CT. After the banquet: mitochondrial biogenesis, mitophagy, and cell survival[J]. Autophagy, 2013, 9(11): 1663-1676. DOI:10.4161/auto.24135 |
| [15] | Englert JA, Bobba C, Baron RM. Integrating molecular pathogenesis and clinical translation in sepsis-induced acute respiratory distress syndrome[J]. JCI Insight, 2019, 4(2): e124061. DOI:10.1172/jci.insight.124061 |
| [16] | Thompson BT, Chambers RC, Liu KD. Acute respiratory distress syndrome[J]. N Engl J Med, 2017, 377(6): 562-572. DOI:10.1056/nejmra1608077 |
| [17] | 宋剑峰, 宋振举. 重视急性呼吸窘迫综合征基础与临床研究, 探索诊疗新策略[J]. 中华急诊医学杂志, 2024, 33(8): 1059-1062. DOI:10.3760/cma.j.issn.1671-0282.2024.08.002 |
| [18] | Pierrakos C, Karanikolas M, Scolletta S, et al. Acute respiratory distress syndrome: pathophysiology and therapeutic options[J]. J Clin Med Res, 2012, 4(1): 7-16. DOI:10.4021/jocmr761w |
| [19] | Takeuchi O, Akira S. Pattern recognition receptors and inflammation[J]. Cell, 2010, 140(6): 805-820. DOI:10.1016/j.cell.2010.01.022 |
| [20] | Huang M, Cai SL, Su JQ. The pathogenesis of sepsis and potential therapeutic targets[J]. Int J Mol Sci, 2019, 20(21): 5376. DOI:10.3390/ijms20215376 |
| [21] | Zhou X, Liao YX. Gut-lung crosstalk in sepsis-induced acute lung injury[J]. Front Microbiol, 2021, 12: 779620. DOI:10.3389/fmicb.2021.779620 |
| [22] | Griffiths MJD, McAuley DF, Perkins GD, et al. Guidelines on the management of acute respiratory distress syndrome[J]. BMJ Open Respir Res, 2019, 6(1): e000420. DOI:10.1136/bmjresp-2019-000420 |
| [23] | Chen HJ, Zhang YL, Zhang WX, et al. Inhibition of myeloid differentiation factor 2 by baicalein protects against acute lung injury[J]. Phytomedicine, 2019, 63: 152997. DOI:10.1016/j.phymed.2019.152997 |
| [24] | Kumar V. Pulmonary innate immune response determines the outcome of inflammation during pneumonia and sepsis-associated acute lung injury[J]. Front Immunol, 2020, 11: 1722. DOI:10.3389/fimmu.2020.01722 |
| [25] | Guttenberg MA, Vose AT, Tighe RM. Role of innate immune system in environmental lung diseases[J]. Curr Allergy Asthma Rep, 2021, 21(5): 34. DOI:10.1007/s11882-021-01011-0 |
| [26] | Denning NL, Aziz M, Gurien SD, et al. DAMPs and NETs in sepsis[J]. Front Immunol, 2019, 10: 2536. DOI:10.3389/fimmu.2019.02536 |
| [27] | Alharbi AS, Sanyi RH, Azhar EI. Bacteria and host: what does this mean for sepsis bottleneck?[J]. World J Emerg Med, 2025, 16(1): 10-17. DOI:10.5847/wjem.j.1920-8642.2025.001 |
| [28] | Barker KA, Etesami NS, Shenoy AT, et al. Lung-resident memory B cells protect against bacterial pneumonia[J]. J Clin Invest, 2021, 131(11): e141810. DOI:10.1172/JCI141810 |
| [29] | Huppert LA, Matthay MA, Ware LB. Pathogenesis of acute respiratory distress syndrome[J]. Semin Respir Crit Care Med, 2019, 40(1): 31-39. DOI:10.1055/s-0039-1683996 |
| [30] | Mantovani A, Cassatella MA, Costantini C, et al. Neutrophils in the activation and regulation of innate and adaptive immunity[J]. Nat Rev Immunol, 2011, 11(8): 519-531. DOI:10.1038/nri3024 |
| [31] | Garcia CC, Weston-Davies W, Russo RC, et al. Complement C5 activation during influenza A infection in mice contributes to neutrophil recruitment and lung injury[J]. PLoS One, 2013, 8(5): e64443. DOI:10.1371/journal.pone.0064443 |
| [32] | Gotts JE, Matthay MA. Sepsis: pathophysiology and clinical management[J]. BMJ, 2016, 353: i1585. DOI:10.1136/bmj.i1585 |
| [33] | Kor DJ, Carter RE, Park PK, et al. Effect of aspirin on development of ARDS in at-risk patients presenting to the emergency department: the LIPS-a randomized clinical trial[J]. JAMA, 2016, 315(22): 2406-2414. DOI:10.1001/jama.2016.6330 |
| [34] | Owen-Woods C, Joulia R, Barkaway A, et al. Local microvascular leakage promotes trafficking of activated neutrophils to remote organs[J]. J Clin Invest, 2020, 130(5): 2301-2318. DOI:10.1172/JCI133661 |
| [35] | 戴敏惠. 中性粒细胞反向跨内皮迁移在急性肺损伤的作用及机制研究[D]. 长沙: 中南大学, 2023. DOI: 10.27661/d.cnki.gzhnu.2023.000317. |
| [36] | Zhang H, Wang Y, Qu MD, et al. Neutrophil, neutrophil extracellular traps and endothelial cell dysfunction in sepsis[J]. Clin Transl Med, 2023, 13(1): e1170. DOI:10.1002/ctm2.1170 |
| [37] | Xie LL, Shi F, Tan ZQ, et al. Mitochondrial network structure homeostasis and cell death[J]. Cancer Sci, 2018, 109(12): 3686-3694. DOI:10.1111/cas.13830 |
| [38] | Kumar R, Reichert AS. Common principles and specific mechanisms of mitophagy from yeast to humans[J]. Int J Mol Sci, 2021, 22(9): 4363. DOI:10.3390/ijms22094363 |
| [39] | 孙正中, 江利亚, 孟冉, 等. 激活Pink1/Parkin通路减轻劳力型热射病大鼠急性肺损伤[J]. 中华急诊医学杂志, 2024, 33(7): 983-990. DOI:10.3760/cma.j.issn.1671-0282 |
| [40] | Chen HG, Lin HY, Dong BB, et al. Hydrogen alleviates cell damage and acute lung injury in sepsis via PINK1/Parkin-mediated mitophagy[J]. Inflamm Res, 2021, 70(8): 915-930. DOI:10.1007/s00011-021-01481-y |
| [41] | Zhang ZH, Chen ZG, Liu RM, et al. Bcl-2 proteins regulate mitophagy in lipopolysaccharide-induced acute lung injury via PINK1/parkin signaling pathway[J]. Oxid Med Cell Longev, 2020, 2020: 6579696. DOI:10.1155/2020/6579696 |
| [42] | Cheng HX, Wang XH, Yao JY, et al. Mitophagy and ferroptosis in sepsis-induced ALI/ARDS: molecular mechanisms, interactions and therapeutic prospects of medicinal plants[J]. J Inflamm Res, 2024, 17: 7819-7835. DOI:10.2147/JIR.S488655 |
| [43] | Zhang WL. The mitophagy receptor FUN14 domain-containing 1(FUNDC1): a promising biomarker and potential therapeutic target of human diseases[J]. Genes Dis, 2021, 8(5): 640-654. DOI:10.1016/j.gendis.2020.08.011 |
| [44] | Pan YT, Wu G, Chen M, et al. Lactate promotes hypoxic granulosa cells'autophagy by activating the HIF-1α/BNIP3/beclin-1 signaling axis[J]. Genes (Basel), 2024, 16(1): 14. DOI:10.3390/genes16010014 |
| [45] | Lerner CA, Sundar IK, Rahman I. Mitochondrial redox system, dynamics, and dysfunction in lung inflammaging and COPD[J]. Int J Biochem Cell Biol, 2016, 81(Pt B): 294-306. DOI:10.1016/j.biocel.2016.07.026 |
| [46] | Hu S, Zhou WY, Wang S, et al. Global research trends and hotspots on mitochondria in acute lung injury from 2012-2021:a bibliometric analysis[J]. Int J Environ Res Public Health, 2022, 20(1): 585. DOI:10.3390/ijerph20010585 |
| [47] | Kraft BD, Pavlisko EN, Roggli VL, et al. Alveolar mitochondrial quality control during acute respiratory distress syndrome[J]. Lab Invest, 2023, 103(9): 100197. DOI:10.1016/j.labinv.2023.100197 |
| [48] | Zhao JY, Liang Q, Fu CF, et al. Autophagy in sepsis-induced acute lung injury: Friend or foe?[J]. Cell Signal, 2023, 111: 110867. DOI:10.1016/j.cellsig.2023.110867 |
| [49] | Guo N, Xia Y, He NN, et al. IRGM inhibits the AKT/mTOR signaling pathway by interacting with TRIM21 to alleviate sepsis-induced acute lung injury[J]. Inflammation, 2025. DOI:10.1007/s10753-025-02265-w |
| [50] | van der Poll T, Shankar-Hari M, Wiersinga WJ. The immunology of sepsis[J]. Immunity, 2021, 54(11): 2450-2464. DOI:10.1016/j.immuni.2021.10.012 |
| [51] | Kulle A, Thanabalasuriar A, Cohen TS, et al. Resident macrophages of the lung and liver: the guardians of our tissues[J]. Front Immunol, 2022, 13: 1029085. DOI:10.3389/fimmu.2022.1029085 |
| [52] | White A, Wang ZK, Wang X, et al. NLRP3 inflammasome activation in cigarette smoke priming for Pseudomonas aeruginosa-induced acute lung injury[J]. Redox Biol, 2022, 57: 102467. DOI:10.1016/j.redox.2022.102467 |
| [53] | Zhong YJ, Lu YY, Yang XL, et al. The roles of NLRP3 inflammasome in bacterial infection[J]. Mol Immunol, 2020, 122: 80-88. DOI:10.1016/j.molimm.2020.03.020 |
| [54] | Wu DD, Zhang H, Li F, et al. Resveratrol alleviates acute lung injury in mice by promoting Pink1/Parkin-related mitophagy and inhibiting NLRP3 inflammasome activation[J]. Biochim Biophys Acta Gen Subj, 2024, 1868(7): 130612. DOI:10.1016/j.bbagen.2024.130612 |
| [55] | Sang WH, Chen S, Lin LD, et al. Antioxidant mitoquinone ameliorates EtOH-LPS induced lung injury by inhibiting mitophagy and NLRP3 inflammasome activation[J]. Front Immunol, 2022, 13: 973108. DOI:10.3389/fimmu.2022.973108 |
| [56] | Wu DD, Zhang H, Wu QG, et al. Sestrin 2 protects against LPS-induced acute lung injury by inducing mitophagy in alveolar macrophages[J]. Life Sci, 2021, 267: 118941. DOI:10.1016/j.lfs.2020.118941 |
| [57] | 朱云龙, 吴芳, 张杰, 等. 基于Tim-3促进肺泡巨噬细胞线粒体自噬和抑制NLRP3炎症小体激活对脓毒症急性肺损伤保护作用的研究[J/OL]. 中国免疫学杂志, 2024: 1-18. (2024-05-07). https://kns.cnki.net/kcms/detail/22.1126.R.20240506.1220.002.html. |
| [58] | Bock FJ, Tait SWG. Mitochondria as multifaceted regulators of cell death[J]. Nat Rev Mol Cell Biol, 2020, 21(2): 85-100. DOI:10.1038/s41580-019-0173-8 |
| [59] | Murphy MP, O'Neill LAJ. A break in mitochondrial endosymbiosis as a basis for inflammatory diseases[J]. Nature, 2024, 626(7998): 271-279. DOI:10.1038/s41586-023-06866-z |
| [60] | Liu JX, Yang C, Zhang WH, et al. Disturbance of mitochondrial dynamics and mitophagy in sepsis-induced acute kidney injury[J]. Life Sci, 2019, 235: 116828. DOI:10.1016/j.lfs.2019.116828 |
| [61] | Long GY, Gong R, Wang Q, et al. Role of released mitochondrial DNA in acute lung injury[J]. Front Immunol, 2022, 13: 973089. DOI:10.3389/fimmu.2022.973089 |
| [62] | Zhan B, Shen J. Mitochondria and their potential role in acute lung injury[J]. Exp Ther Med, 2022, 24(1): 479. DOI:10.3892/etm.2022.11406 |
| [63] | Nagar H, Piao SY, Kim CS. Role of mitochondrial oxidative stress in sepsis[J]. Acute Crit Care, 2018, 33(2): 65-72. DOI:10.4266/acc.2018.00157 |
| [64] | Lennicke C, Cochemé HM. Redox metabolism: ROS as specific molecular regulators of cell signaling and function[J]. Mol Cell, 2021, 81(18): 3691-3707. DOI:10.1016/j.molcel.2021.08.018 |
| [65] | Schofield JH, Schafer ZT. Mitochondrial reactive oxygen species and mitophagy: a complex and nuanced relationship[J]. Antioxid Redox Signal, 2021, 34(7): 517-530. DOI:10.1089/ars.2020.8058 |
| [66] | West AP, Brodsky IE, Rahner C, et al. TLR signalling augments macrophage bactericidal activity through mitochondrial ROS[J]. Nature, 2011, 472(7344): 476-480. DOI:10.1038/nature09973 |
| [67] | Sharma A, Ahmad S, Ahmad T, et al. Mitochondrial dynamics and mitophagy in lung disorders[J]. Life Sci, 2021, 284: 119876. DOI:10.1016/j.lfs.2021.119876 |
| [68] | Basnet R, Bahadur Basnet B, Gupta R, et al. Mammalian target of rapamycin (mTOR) signalling pathway-a potential target for cancer intervention: a short overview[J]. Curr Mol Pharmacol, 2024, 17(1): e310323215268. DOI:10.2174/1874467217666230331081959 |
| [69] | Glorieux C, Enríquez C, Buc Calderon P. The complex interplay between redox dysregulation and mTOR signaling pathway in cancer: a rationale for cancer treatment[J]. Biochem Pharmacol, 2025, 232: 116729. DOI:10.1016/j.bcp.2024.116729 |
| [70] | Yen YT, Yang HR, Lo HC, et al. Enhancing autophagy with activated protein C and rapamycin protects against sepsis-induced acute lung injury[J]. Surgery, 2013, 153(5): 689-698. DOI:10.1016/j.surg.2012.11.021 |
 2025, Vol. 34
2025, Vol. 34