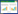2. 苏州大学医院保健科,苏州 215006
2. Department of Health, School Infirmary of Soochow University, Suzhou 215006, China
创伤性颅脑损伤(traumatic brain injury, TBI)是指由钝挫伤、穿通伤、加速力或减速力等引起的脑功能的改变或出现脑病理学变化[1],格拉斯哥昏迷量表评分(Glasgow coma scale, GCS)在3~8分为重型颅脑损伤(severe traumatic brain injury, sTBI),sTBI不仅可造成患者严重的头部损伤,还会引发诸多颅外并发症,其中呼吸系统并发症是最常见的[2],常可使患者病情恶化,最终导致患者的不良预后结局。目前临床研究和动物实验均表明重型颅脑损伤后肺损伤(severe traumatic brain injury secondary to acute lung injury, sTBI-ALI)并非由外力直接作用于肺引起的损伤,而是脑与肺之间的神经体液反应间接造成[3],主要的机制包括爆炸理论[4]、二次打击理论[5]、下丘脑-垂体-肾上腺轴理论[5]等,因此对于sTBI患者早期识别判断呼吸系统症状可更好改善患者预后。鉴于此寻求能够预测sTBI后继发肺损伤的生物标记物至关重要,相关研究表明研究系统性免疫炎症指数(systemic immune inflammation index, SII)指标可预测自发性脑出血患者卒中相关肺炎的发生及不良预后[6],但在重型颅脑外伤患者中未见临床报道,本研究拟采用回顾性分析的方法探讨SII与sTBI-ALI是否相关,进一步探讨该指标是否可预测sTBI-ALI患者的预后。
1 资料与方法 1.1 研究对象本研究为回顾性研究,将2021年1月至2023年11月就诊于苏州大学附属第一医院急诊创伤中心并符合以下入选标准者纳入研究。入选标准:(1)sTBI患者损伤类型,包括车祸、高处坠落伤及其他类型头部损伤;(2)受伤后12 h内入院,并在抢救室完成血液指标的基本实验室检查;(3)GCS≤8分;(4)临床资料完整并能完成随访。排除标准:(1)入院后12 h内死亡;(2)有恶性肿瘤病史尤其血液系统或自身免疫性疾病;(3)既往有肺部感染、支气管哮喘、支气管扩张等其他慢性肺部疾病;(4)此次外伤导致肋骨骨折、血气胸、误吸等急性胸部疾病;(5)临床资料不完整,中途出院或转院,无法完成随访工作。
纳入标准组中符合呼吸机相关性肺炎[7]、急性呼吸窘迫综合征[8]、神经源性肺水肿[9]其中之一诊断标准,即可诊断为sTBI-ALI。
本研究患者家属或法定代理人签署伦理知情同意书,本研究得到苏州大学附属第一医院医学伦理委员会的审核批准,批号为(2024)伦研批第050号。
1.2 救治流程患者入院后询问相关家属其病史,明确受伤机制,并完善头颅及胸部平扫CT检查明确患者存在颅脑损伤并排除胸部外伤,由具有行医资质的急诊科医生评估其GCS评分,根据GCS评分及影像学图像判断是否需行急诊手术,并立即完善血常规、血凝等抽血检查,若患者需要行急诊手术则立即开通绿色通道至急诊手术室,若患者结束手术或无需手术,只需保守治疗则将患者转运至急诊外科创伤ICU继续治疗,予以降压、脱水、止血、改善脑循环、营养神经、抗感染、维持水电解质平衡等标准化治疗。根据sTBI诊断标准、sTBI-ALI诊断标准及排除标准评估患者是否存在继发性肺损伤,以此分为sTBI组和sTBI-ALI组,其次在sTBI-ALI组中根据患者是否在30 d内死亡进一步分为生存组和死亡组
1.3 观察指标基线资料:患者性别、年龄、GCS评分、是否进行手术治疗、是否为孤立性损伤、受伤原因、心率、呼吸频率、收缩压、舒张压、既往慢性病史、白细胞计数、中性粒细胞计数、血小板计数、淋巴细胞计数等指标。
SII指标计算公式为血小板计数×中性粒细胞计数/淋巴细胞计数。本研究所需的血检皆在本院内完成,血细胞分析结果用迈瑞BC-6000全自动血液细胞分析仪制作完成。
主要预后指标:sTBI患者是否发生ALI及sTBI-ALI患者30 d生存情况。
1.4 统计学方法本研究数据采用SPSS 25.0进行数据分析。计数资料以频数和百分比表示,组间比较采用χ2检验;计量资料均采用Shapiro-Wilk检验进行正态性检验,符合正态分布的计量资料用均值±标准差(x±s)进行表示,组间比较采用独立样本t检验,非正态分布的计量资料采用中位数和四分位数间距[M(Q1, Q3)]进行表示,组间比较采用Mann-Whitney U秩和检验。多因素分析采用二元Logistic回归分析,使用GraphPad Prism6软件绘制二元Logistic回归分析森林图及ROC曲线图,单因素分析和多因素分析确定sTBI-ALI的预测因素及评估影响其肺损伤预后的因素,并使用受试者工作特征(receiver operator characteristic, ROC)曲线分析来评估多因素Logistic回归模型。以P < 0.05为差异有统计学意义。
2 结果 2.1 sTBI组与sTBI-ALI组一般临床资料研究期间有4 336例创伤患者就诊,符合纳入标准342例,排除82例后共有260例sTBI的患者纳入本研究(见图 1),根据患者住院过程中是否继发肺损伤分为sTBI组147例,sTBI-ALI组113例,两组在年龄、性别、GCS评分、是否进行急诊开颅手术、是否孤立性损伤及受伤原因方面差异无统计学意义(均P > 0.05)。在既往史方面,两组患者之间的高血压病史、糖尿病病史、抗凝或抗板药物服用史、脑血管疾病史、心血管疾病史差异无统计学意义(P > 0.05)。在生命体征方面,两组间的收缩压差异无统计学意义(P > 0.05),sTBI-ALI组患者的呼吸频率及心率明显快于sTBI组患者,差异有统计学意义(P < 0.05)。在炎症指标方面,淋巴细胞计数在两组之间差异无统计学意义(P > 0.05)。sTBI-ALI组白细胞计数、中性粒细胞计数、血小板计数和SII指标水平高于sTBI组(均P < 0.05)。见表 1。
|
| 图 1 患者筛选流程图 Fig 1 Patient screening flowchart |
|
|
| 指标 | sTBI组(n=147) | sTBI-ALI组(n=113) | 统计值 | P值 |
| 年龄(岁)a | 52.84±14.08 | 56.67±13.81 | 0.071 | 0.790 |
| 男性b | 101(68.71) | 82(72.57) | 0.456 | 0.499 |
| GCS评分(分) a | 7.35±2.50 | 5.90±2.48 | 0.060 | 0.806 |
| 急诊开颅手术b | 82(55.78) | 75(66.37) | 2.995 | 0.084 |
| 孤立性损伤 b | 80(54.42) | 61(53.98) | 0.107 | 0.744 |
| 受伤原因b | 0.977 | 0.323 | ||
| 交通事故 | 69(46.94) | 59(52.21) | ||
| 高处坠落 | 78(53.06) | 52(46.02) | ||
| 心率(次/min)a | 79.93±6.83 | 88.93±19.62 | 64.314 | <0.001 |
| 呼吸频率(次/min)a | 15.78±2.39 | 16.35±3.02 | 5.561 | 0.019 |
| 收缩压(mmHg)a | 143.87±12.66 | 145.89±15.77 | 2.391 | 0.123 |
| 高血压病史b | 42(28.57) | 42(37.17) | 2.159 | 0.142 |
| 糖尿病病史 b | 10(6.80) | 12(10.62) | 1.202 | 0.273 |
| 脑血管疾病史b | 1(0.68) | 2(1.77) | 0.665 | 0.415 |
| 心血管疾病史 b | 3(2.04) | 4(3.54) | 0.548 | 0.459 |
| 抗凝或抗板药物服用史b | 5 (3.40) | 8(7.08) | 1.820 | 0.177 |
| 白细胞计数(×109/L)a | 14.25±4.88 | 15.32±5.84 | 5.694 | 0.018 |
| 中性粒细胞计数(×109/L)a | 10.56±2.75 | 12.41±3.42 | 4.265 | 0.040 |
| 血小板计数(×109/L)a | 145.37±30.18 | 157.54±46.69 | 18.849 | <0.001 |
| 淋巴细胞计数(×109/L)a | 0.88±0.34 | 0.88±0.35 | 1.733 | 0.189 |
| SII指标a | 1763.00±214.56 | 2277.34±590.55 | 117.116 | <0.001 |
| 注:GCS为格拉斯哥昏迷评分,SII为系统性免疫炎症指数;a为x±s,b为(例,%) | ||||
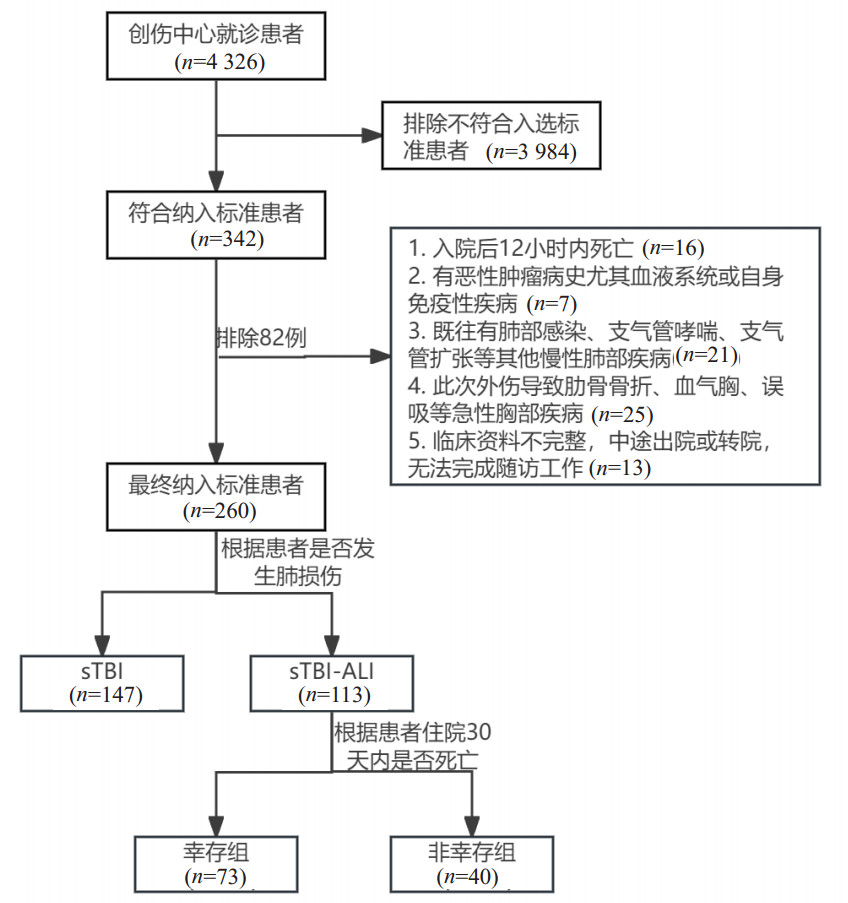
本研究进一步进行多因素分析,将呼吸频率、心率、白细胞计数、中性粒细胞计数、血小板及SII指标纳入多因素Logistic回归分析,通过分析调整混杂因素后结果显示,心率(OR=1.051,95%CI: 1.020~1.083,P=0.001)和SII指标(OR=1.003,95%CI: 1.002~1.004,P < 0.001)是sTBI-ALI的独立危险因素,见图 2。
|
| 注:SII为系统性免疫炎症指数,PLT为血小板计数,NE为中性粒细胞计数,WBC为白细胞计数,HR为心率,RR为呼吸频率 图 2 sTBI患者发生ALI的多因素Logistic回归分析森林图 Fig 2 Forest plot of multivariate Logistic regression analysis of ALI in sTBI patients |
|
|
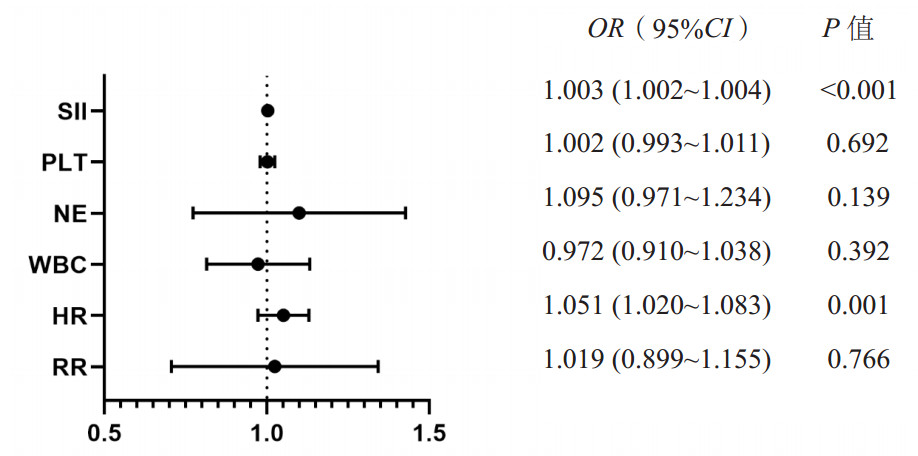
通过多因素分析,本研究将上述相关指标进行ROC曲线拟合,如图 3及表 2所示,心率和SII指标的AUC值分别是0.622(95%CI: 0.550~0.693)和0.779(95%CI: 0.714~0.844),将两因素结合所得联合指标的AUC值是0.801(95%CI: 0.740~0.862),SII指标及联合指标的AUC值均显著优于心率(P < 0.001),但SII指标及联合指标之间的AUC值差异无统计学意义(P=0.179)。
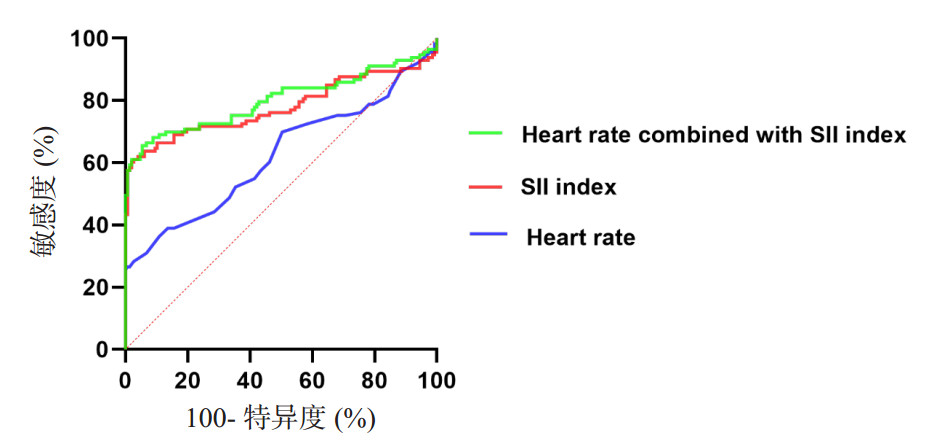
|
| 图 3 心率、SII指标和联合指标预测sTBI患者发生ALI的ROC曲线 Fig 3 ROC curve of heart rate, SII index and combined index to predict ALI in sTBI patients |
|
|
| 预测因素 | AUC | 95%CI | 敏感度 | 特异度 | 最佳截断值 | P值 |
| 心率 | 0.622 | 0.550~0.693 | 0.265 | 0.993 | 92.50 | 0.001 |
| SII指标 | 0.779 | 0.714~0.844 | 0.611 | 0.973 | 2 088.79 | <0.001 |
| 联合指标 | 0.801 | 0.740~0.862 | 0.655 | 0.946 | 0.47 | <0.001 |
根据患者30 d内存活与否,本研究将sTBI-ALI患者分为生存组和死亡组,生存组患者为73例,死亡组患者为40例,年龄、性别及是否行急诊开颅手术在两组患者中差异无统计学意义(P > 0.05),GCS评分在两组患者之间差异有统计学意义(P < 0.05)。在慢性既往史方面,两组患者的高血压病史、糖尿病病史、脑血管疾病史、心血管疾病史及抗凝或抗板药物服用史差异无统计学意义(P > 0.05)。在炎症指标方面,死亡组的中性粒细胞计数及SII指标水平高于生存组(P < 0.05),白细胞计数、血小板计数和淋巴细胞计数在两组患者之间差异无统计学意义(P > 0.05)。见表 3。
| 指标 | 生存组(n=73) | 死亡组(n=40) | 统计值 | P值 |
| 年龄(岁)a | 58.82±12.45 | 52.75±15.40 | 3.631 | 0.059 |
| 男性b | 57(78.08) | 25(62.50) | 3.152 | 0.076 |
| GCS评分(分)a | 6.93±2.44 | 4.05±1.11 | 13.381 | <0.001 |
| 手术b | 54(73.97) | 26(65.00) | 1.006 | 0.316 |
| 高血压病史b | 29(39.73) | 13(32.50) | 0.578 | 0.447 |
| 糖尿病病史b | 6(8.22) | 6(15.00) | 1.252 | 0.263 |
| 脑血管疾病史b | 2(2.74) | 0(0.00) | 1.116 | 0.291 |
| 心血管疾病史b | 3(4.11) | 1(2.50) | 0.196 | 0.658 |
| 抗凝或抗板药物服用史b | 7(9.59) | 1(2.50) | 1.974 | 0.160 |
| 白细胞计数(×109/L)a | 15.48±5.78 | 15.05±5.99 | 1.442 | 0.232 |
| 中性粒细胞计数(×109/L)a | 12.03±3.98 | 13.09±1.92 | 14.922 | <0.001 |
| 血小板计数(×109/L)a | 157.05±48.22 | 158.43±44.35 | 0.115 | 0.735 |
| 淋巴细胞计数(×109/L)a | 0.91±0.36 | 0.83±0.32 | 0.333 | 0.565 |
| SII指标a | 2112.58±624.46 | 2578.01±371.61 | 13.594 | <0.001 |
| 注: GCS为格拉斯哥昏迷评分,SII为系统性免疫炎症指数,计算公式为中性粒细胞计数×血小板计数/淋巴细胞计数;a为x±s,b为(例,%) | ||||
根据单因素分析,本研究进一步进行多因素分析,将GCS评分、中性粒细胞及SII指标纳入多因素Logistic回归分析,通过分析调整混杂因素后结果显示SII指标(OR=1.002, P=0.004, 95%CI: 1.000~1.003)和GCS评分(OR=0.372, P < 0.001, 95%CI: 0.247~0.561)是sTBI-ALI死亡的独立危险因素。见图 4。
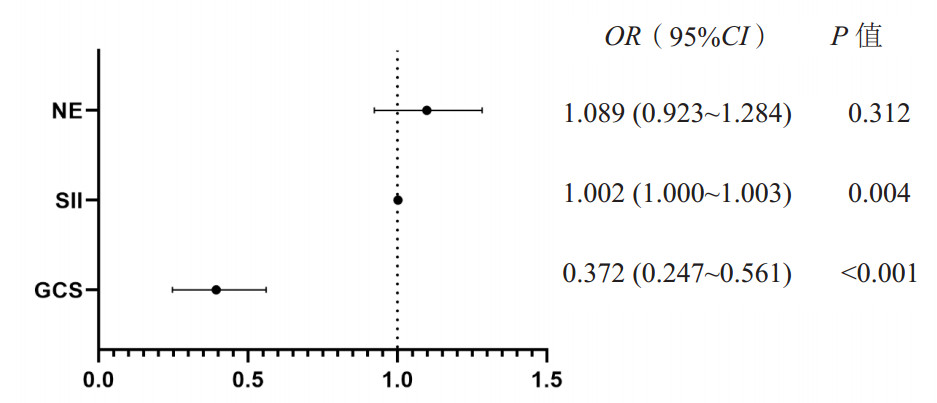
|
| 注:NE为中性粒细胞计数,SII为系统性免疫炎症指数,GCS为格拉斯哥昏迷评分 图 4 sTBI患者30 d预后的多因素Logistic回归分析森林图 Fig 4 Forest plot of multivariate Logistic regression analysis of 30-day prognosis of sTBI patients |
|
|
结合SII指标及GCS评分,本研究为此构建基于多变量逻辑回归分析的预测sTBI-ALI患者的死亡预测模型,GCS的AUC值是0.858(95%CI: 0.791~0.925),SII指标的AUC值是0.751(95%CI: 0.660~0.841),将上述指标联合可得出该模型AUC值是0.904(95%CI: 0.848~0.960)。见图 5和表 4。联合指标的AUC值大于SII指标及GCS评分(P < 0.001),加入SII指标可更好的评估患者预后水平。
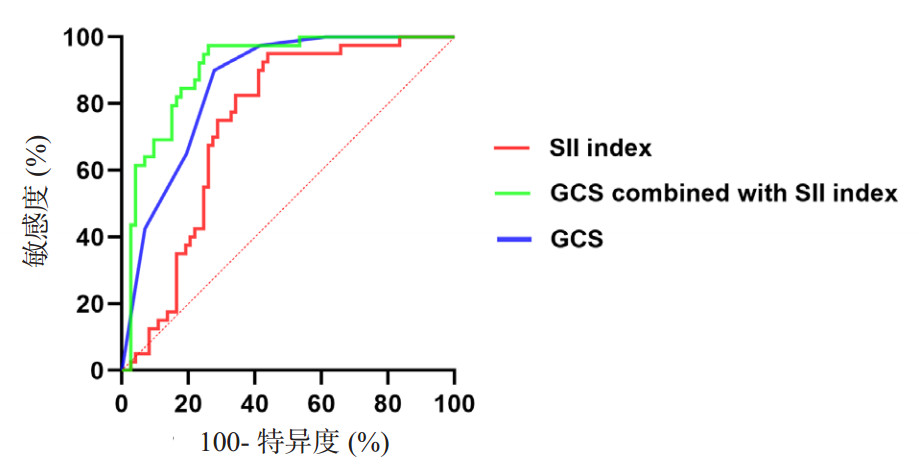
|
| 图 5 SII指标、GCS和联合指标预测sTBI患者预后的ROC曲线 Fig 5 ROC curve of SII index, GCS and combined index to predict the prognosis of sTBI patients |
|
|
| 预测因素 | AUC | 95%CI | 敏感度 | 特异度 | 最佳截断值 | P值 |
| GCS | 0.858 | 0.791~0.925 | 0.722 | 0.900 | 0.183 | <0.001 |
| SII指标 | 0.751 | 0.660~0.841 | 0.569 | 0.950 | 2043.527 | <0.001 |
| 联合指标 | 0.904 | 0.848~0.960 | 0.750 | 0.975 | 0.198 | <0.001 |
临床上常常可以观察到部分患者虽然肺部没有受到外伤,但在治疗期间却逐渐出现不同程度的呼吸困难,甚至难以纠正的低氧血症,影像学上可表现出广泛的斑片状或融合的浑浊影,提示患者出现了急性肺损伤。sTBI-ALI患者的病死率及残疾率是未合并肺损伤患者的1.5~2倍,严重影响患者的预后转归,因此从相关的细胞因子、炎症介质等血清标志物中寻找一种能够预测sTBI-ALI发生及判定其预后的指标极其重要,这不仅在临床可以评估其病情,甚至可以从相关机制层面开发出临床靶向药物预防肺损伤的发生,改善其结局预后。相关研究表明SII指标可预测自发性脑出血患者卒中相关肺炎的发生及不良预后[6],但目前暂未有研究表明SII指标和sTBI患者发生肺损伤及预后的关系。为此笔者设计了本项回顾性研究,探讨SII指标对sTBI-ALI发生及结局预后的预测价值。
SII是通过淋巴细胞计数、中性粒细胞计数和血小板计数这三方面通过计算公式获得,具体计算公式是中性粒细胞计数×血小板计数/淋巴细胞计数。本研究表明心率(OR=1.051,95%CI: 1.020~1.083,P=0.001)和SII指标(OR=1.003,95%CI: 1.002~1.004,P < 0.001)是预测sTBI-ALI的独立危险因素,通过构建ROC曲线,心率和SII指标的AUC值分别是0.622(95%CI: 0.550~0.693)和0.779(95%CI: 0.714~0.844),同时,SII指标是sTBI-ALI死亡的独立危险因素,SII指标的AUC值是0.751(95%CI: 0.660~0.841),AUC值> 0.7,具有良好的拟合性。鉴于SII指标由中性粒细胞、血小板及淋巴细胞计数通过计算公式计算而得,后续将从三方面分别讨论SII指标。
sTBI患者体内产生大量各种促炎和抗炎细胞因子,中性粒细胞受到多种刺激,如细菌毒素和内源性促炎介质的强烈激活,通过释放各种细胞毒性分子,在诱导组织损伤和由此导致的器官功能障碍中发挥关键作用。其中,中性粒细胞弹性酶是一种丝氨酸蛋白酶,它数量丰富且对多种底物具有强大的降解活性,几乎能够直接降解细胞外基质蛋白以及多种关键血浆蛋白的酶,破坏细胞间的紧密连接,同时诱导内皮细胞产生趋化性细胞因子,局部应用中性粒细胞弹性蛋白酶可导致肺间质及肺泡水肿、肺泡内出血和潜在的中性粒细胞浸润[10]。中性粒细胞弹性酶抑制剂目前已在许多动物研究中使用,在不同动物模型中,这些抑制剂对各种损伤引起的急性肺损伤的全身治疗有效一致。此外,中性粒细胞胞外诱捕网(neutrophil extracellular traps, NETs)的释放也是目前常见的一种致病机制[11]。NETs释放的增加会促进微血管功能障碍、炎症以及直接的细胞损伤。危重患者外周血或支气管肺泡灌洗中高水平的NETs往往与不良预后相关[12]。短时间的机械通气已被证明与促炎细胞因子的释放有关,包括TNF-α、白介素(interleukin, IL)-1b和IL-8[13],而上述的促炎细胞因子正是NETs的激活剂。
关于淋巴细胞减少症与sTBI患者预后及肺损伤之间关系的研究很少,Campbell等[14]对sTBI患者进行了一项为期10年的回顾性研究,同Morotti等[15]在自发性脑出血患者中的报道一致,研究表明入院时淋巴细胞减少与入院的sTBI患者预后不良有关,淋巴细胞减少可增加sTBI患者肺炎发生、病死率及住院时间延长。导致淋巴细胞减少的病理生理过程涉及多种机制,这些包括IL系统的众多破坏[16]和细胞因子风暴继发的细胞凋亡[17]。目前已经可以确定这些严重的损伤诸如sTBI会导致患者出现明显的免疫功能障碍,由此产生的免疫抑制被认为是损伤后延迟死亡的主要原因[18],因为它有利于病毒再激活和影响生存的感染性疾病,包括肺炎[19]。损伤严重程度评分较高的患者比损伤较轻的患者表现出更明显的淋巴细胞减少[20]。淋巴细胞亚群受到不同程度的影响,CD4+和NK-T细胞数量减少,而CD8+T细胞数量没有表现出明显变化。作为CD4+T细胞的亚群,Th17和Treg细胞失衡是监测免疫异常的重要指标,通常情况下,辅助性T细胞亚群的比例处于平衡状态,当机体受到创伤等因素刺激时,这一比例可能发生改变[21]。Li等[22]的研究表明肺损伤患者中Th17和Th22细胞的百分比明显高于非肺损伤患者,提示Th22细胞和Th17细胞可能参与了诱导肺损伤的发生。IL-22参与肺损伤的机制尚不清楚,可能是当IL-22与其受体JAK1结合时,STAT3通路被激活,导致趋化因子和炎症因子的产生,促进中性粒细胞和巨噬细胞向肺部募集[23]。Th17细胞是CD4+T细胞亚群,具有促进中性粒细胞和巨噬细胞分泌炎症因子的作用[24]。
血小板与sTBI-ALI的发病机制有关,但其潜在机制尚未完全清楚。目前研究表明血小板在止血和血栓形成中起关键作用。除了这一经典功能外,血小板通过支持免疫细胞的募集和活性,越来越多地被认为是炎症过程的中枢协调者[25]。Burkard等[26]通过构建脂多糖诱导的小鼠肺损伤模型中发现免疫受体酪氨酸激活基序偶联的免疫球蛋白样血小板受体糖蛋白VI(glycoprotein VI, GPVI)在肺损伤的早期阶段起着关键作用,GPVI是一种胶原蛋白和纤维蛋白的血小板特异性受体[27],GPVI缺陷小鼠和抗GPVI处理的小鼠受到显著保护,避免遭受到肺部和全身损害,抗GPVI治疗导致血小板与中性粒细胞的相互作用不太稳定,总体上减少了血小板-中性粒细胞复合物(platelet-neutrophil complex, PNC)的形成。抗GPVI治疗还减少了中性粒细胞在内皮细胞上的粘附,从而减少了中性粒细胞迁移和肺泡浸润。值得注意的是,与对照小鼠相比,抗GPVI治疗的动物中性粒细胞活化也减少,这与PNC簇和NETs的形成显著减少有关。此外,在脂多糖诱导的肺损伤模型中,活化血小板释放促炎细胞因子影响肺中性粒细胞浸润,这些细胞因子的中和减少了中性粒细胞的募集和相关的肺损伤[28]。这些结果证实GPVI是实验性肺损伤中性粒细胞募集、PNC形成和NETs的关键介质,抑制GPVI可能是减少导致急性肺部炎症的一种很有前途的策略。
根据本研究发现,中性粒细胞、淋巴细胞和血小板在sTBI和sTBI-ALI及sTBI-ALI的生存组和死亡组之间皆差异无统计学意义,综合中性粒细胞、淋巴细胞及血小板这三方面的SII指标在判断其诊断价值和预后价值方面都有较好的表现,可作为预测sTBI-ALI发生的独立危险因素并且是患者住院死亡的一个关键原因。SII可以反映全身性炎症状态和免疫反应[29]。由炎症反应和免疫细胞释放细胞因子引起的神经损伤导致产生抗炎信号并抑制细胞因子的产生,最终抑制感染和预防疾病进展。然而,持续的炎症反应最终会耗尽免疫系统,从而降低全身免疫活性,抑制全身细胞免疫反应[30],并导致外周血淋巴细胞亚群迅速减少,这显著增加了患者对肺损伤的易感性。此外,SII指标来源于血常规,简单、易检测,检查成本也较低,作为一种新的炎症指标在临床诊疗实践中更具实用性,适合基层医院使用,具有良好的应用前景。
利益冲突 所有作者声明无利益冲突
作者贡献声明 谢柯:研究设计、论文撰写;石翠翠、孙雪:研究设计;胡丽勤、刘雄、路鑫、步涨:统计学分析、实施研究、采集数据;杨鹏、徐峰、陈雄辉:研究设计指导、论文修改
| [1] | Scarboro M, McQuillan KA. Traumatic brain injury update[J]. AACN Adv Crit Care, 2021, 32(1): 29-50. DOI:10.4037/aacnacc2021331 |
| [2] | Chacón-Aponte AA, Durán-Vargas ÉA, Arévalo-Carrillo JA, et al. Brain-lung interaction: a vicious cycle in traumatic brain injury[J]. Acute Crit Care, 2022, 37(1): 35-44. DOI:10.4266/acc.2021.01193 |
| [3] | Li CY, Chen WL, Lin F, et al. Functional two-way crosstalk between brain and lung: the brain-lung axis[J]. Cell Mol Neurobiol, 2023, 43(3): 991-1003. DOI:10.1007/s10571-022-01238-z |
| [4] | Theodore J, Robin ED. Speculations on neurogenic pulmonary edema (NPE)[J]. Am Rev Respir Dis, 1976, 113(4): 405-411. DOI:10.1164/arrd.1976.113.4.405 |
| [5] | Mrozek S, Constantin JM, Geeraerts T. Brain-lung crosstalk: Implications for neurocritical care patients[J]. World J Crit Care Med, 2015, 4(3): 163-178. DOI:10.5492/wjccm.v4.i3.163 |
| [6] | Wang RH, Wen WX, Jiang ZP, et al. The clinical value of neutrophil-to-lymphocyte ratio (NLR), systemic immune-inflammation index (SII), platelet-to-lymphocyte ratio (PLR) and systemic inflammation response index (SIRI) for predicting the occurrence and severity of pneumonia in patients with intracerebral hemorrhage[J]. Front Immunol, 2023, 14: 1115031. DOI:10.3389/fimmu.2023.1115031 |
| [7] | 王拥军, 陈玉国, 吕传柱, 等. 卒中相关性肺炎诊治中国专家共识(2019更新版)[J]. 中国卒中杂志, 2019, 14(12): 1251-1262. DOI:10.3969/j.issn.1673-5765.2019.12.011 |
| [8] | ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the berlin definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [9] | Busl KM, Bleck TP. Neurogenic pulmonary edema[J]. Crit Care Med, 2015, 43(8): 1710-1715. DOI:10.1097/ccm.0000000000001101 |
| [10] | Tomashefski JF. Pulmonary pathology of acute respiratory distress syndrome[J]. Clin Chest Med, 2000, 21(3): 435-466. DOI:10.1016/S0272-5231(05)70158-1 |
| [11] | Scozzi D, Liao FY, Krupnick AS, et al. The role of neutrophil extracellular traps in acute lung injury[J]. Front Immunol, 2022, 13: 953195. DOI:10.3389/fimmu.2022.953195 |
| [12] | Mikacenic C, Moore R, Dmyterko V, et al. Neutrophil extracellular traps (NETs) are increased in the alveolar spaces of patients with ventilator-associated pneumonia[J]. Crit Care, 2018, 22(1): 358. DOI:10.1186/s13054-018-2290-8 |
| [13] | Bose CL, Laughon MM, Allred EN, et al. Systemic inflammation associated with mechanical ventilation among extremely preterm infants[J]. Cytokine, 2013, 61(1): 315-322. DOI:10.1016/j.cyto.2012.10.014 |
| [14] | Campbell B, Budreau D, Williams-Perez S, et al. Admission lymphopenia predicts infectious complications and mortality in traumatic brain injury victims[J]. Shock, 2022, 57(2): 189-198. DOI:10.1097/SHK.0000000000001872 |
| [15] | Morotti A, Marini S, Jessel MJ, et al. Lymphopenia, infectious complications, and outcome in spontaneous intracerebral hemorrhage[J]. Neurocrit Care, 2017, 26(2): 160-166. DOI:10.1007/s12028-016-0367-2 |
| [16] | Ritzel RM, Doran SJ, Barrett JP, et al. Chronic alterations in systemic immune function after traumatic brain injury[J]. J Neurotrauma, 2018, 35(13): 1419-1436. DOI:10.1089/neu.2017.5399 |
| [17] | Girardot T, Rimmelé T, Venet F, et al. Apoptosis-induced lymphopenia in sepsis and other severe injuries[J]. Apoptosis, 2017, 22(2): 295-305. DOI:10.1007/s10495-016-1325-3 |
| [18] | 花嵘, 张咏梅, 陈复兴, 等. 严重创伤后多器官功能不全与T淋巴细胞变化关系的研究[J]. 中华创伤杂志, 2014, 30(2): 150-152. DOI:10.3760/cma.j.issn.1001-8050.2014.02.016 |
| [19] | Hotchkiss RS, Monneret G, Payen D. Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach[J]. Lancet Infect Dis, 2013, 13(3): 260-268. DOI:10.1016/S1473-3099(13)70001-X |
| [20] | Hotchkiss RS, Nicholson DW. Apoptosis and caspases regulate death and inflammation in sepsis[J]. Nat Rev Immunol, 2006, 6(11): 813-822. DOI:10.1038/nri1943 |
| [21] | Szabó K, Papp G, Szántó A, et al. A comprehensive investigation on the distribution of circulating follicular T helper cells and B cell subsets in primary Sjögren's syndrome and systemic lupus erythematosus[J]. Clin Exp Immunol, 2016, 183(1): 76-89. DOI:10.1111/cei.12703 |
| [22] | Li G, Zhang LT, Han NN, et al. Increased Th17 and Th22 cell percentages predict acute lung injury in patients with sepsis[J]. Lung, 2020, 198(4): 687-693. DOI:10.1007/s00408-020-00362-1 |
| [23] | McAleer JP, Kolls JK. Directing traffic: IL-17 and IL-22 coordinate pulmonary immune defense[J]. Immunol Rev, 2014, 260(1): 129-144. DOI:10.1111/imr.12183 |
| [24] | 王华兵, 董芳, 徐玲文, 等. 自噬在急性肺损伤小鼠Treg/Th17细胞失衡中的作用研究[J]. 中华急诊医学杂志, 2022, 31(11): 1476-1480. DOI:10.3760/cma.j.issn.1671-0282.2022.11.007 |
| [25] | Guo L, Rondina MT. The era of thromboinflammation: platelets are dynamic sensors and effector cells during infectious diseases[J]. Front Immunol, 2019, 10: 2204. DOI:10.3389/fimmu.2019.02204 |
| [26] | Burkard P, Schonhart C, Vögtle T, et al. A key role for platelet GPVI in neutrophil recruitment, migration, and NETosis in the early stages of acute lung injury[J]. Blood, 2023, 142(17): 1463-1477. DOI:10.1182/blood.2023019940 |
| [27] | Rayes J, Watson SP, Nieswandt B. Functional significance of the platelet immune receptors GPVI and CLEC-2[J]. J Clin Invest, 2019, 129(1): 12-23. DOI:10.1172/JCI122955 |
| [28] | Sreeramkumar V, Adrover JM, Ballesteros I, et al. Neutrophils scan for activated platelets to initiate inflammation[J]. Science, 2014, 346(6214): 1234-1238. DOI:10.1126/science.1256478 |
| [29] | Yan D, Dai CJ, Xu RT, et al. Predictive ability of systemic inflammation response index for the risk of pneumonia in patients with acute ischemic stroke[J]. Gerontology, 2023, 69(2): 181-188. DOI:10.1159/000524759 |
| [30] | Liu DD, Chu SF, Chen C, et al. Research progress in stroke-induced immunodepression syndrome (SIDS) and stroke-associated pneumonia (SAP)[J]. Neurochem Int, 2018, 114: 42-54. DOI:10.1016/j.neuint.2018.01.002 |
 2025, Vol. 34
2025, Vol. 34