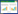急性创伤性脑损伤(traumatic brain injury, TBI)常伴脑血管自动调节(cerebrovascular autoregulation, CA)功能受损,导致颅内压(intracranial pressure, ICP)升高和脑血流量(cerebral blood flow, CBF)异常,此外脑血流对血压变化敏感性增加,使得患者短期内不良结局的发生率高达50%[1]。开颅手术作为TBI救治的重要手段,能够及时清除颅内血肿并降低颅内压,但术后疼痛及气管导管刺激可兴奋交感神经系统,导致血压升高,增加颅内再出血及二次手术的风险[2]。右美托咪定可抑制交感过度兴奋,减轻气管导管机械性刺激,被广泛用于围手术期管理[3]。而有研究显示,开颅术后约60%~84%的患者仍存在中至重度疼痛,主要源自头皮切口[4]。超声引导头皮神经阻滞(scalp nerve block, SNB)作为一种新型的区域阻滞技术,可有效减轻术后切口疼痛程度,近年被应用于清醒开颅和脑肿瘤开颅术后镇痛[5]。本研究拟评价超声引导SNB联合右美托咪定对急性TBI患者开颅术后脑血流的影响,为优化麻醉方案提供参考。
1 资料与方法 1.1 研究对象本研究为单中心随机对照临床试验。纳入2024年1月至2025年2月就诊于昆山市中医医院并接受急诊开颅手术的TBI(硬膜下出血)患者84例。纳入标准:性别不限,年龄25~65岁,身体质量指数(body mass index, BMI)18~30 kg/m2,美国麻醉医师协会(American Society of Anesthesiologists, ASA)分级Ⅰ~Ⅲ级,入院时格拉斯哥昏迷量表(Glasgow Coma Scale, GCS)评分9~12分,病案资料完整。
排除标准:(1)入院时血压异常(严重高血压或低血压)、心率不稳定、心律失常、需紧急气管插管、瞳孔散大、脑疝、出血量≥600 mL、合并多发伤;(2)颅脑肿瘤疾病史;(3)心脑血管疾病史;(4)颈内动脉或大脑中动脉解剖变异或严重狭窄或斑块;(5)局麻药过敏史;(6)穿刺部位感染或破损或骨折;(7)凝血功能障碍。剔除标准:(1)手术时间 > 6 h;(2)围术期出现严重血流动力学异常;(3)二次手术;(4)术后死亡;(5)术后失访。
采用随机数字表法将患者分为2组:超声引导SNB联合右美托咪定组(SD组)和右美托咪定组(D组)。
本研究获昆山市中医医院医学伦理委员会批准(批准号:KZY2024-012-01),并签署知情同意书。并在中国临床试验注册中心完成注册,注册号为ChiCTR2400087969。
1.2 研究方法患者入室后监测心电图、血压、脉搏血氧饱和度,右颈内静脉穿刺置管监测中心静脉压(central venous pressure, CVP),桡动脉穿刺置管监测有创动脉压,鼻咽测温。麻醉诱导:依次静脉注射芬太尼(批号:AB40403331,宜昌人福药业)2~5 μg/kg、丙泊酚(批号:12412201,江苏盈科生物制药有限公司)1~2 mg/kg和顺阿曲库铵(批号:GD2475,浙江仙琚制药股份有限公司)0.2 mg/kg。两组患者均行气管插管全身麻醉,机械通气,采用容量控制模式,设置潮气量6~10 mL/kg,通气频率12~18次/min,吸气时间:呼气时间为1.0∶(1.5~2.0),吸入氧浓度为60%。根据血气结果调整通气参数,维持呼气末二氧化碳分压(end-tidal carbon dioxide, PETCO2)30~35 mmHg(1 mmHg=0.133 kPa)。
干预措施:两组患者静脉输注负荷剂量右美托咪定(批号:12407291,遂成药业股份有限公司)1 μg/kg 10 min,后以0.3 μg/(kg·h)的速率持续泵注。SD组在气管插管机械通气完成后,行手术侧超声引导SNB,给予0.6%的甲磺酸罗哌卡因注射液(批号:24112951,石家庄四药有限公司),分别行眶上(2 mL)、滑车上(2 mL)、耳颞(2 mL)、枕大(5 mL)和枕小(5 mL)神经阻滞(图 1)。所有操作由两名熟练掌握超声引导SNB的高年资麻醉医师完成。
|
| 图 1 超声引导SNB Fig 1 Ultrasound-guided SNB |
|
|
麻醉维持:持续吸入1 %七氟烷(批号:24021531,上海恒瑞医药有限公司),静脉输注瑞芬太尼(批号:AC4050291,宜昌人福药业)0.05~0.30 μg/(kg·min),丙泊酚2~5 mg/(kg·h),根据需要间断给予芬太尼、顺阿曲库铵,调整瑞芬太尼或丙泊酚剂量。术中根据CVP调整液体管理方案,及时补充晶体和胶体,必要时输注新鲜冰冻血浆和少白细胞红细胞,维持CVP 5~12 cmH2O(1 cmH2O=0.098 kPa)。术中根据情况酌情使用血管活性药物,维持收缩压90~180 mmHg,平均动脉压 > 60 mmHg,心率60~100次/min。同时术中维持体温在36~37 ℃。
手术前由神经外科医师行ICP监测传感器置入,选择血肿侧Kocher点(侧脑室额角穿刺点)为置入点,将调零后的脑实质型ICP监测传感器(Codman,美国)置入脑实质内2.0 cm左右,妥善固定后连接ICP监护仪(Codman ICP Express,美国)行ICP监测。
术毕停用所有麻醉药物,继续泵注右美托咪定维持镇静,带气管导管回病房或重症监护室。次日全面评估患者意识状态、呼吸功能等指标。
分别于术毕即刻(T0)、术后2 h(T1)、术后6 h(T2)时,采用经颅多普勒超声(transcranial doppler, TCD)检测手术侧大脑中动脉(middle cerebral artery, MCA)峰值血流速度(peak systolic velocity, PSV)、平均血流速度(mean blood flow velocity, MBFV);记录ICP值;采用放射免疫法测定血清星形胶质细胞蛋白(S-100β)、神经原特异性烯醇化酶(neuron-specific enolase, NSE)浓度;记录术后6 h内高血压,心动过速,躁动等并发症的发生情况及血管活性药物使用率。
1.3 统计学方法采用PASS 15.0软件计算样本量。本研究以主要结局指标术后6 h PSV估算样本量。预试验结果显示,SD组术后6 h PSV为(110.45±18.17)cm/s,D组术后6 h PSV为(121.17±20.04)cm/s,设定双侧α=0.05,β=0.1,预计失访率为20%,预计样本量应为84例,两组各42例。
采用SPSS 22.0软件进行统计分析。正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用两独立样本t检验(Levene检验方差齐性);组内不同时间点比较采用重复测量方差分析,组间同一时间点比较采用独立样本t检验。计数资料以例数或百分比(%)表示,采用χ2检验或Fisher确切概率法。以P < 0.05为差异有统计学意义。
2 结果 2.1 患者的一般情况本研究最初选择实施手术治疗的急性TBI患者84例,后剔除5例,1例围术期出现严重血流动力学异常,1例手术时间超过6 h,2例再次手术,1例术后失访,最终79例患者纳入统计分析,其中SD组40例,D组39例(图 2)。两组患者一般资料比较差异均无统计学意义(均P > 0.05),见表 1。
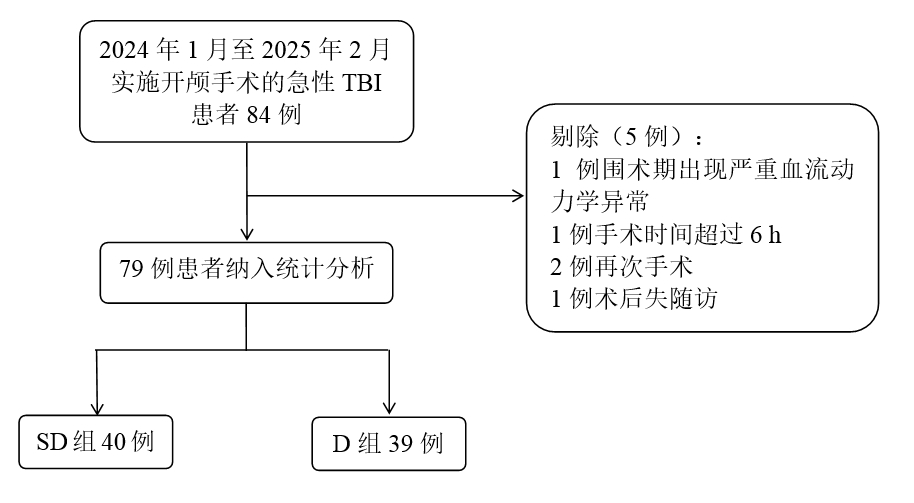
|
| 图 2 患者入组流程图 Fig 2 Flowchart of selection of the patients |
|
|
| 指标 | SD组(n=40) | D组(n=39) | t/χ2值 | P值 |
| 年龄(岁)a | 51.73 ± 6.24 | 52.47 ± 6.93 | -0.499 | 0.619 |
| 男性/女性(例) | 28/12 | 29/10 | 0.187 | 0.666 |
| BMI(kg/m2)a | 22.38 ± 2.16 | 22.45 ± 2.37 | -0.137 | 0.891 |
| ASA Ⅰ级/Ⅱ级/Ⅲ级(例) | 14/23/3 | 13/24/2 | 0.246 | 0.884 |
| 术前GCS评分(分)a | 10.82 ± 0.91 | 10.76 ± 0.78 | 0.314 | 0.754 |
| 手术时间(min)a | 207.39 ± 27.16 | 215.74 ± 30.51 | -1.286 | 0.202 |
| 麻醉时间(mL)a | 218.46 ± 29.37 | 224.35 ± 31.06 | -0.866 | 0.389 |
| 注:BMI为体质量指数,ASA为美国麻醉医师学会,GCS为格拉斯哥昏迷量表,a为(x±s),b为例(%) | ||||
与T0相比,SD组T1、T2时,PSV、MBFV差异无统计学意义(F=0.370, P=0.692; F=0.171, P=0.843);D组T1、T2时PSV、MBFV升高(F=7.487, P=0.001; F=4.245, P=0.017)。与D组相比,SD组T1、T2时PSV、MBFV均降低(P < 0.05),见表 2。
| 指标 | SD组(n=40) | D组(n=39) | t值 | P值 |
| PSV(cm/s) | ||||
| T0 | 109.05 ± 17.65 | 110.63 ±18.49 | -0.389 | 0.699 |
| T1 | 110.84 ± 18.32 | 125.04 ± 20.43 | -3.254 | 0.002 |
| T2 | 112.61 ± 19.52 | 126.83 ± 21.76 | -3.059 | 0.003 |
| MBFV(cm/s) | ||||
| T0 | 56.34 ± 6.81 | 57.82 ± 6.93 | -0.957 | 0.341 |
| T1 | 56.92 ± 6.97 | 61.75 ± 8.34 | -2.796 | 0.007 |
| T2 | 57.24 ± 7.13 | 62.81 ± 8.54 | -3.150 | 0.002 |
| 注:PSV为峰值血流速度,MBFV为平均血流速度 | ||||
与D组相比,SD组T1、T2时ICP降低(P < 0.05),见表 3。
| 指标 | SD组(n=40) | D组(n=39) | t值 | P值 |
| ICP(mmHg) | ||||
| T0 | 10.71 ± 3.42 | 10.92 ± 3.57 | -0.267 | 0.790 |
| T1 | 11.28 ± 3.65 | 13.74 ± 4.06 | -2.834 | 0.006 |
| T2 | 11.54 ± 3.84 | 13.92 ± 4.37 | -2.573 | 0.012 |
| 注:ICP为颅内压 | ||||
与D组相比,SD组T1、T2时S-100β蛋白和NSE浓度均降低(P < 0.05),见表 4。
| 指标 | SD组(n=40) | D组(n=39) | t值 | P值 |
| S-100β蛋白(mmol/L) | ||||
| T0 | 0.54 ± 0.03 | 0.55 ± 0.03 | -1.481 | 0.143 |
| T1 | 0.68 ± 0.06 | 0.74 ± 0.07 | -4.094 | <0.001 |
| T2 | 0.75 ± 0.05 | 0.82 ± 0.09 | -4.287 | <0.001 |
| NSE(mmol/L) | ||||
| T0 | 12.78 ± 1.24 | 12.85 ± 1.19 | -0.256 | 0.799 |
| T1 | 16.89 ± 1.43 | 19.74 ± 1.62 | -8.295 | <0.001 |
| T2 | 20.14 ± 1.79 | 23.06 ± 1.95 | -6.936 | <0.001 |
| 注:S-100β为星形胶质细胞蛋白,NSE为神经原特异性烯醇化酶 | ||||
与D组相比,SD组术后躁动、高血压的发生率及血管活性药物使用率均下降(P < 0.05),见表 5。
| 指标 | SD组(n=40) | D组(n=39) | 统计值 | P值 |
| 高血压 | 3(7.5) | 14(36) | 9.429 | 0.002 |
| 心动过速 | 2(5) | 2(5) | 0.237 | 0.626 |
| 躁动发生率 | 4(10) | 14(36) | 7.528 | 0.006 |
| 血管活性药物使用率 | 3(7.5) | 14(36) | 9.429 | 0.002 |
CBF受交感神经活动、CA功能等多种因素调控,同时还受到麻醉药物、动脉血氧分压、动脉血二氧化碳分压以及气道压等的影响[6]。在本研究中,吸入氧浓度、PETCO2、气道压、CVP和体温控制在稳定范围内,一定程度上均衡了上述因素对CBF的干扰。研究证实,TBI患者CA功能受损,创伤后早期脑血流速度增快,ICP增高,血压的微小波动即可引发脑容积、脑血流和脑血管压力的显著变化,因此围术期维持适当的血压水平至关重要[7]。
颅脑外伤患者术后保留气管导管是常见的管理措施。右美托咪定作为一种高选择性α2-肾上腺素能受体激动剂,具有镇静、减轻血压和心率波动以及稳定血流动力学的作用。研究显示,在麻醉诱导前泵住右美托咪定1 μg/kg 15 min,可调节颅脑手术患者脑氧供需平衡,改善脑血流灌注,尤其在插管全身麻醉后,能显著减少CBF和ICP参数的波动[8]。另有研究表明,在诱导前静脉输注右美托咪定1.0 μg/kg,后以0.2~0.4 μg/(kg·h)的速率维持,可维持脑外伤手术患者术中血流动力学稳定,并减轻炎性反应[9]。本研究参考临床推荐用量使用右美托咪定,以确保其在发挥治疗作用的同时,最大限度地保障患者安全。
术后镇痛不完善可使血压增高、心率加快,进而引起ICP增高。研究显示,开颅术后疼痛程度高,主要由头部皮肤及肌肉的切割和牵拉所致[10]。SNB可有效阻断头部交感神经传导,抑制处理头皮引发的血流动力学剧烈波动,并提供完善的围术期镇痛效果,其最常阻滞包括枕大神经、枕小神经、耳颞神经、眶上神经和滑车上神经[11]。本研究采用超声引导实施SNB,定位精确,操作简便,用时少,安全性高,尤其适用于解剖结构复杂或个体差异较大的患者。本课题组前期探讨了右美托咪定-SNB联合全麻用于TBI患者开颅术的效果,结果显示两者合用可优化镇痛效果,维持术中血流动力学平稳。
研究证实CBF与脑血流速度呈高度线性相关,TCD检测MCA血流动力学参数并分析其变化,可了解CBF变化[12]。开颅手术对TBI患者双侧大脑半球脑血流速的效果,手术侧比非手术侧更明显[13]。本研究结果示,SD组T0、T1、T2时PSV、MBFV差异无统计学意义,而D组T1、T2时较T0时PSV、MBFV升高;同时与D组相比,SD组T1、T2时PSV、MBFV降低,提示超声引导SNB联合右美托咪定可在一定程度上稳定TBI患者开颅术后的CBF,分析原因与两者联合使用后具有完善的镇痛、镇静作用,维持血流动力学平稳相关。
国内外颅脑损伤诊治指南将ICP监测作为多模态监测的核心。脑外伤术后颅内压反复增高是一种严重的临床问题,可由脑水肿、术后出现新的出血或血肿形成,脑血管扩张致CBF异常等有关[14]。本研究结果显示,与D组相比,SD组在T1、T2时ICP降低,提示超声引导SNB联合右美托咪定可稳定TBI患者开颅术后的ICP,然而在实际工作中,其ICP值的绝对差异可能没有临床意义。
稳定的脑血流动力学和ICP是神经功能恢复的基础[15]。血清S-100β蛋白和NSE水平对早期神经细胞损伤的判断具有高度敏感度和特异度,其浓度与神经功能损伤严重程度呈正相关,被广泛用于脑损伤研究实验中[16]。本研究检测了3个不同时点三者的浓度变化,结果显示:与D组相比,SD组T1、T2时S-100β蛋白和NSE浓度均降低,提示超声引导SNB联合右美托咪定可在一定程度上减轻神经细胞损伤;既往文献的结果支持本研究[17]。
术后躁动亦可导致血压增高、心率加快,加重ICP、脑组织缺血、缺氧。从术后并发症方面看,本研究中SD组术后躁动、高血压的发生率及血管活性药物使用率均下降,均与SNB联合右美托咪定具有良好的镇痛及镇静作用有关。2组术后心动过速的发生率差异无统计学意义,与右美托咪定对心脏具有负性变时作用有关[18]。
本研究的不足之处:首先,本研究脑血流动力学参数只选择了术后早期3个时点,随着继发性脑损伤程度的不断变化,脑血流动力学也变得愈发复杂;其次,TCD监测也受诸多因素影响,如肥胖、解剖异常、过厚的颞骨等都会导致声窗信号欠佳及信号质量。
综上所述,超声引导SNB联合右美托咪定用于TBI患者开颅术后,可在一定程度上稳定脑血流和ICP,减轻神经细胞损伤,降低术后并发症发生率。
利益冲突 所有作者声明无利益冲突
作者贡献声明 赵赢、冯树全、张代玲:课题实施、病例收集;俞灵:围术期随访;潘鹏:数据整理;孙贺斌:统计分析;费建平:研究指导、论文修改;乔世刚:课题设计、论文撰写
临床试验注册:中国临床试验注册中心(ChiCTR2400087969)
Trail registration: Chinese Clinical Trail registry (ChiCTR2400087969)
| [1] | 冯一, 王建莉, 孙荷, 等. 重型颅脑损伤患者血清标志物检测及意义[J]. 中国卫生检验杂志, 2020, 30(15) 1859-1861, 1865. |
| [2] | James Cooper D, Nichol AD, Bailey M, et al. Effect of early sustained prophylactic hypothermia on neurologic outcomes among patients with severe traumatic brain injury: the POLAR randomized clinical trial[J]. JAMA, 2018, 320(21): 2211-2220. DOI:10.1001/jama.2018.17075 |
| [3] | Feeney JC, O'Halloran AM, Kenny RA. The association between hair Cortisol, hair cortisone, and cognitive function in a population-based cohort of older adults: results from the Irish longitudinal study on ageing[J]. J Gerontol A Biol Sci Med Sci, 2020, 75(2): 257-265. DOI:10.1093/gerona/gly258 |
| [4] | 侯新冉, 谢咏秋, 郭曲练. 成人开颅手术术后疼痛现状及治疗进展[J]. 临床麻醉学杂志, 2017, 33(5): 512-515. DOI:10.3969/j.issn.1004-5805.2017.05.025 |
| [5] | 周晓芬, 陈晗, 于荣国, 等. 神经重症患者术后多模态监测技术的应用研究[J]. 中华危重病急救医学, 2020, 32(8): 960-964. DOI:10.3760/cma.j.cn121430-20200130-00148 |
| [6] | Theerth KA, Sriganesh K, Madhusudan Reddy K, et al. Analgesia Nociception Index-guided intraoperative fentanyl consumption and postoperative analgesia in patients receiving scalp block versus incision-site infiltration for craniotomy[J]. Minerva Anestesiol, 2018, 84(12): 1361-1368. DOI:10.23736/S0375-9393.18.12837-9 |
| [7] | 陈桑, 田君, 王守森. 多模态超声在重型创伤性脑损伤患者大骨瓣开颅术中应用的研究进展[J]. 中华创伤杂志, 2023, 39(8): 748-755. DOI:10.3760/cma.j.cn501098-20230602-00314 |
| [8] | Tian RF, Liu WM, Dong JQ, et al. Prognostic predictors of early outcomes and discharge status of patients undergoing decompressive craniectomy after severe traumatic brain injury[J]. World Neurosurg, 2019, 126: e101-e108. DOI:10.1016/j.wneu.2019.01.246 |
| [9] | Gan ZS, Stein SC, Swanson R, et al. Blood biomarkers for traumatic brain injury: a quantitative assessment of diagnostic and prognostic accuracy[J]. Front Neurol, 2019, 10: 446. DOI:10.3389/fneur.2019.00446 |
| [10] | Creswell Simpson J, Bao XD, Agarwala A. Pain management in enhanced recovery after surgery (ERAS) protocols[J]. Clin Colon Rectal Surg, 2019, 32(2): 121-128. DOI:10.1055/s-0038-1676477 |
| [11] | Yang YX, Ou MC, Zhou HY, et al. Effect of scalp nerve block with ropivacaine on postoperative pain in patients undergoing craniotomy: a randomized, double blinded study[J]. Sci Rep, 2020, 10(1): 2529. DOI:10.1038/s41598-020-59370-z |
| [12] | Blanco P, Abdo-Cuza A. Transcranial Doppler ultrasound in neurocritical care[J]. J Ultrasound, 2018, 21(1): 1-16. DOI:10.1007/s40477-018-0282-9 |
| [13] | Sam SS, Lin HF, Tsai YH, et al. Intraoperative ultrasound is valuable for detecting intracranial hematoma progression and decreasing mortality in traumatic brain injury[J]. J Clin Ultrasound, 2023, 51(4): 731-738. DOI:10.1002/jcu.23431 |
| [14] | Gomez A, Dian J, Froese L, et al. Near-infrared cerebrovascular reactivity for monitoring cerebral autoregulation and predicting outcomes in moderate to severe traumatic brain injury: proposal for a pilot observational study[J]. JMIR Res Protoc, 2020, 9(8): e18740. DOI:10.2196/18740 |
| [15] | Langeh U, Singh S. Targeting S100B protein as a surrogate biomarker and its role in various neurological disorders[J]. Curr Neuropharmacol, 2021, 19(2): 265-277. DOI:10.2174/1570159X18666200729100427 |
| [16] | Haque A, Polcyn R, Matzelle D, et al. New insights into the role of neuron-specific enolase in neuro-inflammation, neurodegeneration, and neuroprotection[J]. Brain Sci, 2018, 8(2): 33. DOI:10.3390/brainsci8020033 |
| [17] | 吴南玲, 刘苏, 王瑶琳, 等. 头皮神经阻滞联合右美托咪定泵注对幕上肿瘤切除术患者术后恢复质量的影响[J]. 实用医学杂志, 2023, 39(8): 1015-1021. DOI:10.3969/j.issn.1006-5725.2023.08.017 |
| [18] | Tian LJ, Yao YT, Yuan S, et al. Effect of dexmedetomidine on maintaining perioperative hemodynamic stability in elderly patients: a systematic review and meta-analysis[J]. Chin Med Sci J, 2023, 38(1): 1-10. DOI:10.24920/004088 |
 2025, Vol. 34
2025, Vol. 34