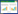2. 海南西部中心医院病理科,儋州 571700;
3. 东莞市人民医院(南方医科大学第十附属医院)老年医学科,东莞 523059
2. Department of Pathology, Hainan Western Central Hospital, Danzhou 571700, China;
3. Department of Geriatrics, The Tenth Affiliated Hospital, Southern Medical University (Dongguan People's Hospital), Dongguan 523059, China
百草枯(paraquat, PQ)是一种季铵盐除草剂,经血液循环分布于各组织器官,导致多器官功能衰竭,其中以肺损伤最为显著。早期表现为急性肺损伤(acute lung injury, ALI)或急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS),后期则出现肺间质纤维化,是PQ中毒患者死亡的主要原因。由于缺乏有效的治疗手段及特效解毒药物,临床上大多数PQ中毒患者预后极差,病死率高达50%~70%[1]。
目前大量研究表明,炎症反应、氧化应激、线粒体损伤、凋亡、自噬、细胞外基质的生成和降解失衡等多种病理过程均与PQ中毒导致肺损伤及纤维化有密切关系[2]。其中,Nlrp3蛋白作为一种细胞胞浆中的模式识别受体(pattern-recognition receptors, PRRs),在启动急性炎症过程中的级联反应中起着至关重要的作用。目前已有较多的文献证实[2-4],通过阻断Nlrp3炎症小体的激活可以改善PQ诱导的肺部炎症和纤维化进展。
西维来司他钠(sivelestat sodium, SV)通过抑制中性粒细胞弹性蛋白酶(neutrophil elastase, NE)活性,可有效减轻ALI/ARDS程度[5]。本研究旨在明确SV能否早期通过抑制Nlrp3炎症小体通路减轻PQ中毒所致的ALI/ARDS相关性肺纤维化(pulmonary fibrosis, PF)进展,阐明PQ引起肺纤维化发生的关键蛋白及其调控机制,以期为PQ中毒所致肺纤维化的临床治疗提供理论依据和潜在治疗靶点。
1 材料与方法 1.1 实验动物无特定病原体级别(specific pathogen free, SPF)的C57BL/6J小鼠[6周龄,雄性,(20±2)g]购于北京维通利华实验动物技术有限公司湖北分公司。所有动物均在(23±2)℃、50%~60%湿度以及12 h昼夜循环光照的房间内饲养,标准饮食和饮水,在实验前至少饲养1周。
本研究中动物处置方法符合动物伦理学标准,经武汉塞维尔生物科技有限公司实验动物中心实验动物管理与使用委员会批准[审批号:塞维尔动(福)第2024034号]。
1.2 主要试剂及仪器本研究主要试剂包括PQ(上海阿拉丁生化科技股份有限公司,中国);SV(上海汇伦江苏药业有限公司,中国);苏木精-伊红染色法(hematoxylin-eosin staining, HE)染色试剂(珠海贝索生物技术有限公司,中国);不同浓度的酒精和二甲苯(西陇科学股份有限公司,中国);Nlrp3炎症小体(Nlrp3)、半胱氨酸蛋白酶-1(Caspase-1)、α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、Ⅰ型胶原蛋白(Collagen Ⅰ)、β-肌动蛋白(β-actin)抗体(广州千鑫生物科技有限公司,中国);辣根过氧化物酶标记羊抗鼠/兔免疫球蛋白G、3,3’-二氨基苯基联氧化物(Diaminobenzidine, DAB)(北京中杉金桥生物技术有限公司,中国);蛋白裂解液(radio-immunoprecipitation assay, RIPA)、蛋白酶抑制剂(phenylmethanesulfonyl fluoride, PMSF)(碧云天生物技术有限公司,中国);Masson染色试剂(北京索莱宝科技有限公司,中国)。主要仪器包括光学显微镜(奥林巴斯公司,日本);组织冷冻研磨机(武汉塞维尔生物科技有限公司,中国);凝胶成像系统(UVITEC公司,英国)。
1.3 实验分组及处理按随机数字表法将C57BL/6J小鼠分为4组:对照组(Control组)、PQ组、PQ+SV组、SV组,每组8只。将PQ加入生理盐水稀释为1 g/L溶液,按照20 mg/kg抽取溶液,并用生理盐水稀释至1 mL后经左侧腹腔注射至PQ组及PQ+SV组小鼠建立PQ中毒模型,Control组、SV组小鼠经左侧腹腔注射1 mL生理盐水;1 h后,将SV粉末溶于生理盐水稀释为10 g/L溶液,按照100 mg/kg抽取溶液,并用生理盐水稀释至1 mL后经右侧腹腔注射至PQ+SV组、SV组小鼠,Control组及PQ组小鼠经右侧腹腔注射1 mL生理盐水。记录小鼠干预前及干预48 h体重及行为学情况,并于第48 h后用10%水合氯醛(3 mg/kg)腹膜腔注射麻醉,仰卧位固定于恒温手术台上,开胸充分暴露双肺,快速剪取右肺组织于4 %多聚甲醛固定48 h后行HE、Masson及免疫组化染色,取左肺组织行蛋白质印迹检测。
1.4 小鼠肺组织病理学检查将小鼠右肺组织在4 %的多聚甲醛中固定48 h,石蜡包埋,4 μm连续切片。分别进行HE及Masson染色,光镜下观察肺组织显微结构并由3名病理科医师应用Smith及Ashcroft评分[6-7]对肺组织损伤及纤维化程度进行评定。
1.5 免疫组化染色取4 μm厚的小鼠肺组织石蜡切片,经抗原修复后加入一抗,在4 ℃孵育过夜,使一抗与组织抗原结合。之后加入酶标羊抗鼠/兔IgG聚合物二抗,与一抗结合,最后用DAB显色。每个样本随机选取5个视野,使用Image J软件进行阳性信号面积占比(%Area)分析,取平均值。
1.6 蛋白质印迹检测称取30 mg的小鼠肺组织,加入适量蛋白裂解液(RIPA∶PMSF =100∶1),使用组织冷冻研磨机研磨,65 Hz研磨1 min,于4 ℃裂解30 min,12 000 r/min离心30 min,吸取上清液,按比例加入5×蛋白上样缓冲液,100 ℃加热10 min使蛋白变性。往10%的蛋白电泳凝胶中加入适量蛋白样本进行电泳,转膜,封闭1.5 h,加入一抗4 ℃孵育过夜。次日孵育二抗,显影成像后分析。
1.7 统计学方法使用GraphPad Prism 8.0及SPSS 25.0软件分析数据。所有计量资料均通过Shapiro-Wilk检验进行正态性评估,符合正态分布者以均值±标准差(x±s)描述。数据为正态分布且方差齐时,多组间比较用单因素方差分析(one-way ANOVA),组间进一步两两比较使用最小显著性差异法(least significance difference,LSD)。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠行为学及体重变化Control组及SV组小鼠进食正常,皮毛光滑,活动自如,反应灵敏。PQ组及PQ+SV组小鼠在染毒2 h后,活动及进食明显减少,反应迟钝,呈现蜷卧状,呼吸急促,毛发暗淡。PQ组及PQ+SV组小鼠与Control组相比,干预后体重均较干预前减轻[(-3.31±0.81) g vs. (-0.03±0.48) g,P < 0.001;(-2.95±0.60) g vs. (-0.03±0.48) g,P < 0.001],见表 1。
| 组别 | 动物数(只) | 体重变化(g) |
| Control组 | 8 | -0.03±0.48 |
| PQ组 | 8 | -3.31±0.81a |
| PQ+SV组 | 8 | -2.95±0.60a |
| SV组 | 8 | 0.69±1.00 |
| F值 | 60.267 | |
| P值 | <0.001 | |
| 注:体重变化(g)=干预后体重-干预前体重;与Control组比较,aP<0.001 | ||
Control组、SV组小鼠肺组织形态正常,PQ+SV组较PQ组肺组织出血、淤血、水肿情况减轻,见图 1。
|
| 图 1 各组小鼠肺组织形态 Fig 1 Lung tissue morphology of mice in each group |
|
|
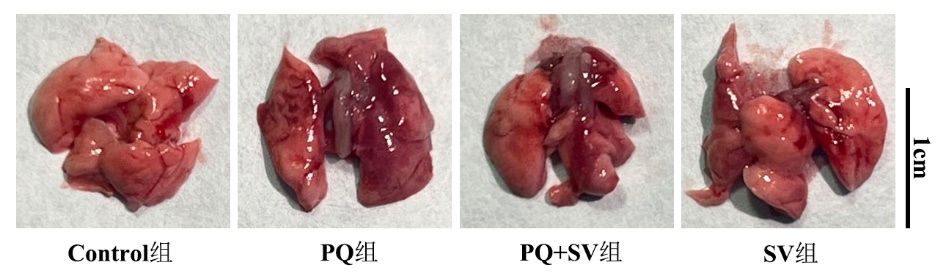
HE染色及Masson染色结果显示,PQ组小鼠肺组织肺泡间隔增厚,肺泡壁充血水肿,炎性细胞浸润,肺泡塌陷或消失,成纤维细胞大量增殖,且伴有粗大的胶原纤维蛋白沉积形成纤维瘢痕样组织;PQ+SV组与PQ组相比,小鼠肺泡壁充血水肿及炎性细胞浸润程度有所缓解,胶原纤维蛋白沉积减少。见图 2。由3名病理科医师在倒置显微镜下观察HE、Masson染色病理切片,对肺损伤及纤维化程度进行评分,PQ+SV组Smith及Ashcroft评分均较PQ组减少[(5.92±1.34)分vs. (10.88±1.88)分,P < 0.001;(3.42±1.35)分vs. (5.75±0.79)分,P < 0.001]。见表 2。
|
| 注:A为HE染色光镜下所见,Control组及SV组肺组织肺泡间隔厚度正常,未见水肿及透明膜形成,肺泡腔内偶见炎症细胞;PQ组肺泡间隔明显增厚,肺泡上皮损伤,肺泡结构萎陷或消失,肺泡腔内可见大量炎症细胞及红细胞;PQ+SV组上述病理改变均较PQ组减轻。B为Mason染色,胶原纤维呈蓝色,肌纤维、胞质、纤维素和红细胞呈红色,细胞核呈蓝色;PQ组肺组织支气管、血管及肺泡壁周围可见大量胶原纤维增生,可见条索状纤维化区域,肺泡结构明显紊乱;与PQ组相比,PQ+SV组蓝染胶原纤维沉积减少,肺泡腔结构尚完整 图 2 光镜下观察各组小鼠干预48 h后肺组织HE染色及Masson染色(×20及×80) Fig 2 HE and Masson staining results (at ×20 and 80 × magnifications) of the lung tissues of study mice under light microscopy after 48 h of intervention |
|
|
| 组别 | 动物数(只) | Smith评分(分) | Ashcroft评分(分) |
| Control组 | 8 | 0.71±0.66 | 0.50±0.59 |
| PQ组 | 8 | 10.88±1.88a | 5.75±0.79a |
| PQ+SV组 | 8 | 5.92±1.34ab | 3.42±1.35ab |
| SV组 | 8 | 1.58±1.17 | 1.00±0.80 |
| F值 | 97.885 | 54.301 | |
| P值 | <0.001 | <0.001 | |
| 注:与Control组比较,aP<0.001;与PQ组比较,bP<0.001 | |||
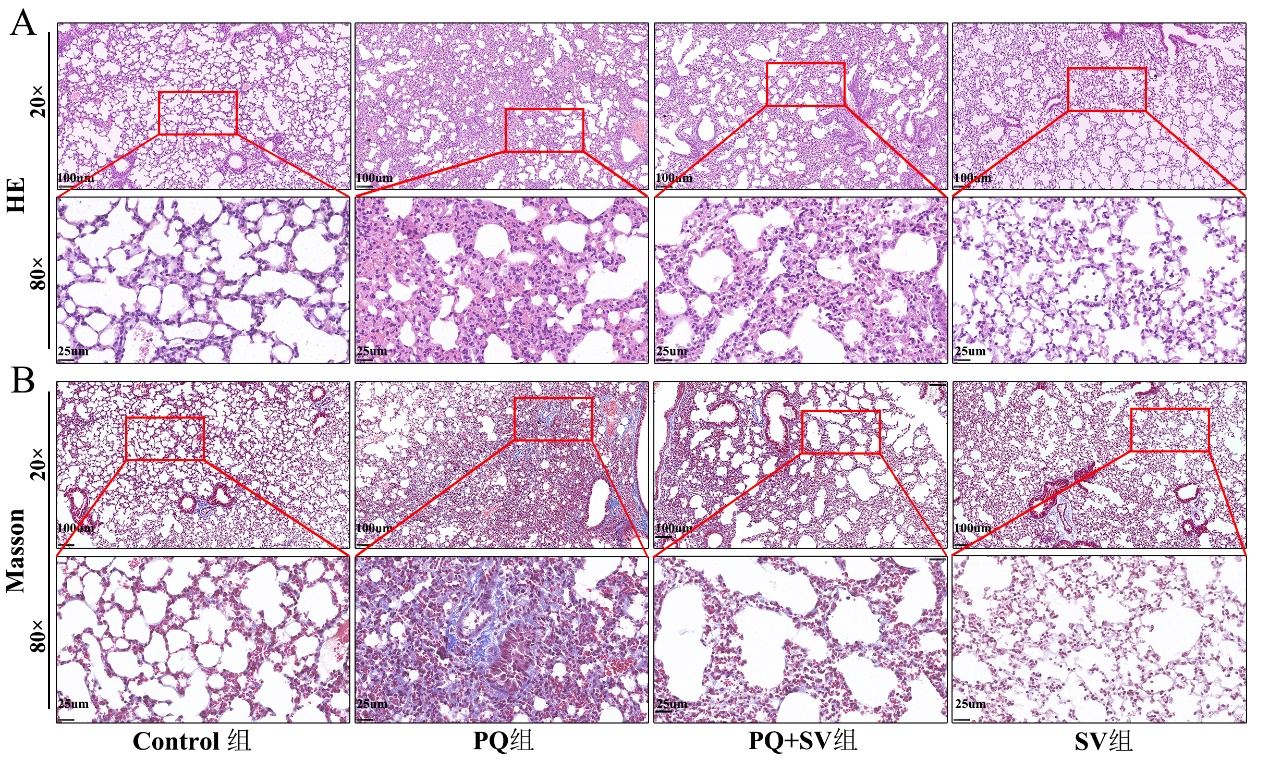
免疫组化染色结果显示,PQ+SV组小鼠肺上皮细胞及炎症细胞中可观察到Nlrp3、Caspase-1蛋白表达面积百分比均较PQ组有所减少[(12.79%±0.43%) vs. (16.59%±0.40%),P < 0.001;(17.71%±0.92%) vs. (19.84% ± 0.71%),P < 0.001],PQ+SV组小鼠肺间质中α-SMA、Collagen Ⅰ蛋白表达面积百分比均较PQ组表达减少[(11.79%±0.58%) vs.(16.14%±0.74%),P < 0.001;(16.43%±0.56%) vs. (18.86%±0.60%),P < 0.001],见图 3及表 3。
|
| 注:光镜下观察四组小鼠肺组织Nlrp3、Caspase-1、α-SMA、Collagen Ⅰ表达情况,细胞内棕色颗粒为阳性表达,颜色越深,表达越强。肺组织Nlrp3、Caspase-1的表达:Control组及SV组肺组织内仅少量肺泡上皮细胞胞核内可见Nlrp3、Caspase-1表达,细胞质未见阳性表达;PQ组肺泡上皮细胞、肺泡巨噬细胞及炎症细胞胞核及细胞质内均可见Nlrp3、Caspase-1强表达,PQ+SV组Nlrp3、Caspase-1表达较PQ组减弱。肺组织α-SMA、Collagen Ⅰ表达:PQ组及SV组肺组织中α-SMA、Collagen Ⅰ仅在气管及血管周围少量表达,在肺泡腔及间质内几乎无表达或仅少量表达;PQ组支气管及血管周围可见强表达α-SMA的肌成纤维细胞,胞质明显增粗,肺间质内可见Collagen Ⅰ强表达;PQ+SV组α-SMA、Collagen Ⅰ表达均较PQ组明显减弱 图 3 四组小鼠肺组织免疫组化染色(×40) Fig 3 Immunohistochemical staining of the lung tissues in the four groups of mice (at 40× magnification) |
|
|
| 组别 | 动物数(只) | Nlrp3(%) | Caspase-1(%) | α-SMA(%) | Collagen Ⅰ(%) |
| Control组 | 8 | 9.73±0.40 | 7.90±0.48 | 6.7±0.54 | 7.55±0.98 |
| PQ组 | 8 | 16.59±0.40a | 19.84±0.71a | 16.14±0.74a | 18.86±0.60a |
| PQ+SV组 | 8 | 12.79±0.43ab | 17.71±0.92ab | 11.79±0.58ab | 16.43±0.56ab |
| SV组 | 8 | 8.71±0.22 | 8.63±0.44 | 6.30±0.35 | 6.84±0.47 |
| F值 | 720.975 | 686.677 | 534.904 | 644.800 | |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | |
| 注:与Control组比较,aP<0.001;与PQ组比较,bP<0.001 | |||||
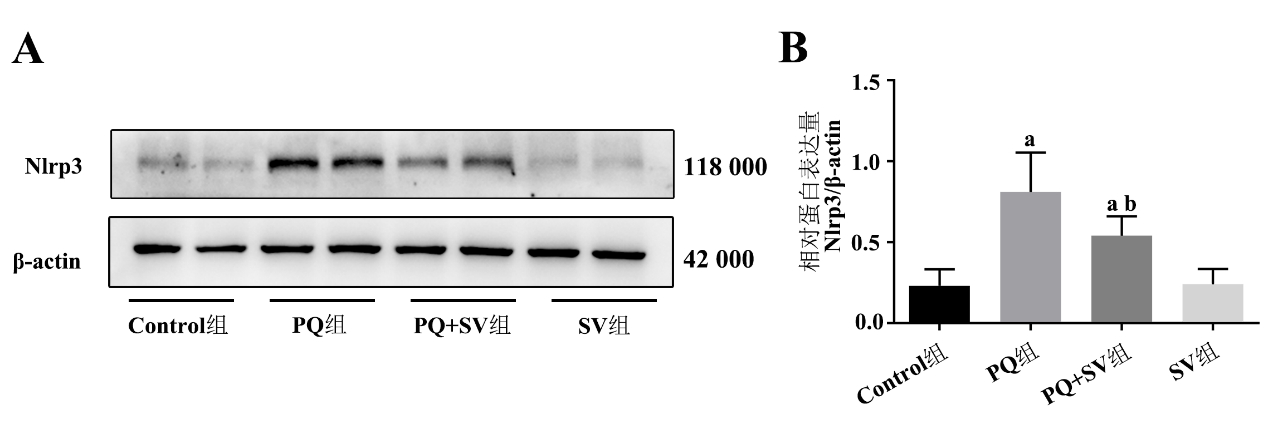
Western Blot发现,与Control组相比,PQ组及PQ+SV组Nlrp3蛋白显著上调[(0.81±0.24) vs. (0.23±0.10),P < 0.05;(0.54±0.12) vs. (0.23±0.10),P < 0.05];PQ+SV组Nlrp3蛋白表达较PQ组明显减少[(0.54±0.12) vs. (0.81±0.24),P < 0.05],见图 4。
|
| 注:A为各组小鼠肺组织中Nlrp3蛋白表达;B为各组小鼠肺组织中Nlrp3蛋白表达量化;与Control组比较,aP < 0.05;与PQ组比较,bP < 0.05 图 4 各组小鼠肺组织中Nlrp3蛋白表达 Fig 4 The protein expressions of Nlrp3 in the lung tissues of mice in each group |
|
|
本实验通过腹腔注射PQ建立肺纤维化模型,干预48 h后通过HE及Masson染色,可见PQ组小鼠肺组织肺泡间隔增厚,肺泡壁充血水肿,肺泡塌陷或消失,肺泡腔内大量巨噬细胞、炎性细胞浸润及成纤维细胞增殖,血管内微血栓形成,间质有大量胶原纤维蛋白沉积形成纤维瘢痕样组织,证实PQ诱导早期ALI/ARDS相关性肺纤维化模型建立成功。目前研究表明,ALI/ARDS相关性肺纤维化发生早在病程第一天就已启动[8],本实验证实PQ诱导纤维化发生在病程早期(48 h内),因此早期采取干预,减缓或阻止肺纤维化的进程可能是改善PQ中毒预后的关键节点。
SV可以抑制NE活性,是治疗伴全身炎症反应综合征的ALI/ARDS的有效药物[5]。NE是一种在原代中性粒细胞中表达的丝氨酸蛋白酶,可分解弹性蛋白、胶原蛋白和纤连蛋白等多种物质[9]。NE通过增加细胞因子的表达和释放直接激活炎症反应,诱导气道重塑并中断上皮修复[10]。SV作为选择性和竞争性的NE抑制剂,可以通过抑制体内炎症反应、血管内皮通透性和细胞凋亡相关分子来有效缓解脂多糖诱导的ALI[11]。Takemasa等[12]研究表明SV可通过抑制TGF-β活化和肺部炎性细胞募集来缓解博来霉素诱导的肺纤维化。本研究显示,加用SV干预的PQ中毒小鼠,肺组织破坏程度较单纯PQ干预小鼠明显减轻,炎症渗出及肺内出血情况明显减少,纤维化程度明显改善,以上结果说明,SV可抑制PQ诱导的ALI/ARDS相关性肺纤维化进展。
近年来,许多研究表明信号转导在PQ致肺纤维化中起到重要作用,包括TGF-β/Smad信号通路[13]、丝裂素活化蛋白激酶相关信号通路[14]、Wnr/β-连环蛋白信号通路[15]等。此外Nlrp3炎症小体信号通路也被多个研究证明与肺纤维化进展密切相关[16-18]。Nlrp3蛋白被病原相关分子模式或者宿主来源的危险信号分子激活后,以凋亡相关点样蛋白作为桥梁,招募和激活促炎症蛋白酶Caspase-1,从而组装成Nlrp3炎症小体[19]。作为Caspase家族的一员,Caspase-1在Nlrp3炎症小体促炎作用中发挥核心作用。活化的Caspase-1通过切割细胞因子白细胞介素(interleukin, IL)-1β、IL-18的前体,产生相应成熟的IL-1β和IL-18并释放到细胞外,引起炎症反应发生[20]。本研究显示,经PQ干预后,小鼠肺泡腔内可见大量的巨噬细胞及炎症细胞浸润,且经过免疫组化染色可见巨噬细胞、炎症细胞及肺泡上皮细胞内Nlrp3、Caspase-1蛋白强表达,同时支气管及血管周围可见强表达α-SMA蛋白的肌成纤维细胞,胞核增大,胞质明显增粗;肺泡间质内可见Collagen Ⅰ强表达,提示PQ可能通过激活Nlrp3炎症小体信号通路促进肺纤维化进展。而经过SV干预的PQ中毒小鼠肺组织免疫组化染色结果显示:Nlrp3、Caspase-1、α-SMA、Collagen Ⅰ表达均较PQ组明显减弱。蛋白质印迹检测进一步验证PQ+SV组小鼠肺组织Nlrp3蛋白表达量较PQ组明显减少,提示SV可通过抑制Nlrp3炎症小体信号通路减轻肺纤维化发展。
本研究证实SV可通过抑制Nlrp3炎症小体信号通路减轻PQ所致ALI/ARDS相关性早期肺纤维化进展,其具体机制有待进一步探究。
利益冲突 所有作者声明无利益冲突。
作者贡献声明 蔡秋燕、赵展庆:实验操作、论文撰写;刘晶、周小敏:数据收集及整理、统计学分析;夏婷婷:研究设计、论文修改
致谢: 感谢蒲培云对本文统计设计与分析的指导;感谢病理科许小康、陈观健、林琳医师对本文肺组织损伤及纤维化程度评分工作中给予的专业支持
| [1] | Chen JX, Su YL, Lin F, et al. Effect of paraquat on cytotoxicity involved in oxidative stress and inflammatory reaction: a review of mechanisms and ecological implications[J]. Ecotoxicol Environ Saf, 2021, 224: 112711. DOI:10.1016/j.ecoenv.2021.112711 |
| [2] | Liu XB, Yang H, Liu ZN. Signaling pathways involved in paraquat-induced pulmonary toxicity: molecular mechanisms and potential therapeutic drugs[J]. Int Immunopharmacol, 2022, 113(Pt A): 109301. DOI:10.1016/j.intimp.2022.109301 |
| [3] | Liu ZN, Zhao HY, Liu W, et al. NLRP3 inflammasome activation is essential for paraquat-induced acute lung injury[J]. Inflammation, 2015, 38(1): 433-444. DOI:10.1007/s10753-014-0048-2 |
| [4] | Ren Y, Yang ZZ, Sun ZR, et al. Curcumin relieves paraquat-induced lung injury through inhibiting the thioredoxin interacting protein/NLR pyrin domain containing 3-mediated inflammatory pathway[J]. Mol Med Rep, 2019, 20(6): 5032-5040. DOI:10.3892/mmr.2019.10612 |
| [5] | 中国研究型医院学会危重医学专业委员会, 中国医药教育协会重症医学专业委员会. 西维来司他钠临床应用专家共识(2022)[J]. 中华卫生应急电子杂志, 2022, 8(1): 1-5. DOI:10.3877/cma.j.issn.2095-9133.2022.01.001 |
| [6] | Smith KM, Mrozek JD, Simonton SC, et al. Prolonged partial liquid ventilation using conventional and high-frequency ventilatory techniques: gas exchange and lung pathology in an animal model of respiratory distress syndrome[J]. Crit Care Med, 1997, 25(11): 1888-1897. DOI:10.1097/00003246-199711000-00030 |
| [7] | Ashcroft T, Simpson JM, Timbrell V. Simple method of estimating severity of pulmonary fibrosis on a numerical scale[J]. J Clin Pathol, 1988, 41(4): 467-470. DOI:10.1136/jcp.41.4.467 |
| [8] | Bos LDJ, Ware LB. Acute respiratory distress syndrome: causes, pathophysiology, and phenotypes[J]. Lancet, 2022, 400(10358): 1145-1156. DOI:10.1016/S0140-6736(22)01485-4 |
| [9] | Zeng WL, Song YQ, Wang RZ, et al. Neutrophil elastase: From mechanisms to therapeutic potential[J]. J Pharm Anal, 2023, 13(4): 355-366. DOI:10.1016/j.jpha.2022.12.003 |
| [10] | Voynow JA, Shinbashi M. Neutrophil elastase and chronic lung disease[J]. Biomolecules, 2021, 11(8): 1065. DOI:10.3390/biom11081065 |
| [11] | Ren JJ, Deng GR, Li RH, et al. Possible pharmacological targets and mechanisms of sivelestat in protecting acute lung injury[J]. Comput Biol Med, 2024, 170: 108080. DOI:10.1016/j.compbiomed.2024.108080 |
| [12] | Takemasa A, Ishii Y, Fukuda T. A neutrophil elastase inhibitor prevents bleomycin-induced pulmonary fibrosis in mice[J]. Eur Respir J, 2012, 40(6): 1475-1482. DOI:10.1183/09031936.00127011 |
| [13] | Wang D, Deng BC, Cheng L, et al. The novel peptide DR4penA attenuates the bleomycin- and paraquat-induced pulmonary fibrosis by suppressing the TGF-β/Smad signaling pathway[J]. FASEB J, 2023, 37(11): e23225. DOI:10.1096/fj.202301363R |
| [14] | Li JR, Deng BC, Zhang J, et al. The peptide DH α-(4-pentenyl)-ANPQIR-NH2 exhibits antifibrotic activity in multiple pulmonary fibrosis models induced by particulate and soluble chemical fibrogenic agents[J]. J Pharmacol Exp Ther, 2024, 388(2): 701-714. DOI:10.1124/jpet.123.001849 |
| [15] | Yang ZZ, Wang MM, Ren Y, et al. Inhibition of Wnt10b/β-catenin signaling alleviates pulmonary fibrogenesis induced by paraquat in vivo and in vitro[J]. Life Sci, 2021, 286: 120027. DOI:10.1016/j.lfs.2021.120027 |
| [16] | Li JL, Xiao Y, Zhang YM, et al. Pulmonary delivery of specialized pro-resolving mediators-based nanotherapeutics attenuates pulmonary fibrosis in preclinical animal models[J]. ACS Nano, 2023, 17(16): 15354-15370. DOI:10.1021/acsnano.2c10388 |
| [17] | Wei YG, You YC, Zhang JR, et al. Crystalline silica-induced macrophage pyroptosis interacting with mitophagy contributes to pulmonary fibrosis via modulating mitochondria homeostasis[J]. J Hazard Mater, 2023, 454: 131562. DOI:10.1016/j.jhazmat.2023.131562 |
| [18] | Wang XH, Wan W, Zhang JG, et al. Efficient pulmonary fibrosis therapy via regulating macrophage polarization using respirable cryptotanshinone-loaded liposomal microparticles[J]. J Control Release, 2024, 366: 1-17. DOI:10.1016/j.jconrel.2023.12.042 |
| [19] | Elliott EI, Sutterwala FS. Initiation and perpetuation of NLRP3 inflammasome activation and assembly[J]. Immunol Rev, 2015, 265(1): 35-52. DOI:10.1111/imr.12286 |
| [20] | Mangan MSJ, Olhava EJ, Roush WR, et al. Targeting the NLRP3 inflammasome in inflammatory diseases[J]. Nat Rev Drug Discov, 2018, 17(8): 588-606. DOI:10.1038/nrd.2018.97 |
 2025, Vol. 34
2025, Vol. 34