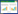2. 南京医科大学附属连云港临床医学院(连云港市第一人民医院),连云港 222000
2. Lianyungang Clinical College of Nanjing Medical University/The First People's Hospital of Lianyungang, Lianyungang 222000, China
危重患者极易出现糖代谢紊乱,无论是入院前既有的糖尿病、应激引起的高血糖,还是内分泌疾病导致的低血糖,都会对炎症、氧化应激、中性粒细胞功能、肾功能和血流动力学产生不利影响。既往研究中血糖水平与不良临床结局几乎呈线性关系[1]。脓毒症患者在入住ICU极易出现代谢亢进[2],脓毒症的严重程度和发展阶段会引发葡萄糖摄取和利用的复杂变化。初期,脓毒症患者通常处于高分解代谢状态,伴随高血糖的出现,这是机体对抗感染和炎症的应激反应[3]。血糖升高是机体应对应激状态的生理反应之一,高血糖导致脓毒症患者病死率增加[4]。目前,血糖及其变异率与脓毒症患者死亡风险增加的截断值各不相同,仍不确定[5]。本研究的最终目的是确定合适血糖时间强度和血糖变异率对患者病死率的影响。
1 资料与方法 1.1 研究对象本调查遵循加强流行病学观察性研究报告(STROBE)声明中指南[6]。使用来自MIMIC-Ⅳ[7-8]和2020—2024年连云港市第一人民医院电子健康记录数据进行回顾性队列研究。
纳入标准:(1)符合脓毒症3.0[9]诊断标准;(2)血气分析包含动脉血血糖检测值。排除标准:(1)年龄小于18岁。本团队对每一次入住ICU的数据均进行分析。
根据患者糖尿病诊断情况分为糖尿病组和非糖尿病组,并拟合患者最佳血糖范围。根据SOFA评分将患者分为低危脓毒症组(SOFA < 6分)和高危脓毒症组(SOFA≥6分)。
本研究经过连云港市第一人民医院伦理委员会批准(伦理审批号:LW-202402260001-01)。且已获得MIMIC-Ⅳ数据库访问权限并访问和提取,符合使用观察性定期收集的健康数据(RECORD)进行的研究报告声明。
1.2 变量提取研究团队从MIMIC-Ⅳ数据库中提取了患者的性别、年龄、入院类型,并根据入院时的序贯器官衰竭(sequential organ failure assessment, SOFA)评分评估病情严重程度。合并症数据通过查尔森共病指数收集。根据脓毒症3.0诊断标准,使用抗生素及送检血培养的患者被认为是感染患者,入院24 h内SOFA评分≥2分的感染患者为脓毒症患者。提取每次入院患者血气中的血糖数据及测量时间。同时提取随访数据。同样标准入组连云港市第一人民医院诊断为脓毒症患者,收集血糖及随访数据。
1.3 暴露值和结果本研究的主要结果是时变血糖(time-weighted average glucose, TWA-G)和时变血糖变异率(time-weighted average glucose variation, TWA-GV)。通过二次分析进一步量化有害暴露对患者病死率的影响。
主要结局是患者28 d生存情况(病死率),次要结局是患者住院病死率、总病死率和生存时间。
1.4 统计学方法所有统计分析均使用R(版本4.0.3)进行分析,正态分布的计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验;分类变量以例(%)表示,组间比较用卡方检验。
基于分段指数加性混合模型(piece-wise exponential additive mixed models, PAMM),选择并调整基线参数,包括年龄、性别、入院类型和查尔森共病指数评分。考虑到随访期间混杂因素可能变化,并且这些基线风险参数对结果的影响随时间变化,研究将随访期间的纵向数据即SOFA评分视为PAMM中的时变混杂因素。研究团队在模型中加入时间和暴露量的交互作用项,并对其关系进行拟合。为避免缺失数据引起的偏差,使用链式方程多重插补填补缺失数据。使用限制性立方样条图(restricted cubic spline, RCS)对异常血糖时间比例进行分析,分析异常血糖强度累积比例与病死率的关系。以P < 0.05为差异有统计学意义。
2 结果 2.1 临床基线特征资料按入组标准纳入研究的患者共13 293例,住院次数15 116次(图 1),中位年龄为63.8岁,其中38.1%的住院次数为男性,61.9%为女性。对糖尿病和非糖尿病患者的基线资料进行分类统计(表 1),发现入院时的体重及身体质量指数差异均有统计学意义。SOFA评分、查尔森合并症指数和格拉斯哥昏迷评分及住院结局、28 d病死率、总病死率也均差异有统计学意义(均P < 0.05)。
|
| 图 1 研究对象筛选流程图 Fig 1 Flowchart of participants inclusion |
|
|
| 变量 | 所有(n=15 116) | 非糖尿病患者(n=14 131) | 糖尿病患者(n=985) | χ2/t值 | P值 |
| 年龄(岁)a | 63.8±15.1 | 63.8±15.2 | 64.8±13.4 | -2.25 | 0.025 |
| 性别b | 0.09 | 0.761 | |||
| 女 | 5755(38.1) | 5375(38.0) | 380(38.6) | ||
| 男 | 9361(61.9) | 8756(62.0) | 605(61.4) | ||
| 身高(cm)a | 170.1±10.5 | 170.1±10.5 | 170±11.0 | 0.40 | 0.691 |
| 体重(kg)a | 84.1±23.6 | 83.8±23.3 | 88.3±26.2 | -4.91 | <0.001 |
| BMIa | 29.2±6.7 | 28.9±6.5 | 31.5±7.2 | -5.08 | <0.001 |
| 入院类型b | 1125.74 | <0.001 | |||
| 急诊入院 | 724(4.8) | 678(4.8) | 46(4.7) | ||
| 观察患者 | 2(0.0) | 2(0.0) | 0(0.0) | ||
| 择期患者 | 1 151(7.6) | 1 112(7.9) | 39(4.0) | ||
| 急诊观察 | 2(0.0) | 2(0.0) | 0(0.0) | ||
| 急诊病房 | 6 144(40.6) | 5 813(41.1) | 331(33.6) | ||
| 观察入院 | 1 304(8.6) | 1 021(7.2) | 283(28.7) | ||
| 手术入院 | 2 540(16.8) | 2 468(17.5) | 72(7.3) | ||
| 紧急入院 | 3 249(21.5) | 3 035(21.5) | 214(21.7) | ||
| SOFA评分(D1)a | 3.93±2.22 | 3.90±2.20 | 4.40±2.46 | -6.14 | <0.001 |
| 查尔森合并症(D1)a | 5.0±2.8 | 4.8±2.8 | 7.6±2.7 | -31.11 | <0.001 |
| GCS评分(D1)a | 13.2±3.4 | 13.1±3.4 | 13.5±2.9 | -4.42 | <0.001 |
| 平均心率(次/min)(D1)a | 87.2±15.5 | 87.3±15.4 | 85.7±15.8 | 3.08 | 0.002 |
| 收缩压(mmHg)(D1)a | 114.5±14.2 | 114.4±14.1 | 115.6±16.1 | -3.10 | 0.002 |
| 平均呼吸频率(次/分)(D1)a | 19.3±4.0 | 19.3±4.0 | 20.0±3.8 | -6.22 | <0.001 |
| 平均氧饱和度(%)(D1)a | 97.3±2.5 | 97.3±2.6 | 97.2±2.4 | 1.35 | 0.177 |
| 平均血糖(mg/dL)(D1)a | 315.4±78.9 | 319.2±80.5 | 260.6±65.3 | 11.23 | <0.001 |
| 住院死亡b | 2 366(15.7) | 2 168(15.3) | 198(20.1) | 28.94 | <0.001 |
| 28 d死亡b | 2 153(14.2) | 1 972(13.9) | 181(18.4) | 24.73 | <0.001 |
| 随访死亡b | 2 517(16.7) | 2 304(16.3) | 213(21.6) | 30.45 | <0.001 |
| 随访生存时间(d)a | 321.1±137.7 | 322.1±136.5 | 306.9±153.7 | 2.95 | 0.003 |
| 注:BMI为身体质量指数,SOFA为序贯器官衰竭评估,GCS为格拉斯哥昏迷评分,D1为第1个24 h;a为x±s,b为(例,%) | |||||
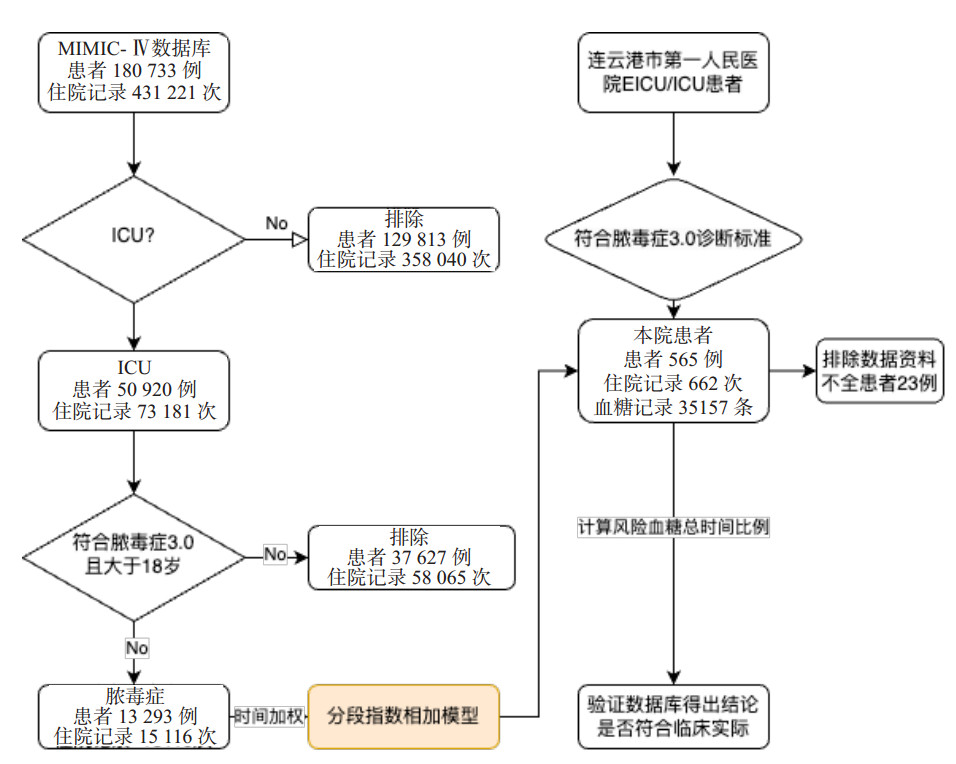
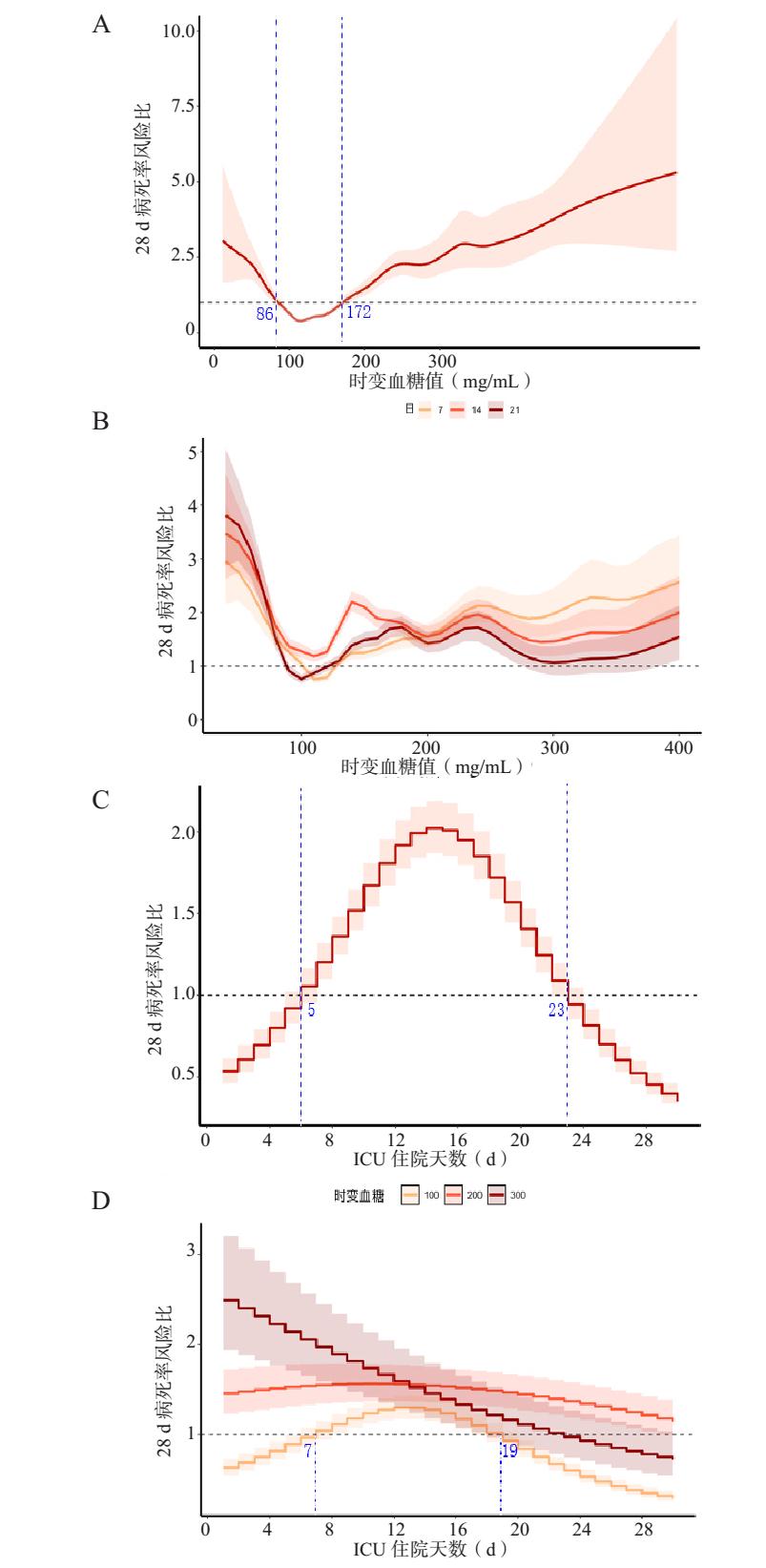
通过对数据库中13 293例脓毒症患者,住院次数15 116次的分析发现,TWA-G或TWA-GV与28 d病死率风险之间的U形关系(图 2和图 3)。当TWA-G处于86 mg/dL至172 mg/dL范围外时,死亡风险持续增加,当TWA-GV大于8%时显著增加患者死亡风险。TWA-G和TWA-GV与28 d病死率相关。TWA-G显著影响疾病中期病死率,发生主要集中在5~23 d;TWA-GV对脓毒症中期病死率的影响主要集中在4~21 d。血糖对整个ICU住院过程的影响是持续存在的。然而,研究发现,在疾病早中期,部分时间段内稍高的TWA-GV对应稍低的病死率,这可能提示早期适度允许的血糖变异更符合疾病生理状态。
|
| 注:A为调整后的TWA-G随时间变化与28 d病死率之间的关系;B为随时间变化的TWA-G与按暴露时间(7,14,21 d)的28 d病死率之间的关系;C为TWA-G对28 d病死率的时变效应; ;D为按TWA-G水平(100,200,300 mg/dL)分层的28 d病死率的时变影响 图 2 TWA-G与28 d病死率之间的关系 Fig 2 The relationship between TWA-G and 28-day mortality |
|
|
|
| 注:A为调整后的TWA-GV随时间变化与28 d病死率之间的关系;B为随时间变化的TWA-GV与按暴露时间(7,14,21 d)的28 d病死率之间的关系;C为TWA-G对28 d病死率的时变效应;D为TWA-GV对按TWA-GV水平(100,200,300 mg/dL)分层的28 d病死率的时变影响 图 3 TWA-GV与28 d病死率之间的关系 Fig 3 Relationship between TWA-GV and 28-day mortality |
|
|
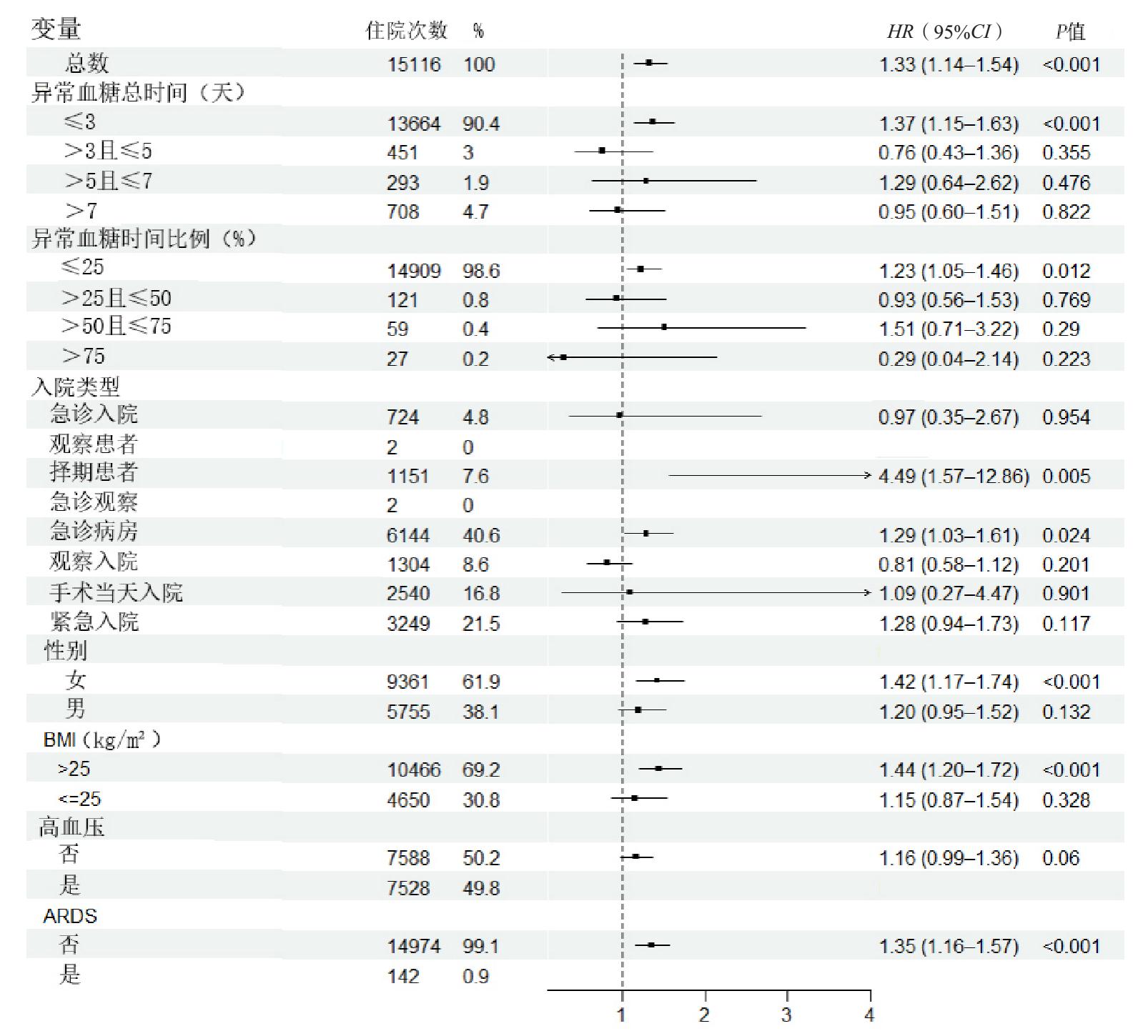
基于数据库数据分析糖尿病相对于非糖尿病对死亡风险的影响(图 4)。多变量Cox回归分析,亚组分析结果显示,随着时间暴露窗的增加异常血糖总时间及比例对患者死亡影响逐步降低,在分层分析中,住院期间出现异常血糖时间≤3 d的患者仍表现出显著的死亡风险升高(HR=1.37, 95%CI: 1.15~1.63, P < 0.001)并且异常血糖时间比例≤25%的患者同样存在统计学意义(HR=1.23, 95%CI: 1.05~1.46, P=0.012)。在不同入院类型中,择期入院患者的死亡风险最高(HR=4.49 95%CI: 1.57~12.86, P=0.005),急诊病房入院的患者也具有较高风险(HR=1.29, 95%CI: 1.03~1.61,P=0.024)。此外,女性(HR=1.42,95%CI: 1.17~1.74,P < 0.001)、BMI > 25 kg/m2者(HR=1.44, 95%CI: 1.20~1.72, P < 0.001)、未合并ARDS的患者(HR=1.35, 95%CI: 1.16~1.57, P < 0.001)死亡风险升高。其他变量分层中差异无统计学意义。
|
| 图 4 不同亚组中糖尿病对28 d死亡风险的影响的Cox回归分析 Fig 4 Cox regression analysis of the effect of diabetes on 28-day mortality risk in different subgroups |
|
|
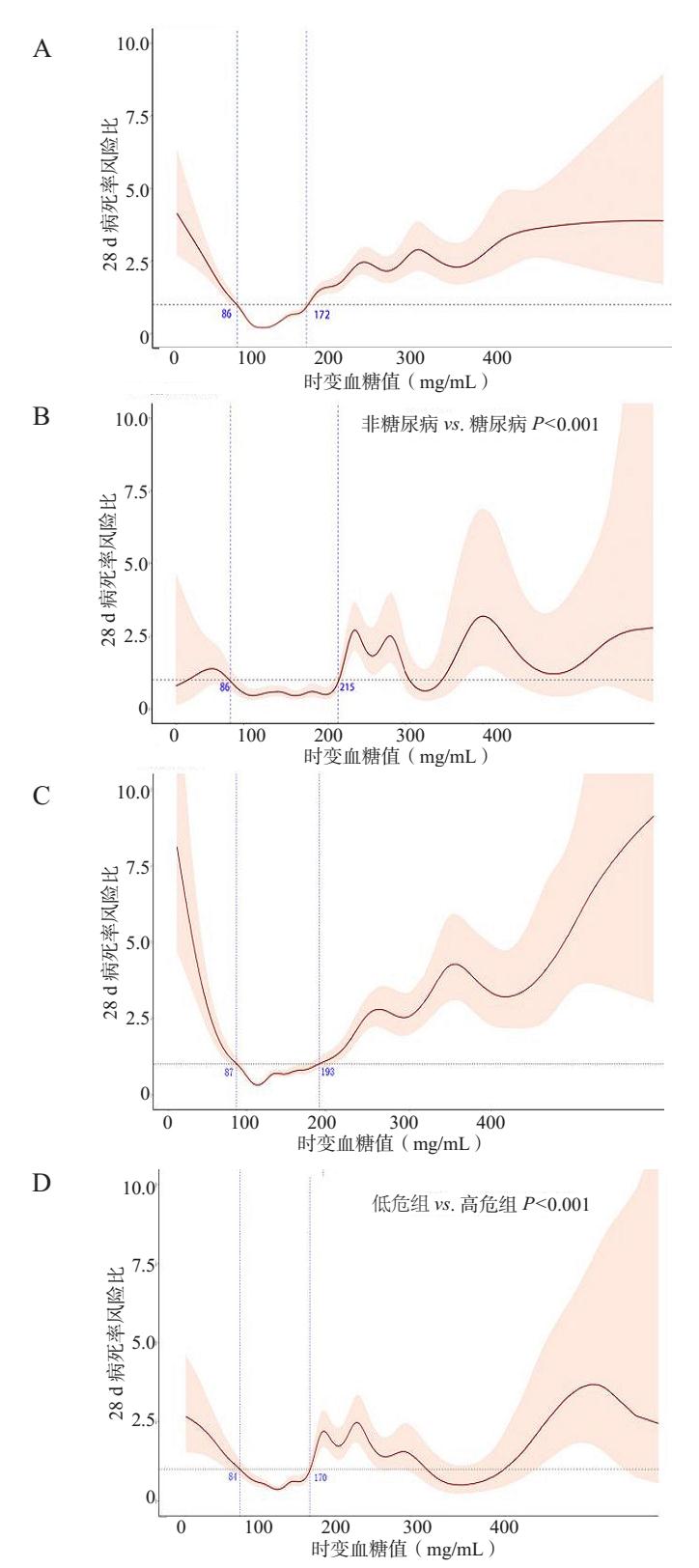
非糖尿病组在86~172 mg/dL范围内的病死率较低,而糖尿病组在86~215 mg/dL范围内表现出较低的病死率,这表明糖尿病患者对血糖的耐受范围比非糖尿病患者更广。而两组人群中,当血糖低于86 mg/dL时,病死率均升高,这可能与低血糖发生率增加直接相关。见图 5。
|
| 注:A为在非糖尿病患者中TWA-G与28 d病死率的关系;B为在糖尿病患者中TWA-G与28 d病死率的关系;C为在低危组患者中TWA-G与28 d病死率的关系;D为在高危组患者中TWA-G与28 d病死率的关系 图 5 亚患者群TWA-G与28 d病死率的关系 Fig 5 Subgroup analysis of the association between time-weighted average glucose and 28-day mortality |
|
|
同时考虑到不同脓毒症严重程度患者对血糖的耐受程度范围可能也存在不同,研究团队将患者分为根据SOFA评分将患者分为低危组(SOFA < 6分)和高危组(SOFA≥6分)分别绘制TWA-G与患者28 d病死率关系(图 5C~D),结果显示患者低危组患者87~193 mg/dL对应较低的病死率而高危组病死率较低范围为84~170 mg/dL。可能由于低危组患者各脏器功能相对完好,对代谢应激的应对能力更强,对高血糖状态下的渗透压变化、氧化应激和炎症介质释放的缓冲能力更完善;这种基于SOFA分层的血糖管理,更贴合不同严重度患者的生理耐受性,有助于个体化优化血糖目标。
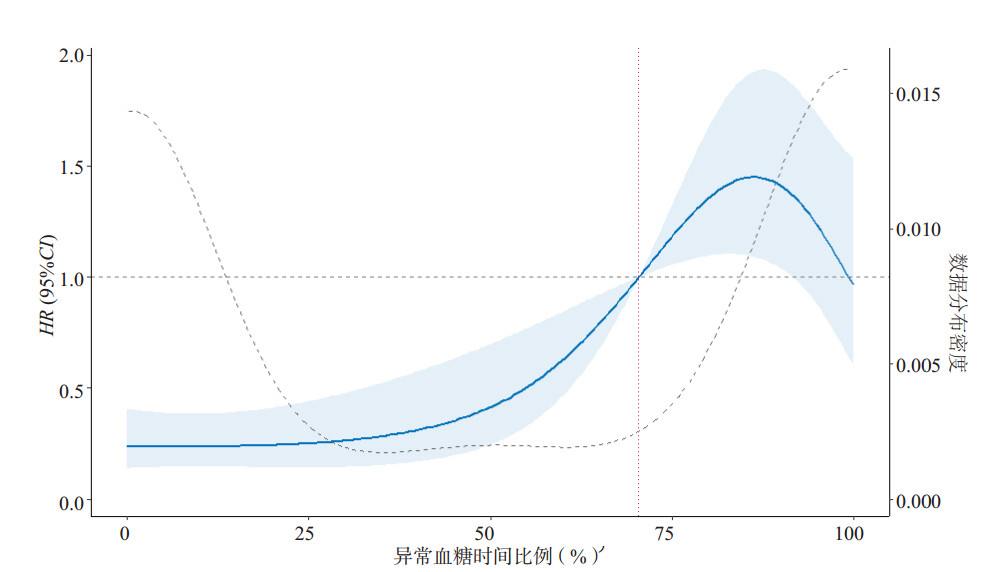
2.4 异常血糖时间比例和病死率关系验证使用RCS对连云港市第一人民医院565例脓毒症患者血糖数据进行异常血糖的时间比例与28 d病死率相关分析,可见异常血糖累积时间大于72%(HR=1.01, 95%CI: 1.00~1.02, P=0.04)时患者死亡风险增加(图 6)。提示对于异常血糖累积时间≤72%:可持续常规监测与胰岛素调整。若异常血糖累积时间 > 72%,建议加强血糖管理,比如提前启动动态胰岛素泵或强化胰岛素治疗;严密监测低血糖风险并建立预警;必要时考虑早期内分泌科会诊。
|
| 图 6 异常血糖累积时间与28 d病死率的关系 Fig 6 The relationship between the cumulative time of abnormal blood sugar and the final mortality rate of all patients |
|
|
对于危重病患者的血糖管理,长期以来存在分歧。2001年,van den Berghe等[10]报道,在外科ICU中,如果将患者血糖水平维持在80~110 mg/dL,患者的病死率比接受常规血糖管理的患者低42%。然而2006年,该团队在内科ICU中使用相同的血糖目标值进行了新的研究发现,强化的血糖控制方案只降低在ICU中住院超过3 d的患者的病死率[11]。2023年新英格兰杂志再次发表的关于ICU患者血糖控制的研究发现,严格控制血糖未能改善ICU危重患者的临床结局[2]。
本研究显示血糖暴露强度(TWA-G和TWA-GV)与脓毒症患者的28 d病死率增加相关,尤其在病程早中期。有害暴露(如86 mg/dL≤TWA-G≤172 mg/dL或TWA-GV≥8%)随时间累积,且较高的血糖变异率直接增加病死率,但轻度升高的变异率却对应较低病死率,可能反映了生理性血糖波动对应患者的生理环境适应性[12]。这似乎表示在疾病早期采取更宽松的血糖控制策略将存在临床获益,更有助于功能恢复[13]。为临床上制定更具针对性的血糖控制目标提供依据,从而减少“一刀切”式的严格或宽松管理带来的风险差异。根据早中期TWA-G及TWA-GV对病死率的动态影响,提示在病程第5~23天及第4~21天这两个窗口期,可考虑适时调整胰岛素剂量或启动动态胰岛素泵,以最大限度降低患者死亡风险。
ICU住院期间高GV与危重患者不良预后具有明确而一致的关系[14-17]。然而,关于GV对脓毒症患者死亡率的影响尚无共识。高血糖变异率水平与脓毒症患者ICU死亡风险增加独立相关。还有研究显示,通过使用整个住院期间的所有生化血糖数据和外周血糖值计算出的GV是与患者整体住院病死率高度相关[18]。
而对于糖尿病及非糖尿病患者一些证据表明,慢性的高血糖建立了一种细胞调节模式,实际上保护了危重症期间急性高血糖介导的损伤。这种效应的一种机制可能是在慢性高血糖条件下机体会下调部分葡萄糖转运蛋白。这些葡萄糖转运蛋白允许葡萄糖不受胰岛素影响进入细胞,可能使葡萄糖不受正常降糖效应的抑制。因此,在急性高血糖升高时,机体组织可能更容易受到血糖毒性增强的影响[14, 19-20]。多种氧化应激源可阻止血管内皮细胞中葡萄糖转运蛋白-1转运蛋白的下调[21]。同时,葡萄糖浓度的急剧波动与急症患者的病死率相关,与平均葡萄糖浓度无关[19-20, 22-23],多次的急性血糖波动会诱导更多的内皮细胞凋亡以及更大的内皮功能障碍和氧化应激反应[24]。因此,急性高血糖期间氧化应激增加(与慢性高血糖或糖尿病相比)似乎是急性血糖变化导致不良后果的重要机制。
通过使用大量数据样本分析结果显示,糖尿病患者表现出更加宽松的阈值标准,这与既往相关研究高度一致[25]。根据既往研究,这种差别可能由于糖尿病和非糖尿病危重患者的可溶性晚期糖基化终末产物受体的释放、时程和对强化胰岛素治疗的反应不同。
高血糖在糖尿病和非糖尿病重症患者中很常见,但慢性高血糖在病理生理学上可能与急性高血糖不同,适应高血糖可能是其中一个关键机制[26]。急性高血糖和炎症会诱导氧化应激,导致内皮损伤[27-28]。对于没有糖尿病的患者来说,中度高血糖可能具有一定的毒性,因为急性高血糖环境下细胞的适应机制会首次被激活;而长期患糖尿病的患者则可能已经对高血糖形成了耐受,从而在急性环境中对高血糖的发作更为适应。这或许可以解释为何非糖尿病患者的耐受风险区间更广,而糖尿病患者则相反。
尽管存在一些差异,关于血糖暴露与病死率相关的研究结果总体上与之前的研究基本一致。本研究在血糖暴露评估方面与以往有所不同。将每日血糖暴露视为PAMM中的时变因素,以更好地理解随时间变化的影响。其次,本研究基于算法得出阈值而不是主观划分[2, 10-11]。第三,传统的多变量Cox回归模型通常只对基线混杂因素进行调整,而PAMM模型则能够更全面地考虑到时间变化对暴露效应的影响。通过PAMM可以建模过去暴露的累积效应,将其作为暴露时间和暴露量的函数来解释,而这些因素随着时间的推移而变化。
本文存在一定的局限性。首先,本研究基于回顾性观察性设计,利用多中心数据库进行数据分析,本研究仅评估了数据库及健康电子病历中现有的血糖数据,未能在真实世界中开展大型RCT研究以进一步验证结果,在这项现实世界的观察性研究中,本团队无法量化每次血糖测量的时间,例如空腹或非空腹,因此本研究中的每个血糖记录应被视为随机血糖;同时,随机血糖缺乏连续动态的采集,可能低估或遗漏短期内血糖波动对预后的影响。其次,虽然考虑了部分时变混杂因素,但仍可能存在未测量的混杂因素,患者在ICU中使用的多种药物和异常的营养途径都与患者糖代谢紊乱高度相关有关,这种混杂因素在观察性研究中是难以避免。此外,本研究仅针对脓毒症患者,未来的研究应涵盖更广泛的危重病群体,或针对不同疾病亚组进行更精细的分类分析,以提高临床适用性。最后,本研究数据聚焦于28 d病死率未评估长期功能结局(如ICU脱机率、90 d或1年生存),难以全面反映血糖管理对患者长期生活质量和功能恢复的影响。
综上所述,脓毒症患者入ICU后的早中期应严密监测血糖和血糖变异率。高强度的血糖暴露与死亡风险增加相关,轻度血糖变异率更符合脓毒症早期生理。
利益冲突 所有作者声明无利益冲突
作者贡献声明 洪琪翔、吴问涛:酝酿研究设计、论文撰写;洪琪翔、吴问涛:数据收集及整理、统计学分析;李小民:研究设计修改、论文修改
| [1] | Al-Yousif N, Rawal S, Jurczak M, et al. Endogenous glucose production in critical illness[J]. Nutr Clin Pract, 2021, 36(2): 344-359. DOI:10.1002/ncp.10646 |
| [2] | Gunst J, Debaveye Y, Güiza F, et al. Tight blood-glucose control without early parenteral nutrition in the ICU[J]. N Engl J Med, 2023, 389(13): 1180-1190. DOI:10.1056/NEJMoa2304855 |
| [3] | Ji Y. Stress hyperglycemia has a J-shaped association with mortality among critically ill patients with sepsis[J]. J Crit Care, 2024, 80: 154503. DOI:10.1016/j.jcrc.2023.154503 |
| [4] | Kosiborod M, Rathore SS, Inzucchi SE, et al. Admission glucose and mortality in elderly patients hospitalized with acute myocardial infarction: implications for patients with and without recognized diabetes[J]. Circulation, 2005, 111(23): 3078-3086. DOI:10.1161/CIRCULATIONAHA.104.517839 |
| [5] | Pravda J. Sepsis: evidence-based pathogenesis and treatment[J]. World J Crit Care Med, 2021, 10(4): 66-80. DOI:10.5492/wjccm.v10.i4.66 |
| [6] | von Elm E, Altman DG, Egger M, et al. The strengthening the reporting of observational studies in epidemiology (STROBE) statement: guidelines for reporting observational studies[J]. Ann Intern Med, 2007, 147(8): 573-577. DOI:10.7326/0003-4819-147-8-200710160-00010 |
| [7] | Johnson AEW, Bulgarelli L, Shen L, et al. MIMIC-Ⅳ, a freely accessible electronic health record dataset[J]. Sci Data, 2023, 10(1): 1. DOI:10.1038/s41597-022-01899-x |
| [8] | Goldberger AL, Amaral LA, Glass L, et al. PhysioBank, PhysioToolkit, and PhysioNet: components of a new research resource for complex physiologic signals[J]. Circulation, 2000, 101(23): E215-E220. DOI:10.1161/01.cir.101.23.e215 |
| [9] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [10] | van den Berghe G, Wouters P, Weekers F, et al. Intensive insulin therapy in critically ill patients[J]. N Engl J Med, 2001, 345(19): 1359-1367. DOI:10.1056/NEJMoa011300 |
| [11] | Van den Berghe G, Wilmer A, Hermans G, et al. Intensive insulin therapy in the medical ICU[J]. N Engl J Med, 2006, 354(5): 449-461. DOI:10.1056/NEJMoa052521 |
| [12] | Panda S. Circadian physiology of metabolism[J]. Science, 2016, 354(6315): 1008-1015. DOI:10.1126/science.aah4967 |
| [13] | Hiemstra FW, Stenvers DJ, Kalsbeek A, et al. Daily variation in blood glucose levels during continuous enteral nutrition in patients on the intensive care unit: a retrospective observational study[J]. EBioMedicine, 2024, 104: 105169. DOI:10.1016/j.ebiom.2024.105169 |
| [14] | Lu ZQ, Tao G, Sun XY, et al. Association of blood glucose level and glycemic variability with mortality in sepsis patients during ICU hospitalization[J]. Front Public Health, 2022, 10: 857368. DOI:10.3389/fpubh.2022.857368 |
| [15] | Krinsley JS, Egi M, Kiss A, et al. Diabetic status and the relation of the three domains of glycemic control to mortality in critically ill patients: an international multicenter cohort study[J]. Crit Care, 2013, 17(2): R37. DOI:10.1186/cc12547 |
| [16] | Krinsley JS. Glycemic variability: a strong independent predictor of mortality in critically ill patients[J]. Crit Care Med, 2008, 36(11): 3008-3013. DOI:10.1097/CCM.0b013e31818b38d2 |
| [17] | Meynaar IA, Eslami S, Abu-Hanna A, et al. Blood glucose amplitude variability as predictor for mortality in surgical and medical intensive care unit patients: a multicenter cohort study[J]. J Crit Care, 2012, 27(2): 119-124. DOI:10.1016/j.jcrc.2011.11.004 |
| [18] | Ali NA, O'Brien JM Jr, Dungan K, et al. Glucose variability and mortality in patients with sepsis[J]. Crit Care Med, 2008, 36(8): 2316-2321. DOI:10.1097/CCM.0b013e3181810378 |
| [19] | Egi M, Bellomo R, Stachowski E, et al. Variability of blood glucose concentration and short-term mortality in critically ill patients[J]. Anesthesiology, 2006, 105(2): 244-252. DOI:10.1097/00000542-200608000-00006 |
| [20] | Quagliaro L, Piconi L, Assaloni R, et al. Intermittent high glucose enhances apoptosis related to oxidative stress in human umbilical vein endothelial cells: the role of protein kinase C and NAD(P)H-oxidase activation[J]. Diabetes, 2003, 52(11): 2795-2804. DOI:10.2337/diabetes.52.11.2795 |
| [21] | Cohen G, Riahi Y, Alpert E, et al. The roles of hyperglycaemia and oxidative stress in the rise and collapse of the natural protective mechanism against vascular endothelial cell dysfunction in diabetes[J]. Arch Physiol Biochem, 2007, 113(4/5): 259-267. DOI:10.1080/13813450701783513 |
| [22] | Dossett LA, Cao HQ, Mowery NT, et al. Blood glucose variability is associated with mortality in the surgical intensive care unit[J]. Am Surg, 2008, 74(8): 679-685. DOI:10.1177/000313480807400802 |
| [23] | Waeschle RM, Moerer O, Hilgers R, et al. The impact of the severity of sepsis on the risk of hypoglycaemia and glycaemic variability[J]. Crit Care, 2008, 12(5): R129. DOI:10.1186/cc7097 |
| [24] | Ceriello A, Esposito K, Piconi L, et al. Oscillating glucose is more deleterious to endothelial function and oxidative stress than mean glucose in normal and type 2 diabetic patients[J]. Diabetes, 2008, 57(5): 1349-1354. DOI:10.2337/db08-0063 |
| [25] | Chao HY, Liu PH, Lin SC, et al. Association of in-hospital mortality and dysglycemia in septic patients[J]. PLoS One, 2017, 12(1): e0170408. DOI:10.1371/journal.pone.0170408 |
| [26] | Siegelaar SE, Hoekstra JBL, Hans DeVries J. Special considerations for the diabetic patient in the ICU; targets for treatment and risks of hypoglycaemia[J]. Best Pract Res Clin Endocrinol Metab, 2011, 25(5): 825-834. DOI:10.1016/j.beem.2011.03.004 |
| [27] | Darenskaya MA, Kolesnikova LI, Kolesnikov SI. Oxidative stress: pathogenetic role in diabetes mellitus and its complications and therapeutic approaches to correction[J]. Bull Exp Biol Med, 2021, 171(2): 179-189. DOI:10.1007/s10517-021-05191-7 |
| [28] | Chaudhuri A, Umpierrez GE. Oxidative stress and inflammation in hyperglycemic crises and resolution with insulin: implications for the acute and chronic complications of hyperglycemia[J]. J Diabetes Complications, 2012, 26(4): 257-258. DOI:10.1016/j.jdiacomp.2012.04.016 |
 2025, Vol. 34
2025, Vol. 34