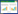嗜血综合征又名噬血细胞性淋巴组织细胞增多症(hemophagocytic lymphohistiocytosis, HLH),其中继发性嗜血综合征(secondary HLH, sHLH)与多种诱因(感染、自身炎症性疾病、自身免疫性疾病所致、获得性免疫缺陷、恶性肿瘤等)相关,特征是持续过度炎症反应,导致病情迅速恶化并发展为多器官衰竭和死亡 [1-2]。临床上主要依据HLH-2004标准[发热、血细胞减少、脾肿大、铁蛋白血症、自然杀伤(natural killer, NK)细胞活性降低、可溶性白介素2受体(human soluble interleukin 2 receptor, sCD25)水平升高、低纤维蛋白原血症和高甘油三酯血症]及H-Score建立诊断[3-4],发病机制可能与淋巴细胞毒性和免疫调节异常有关[2],患者NK细胞和细胞毒性T淋巴细胞的细胞活性异常,维持细胞因子持续释放能力,并存在灭活障碍。感染的情况下,T淋巴细胞和NK细胞活化,穿孔素和颗粒酶释放,导致细胞溶解[5]。正常状态下当触发消失后,免疫系统恢复到正常稳定状态。如果细胞毒性细胞不能消除感染的抗原呈递细胞,持续的免疫刺激将导致HLH,出现过度的炎症细胞因子释放,引发严重的炎症反应而威胁患者的生命[2, 6-7]。
研究发现sHLH患者的临床表现与炎症风暴明显相关[8],有效的评估炎症状态有助于sHLH患者的病情评估,目前临床上应用急性病理慢性健康评分Ⅱ(acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ评分)、序贯器官衰竭评估(sequential organ failure assessment, SOFA)评分进行危重患者的病情严重程度评估[9],但是尚缺乏针对sHLH患者早期预后评估的方法,同时也缺乏炎症状态评估方法(APACHE Ⅱ评分,SOFA评分)在sHLH应用的研究。因此,本研究回顾分析北京大学人民医院急诊科首诊的sHLH患者的相关资料,探讨临床不良预后的相关因素,建立预警模型,并进一步评价该模型临床应用价值。
1 资料与方法 1.1 研究对象本研究收集2017年9月至2024年12月首诊于北京大学人民医院急诊科,诊断sHLH患者。依据HLH-2004诊断标准和(或)H-score评分≥169分建立临床诊断[2]。入选标准: (1)16岁以上的成年患者;(2)符合HLH-2004诊断标准(≥5项)和(或)H-score评分≥169;(3)依据2019年成人嗜血综合征治疗推荐进行针对过度炎症[激素和(或)依托泊苷]及诱因进行初始治疗。排除标准:(1)已开始HLH相关治疗后就诊急诊科的HLH患者;(2)临床数据不足以支持研究;(3)长期使用糖皮质激素和细胞毒性药物的患者;(4)非疾病因素导致患者临床死亡。
本研究符合医学伦理学标准,经北京大学人民医院伦理委员会审查通过(审批号:2022PHB043-001)。
1.2 研究方法入院时收集患者性别、年龄、精神状态改变(altered mental status, AMS)等情况,记录入院24 h内白细胞计数(white blood cell, WBC)、血红蛋白(hemoglobin, HGB)、血小板计数(platelet, PLT)、丙氨酸氨基转移酶(alanine transaminase, ALT)、天门冬氨酸氨基转移酶(aspartate transaminase, AST)、乳酸脱氢酶(lactate dehydrogenase, LDH)、总蛋白(total protein, TP)、白蛋白(albumin, ALB)、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、高密度脂蛋白(high density lipoprotein, HDL)、低密度脂蛋白(low density lipoprotein, LDL)、估算肾小球滤过率(estimated glomerular filtration rate, eGFR)、二氧化碳(carbon dioxide, CO2)、凝血酶原时间(prothrombin Time, PT)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)、纤维蛋白原(fibrinogen, FIB)、D-二聚体(D-dimer, D-D)、电解质、心肌损伤(myocardial injury, MI)标志物、血清铁蛋白、NK细胞活性、sCD25水平、外周血涂片、心电图、骨髓穿刺、腹部CT等临床指标。MI定义为:MI标志物(肌钙蛋白)高于正常值和(或)心电图提示ST段抬高或压低≥0.05 mv。
根据HLH-2004和(或)H-score诊断标准建立临床诊断。根据入选标准和排除标准纳入研究数据,根据患者院内死亡情况,将患者分为死亡组和生存组,并进行组间对比。通过变量筛选,建立新模型,进行新模型评价,并与APACHEⅡ评分和SOFA评分进行比较。
1.3 统计学方法采用SPSS 25.0版和R语言4.5.1软件进行数据分析。符合正态分布的定量资料用均数±标准差(x±s)表示,组间比较采用独立样本t检验;不符合正态分布的定量资料用中位数(四分位数)[M(Q1, Q3)]表示,组间比较采用Mann-Whitney U检验;无序分类资料用频数(百分比)表示,组间比较采用χ2检验。相关临床资料进行单因素分析,差异有统计学意义及临床价值的指标进行多因素Logistic回归分析,建立预测模型,构建预测模型列线图(Nomogram plot)。分别采用受试者工作特征(receiver operator characteristic, ROC)曲线的曲线下面积(area under the curve, AUC)、净重新分类改善指数(net reclassification improvement, NRI)、校准曲线和临床决策曲线(decision curve analysis, DCA)评价预测模型的区分度、校准度和临床实用性。采用K折交叉验证法进行模型验证。以P<0.05为差异有统计学意义。
2 结果 2.1 死亡组和生存组临床治疗的比较研究纳入sHLH病例共116例,死亡组36例[男性48.65%,年龄(67.38±16.94)岁],生存组80例[男性32.10%,年龄(49.39±19.44)岁]。死亡组患者年龄较高,AMS、MI比例较高,PT、TBIL较高,PLT、TP、ALB、TC、HDL、LDL、eGFR、CO2较低。死亡组患者APACHEⅡ评分、SOFA评分高于幸存组,两组间相比均差异有统计学意义(表 1)。
| 指标 | 死亡组(n=36) | 生存组(n=80) | t/Z/χ2值 | P值 |
| 危重症评分 | ||||
| APACHEⅡ (s) a | 20.47±8.39 | 13.89±4.92 | 4.381 | < 0.001 |
| SOFA (s) b | 7.00 (5.00, 8.75) | 4.00 (2.00, 5.00) | -5.507 | < 0.001 |
| 一般情况 | ||||
| 年龄(岁)a | 67.38±16.94 | 49.39±19.44 | 4.861 | < 0.001 |
| 男性c | 17 (47.22) | 25 (31.25) | 2.742 | 0.098 |
| 入院状态 | ||||
| T-max (℃) a | 39.41±0.60 | 39.43±0.82 | -0.107 | 0.915 |
| AMS c | 16(44.44) | 9(11.25) | 16.181 | < 0.001 |
| 常规检查 | ||||
| WBC (×109/L)b | 4.04(1.03, 9.88) | 3.92(1.76, 7.78) | -0.460 | 0.646 |
| HGB (g/L)a | 85.69±24.42 | 91.09±26.82 | -1.029 | 0.306 |
| PLT (×109/L) b | 35.00(14.00, 65.25) | 73.50(27.50, 131.00) | -3.131 | 0.002 |
| PT (s) a | 15.34±3.94 | 12.97±2.19 | 3.378 | 0.002 |
| APTT (s) b | 32.90(29.70, 39.20) | 31.10(27.20, 36.00) | -1.855 | 0.064 |
| FIB (mg/dL) b | 284.00(132.50, 442.75) | 281.00(184.00, 384.00) | -0.113 | 0.910 |
| D-D (ng/mL) b | 2 687.00(941.00, 4 694.00) | 1 150.00(682.00, 5 393.00) | -0.977 | 0.329 |
| ALT (IU/L) b | 45.50(18.75, 84.00) | 39.00(21.25, 90.75) | -0.454 | 0.650 |
| AST (IU/L) b | 116.50(33.75, 152.00) | 52.00(30.25, 154.25) | -1.662 | 0.096 |
| LDH (IU/L) b | 837.00(359.00, 1 439.00) | 489.00(329.00, 932.00) | -1.859 | 0.063 |
| TP (g/L) a | 53.89±8.87 | 60.45±9.70 | -3.458 | 0.001 |
| ALB (g/L) a | 27.42±4.81 | 30.75±6.10 | -2.889 | 0.005 |
| TC (mmol/L) b | 2.73(2.24, 3.40) | 3.22(2.55, 4.11) | -2.098 | 0.036 |
| TG (mmol/L) b | 2.11(1.64, 3.42) | 2.02(1.41, 2.97) | -0.624 | 0.533 |
| HDL(mmol/L) b | 0.58(0.32, 0.74) | 0.71(0.46, 0.93) | -0.624 | 0.007 |
| LDL(mmol/L) b | 0.96(0.41, 1.30) | 1.64(0.97, 2.45) | -4.214 | < 0.001 |
| TBIL(μmol/L) b | 31.20(13.60, 68.48) | 11.65(8.53, 19.78) | -4.258 | < 0.001 |
| Cr (μmol/L) b | 82.00(60.25, 111.25) | 62.00(48.00, 91.00) | -2.325 | 0.020 |
| eGFR(mL/min/1.73 m2) a | 72.07±30.60 | 94.52±35.02 | -3.307 | 0.001 |
| P(mmol/L) a | 1.01±0.31 | 1.03±0.42 | -0.240 | 0.811 |
| Na(mmol/L) a | 132.58±8.97 | 135.14±5.96 | -1.558 | 0.126 |
| K(mmol/L) a | 4.06±0.59 | 3.87±0.67 | 1.492 | 0.138 |
| CO2 (mmol/L) a | 19.74±4.60 | 22.82±4.81 | -3.199 | 0.002 |
| MI c | 21(58.33) | 24(30.00) | 8.394 | 0.004 |
| 注:APACHEⅡ为急性生理与慢性健康评分Ⅱ,SOFA为序贯器官衰竭评分,T-max为体温峰值,AMS为精神状态改变,WBC为白细胞,HGB为血红蛋白,PLT为血小板,CRP为C反应蛋白,PT为凝血酶原时间,APTT为活化部分凝血活酶时间,FIB为纤维蛋白原,D-D为D二聚体,ALT为丙氨酸氨基转移酶,AST为天门冬氨酸氨基转移酶,LDH为乳酸脱氢酶,TP为总蛋白、ALB为白蛋白,TC为总胆固醇,TG为甘油三酯,HDL为高密度脂蛋白,LDL为低密度脂蛋白,TBIL为总胆红素,Cr为肌酐,P为磷,Na为钠,K钾,eGFR为估算肾小球滤过率,CO2为二氧化碳结合力,MI为心肌损伤;a为x±s,b为M(Q1, Q3),c为例数(%) | ||||
多因素Logistic回归分析显示:年龄(OR=1.062,95%CI: 1.025~1.100)、PLT(OR=0.502,95%CI: 0.288~0.876)、PT(OR=1.404,95%CI: 1.067~1.847)、TBIL(OR=3.159,95%CI: 1.480~6.743)、AMS(OR=7.375,95%CI: 1.743~31.196)、MI(OR=6.252,95%CI: 1.705~22.926)与患者临床不良预后相关(表 2)。基于多因素Logistic回归分析结果选择年龄、PLT、PT、TBIL、精神改变、心脏损伤情况为候选参数,建立临床不良预后模型,绘制模型列线图(图 1)。
| 指标 | 单因素 | 多因素 | |||||
| OR | 95%CI | P值 | OR | 95%CI | P值 | ||
| 年龄 | 1.056 | 1.029~1.084 | < 0.001 | 1.062 | 1.025~1.100 | 0.001 | |
| AMS | 6.311 | 2.427~16.410 | < 0.001 | 7.375 | 1.743~31.196 | 0.007 | |
| PLT | 0.585 | 0.403~0.849 | 0.005 | 0.502 | 0.288~0.876 | 0.015 | |
| PT | 1.340 | 1.135~1.582 | 0.001 | 1.404 | 1.067~1.847 | 0.015 | |
| TP | 0.926 | 0.883~0.971 | 0.001 | - | - | - | |
| HDL | 0.347 | 0.170~0.708 | 0.004 | - | - | - | |
| LDL | 0.288 | 0.155~0.532 | < 0.001 | - | - | - | |
| TBIL | 2.644 | 1.621~4.313 | < 0.001 | 3.159 | 1.480~6.743 | 0.003 | |
| eGFR | 0.981 | 0.970~0.993 | 0.002 | - | - | - | |
| MI | 3.933 | 1.717~9.010 | 0.001 | 6.252 | 1.705~22.926 | 0.006 | |
| 注:AMS为精神状态改变,PLT为血小板,PT为凝血酶原时间,TP为总蛋白,HDL为高密度脂蛋白,LDL为低密度脂蛋白,TBIL为总胆红素,eGFR为估算肾小球滤过率,MI为心肌损伤 | |||||||
|
| 注:AMS为精神状态改变,MI为心肌损伤,lnPLT为血小板的自然对数,lnTBIL为总胆红素的自然对数,PT为凝血酶原时间 图 1 临床不良预后预测模型列线图 Fig 1 Nomogram in prediction for clinical poor prognosis in sHLH |
|
|
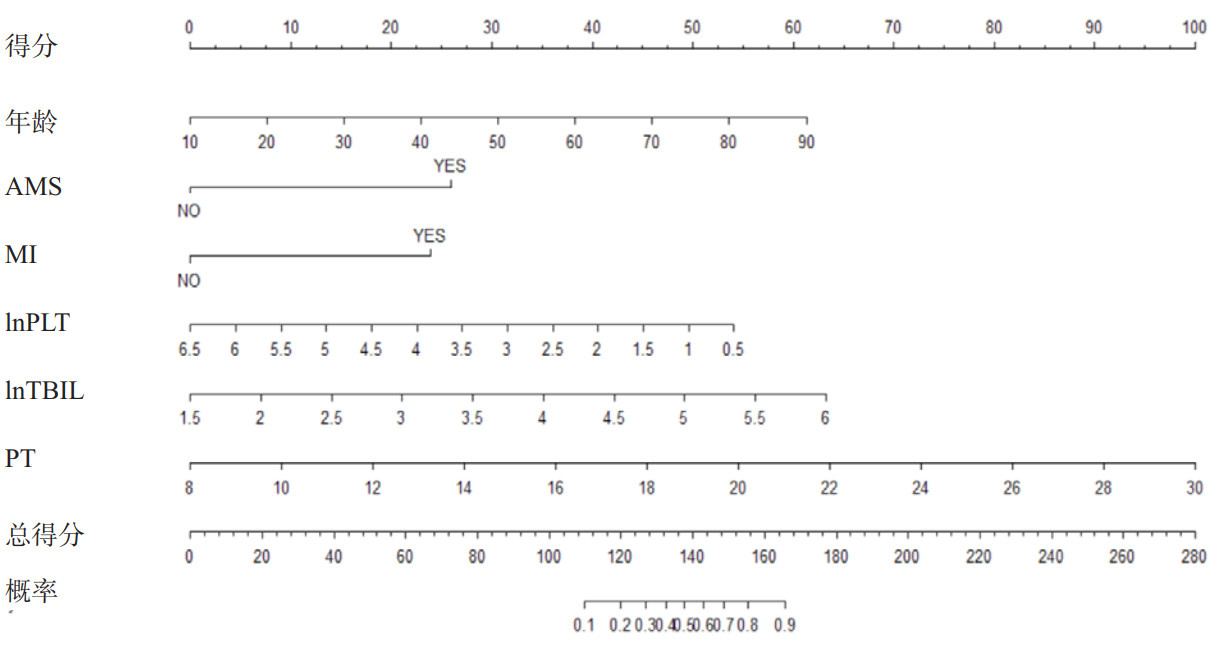
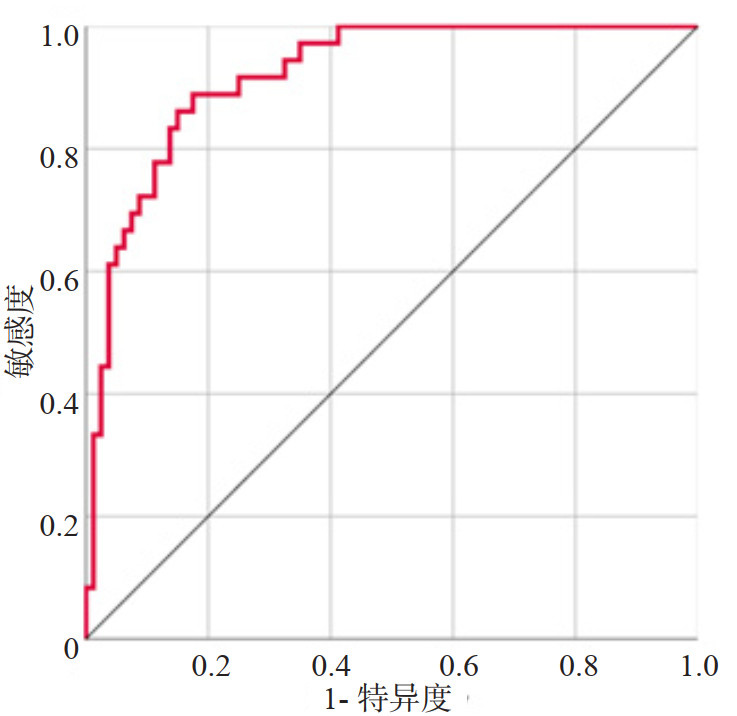
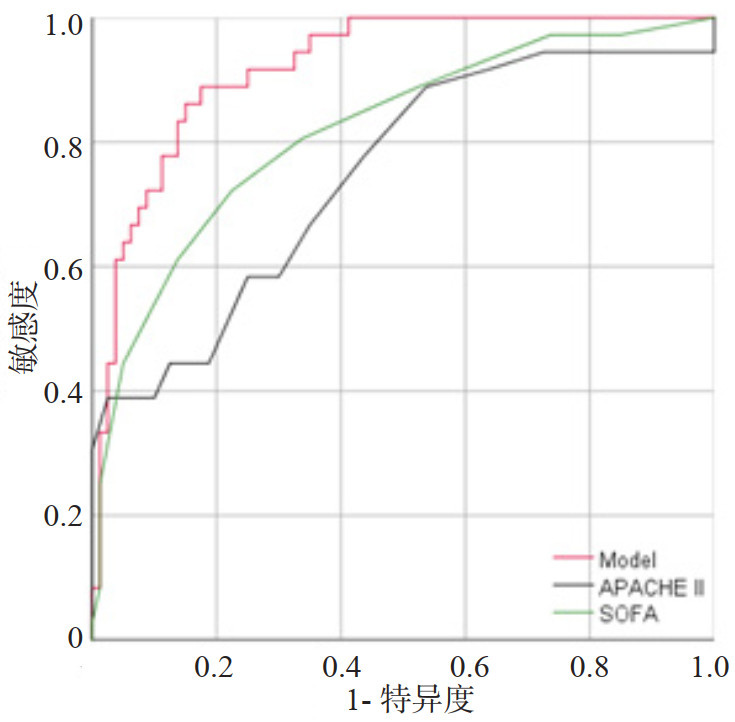
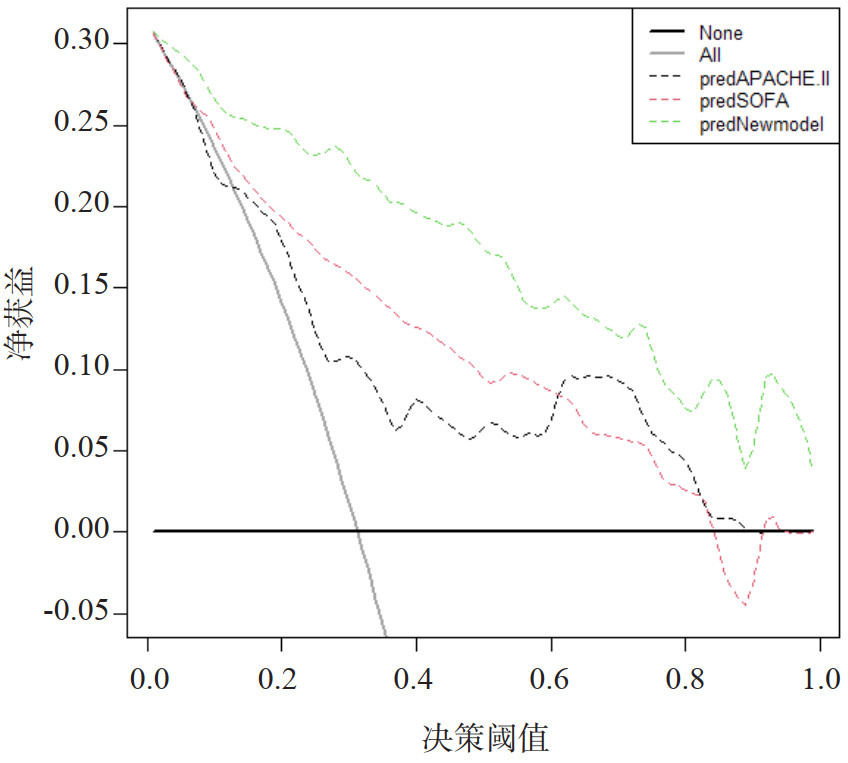
本预测模型预测sHLH患者不良预后的AUC为0.920(95%CI:0.871~0.969),K折交叉验证(K=10)后AUC为0.950(图 2)。Hosmer-Lemeshow检验显示,本模型拟合效果良好(χ2=2.5476, P=0.980),校正曲线(R2=0.649,P=0.906)显示预测模型具有良好的区分度、校准度(图 3)。ROC曲线显示临床预测模型优于APACHEⅡ,SOFA评分在sHLH不良临床预后风险的预测价值(图 4、表 3),NRI显示(连续变量和分类变量分析)预测模型与APACHEⅡ、SOFA评分相比,其预测价值均有所提高(表 4),决策曲线显示预测模型净获益优于APACHEⅡ、SOFA评分(图 5)。
|
| 图 2 预测模型临床不良预后预测的ROC曲线 Fig 2 ROC curve of the prediction model for predicting clinical poor prognosis |
|
|
|
| 图 3 预测模型预测不良预后的校准曲线 Fig 3 Calibration plot of the prediction model for predicting clinical poor prognosis |
|
|
|
| 图 4 预测模型、APACHE Ⅱ评分、SOFA评分的ROC曲线 Fig 4 ROC curve of the prediction model, APACHE Ⅱ score, and SOFA score |
|
|
| 指标 | AUC | 95%CI | P值 |
| APACHEⅡ | 0.747 | 0.646~0.847 | < 0.001 |
| SOFA | 0.818 | 0.732~0.904 | < 0.001 |
| 模型(年龄+PT+lnPLT+lnTBIL +AMS+MI) | 0.920 | 0.871~0.969 | < 0.001 |
| APACHEⅡ与SOFA | 0.747/0.818 | - | 0.199 |
| APACHEⅡ与模型 | 0.747/0.920 | - | < 0.001 |
| SOFA与模型 | 0.818/0.920 | - | 0.005 |
| 注:APACHEⅡ为急性生理与慢性健康评分Ⅱ,SOFA为序贯器官衰竭评分,PT为凝血酶原时间,lnPLT为血小板的自然对数,lnTBIL为总胆红素的自然对数,AMS为精神状态改变,MI为心肌损伤 | |||
| 指标 | NRI | NRI + | NRI − |
| 训练队列预测模型与SOFA | |||
| 连续变量 | 0.867 | 0.500 | 0.367 |
| 分类变量 | 0.255 | 0.166 | 0.089 |
| 训练队列预测模型与APACHEⅡ | |||
| 连续变量 | 1.216 | 0.583 | 0.633 |
| 分类变量 | 0.419 | 0.306 | 0.114 |
| 注:APACHEⅡ为急性生理与慢性健康评分Ⅱ,SOFA为序贯器官衰竭评分,NRI为新模型的改善能力,NRI+为新模型事件发生的改善能力,NRI-为新模型事件不发生的改善能力 | |||
|
| 图 5 预测模型,APACHE Ⅱ评分,SOFA评分的决策曲线 Fig 5 Decision curve analysis of the prediction model, APACHE Ⅱ score, and SOFA score |
|
|
本研究依据sHLH患者临床特征和客观、常规临床资料建立了sHLH临床不良预后预警模型,绘制模型列线图,该模型包含6个预测因子:年龄、精神状态改变、PLT、PT、TBIL和MI。经模型评价和K折交叉验证显示,该模型具有良好的区分度、校准度和临床实用性,优于APACHE Ⅱ评分,SOFA评分对临床不良预后的预测,有助于sHLH患者临床不良预后的早期判读。
sHLH的特征是不受控制的炎症,其可能继发于感染,自身免疫性疾病和恶性肿瘤等诱因,未经治疗的嗜血综合征患者的中位生存期常不超过2个月[10-12],目前在sHLH的治疗上的重点在于细胞毒性、免疫抑制治疗和针对已知的sHLH诱因的治疗,从而抑制过度的炎症状态,在积极糖皮质激素、依托泊苷治疗的情况下,甚至在接受异基因造血干细胞移植(Allo-HSCT)治疗的情况下,其治疗效果较前有了较为明显的改善,但是sHLH患者仍呈现早期死亡高风险,临床病死率维持较高水平的状态,及时识别高危患者,早期个体化治疗是降低病死率的关键[13-16]。
本研究显示sHLH患者临床不良预后与年龄、精神状态改变、PLT、PT、TBIL和MI相关。年龄与sHLH预后的相关性在既往研究中已经得到证实,考虑与高龄患者的器官衰老,更易发生严重器官功能障碍或合并其他疾病相关[17-18]。既往研究同样显示精神状态与sHLH预后相关,精神状态变化的出现提示疾病影响到神经系统,研究认为神经系统受到影响可能是病情进展的重要提示之一[19-20]。文献报道,高达60%的sHLH患者可能出现凝血功能障碍,本研究发现在sHLH不良预后模型中PLT减少和PT延长是相关危险因素,PLT减少既是疾病的临床表现之一,也是发生出血的高危因素之一,同时研究发现sHLH患者约有50%存在PT延长,而凝血功能障碍的出现可能与患者发生弥漫性血管内凝血及病程中出血事件发生率增加有关,进而影响患者的临床预后[17, 21-22]。本研究和既往研究均发现TBIL与sHLH不良临床预后存在相关性,TBIL是肝脏功能损伤的重要指标,也是MODS评分、SOFA评分等危重症评分的重要组成部分,本研究认为TBIL在一定程度上体现了肝脏功能和红细胞破坏的情况,进而体现出疾病的严重程度 [23]。目前尚缺乏关于MI与sHLH预后的研究,本研究认为MI提示心肌细胞坏死,与不良预后相关,其原因可能贫血和炎症风暴相关。虽然近年来提出数个针对sHLH不良临床预后的评估系统,但是研究结果的一致性不理想,结合目前相关研究结果,本研究认为年龄、精神状态改变、PLT、PT、TBIL、MI与患者预后的相关性是客观存在的,可以在一定程度上提示sHLH患者的疾病状态,有助于临床预后的评估,不同研究结果差异可能与单中心回顾性研究、样本量不足、患者原发疾病的差异相关。同时本研究也显示与APACHE Ⅱ评分、SOFA评分等评分系统比较,新模型可以更好的预测患者的临床预后,具有良好的区分度、校准度和临床实用性。
本研究是一项单中心回顾性研究,研究数据全部为sHLH患者,样本量较小,未针对导致嗜血综合征的病因进行区分进行亚组分析,存在一些局限性,但是纳入患者发病的诱因占比基本相同,同时既往研究结果和本研究结果存在一致性。因此,本研究认为预测模型(年龄、PLT、PT、TBIL、MI、精神改变)可以有效的,较为准确的预测临床预后,具有良好的区分度、校准度和临床实用性,对sHLH患者的预后评估有一定的临床意义。
综上所述,本研究认为sHLH患者临床表现多种多样,其临床特点不典型,早期死亡风险较高,依据预测模型(年龄、精神状态改变、PLT、PT、TBIL、MI)可以有效的,较为准确的预测临床预后,提升临床医生对危重症患者的关注度,推进依托泊苷、CD20单抗、异基因造血干细胞移植早期干预的个体化治疗,以改善患者的临床预后。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王武超:研究设计、采集数据、分析数据、文章撰写;刘思齐: 采集数据、分析数据;巩皓:采集数据、支持性贡献;裴源源:采集数据、支持性贡献;朱继红:文章修改、对文章内容作批评性审阅、行政支持
| [1] | Chinnici A, Beneforti L, Pegoraro F, et al. Approaching hemophagocytic lymphohistiocytosis[J]. Front Immunol, 2023, 14: 1210041. DOI:10.3389/fimmu.2023.1210041 |
| [2] | Rosée PL, Horne A, Hines M, et al. Recommendations for the management of hemophagocytic lymphohistiocytosis in adults[J]. Blood, 2019, 133(23): 2465-2477. DOI:10.1182/blood.2018894618 |
| [3] | Ponnatt TS, Lilley CM, Mirza KM. Hemophagocytic lymphohistiocytosis[J]. Arch Pathol Lab Med, 2022, 146(4): 507-519. DOI:10.5858/arpa.2020-0802-RA |
| [4] | Fatma A, Raida BS, Mourad C, et al. Performances of the H-score and the HLH-2004 score in the positive diagnosis of secondary hemophagocytic lymphohistiocytosis[J]. Curr Res Transl Med, 2024, 72(2): 103430. DOI:10.1016/j.retram.2023.103430 |
| [5] | Griffiths GM, Tsun A, Stinchcombe JC. The immunological synapse: a focal point for endocytosis and exocytosis[J]. J Cell Biol, 2010, 189(3): 399-406. DOI:10.1083/jcb.201002027 |
| [6] | Kaçar AG, Celkan TT. Hemophagocytic lymphohistiocytosis[J]. Balkan Med J, 2022, 39(5): 309-317. DOI:10.4274/balkanmedj.galenos.2022.2022-4-83 |
| [7] | Russ A, Hua AB, Montfort WR, et al. Blocking "don't eat me" signal of CD47-SIRPα in hematological malignancies, an in-depth review[J]. Blood Rev, 2018, 32(6): 480-489. DOI:10.1016/j.blre.2018.04.005 |
| [8] | Soy M, Atagündüz P, Atagündüz I, et al. Hemophagocytic lymphohistiocytosis: a review inspired by the COVID-19 pandemic[J]. Rheumatol Int, 2021, 41(1): 7-18. DOI:10.1007/s00296-020-04636-y |
| [9] | Beigmohammadi MT, Amoozadeh L, Rezaei Motlagh F, et al. Mortality predictive value of APACHE Ⅱ and SOFA scores in COVID-19 patients in the intensive care unit[J]. Can Respir J, 2022, 2022: 5129314. DOI:10.1155/2022/5129314 |
| [10] | Al-Samkari H, Berliner N. Hemophagocytic lymphohistiocytosis[J]. Annu Rev Pathol Mech Dis, 2018, 13: 27-49. DOI:10.1146/annurev-pathol-020117-043625 |
| [11] | 中国医师协会血液科医师分会, 中华医学会儿科学分会血液学组, 噬血细胞综合征中国专家联盟, 等. 中国噬血细胞综合征诊断与治疗指南(2022年版)[J]. 中华医学杂志, 2022, 102(20): 1492-1499. DOI:10.3760/cma.j.cn112137-20220310-00488 |
| [12] | Ravelli A, Minoia F, Davì S, et al. 2016 classification criteria for macrophage activation syndrome complicating systemic juvenile idiopathic arthritis: a European league against rheumatism/American college of rheumatology/paediatric rheumatology international trials organisation collaborative initiative[J]. Ann Rheum Dis, 2016, 75(3): 481-489. DOI:10.1136/annrheumdis-2015-208982 |
| [13] | Lao K, Sharma N, Gajra A, et al. Hemophagocytic lymphohistiocytosis and bone marrow hemophagocytosis: a 5-year institutional experience at a tertiary care hospital[J]. South Med J, 2016, 109(10): 655-660. DOI:10.14423/SMJ.0000000000000546 |
| [14] | Campo M, Berliner N. Hemophagocytic lymphohistiocytosis in adults[J]. Hematol Oncol Clin North Am, 2015, 29(5): 915-925. DOI:10.1016/j.hoc.2015.06.009 |
| [15] | Bhatt NS, Oshrine B, An Talano J. Hemophagocytic lymphohistiocytosis in adults[J]. Leuk Lymphoma, 2019, 60(1): 19-28. DOI:10.1080/10428194.2018.1482543 |
| [16] | Levels JHM, Lemaire LCJM, van den Ende AE, et al. Lipid composition and lipopolysaccharide binding capacity of lipoproteins in plasma and lymph of patients with systemic inflammatory response syndrome and multiple organ failure[J]. Crit Care Med, 2003, 31(6): 1647-1653. DOI:10.1097/01.CCM.0000063260.07222.76 |
| [17] | Zhang QL, Zhu LX, Zhou D, et al. Risk factors and prognosis of early death in secondary hemophagocytic lymphohistiocytosis[J]. Ann Hematol, 2023, 102(9): 2301-2308. DOI:10.1007/s00277-023-05153-1 |
| [18] | Zhao YC, Lu DL, Ma SS, et al. Risk factors of early death in adult patients with secondary hemophagocytic lymphohistiocytosis: a single-institution study of 171 Chinese patients[J]. Hematology, 2019, 24(1): 606-612. DOI:10.1080/16078454.2019.1660458 |
| [19] | Lu MX, Xie YH, Guan XX, et al. Clinical analysis and a novel risk predictive nomogram for 155 adult patients with hemophagocytic lymphohistiocytosis[J]. Ann Hematol, 2021, 100(9): 2181-2193. DOI:10.1007/s00277-021-04551-7 |
| [20] | Cai GL, Wang YN, Liu XJ, et al. Central nervous system involvement in adults with haemophagocytic lymphohistiocytosis: a single-center study[J]. Ann Hematol, 2017, 96(8): 1279-1285. DOI:10.1007/s00277-017-3035-5 |
| [21] | 祝金莉, 吴凡, 胡林辉, 等. 继发性噬血细胞性淋巴组织细胞增多症早期死亡高危临床因素分析[J]. 中国实验血液学杂志, 2023, 31(6): 1866-1871. DOI:10.19746/j.cnki.issn1009-2137.2023.06.041 |
| [22] | Valade S, Mariotte E, Azoulay E. Coagulation disorders in hemophagocytic lymphohistiocytosis/macrophage activation syndrome[J]. Crit Care Clin, 2020, 36(2): 415-426. DOI:10.1016/j.ccc.2019.12.004 |
| [23] | Qiu KY, Guo SY, Zeng YH, et al. Analysis of clinical characteristics and prognostic factors associated with EBV-associated HLH in children[J]. Hematology, 2022, 27(1): 874-880. DOI:10.1080/16078454.2022.2109328 |
 2025, Vol. 34
2025, Vol. 34