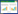2. 正安县人民医院重症医学科, 遵义 563499;
3. 遵义医科大学附属医院胸外科, 遵义 563003
2. Department of Critical Care Medicine, Zhengan People's Hospital, Zunyi 563449, China;
3. Department of Thoracic Surgery, Affiliated Hospital of Zunyi Medical University, Zunyi 563003, China
自发性脑出血(intracerebral hemorrhage, ICH)是导致全球成人高死亡率和致残率的重要公共卫生问题[1-2]。目前,ICH的临床治疗主要包括积极降压、止血治疗、不同的手术策略等,然而ICH患者临床终点的结局仍未明显改善[3]。ICH后神经炎症反应被激活,释放细胞因子和其他免疫调节分子,这些分子可以增强或减轻继发性脑损伤,并参与随后的脑修复机制,可能是潜在的治疗靶点并有效治疗ICH的炎症后遗症[4]。
程序性细胞死亡蛋白-1(programmed cell death protein 1, PD-1)是一种含有288个氨基酸的细胞跨膜表面受体,广泛表达于免疫细胞和其他细胞类型(小胶质细胞和神经元)中[5]。PD-1是免疫应答的负调节因子,通过结合程序性细胞死亡因子配体1(programmed cell death-Ligand 1, PD-L1),抑制免疫细胞的活性,在维持自身免疫耐受和防止过度免疫反应方面有一定意义[5]。除了在免疫系统中扮演重要角色外,越来越多的证据表明PD-1/PD-L1通路同样参与中枢神经系统和周围神经系统中的神经炎症反应[6-7]。在脑外伤或脊髓损伤模型中,大脑和脊髓中的PD-1+小胶质细胞被激活,同时PD-1+巨噬细胞也被招募,这些小胶质细胞和巨噬细胞发生表型改变调节神经炎症和疾病进展[8-9]。除了PD-1和PD-L1的膜结合形式外,循环系统中还发现了这些分子的可溶性形式(soluble PD-1/PD-L1, sPD-1/sPD-L1)[10]。sPD-1和sPD-L2主要由PD-1 mRNA的选择性剪接异构体翻译产生[11],而sPD-L1则是由基质金属蛋白酶剪切PD-L1产生[12]。目前,sPD-1和sPD-L1多在各种肿瘤[13-16](肺癌、肝癌和胰腺癌等)和感染性疾病[10, 17](感染性胰腺炎和脓毒症等)中被检测到显著升高,可以作为血清生物标志物预测患者预后。然而,目前尚未报导ICH患者血液中的sPD-1和sPD-L1水平,及其在预后分析中的预测价值。
1 资料与方法 1.1 研究对象本研究为前瞻性队列研究,纳入2022年1月至2024年10月入住遵义医科大学附属医院重症医学科(intensive care unit,ICU)的ICH患者。纳入标准:(1)年龄≥18岁;(2)符合脑出血诊断标准[18]的首发ICH;(3)出血后24 h内入院的患者;(4)患者家属知情同意参加本项目。排除标准:(1)继发性脑出血与外伤、肿瘤、动静脉畸形、凝血功能障碍或缺血性脑卒中出血转化有关;(2)抗血小板或抗凝药物引起的出血;(3)既往存在其他神经系统疾病,如中风、颅内肿瘤、肌萎缩侧索硬化症、帕金森病、阿尔茨海默病、颅内感染、多发性硬化症等;(4)ICH发病前有其他失代偿性基础疾病或进行性合并症(如肾脏、肝脏或心脏疾病)的患者;(5)哺乳期或妊娠期妇女;(6)资料不全者。
患者本人或法定监护人签署知情同意书,本研究通过遵义医科大学附属医院生物医学研究伦理委员会批准(伦理审查批件号:KLLY-2022-039)。
1.2 数据收集从电子病历中收集ICH患者的人口学资料和临床参数:年龄、性别、既往史、抽烟史、饮酒史、住院时间和实验室结果;计算格拉斯哥昏迷评分(Glasgow Coma Scale, GCS)评分、国家卫生研究院卒中评分(National Institute of Health Stroke Scale, NIHSS)和改良Rankin量表(modified Rankin Scale, mRS)评分;计算机断层扫描指标:出血量、出血部位、出血体积、梗阻性脑积水。
主要结局指标:28 d全因病死率和60 d神经功能预后。
根据患者28 d存活或死亡将患者分为存活组和死亡组;根据mRS评分进行60 d神经功能预后评估,0~3分为神经功能预后良好组,4~6分为神经功能预后不良组。
1.3 血清收集与检测收集纳入ICH患者入院当日(24 h内)外周静脉血3~5 mL,将采集的血标本于4 ℃离心(3 000 r/min, 10 min)后将血清分装,-80 ℃冻存备检。采用酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)法检测血清sPD-1和sPD-L1(华美生物工程有限公司,武汉,中国),具体步骤按试剂盒说明书操作。
1.4 统计学方法所有数据均采用SPSS 29.0和R 4.2.2软件进行数据分析并绘制图表。采用专业统计学软件PASS进行样本量估计,设定显著性水准双侧α=0.05,β=0.2,把握度(Power=1-β)=80%,根据以往相关临床研究的sPD-1的研究结果[10],按照暴露组∶非暴露组=1∶1,计算每组样本量为40例,考虑了10%的脱落病例数,确定每组纳入45例患者,总计纳入至少90例患者。
采用Shapiro-Wilk检验或Kolmogorov-Smirnov检验评估连续变量的正态性,连续变量用均数±标准差(x±s)或中位数(四分位间距法)[M(Q1, Q3)]表示,两组间比较采用独立样本t检验或Mann-Whitney U检验。分类变量用计数(百分比)表示,使用Fisher精确检验或Pearson卡方检验。使用LASSO分析筛选变量,采用二元多因素Logistic回归分析影响28 d死亡风险和60 d神经功能预后的相关独立危险因素。采用列线图将预测模型可视化;采用受试者工作特征(receiver operating characteristic curve, ROC)曲线、决策曲线(decision curve analysis, DCA)、校正曲线、Hosmer-Lemeshow拟合优度统计等对预测模型进行评价。以P<0.05为差异有统计学意义。
2 结果 2.1 纳入患者的基线资料本研究总计纳入194例ICH患者,根据排除标准最终155例患者纳入最终研究队列,其中存活组有101例,死亡组有54例;依据60 d mRS评分,神经功能预后良好组有56例,神经功能预后不良组有99例(图 1)。
|
| 图 1 患者流程图 Fig 1 Participant enrollment flowchart |
|
|
存活组和死亡组患者在年龄、性别、既往史、抽烟史和饮酒史的差异无统计学意义(均P > 0.05,表 1)。死亡组患者的出血体积、脑干出血比例和合并梗阻性脑积水比例多于存活组;但手术干预的存活组患者多于死亡组(均P<0.05)。存活组患者的总住院时间和ICU住院时间长于死亡组;存活组患者入院GCS评分高于死亡组,同时入院NIHSS评分低于死亡组(均P<0.05)。实验室结果显示白细胞计数、中性粒细胞计数、血小板、国际标准化比值、甘油三酯、胆固醇、C-反应蛋白、钠离子和白蛋白在存活组和死亡组患者之间的差异无统计学意义(均P > 0.05);然而死亡组患者的血清乳酸和肌酐浓度高于存活组(均P<0.05)。见表 1。
| 指标 | 整体队列(n=155) | 存活组(n=101) | 死亡组(n=54) | t/Z/χ2值 | P值 |
| 一般情况 | |||||
| 年龄(岁)a | 57.7 ± 13.1 | 58.2 ± 13.5 | 56.6 ± 12.5 | 0.602 | 0.467 |
| 男性b | 111 (71.6) | 67 (66.3) | 44 (81.5) | 3.260 | 0.071 |
| 抽烟史b | 65 (41.9) | 38 (37.6) | 27 (50.0) | 2.213 | 0.137 |
| 饮酒史b | 57 (36.8) | 32 (31.7) | 25 (46.3) | 3.232 | 0.072 |
| 梗阻性脑积水b | 60 (38.7) | 20 (19.8) | 40 (74.1) | 43.684 | < 0.001 |
| 外科手术治疗b | 97 (62.6) | 74 (73.3) | 23 (42.6) | 14.139 | < 0.001 |
| 出血体积(mL)c | 32.5 (11.3, 57.2) | 28.3 (10.1, 49.3) | 39.4 (14.0, 81.1) | -2.974 | 0.003 |
| 入院GCS评分c | 4.0 (3.0, 5.0) | 4.0 (3.0, 5.0) | 3.0 (3.0, 5.0) | 3.600 | < 0.001 |
| 入院NIHSS评分c | 28.0 (24.0, 34.0) | 25.0 (20.5, 28.0) | 35.0 (31.8, 38.0) | -8.390 | < 0.001 |
| 总住院时间(d)c | 6.0 (4.0, 10.0) | 7.0 (4.0, 12.5) | 5.0 (3.0, 9.3) | 2.763 | 0.006 |
| ICU住院时间(d)c | 5.0 (4.0, 10.0) | 6.0 (4.0, 11.0) | 5.0 (3.0, 7.0) | 2.934 | 0.003 |
| 既往史b | |||||
| 糖尿病 | 13 (8.4) | 6 (5.9) | 7 (12.9) | 2.258 | 0.133 |
| 高血压 | 118 (76.1) | 77 (76.2) | 41 (75.9) | 0.002 | 0.965 |
| 冠心病 | 13 (8.4) | 8 (7.9) | 5 (9.3) | 0.082 | 0.775 |
| 慢性肾脏病 | 19 (12.3) | 10 (9.9) | 9 (16.7) | 1.498 | 0.221 |
| 手术史 | 23 (14.8) | 16 (15.8) | 7 (12.9) | 0.231 | 0.631 |
| 出血部位b | |||||
| 基底节区出血 | 75 (48.4) | 53 (52.5) | 22 (40.7) | 1.940 | 0.164 |
| 丘脑出血 | 12 (7.7) | 8 (7.9) | 4 (7.4) | 0.013 | 0.909 |
| 脑叶出血 | 47 (30.3) | 30 (29.7) | 17 (31.5) | 0.053 | 0.818 |
| 小脑出血 | 12 (7.7) | 9 (8.9) | 3 (5.6) | 0.555 | 0.544 |
| 脑室出血 | 6 (3.9) | 4 (3.9) | 2 (3.7) | 0.006 | 0.937 |
| 脑干出血 | 25 (16.1) | 8 (7.9) | 17 (31.5) | 14.439 | < 0.001 |
| 实验室指标 | |||||
| 白细胞计数(×109/L)a | 11.99 ± 4.31 | 12.14 ± 4.55 | 11.69 ± 3.90 | -0.621 | 0.535 |
| 中性粒细胞计数(×109/L)c | 9.78 (7.35, 12.08) | 10.04 (7.49, 12.34) | 9.59 (6.79, 11.56) | 0.916 | 0.359 |
| 血小板(×109/L)c | 165.0 (115.0, 212.0) | 167.0 (117.0, 215.0) | 157.5 (110.3, 204.0) | 0.738 | 0.461 |
| 国际标准化比值c | 0.98 (0.90, 1.06) | 0.98 (0.90, 1.04) | 0.99 (0.90, 1.11) | -1.133 | 0.257 |
| 甘油三酯(mmol/L)c | 1.91 (1.63, 2.84) | 2.05 (1.58, 2.85) | 1.80 (1.67, 2.68) | 0.638 | 0.523 |
| 胆固醇(mmol/L)c | 2.57 (1.84, 3.53) | 2.57 (1.85, 3.53) | 2.59 (1.75, 3.55) | 0.487 | 0.627 |
| 乳酸(mmol/L)c | 4.50 (3.28, 6.50) | 4.23 (2.85, 5.73) | 5.13 (3.74, 6.80) | -2.297 | 0.022 |
| C-反应蛋白(mg/L)c | 56.3 (18.3, 145.3) | 53.8 (18.3, 148.8) | 80.1 (18.7, 134.6) | -0.819 | 0.413 |
| 钠离子(mmol/L)c | 141.0 (138.0, 147.0) | 140.6 (138.0, 146.0) | 141.0 (138.7, 148.0) | -0.812 | 0.422 |
| 肌酐(μmol/L)c | 92.0 (71.0, 126.0) | 90.5 (68.3, 125.8) | 96.0 (84.5, 139.0) | -2.038 | 0.042 |
| 白蛋白(g/L)a | 32.4 ± 5.0 | 32.3 ± 4.9 | 32.6 ± 5.2 | 0.350 | 0.727 |
| 注:GCS为格拉斯哥昏迷评分,ICU为重症监护室,NIHSS为美国国立卫生研究院卒中量表;a为x±s,b为(例,%),c为M(Q1, Q3) | |||||
合并梗阻性脑积水的神经功能预后不良组患者多于预后良好组,神经功能预后良好组患者入院GCS评分高于预后不良组,同时入院NIHSS评分低于预后不良组(均P<0.05)。神经功能预后不良组患者的血乳酸、C反应蛋白和肌酐浓度均高于神经功能预后良好组(均P<0.05)。见表 2。
| 指标 | 整体队列(n=155) | 预后良好组(n=56) | 预后不良组(n=99) | t/Z/χ2值 | P值 |
| 一般情况 | |||||
| 年龄(岁)a | 57.7 ± 13.1 | 59.3 ± 13.8 | 56.7 ± 12.7 | 1.129 | 0.261 |
| 男性b | 111 (71.6) | 36 (64.3) | 75 (75.8) | 2.316 | 0.128 |
| 抽烟史b | 65 (41.9) | 27 (48.2) | 38 (38.4) | 1.420 | 0.233 |
| 饮酒史b | 57 (36.8) | 24 (42.8) | 33 (33.3) | 1.395 | 0.238 |
| 梗阻性脑积水b | 60 (38.7) | 10 (17.8) | 50 (50.5) | 16.069 | < 0.001 |
| 外科手术治疗b | 97 (62.6) | 40 (71.4) | 57 (57.6) | 2.931 | 0.087 |
| 出血体积(mL)c | 32.5 (11.3, 57.2) | 33.8 (10.7, 53.0) | 31.1 (11.9, 68.2) | -1.158 | 0.247 |
| 入院GCS评分c | 4.0 (3.0, 5.0) | 4.5 (3.0, 5.0) | 3.0 (3.0, 5.0) | 2.311 | 0.021 |
| 入院NIHSS评分c | 28.0 (24.0, 34.0) | 24.0 (18.0, 26.0) | 31.0 (26.0, 35.0) | -6.923 | < 0.001 |
| 总住院时间(d)c | 6.0 (4.0, 10.0) | 7.0 (4.3, 11.0) | 5.0 (3.0, 10.0) | 1.761 | 0.078 |
| ICU住院时间(d)c | 5.0 (4.0, 10.0) | 6.0 (4.0, 10.8) | 5.0 (3.0, 10.0) | 1.871 | 0.061 |
| 既往史b | |||||
| 糖尿病 | 13 (8.4) | 5 (8.9) | 8 (8.1) | 0.033 | 0.855 |
| 高血压 | 118 (76.1) | 40 (71.4) | 78 (78.8) | 1.066 | 0.302 |
| 冠心病 | 13 (8.4) | 5 (8.9) | 8 (8.1) | 0.033 | 0.855 |
| 慢性肾脏病 | 19 (12.3) | 6 (10.7) | 13 (13.1) | 0.194 | 0.659 |
| 手术史 | 23 (14.8) | 8 (14.3) | 15 (15.2) | 0.021 | 0.884 |
| 出血部位b | |||||
| 基底节区出血 | 75 (48.4) | 31 (55.4) | 44 (44.4) | 1.706 | 0.192 |
| 丘脑出血 | 12 (7.7) | 4 (7.1) | 8 (8.1) | 0.044 | 0.834 |
| 脑叶出血 | 47 (30.3) | 15 (26.8) | 32 (32.3) | 0.519 | 0.417 |
| 小脑出血 | 12 (7.7) | 6 (10.7) | 6 (6.1) | 1.085 | 0.298 |
| 脑室出血 | 6 (3.9) | 1 (1.7) | 5 (5.1) | 1.025 | 0.311 |
| 脑干出血 | 25 (16.1) | 5 (8.9) | 20 (20.2) | 3.360 | 0.067 |
| 实验室指标 | |||||
| 白细胞计数(×109/L)a | 11.99 ± 4.31 | 11.48 ± 3.36 | 11.36 ± 2.74 | -0.022 | 0.983 |
| 中性粒细胞计数(×109/L)c | 9.78 (7.35, 12.08) | 8.96 (7.56, 11.37) | 9.78 (7.85, 10.60) | -0.030 | 0.976 |
| 血小板(×109/L)c | 165.0 (115.0, 212.0) | 181.0 (149.0, 214.0) | 142.0 (102.0, 227.0) | 0.454 | 0.649 |
| 国际标准化比值c | 0.98 (0.90, 1.06) | 1.01 (0.96, 1.05) | 1.01 (0.90, 1.31) | 0.306 | 0.760 |
| 甘油三酯(mmol/L)c | 1.91 (1.63, 2.84) | 2.52 (1.74, 3.23) | 2.51 (1.75, 2.58) | -0.635 | 0.525 |
| 胆固醇(mmol/L)c | 2.57 (1.84, 3.53) | 2.52 (1.91, 3.53) | 2.04 (1.75, 3.85) | 1.453 | 0.146 |
| 乳酸(mmol/L)c | 4.50 (3.28, 6.50) | 3.05 (2.29, 3.60) | 4.55 (2.53, 15.0) | -2.407 | 0.016 |
| C-反应蛋白(mg/L)c | 56.3 (18.3, 145.3) | 20.3 (4.3, 69.4) | 79.9 (41.9, 158.7) | -2.650 | 0.008 |
| 钠离子(mmol/L)c | 141.0 (138.0, 147.0) | 138.5 (136.8, 142.8) | 142.6 (139.6, 152.0) | 0.099 | 0.100 |
| 肌酐(μmol/L)c | 92.0 (71.0, 126.0) | 78.0 (59.0, 114.0) | 92.0 (85.0, 176.0) | -2.258 | 0.024 |
| 白蛋白(g/L)a | 32.4 ± 5.0 | 33.1 ± 4.6 | 32.8 ± 4.4 | 0.077 | 0.939 |
| 注:GCS为格拉斯哥昏迷评分,ICU为重症监护室,NIHSS为美国国立卫生研究院卒中量表;a为x±s,b为(例,%),c为M(Q1, Q3) | |||||
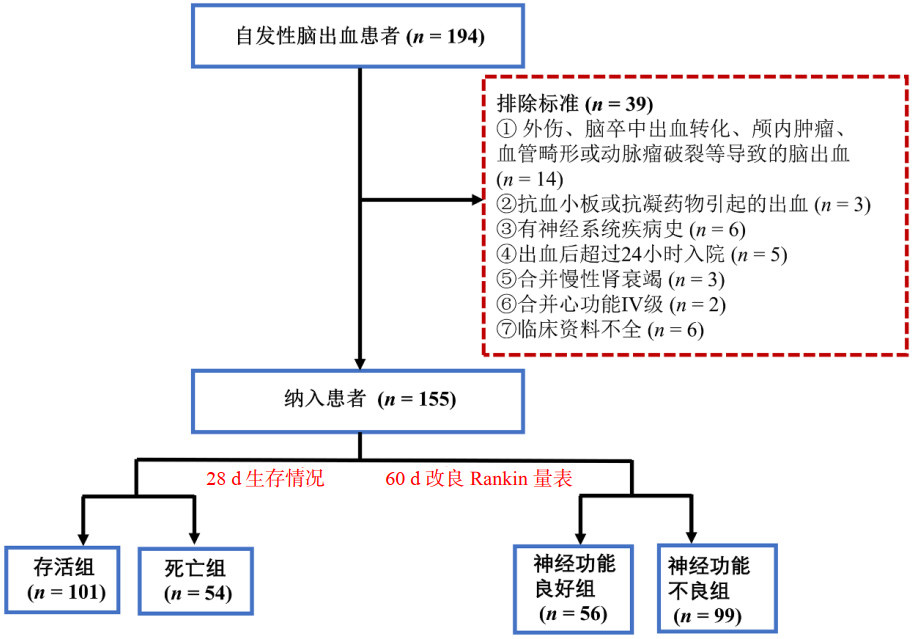
入院当日ICH存活组患者的血清sPD-1浓度高于死亡组;神经功能预后良好组患者血清sPD-1浓度高于神经功能预后不良组(均P<0.05)。然而,入院当日存活组患者的血清sPD-L1浓度低于死亡组;神经功能预后良好组患者血清sPD-L1浓度低于神经功能预后不良组(均P<0.05)。见图 2。
|
| 注:mRS为改良Rankin量表,sPD-1为可溶性程序性细胞死亡蛋白-1,sPD-L1为可溶性程序化细胞死亡配体1 图 2 各组血清sPD-1和sPD-L1浓度的比较 Fig 2 Comparison of serum sPD-1 and sPD-L1 among groups |
|
|
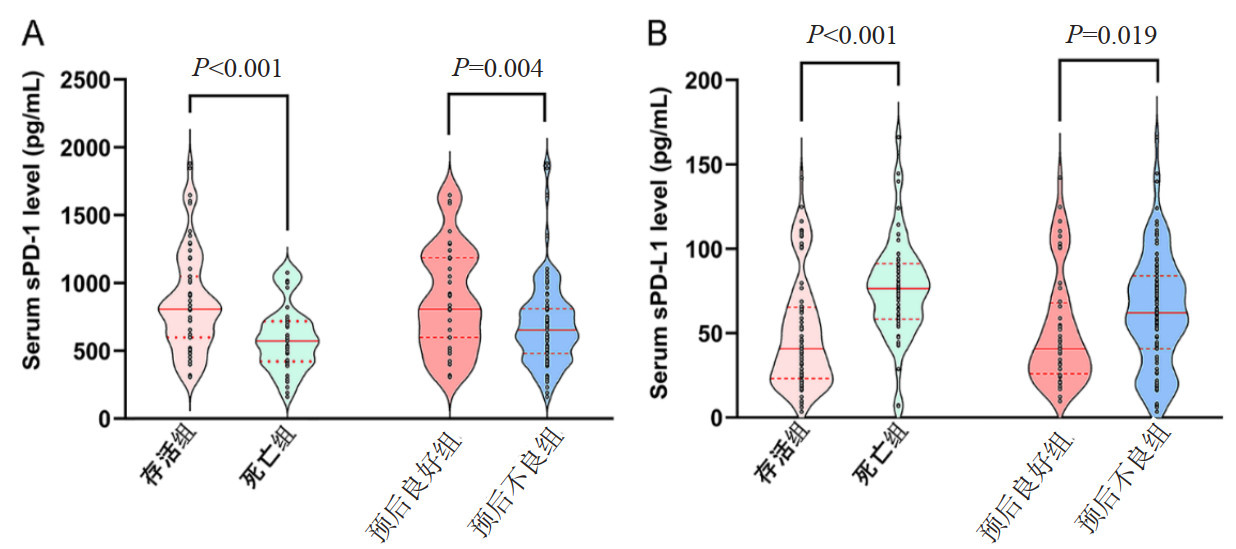
患者基线资料(性别、年龄、基底节区脑出血、丘脑出血、脑叶出血、小脑出血、脑室出血、脑干出血、出血体积、梗阻性脑积水、手术干预);血清乳酸、白细胞计数、血小板、肌酐、sPD-1和sPD-L1浓度;入院GCS评分和NIHSS评分这19个变量纳入进行预后分析(图 3)。经过Lasso分析筛选,本研究选择lambda.min(最小误差对应的lambda)值,进行后续列线图模型的构建。最终选择脑干出血、出血体积、梗阻性脑积水、手术干预、入院NIHSS评分、入院当日的血清sPD-1和sPD-L1浓度7个指标为预测28 d死亡风险的预测因子(图 3A~B;表 3);进一步分析得出脑干出血、出血体积、梗阻性脑积水和入院NIHSS是独立预测因子(均P<0.05)。梗阻性脑积水、入院NIHSS评分和血清sPD-1浓度3个指标成为预测60 d神经功能预后不良的预测因子(图 3C~3D;表 4),入院NIHSS和入院当日的血清sPD-1是独立预测因子(均P<0.05)。
|
| 图 3 基于最小绝对收缩和选择算子和二元logistic回归分析选择28 d死亡风险(A,B)和60 d神经功能预后不良(C,D)的预测因子 Fig 3 Predictor selection of 28-day all-cause mortality (A, B) and 60- day neurological prognosis (C, D) based on LASSO-logistic regression analysis |
|
|
| 变量 | β值 | OR值(95%CI) | P值 |
| 脑干出血(有/无) | 3.449 | 31.469 (3.571~458.866) | 0.004 |
| 出血体积(mL) | 0.050 | 1.051 (1.021~1.094) | 0.003 |
| 梗阻性脑积水(有/无) | 3.605 | 36.785 (6.057~477.416) | < 0.001 |
| 手术干预(有/无) | -1.877 | 0.153 (0.010~1.386) | 0.125 |
| 入院NIHSS评分 | 0.357 | 1.428 (1.229~1.788) | < 0.001 |
| sPD-1 (pg/mL) | -0.002 | 0.997 (0.994~1.000) | 0.177 |
| sPD-L1 (pg/mL) | 0.006 | 1.006 (0.996~1.013) | 0.086 |
| 注:NIHSS为美国国立卫生研究院卒中量表,sPD-1为可溶性程序性细胞死亡蛋白-1,sPD-L1为可溶性程序化细胞死亡配体1 | |||
| 变量 | β值 | OR值(95%CI) | P值 |
| 梗阻性脑积水(有/无) | 0.653 | 1.921 (0.823~4.627) | 0.135 |
| 入院NIHSS评分 | 0.164 | 1.179 (1.107~1.267) | < 0.001 |
| sPD-1 (pg/mL) | -0.001 | 0.998 (0.997~0.999) | 0.036 |
| 注:NIHSS为美国国立卫生研究院卒中量表,sPD-1为可溶性程序性细胞死亡蛋白-1 | |||
各变量之间的相关性分析结果(图 4)结果显示各变量之间最大相关系数绝对值为0.53,提示各变量之间未存在共线性。各变量方差膨胀因子和容忍度结果分别为:脑干出血(2.192;0.456)、出血体积(1.560;0.641)、梗阻性脑积水(1.963;0.509)、手术干预(2.578;0.388)、NIHSS评分(1.066;0.938)、sPD-1(1.223;0.818)、sPD-L1(1.184;0.845),方差膨胀因子值介于1.066~2.578,容忍度值介于0.388~0.938,均提示各变量间不存在多重共线性。
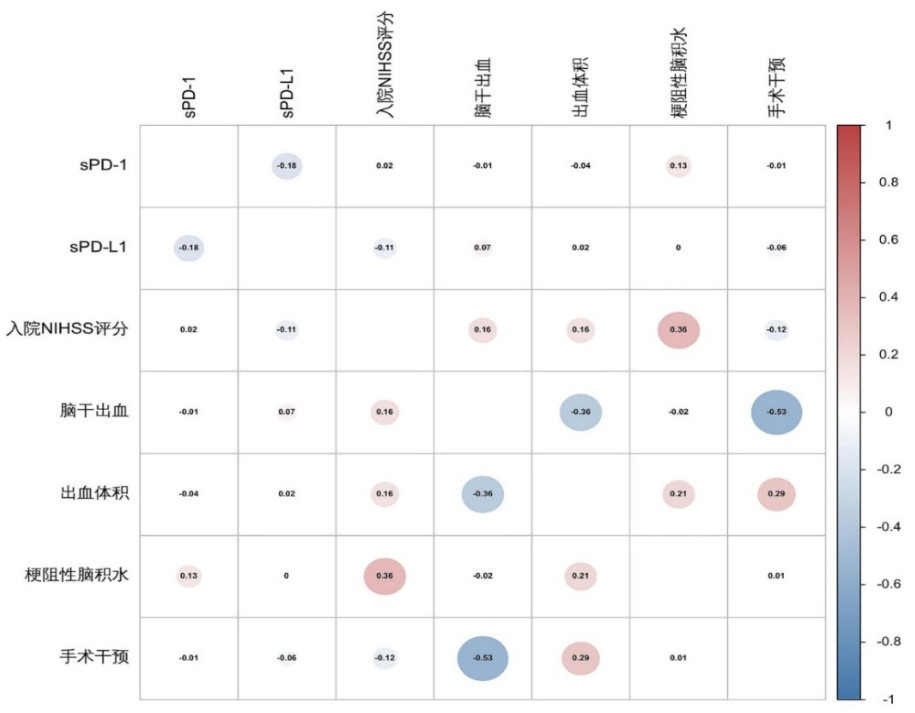
|
| 注:NIHSS为美国国立卫生研究院卒中量表,sPD-1为可溶性程序性细胞死亡蛋白-1,sPD-L1为可溶性程序化细胞死亡配体1 图 4 各变量的相关性分析热图 Fig 4 Heatmaps of correlation of variables |
|
|
本研究根据Lasso-Logistic分析结果,采用脑干出血、出血体积、梗阻性脑积水、手术干预、入院NIHSS评分、入院当日的血清sPD-1和sPD-L1浓度7个指标构建28 d死亡风险模型,生成列线图(图 5)。该列线图的校准曲线(图 6A)和DCA曲线(图 6B)显示了该列线图模型良好的拟合和临床表现。该列线图的C指数为0.984,Bootstrapping验证的C指数为0.975。Hosmer-Lemeshow检验(χ2=6.698, df=8, P=0.569),表明该模型的校正和拟合优秀。此外,本研究应用ROC曲线评价列线图预测性能,AUC为0.984(95%CI: 0.968~1.000),表明该模型具有良好的判别能力(图 6C)。采用DeLong检验对不同变量的AUC进行比较,结果显示列线图模型预测性能优于单独血清sPD-1[AUC=0.712(95%CI: 0.629~0.795)]和sPD-L1[AUC=0.753(95%CI: 0.674~0.833)](均P<0.001,表 5)。
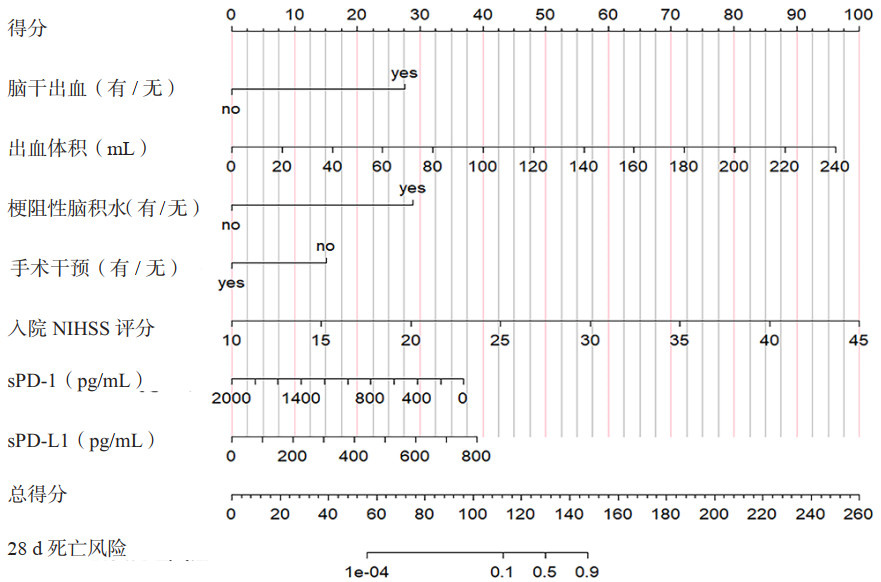
|
| 注:NIHSS为美国国立卫生研究院卒中量表,sPD-1为可溶性程序性细胞死亡蛋白-1,sPD-L1为可溶性程序化细胞死亡配体1 图 5 建立28 d死亡风险的列线图预测模型 Fig 5 Developed nomogram of the predictive model for 28-day allcause mortality |
|
|
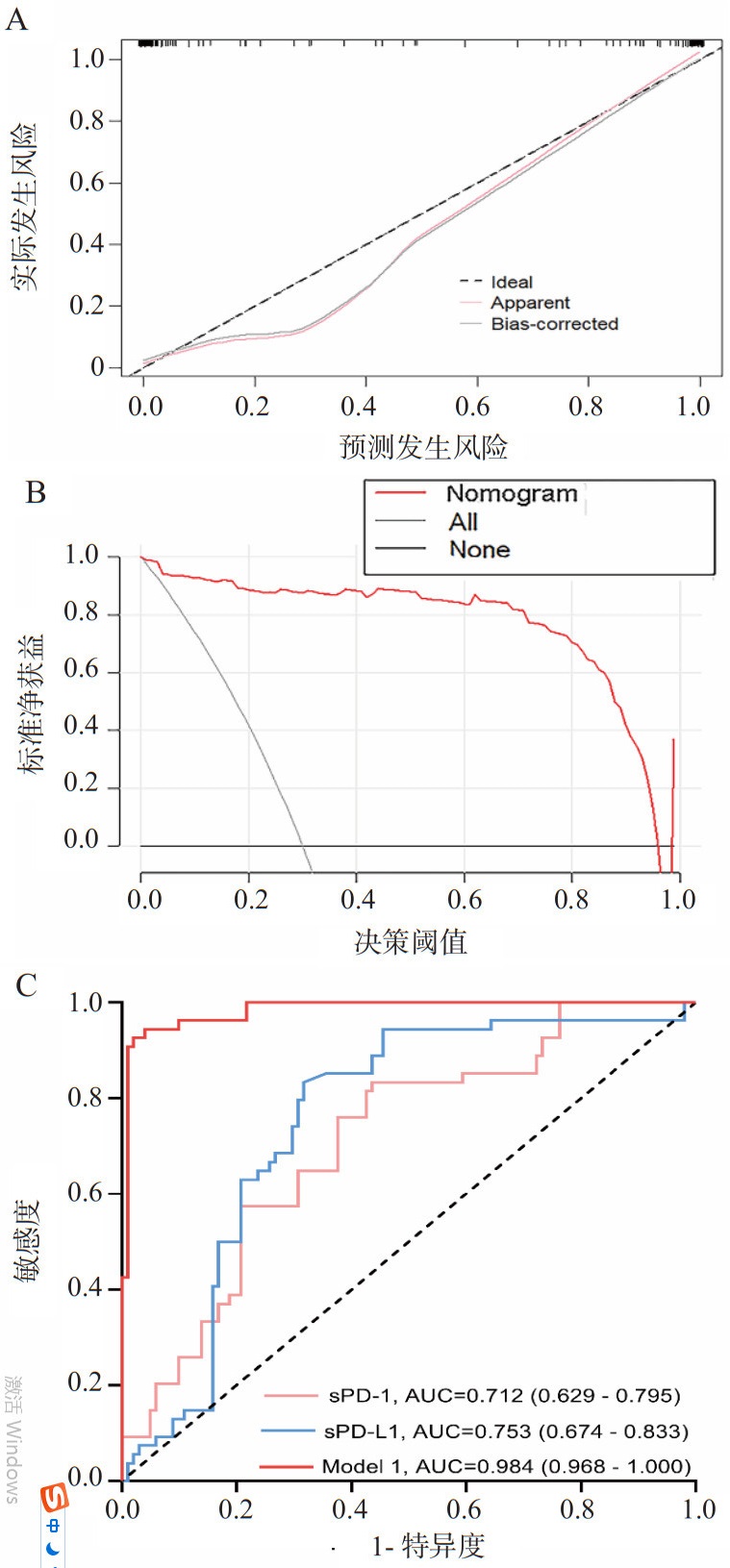
|
| 注:AUC 为曲线下面积,sPD-1 为可溶性程序性细胞死亡蛋白 -1,sPD-L1 为可溶性程序化细胞死亡配体 1 图 6 28 d死亡风险的列线图预测模型的校准曲线(A)、DCA曲线(B)和ROC曲线(C) Fig 6 Calibration curve (A), DCA curve (B), and ROC curve (C) of the nomogram prediction model for 28-day all-cause mortality |
|
|
| 变量 | ΔAUC | 标准误 | Z统计量 | 95%CI | P值 |
| PD-1 vs. PD-L1 | 0.041 | 0.059 | 0.692 | -0.075~0.157 | 0.489 |
| PD-1 vs. model 1 | 0.272 | 0.042 | 6.485 | 0.190~0.354 | < 0.001 |
| PD-L1 vs. model 1 | 0.231 | 0.041 | 5.576 | 0.150~0.312 | < 0.001 |
| 注:AUC为曲线下面积,sPD-1为可溶性程序性细胞死亡蛋白-1,sPD-L1为可溶性程序化细胞死亡配体1 | |||||
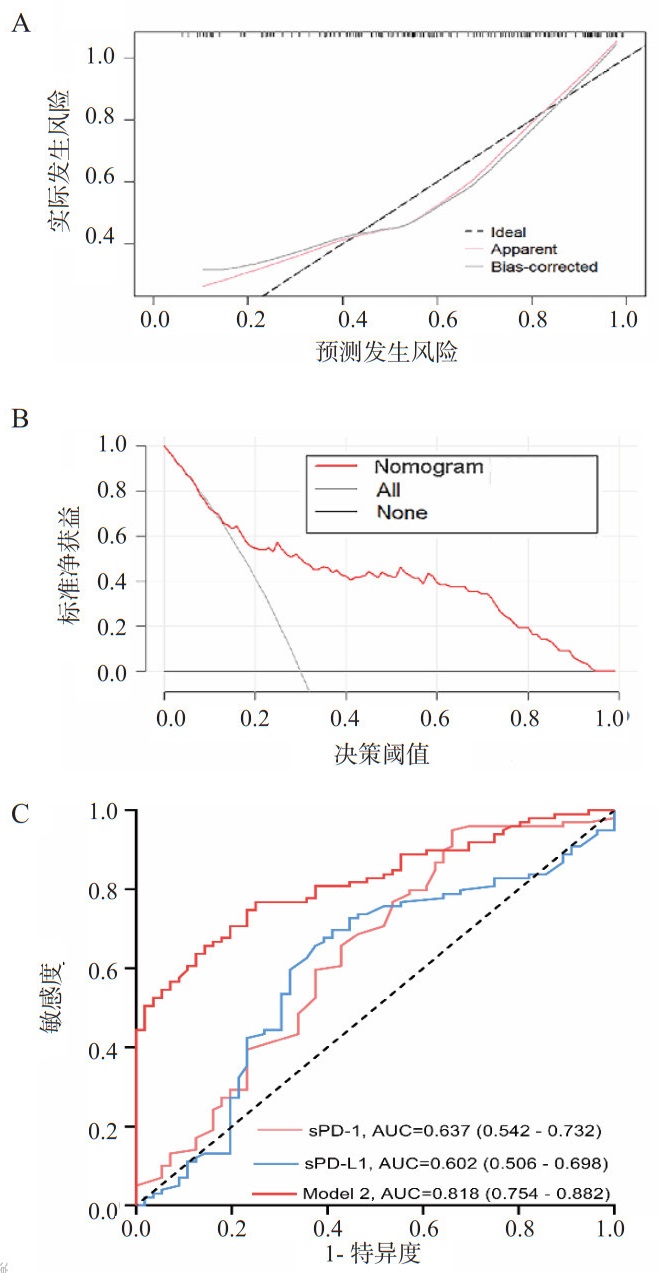
本研究依据Lasso-Logistic分析结果,采用梗阻性脑积水、入院NIHSS评分、入院当日血清sPD-1浓度3个指标构建60 d神经功能预后不良风险模型,生成列线图(图 7)。该列线图的校准曲线(图 8A)和DCA曲线(图 8B)显示了该列线图模型良好的拟合和临床表现。该列线图的C指数为0.818,Bootstrapping验证的C指数为0.806。Hosmer-Lemeshow检验(χ2=7.138, df=8, P=0.522),表明该模型的校正和拟合优秀。此外,本研究应用ROC曲线评价列线图预测性能,AUC为0.818(95%CI: 0.754~0.882),表明该模型具有良好的判别能力(图 8C)。采用DeLong检验对不同变量的AUC进行比较,结果显示列线图模型预测性能优于单独血清sPD-1[AUC:0.637(95%CI: 0.542~0.732)]和sPD-L1 [AUC:0.602(95%CI: 0.506~0.698)](均P<0.05,表 6)。
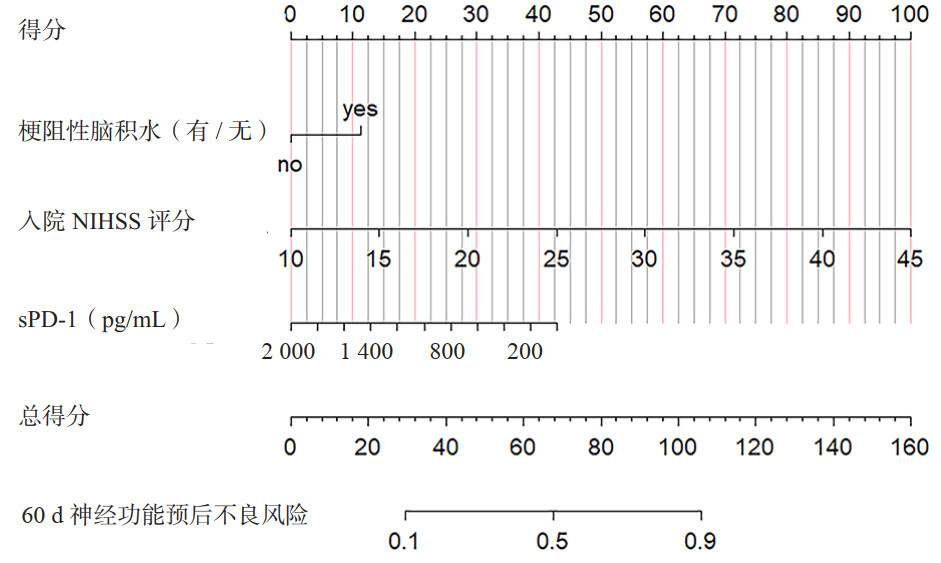
|
| 注 :NIHSS 为美国国立卫生研究院卒中量表,sPD-1 为可溶性 程序性细胞死亡蛋白 -1 图 7 建立60 d神经功能预后不良风险的列线图预测模型 Fig 7 Developed nomogram of the predictive model for 60-day poor neurological prognosis |
|
|
|
| 注:AUC 为曲线下面积,sPD-1 为可溶性程序性细胞死亡蛋白 -1,sPD-L1 为可溶性程序化细胞死亡配体 1 图 8 60 d神经功能预后不良风险的列线图模型的校准曲线(A)、DCA曲线(B)和ROC曲线(C) Fig 8 Calibration curve (A), DCA curve (B), and ROC curve (C) of the nomogram prediction model for 60-day poor neurological prognosis |
|
|
| 变量 | ΔAUC | 标准误 | Z统计量 | 95%CI | P值 |
| PD-1 vs. PD-L1 | 0.102 | 0.049 | 2.064 | 0.005~0.198 | 0.039 |
| PD-1 vs. model 2 | 0.318 | 0.033 | 9.695 | 0.254~0.382 | < 0.001 |
| PD-L1 vs. model 2 | 0.216 | 0.057 | 3.793 | 0.105~0.328 | < 0.001 |
| 注:AUC为曲线下面积,sPD-1为可溶性程序性细胞死亡蛋白-1,sPD-L1为可溶性程序化细胞死亡配体1 | |||||
本研究发现入院当日(24 h)ICH死亡组和神经功能预后不良组患者血清sPD-1浓度分别低于存活组和神经功能预后良好组,然而血清sPD-L1浓度则分别高于存活组和神经功能预后良好组。脑干出血、出血体积、梗阻性脑积水和入院NIHSS是预测28 d死亡风险的独立预测因子;梗阻性脑积水、入院NIHSS评分和血清sPD-1浓度是预测60 d神经功能预后不良的独立预测因子。同时构建了28 d死亡风险和60 d神经功能预后不良的列线图预测模型,经过校准曲线、DCA曲线、ROC曲线、Hosmer-Lemeshow拟合优度统计等验证,两个预测模型均具有良好的预测效能。
大量的临床前研究表明,PD-1/PD-L1轴不仅在外周免疫中发挥作用,而且在神经炎症的调节中也发挥关键作用[7]。不同于PD-1/PD-L1轴在肿瘤疾病中导致肿瘤逃逸、抑制T细胞增殖和诱导T细胞衰竭等有害作用[13];目前PD-1/PD-L1通路在中枢神经系统炎症中的作用存在争议,不同的疾病模型和病理状况下往往得出相互矛盾的结果[7]。在大多数小鼠急性神经炎症模型中,PD-1/PD-L1轴的上调有助于减缓和限制炎症过程,是一种对抗性的平衡保护机制[7, 9, 19]。在小鼠中风模型中显示活化的小胶质细胞和巨噬细胞中PD-1表达增加,PD-1缺乏导致脑梗死面积扩大和加剧神经功能障碍[9]。然而一些研究表明,PD-L1可加重脑卒中患者的炎症,抗PD-L1抗体治疗可控制中枢神经系统炎症[7, 20]。因此,脑卒中PD-1/PD-L1通路可能导致阳性或阴性结果,这可能取决于脑卒中的不同阶段[6]。外周循环中sPD-1和sPD-L1的主要来源是免疫细胞表面表达的膜结合PD-1和PD-L1(membrane PD-1/L1,mPD-1/L1),因此本研究中ICH患者血清sPD-1和sPD-L1浓度升高,也提示ICH后PD-1/PD-L1表达的上调[11]。由于ICH后血脑屏障被破坏,同样不排除神经元或小胶质细胞等表面来源的mPD-1/L1进入外周循环中。
尽管目前sPD-1的作用尚未完全阐明,但大量研究表明,sPD-1具有生物活性,sPD-1通过与mPD-L1和mPD-L2结合来阻断mPD-1/mPD-Ls免疫抑制途径;同时研究发现sPD-1也可增强T淋巴细胞和其他免疫细胞的效应功能[13, 21-22]。一项对接受根治性切除的肝细胞癌患者的回顾性研究发现,外周血sPD-1高浓度与患者更长的生存期相关,sPD-1和sPD-L1是患者预后生物标志物,但是sPD-L1和sPD-1具有相反的预后作用[23]。本研究中也发现ICH存活组和神经功能良好组患者血清sPD-1浓度较死亡组和神经功能不良组显著升高,提示sPD-1可能抑制了mPD-1介导的ICH后患者的外周免疫抑制或增强了免疫细胞的效应功能,并且sPD-1也是ICH患者28 d死亡风险和60 d神经功能预后不良的独立预测因子。与sPD-1相反,sPD-L1结合mPD-1传递负调控信号,激活免疫抑制[13]。脑卒中后的免疫抑制增加了脑卒中后感染的风险,并与神经功能缺损和临床预后恶化有关[24]。Cheng等[20]在小鼠ICH模型中发现脑出血损伤诱导神经元来源的PD-L1释放到外周血,循环中sPD-L1在卒中后诱导了外周免疫抑制,通过抗PD-1单克隆抗体阻断PD-1通路部分逆转脑出血后的免疫抑制并减少肺部细菌感染。本研究中也发现ICH死亡组和神经功能不良组患者血清sPD-L1浓度较存活组和神经功能良好组升高,同样提示外周血sPD-L1可能参与了外周免疫抑制,并且与死亡风险和神经功能预后不良相关,而且血清sPD-L1浓度也是预测28 d死亡风险的独立预测因子。本研究也提示sPD-1和sPD-L1除了可能是ICH患者潜在的炎症干预靶点外,同时也可作为患者死亡风险和神经功能预后的生物标志物。
在本研究中,进一步构建并验证了预测ICH患者28 d死亡风险和60 d神经功能预后不良风险的模型。两个预测模型的校准曲线、DCA曲线和ROC曲线显示模型预测能力较好,临床适用性较好。ROC曲线分析也显示,两个模型预测能力优于单独ICH患者血清sPD-1和sPD-L1的预测能力。
脑干出血、出血体积、手术干预和合并梗阻性脑积水一直是ICH患者预后差的常见独立危险因素[25-26]。同时,NIHSS评分相比于GCS评分更适用于出血性或缺血性脑卒中患者,更能反映神经功能损伤程度[27]。
本研究也有一些局限性,需要进行更多的研究来解决这些问题。首先,本研究仅检测了ICH患者血清中的sPD-1和PD-L1浓度,而没有检测脑脊液、神经细胞表面或神经组织中的PD-1和PD-L1,需要更多的基础研究更好地了解PD-1/PD-L1在ICH中的病理生理机制。其次,本研究是单中心队列研究,患者数量相对有限,本研究仅对列线图模型进行了内部验证。因此,未来的模型需要进行更多的多中心、大样本量临床研究进行外部验证。最后,本研究没有检测血清炎症因子了解ICH患者外周炎症状况,以及连续性的监测sPD-1和PD-L1浓度变化,未来将开展更多针对不同的细胞类型和神经回路的研究。
综上所述,本研究表明ICH患者死亡组和神经功能预后不良组血清sPD-1浓度分别低于存活组和神经功能预后良好组,然而血清sPD-L1浓度则分别高于存活组和神经功能预后良好组。纳入sPD-1和sPD-L1的列线图预测模型,对死亡风险和神经功能预后不良的预测性能表现良好。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张伟:数据采集及整理、论文撰写;廖昭会:实验操作、数据收集及整理;王玲:统计学分析、经费支持;樊哲源:统计学分析、论文修改;付豹:研究设计、论文修改、指导支持
| [1] | GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990-2019:a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet Neurol, 2021, 20(10): 795-820. DOI:10.1016/S1474-4422(21)00252-0 |
| [2] | Tu WJ, Zhao ZP, Yin P, et al. Estimated burden of stroke in China in 2020[J]. JAMA Netw Open, 2023, 6(3): e231455. DOI:10.1001/jamanetworkopen.2023.1455 |
| [3] | Kirshner H, Schrag M. Management of intracerebral hemorrhage: update and future therapies[J]. Curr Neurol Neurosci Rep, 2021, 21(10): 57. DOI:10.1007/s11910-021-01144-9 |
| [4] | Zhu HM, Wang ZQ, Yu JX, et al. Role and mechanisms of cytokines in the secondary brain injury after intracerebral hemorrhage[J]. Prog Neurobiol, 2019, 178: 101610. DOI:10.1016/j.pneurobio.2019.03.003 |
| [5] | Bardhan K, Anagnostou T, Boussiotis VA. The PD1:PD-L1/2 pathway from discovery to clinical implementation[J]. Front Immunol, 2016, 7: 550. DOI:10.3389/fimmu.2016.00550 |
| [6] | Zhao JL, Roberts A, Wang ZL, et al. Emerging role of PD-1 in the central nervous system and brain diseases[J]. Neurosci Bull, 2021, 37(8): 1188-1202. DOI:10.1007/s12264-021-00683-y |
| [7] | Manenti S, Orrico M, Masciocchi S, et al. PD-1/PD-L axis in neuroinflammation: new insights[J]. Front Neurol, 2022, 13: 877936. DOI:10.3389/fneur.2022.877936 |
| [8] | Yao AH, Liu FF, Chen K, et al. Programmed death 1 deficiency induces the polarization of macrophages/microglia to the M1 phenotype after spinal cord injury in mice[J]. Neurotherapeutics, 2014, 11(3): 636-650. DOI:10.1007/s13311-013-0254-x |
| [9] | Ren XF, Akiyoshi K, Vandenbark AA, et al. Programmed death-1 pathway limits central nervous system inflammation and neurologic deficits in murine experimental stroke[J]. Stroke, 2011, 42(9): 2578-2583. DOI:10.1161/STROKEAHA.111.613182 |
| [10] | Banerjee D, Monaghan S, Zhao RP, et al. Soluble programmed cell death protein-1 and programmed cell death ligand-1 in sepsis[J]. Crit Care, 2018, 22(1): 146. DOI:10.1186/s13054-018-2064-3 |
| [11] | Nielsen C, Ohm-Laursen L, Barington T, et al. Alternative splice variants of the human PD-1 gene[J]. Cell Immunol, 2005, 235(2): 109-116. DOI:10.1016/j.cellimm.2005.07.007 |
| [12] | Dezutter-Dambuyant C, Durand I, Alberti L, et al. A novel regulation of PD-1 ligands on mesenchymal stromal cells through MMP-mediated proteolytic cleavage[J]. Oncoimmunology, 2015, 5(3): e1091146. DOI:10.1080/2162402X.2015.1091146 |
| [13] | Niu MK, Liu YM, Yi M, et al. Biological characteristics and clinical significance of soluble PD-1/PD-L1 and exosomal PD-L1 in cancer[J]. Front Immunol, 2022, 13: 827921. DOI:10.3389/fimmu.2022.827921 |
| [14] | Chmielewska I, Grenda A, Krawczyk P, et al. The influence of plasma sPD-L1 concentration on the effectiveness of immunotherapy in advanced NSCLC patients[J]. Cancer Immunol Immunother, 2023, 72(12): 4169-4177. DOI:10.1007/s00262-023-03552-x |
| [15] | Kozuka R, Enomoto M, Dong MP, et al. Soluble programmed cell death-1 predicts hepatocellular carcinoma development during nucleoside analogue treatment[J]. Sci Rep, 2022, 12(1): 105. DOI:10.1038/s41598-021-03706-w |
| [16] | Kruger S, Legenstein ML, Rösgen V, et al. Serum levels of soluble programmed death protein 1 (sPD-1) and soluble programmed death ligand 1 (sPD-L1) in advanced pancreatic cancer[J]. OncoImmunology, 2017, 6(5): e1310358. DOI:10.1080/2162402X.2017.1310358 |
| [17] | Chen Y, Li M, Liu J, et al. sPD-L1 expression is associated with immunosuppression and infectious complications in patients with acute pancreatitis[J]. Scand J Immunol, 2017, 86(2): 100-106. DOI:10.1111/sji.12564 |
| [18] | Greenberg SM, Ziai WC, Cordonnier C, et al. 2022 guideline for the management of patients with spontaneous intracerebral hemorrhage: a guideline from the American heart association/American stroke association[J]. Stroke, 2022, 53(7): e282-e361. DOI:10.1161/STR.0000000000000407 |
| [19] | Chen Q, Xu LX, Du TJ, et al. Enhanced expression of PD-L1 on microglia after surgical brain injury exerts self-protection from inflammation and promotes neurological repair[J]. Neurochem Res, 2019, 44(11): 2470-2481. DOI:10.1007/s11064-019-02864-8 |
| [20] | Cheng N, Wang H, Zou M, et al. Brain-derived programmed death-ligand 1 mediates immunosuppression post intracerebral hemorrhage[J]. J Cereb Blood Flow Metab, 2022, 42(11): 2048-2057. DOI:10.1177/0271678X221116048 |
| [21] | Shin SP, Seo HH, Shin JH, et al. Adenovirus expressing both thymidine kinase and soluble PD1 enhances antitumor immunity by strengthening CD8 T-cell response[J]. Mol Ther, 2013, 21(3): 688-695. DOI:10.1038/mt.2012.252 |
| [22] | Tiako Meyo M, Jouinot A, Giroux-Leprieur E, et al. Predictive value of soluble PD-1, PD-L1, VEGFA, CD40 ligand and CD44 for nivolumab therapy in advanced non-small cell lung cancer: a case-control study[J]. Cancers (Basel), 2020, 12(2): 473. DOI:10.3390/cancers12020473 |
| [23] | Chang BY, Huang T, Wei HJ, et al. The correlation and prognostic value of serum levels of soluble programmed death protein 1 (sPD-1) and soluble programmed death-ligand 1 (sPD-L1) in patients with hepatocellular carcinoma[J]. Cancer Immunol Immunother, 2019, 68(3): 353-363. DOI:10.1007/s00262-018-2271-4 |
| [24] | Shi KB, Wood K, Shi FD, et al. Stroke-induced immunosuppression and poststroke infection[J]. Stroke Vasc Neurol, 2018, 3(1): 34-41. DOI:10.1136/svn-2017-000123 |
| [25] | 杨楠, 宋海庆, 吉训明, 等. 2022年版美国心脏协会/美国卒中协会自发性脑出血患者管理指南更新要点及解读[J]. 中国脑血管病杂志, 2022, 19(11) 729-732, 748. |
| [26] | 魏玄辉, 李姝雅, 秦海强, 等. 美国心脏病协会、美国卒中协会自发性脑出血管理指南[J]. 中国卒中杂志, 2011, 6(2): 155-162. DOI:10.3969/j.issn.1673-5765.2011.02.012 |
| [27] | 赵晓晶, 李群喜, 刘英, 等. 美国国立卫生院脑卒中量表评分与脑出血患者预后的相关性探讨[J]. 中国临床医生杂志, 2019, 47(6): 712-714. DOI:10.3969/j.issn.2095-8552.2019.06.028 |
 2025, Vol. 34
2025, Vol. 34