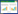2. 清华大学北京清华长庚医院感染疾病中心, 北京 102218;
3. 清华大学北京清华长庚医院呼吸与危重症医学科, 北京 102218;
4. 清华大学临床医学院, 北京 100084
脓毒症急诊科常见疾病,其发病率及致死率极高,且在全球带来的巨大的经济负担[1]。随着脓毒症和免疫反应的研究不断深入,已有研究指出T细胞亚群,如CD4+、CD8+、Tregs T细胞等所介导的免疫反应与脓毒症的预后有一定关系,这种免疫过程的产生主要依赖于细胞表面的免疫受体,其中以程序性死亡受体-1(Programmed cell death receptor, PD-1)、细胞毒性T淋巴细胞抗-4(cytotoxic T lymPhocyte-associated antigen, CTLA-4)最具代表性,但关于其和脓毒症相关性研究结果参差不齐[2-5]。本文就PD-1及CTLA-4所介导的免疫抑制状态和脓毒症相关性进行探索,为临床脓毒症的诊疗提供新思路。
1 资料与方法本研究为前瞻性研究,将脓毒症患者和正常患者的相关指标进行对照研究。本研究经清华大学北京清华长庚医院伦理委员会批准(伦理编号:18190-0-02),由清华大学北京清华长庚医院急诊科开展,研究时间自2021年9月至2022年9月。
1.1 入组标准及分组脓毒症组入组标准:(1)年龄18~80周岁;(2)符合脓毒症诊断标准,即机体存在严重感染并导致器官功能障碍,续贯器官衰竭(sequential organ failure assessment, SOFA)评分≥2分时,可诊断为脓毒症[1]。脓毒症休克定义为在脓毒症基础上进行充分液体复苏或血管加压药,但低血压一直存在,需进行血管加压以维持平均动脉压≥65 mmHg(1 mmHg=0.133 kPa),并尽管有充足容量复苏,但血清乳酸水平大于2 mmol/L;(3)所需临床及统计资料完整,患者感染部位明确;(4)患者知情同意入组。
排除标准:(1)患者合并严重的肝脏[Child B级以上(含)]疾病、严重心脏基础疾病、肾脏基础疾病(CKD≥2级)等;(2)患者存在肿瘤病史、血液病史、免疫系统疾病史;(3)患者3个月内接受免疫抑制治疗或糖皮质激素治疗者;(4)妊娠、哺乳期患者,家属拒绝入组者;(5)临床资料不完整者。
按照入组标准及排除标准纳入脓毒症组,按照是否发生脓毒症休克将脓毒症组分为普通脓毒症组和脓毒症休克组。同时随机筛选既往身体条件良好,非急性感染患者为对照组。
在脓毒症患者中按照患者不同感染部位分为肺部感染组、腹腔感染组(含胆系感染、肠道感染)、泌尿系感染组(含上尿路感染、下尿路感染)。
在脓毒症组中,按照不同病原菌分为革兰阴性(G-)菌组,革兰阳性(G+)菌组和真菌组。
1.2 细胞学方法入组患者在知情同意后,在24 h内采集脓毒症患者静脉血4 mL并置于含乙二胺四乙酸二钾的抗凝管。收集后2 h内在4℃下转运并进行如下处理:(1)分离血液中单个核细胞;(2)刺激并阻断细胞淋巴因子的分泌;(3)细胞表面直接免疫荧光染色;(4)细胞胞内直接免疫荧光染色;(5)流式上机检测FACS Canto Ⅱ(BD Biosciences),并用FCS EPress 4(De Novo SoFtware)软件分析结果。
1.3 统计学方法数据分析采用SPSS 30.0及PRISM 10软件。符合正态分布数据以均数±标准差(x±s)表示,组间比较采用独立样本t检验,多组数据平均值比较采用方差分析,如果总体差异有统计学意义,需进行两两比较,则采用事后比较(LSD法)。非正态分布数据以中位数(四分位数)[M(Q1, Q3)]表示,组间比较采用秩和检验,多组数据分析时采取交叉表。计数数据以例数百分比表示,分组比较采用卡方检验。研究两组数据相关性,采用Pearson线性相关分析。观察指标和某结果相关性采用Logistic回归。相关研究结果通过PRISM绘图或图表形式呈现。以P<0.05为差异有统计学意义。
2 结果本研究共纳入脓毒症患者65例(含普通脓毒症者37例,脓毒症休克者28例),对照组20例。对照组和脓毒症组在年龄、既往病史、性别等方面差异无统计学意义(表 1)。脓毒症组患者中死亡8例,占12.3%,存活患者57例,占87.7%。
| 指标 | 对照组(n=20) | 脓毒症组(n=65) | 统计量 | P值 |
| 一般情况 | ||||
| 性别(男)a | 10(50.0) | 32(49.2) | 0.068 | 0.792 |
| 年龄(岁)b | 61.84±7.32 | 67.58±8.77 | 1.300 | 0.194 |
| 既往病史a | ||||
| 冠心病史 | 3(15.0) | 13(20.0) | 0.169 | 0.681 |
| 糖尿病史 | 5(25.0) | 16(24.6) | 0.023 | 0.880 |
| 肾病史 | 3(15.0) | 6(9.2) | 0.661 | 0.416 |
| 神经系统疾病史 | 2(10.0) | 8(12.3) | 0.044 | 0.833 |
| 注:a为(例,%);b为x±s | ||||
按照不同组别分为普通脓毒症组(n=37)、脓毒症休克组(n=28)、对照组(n=20),CD4+中PD-1、CTLA-4占比差异有统计学意义(F=6.94,P<0.01;F=4.17,P=0.03),其中A组和B组较C组升高(PD1:均数差为8.10,P<0.01;均数差为7.41,P<0.01;CTLA-4:均数差为5.81,P<0.01;均数差4.86,P=0.03;),B组比A症组升高更明显(PD1:均数差为8.10,P<0.01;CTLA-4:均数差为5.81,P=0.03)。三组在CD8+中PD-1、CTLA-4占比差异无统计学意义(F=0.84,P=0.41;F=0.24,P=0.81)。三组在Tregs中的PD-1、CTLA-4占比差异有统计学意义(F=4.41,P=0.01;F=5.29,P<0.01),A组和B组较C组升高(PD1:均数差为8.34,P<0.01;均数差为7.72,P<0.01;CTLA-4:均数差为6.33,P<0.01;均数差5.18,P=0.01);A、B组相比差异无统计学意义(PD1:均数差为4.53,P=0.05;CTLA-4:均数差为2.90,P=0.09)。见图 1。
|
| 注:A为普通脓毒症组,B为脓毒症休克组,C为正常对照组 图 1 不同组间PD-1、CTLA-4比较 |
|
|
SOFA评分、降钙素原(procalcitonin, PCT)和CD4+、CD8+、Tregs中PD-1、CTLA-4均存在正相关关系,C-反应蛋白(C-reactive protein,CRP)与之无相关关系(表 2)。
| 指标 | SOFA评分 | PCT | CRP | |||||
| 相关系数 | P值 | 相关系数 | P值 | 相关系数 | P值 | |||
| CD4+ | ||||||||
| PD-1 | 0.91 | < 0.01 | 0.82 | < 0.01 | -0.10 | 0.443 | ||
| CTLA-4 | 0.83 | < 0.01 | 0.74 | < 0.01 | -0.08 | 0.541 | ||
| CD8+ | ||||||||
| PD-1 | 0.33 | 0.012 | 0.22 | 0.723 | -0.03 | 0.832 | ||
| CTLA-4 | 0.26 | 0.043 | 0.15 | 0.221 | -0.01 | 0.960 | ||
| Tregs | ||||||||
| PD-1 | 0.48 | < 0.01 | 0.39 | < 0.01 | -0.08 | 0.552 | ||
| CTLA-4 | 0.49 | < 0.01 | 0.39 | < 0.01 | 0.146 | 0.253 | ||
| 注:PCT为降钙素原,CRP为C-反应蛋白,PD-1为程序性死亡受体-1,CTLA-4为细胞毒性T淋巴细胞抗-4 | ||||||||
Logistic回归分析提示,性别(Wals 2.19,P=0.14)、年龄(Wals 3.92,P=0.05)、白细胞(Wals 0.05,P=0.10)、红细胞(Wals 0.23,P=0.62)、CRP(Wals 3.71,P=0.05)、PCT(Wals 3.61,P=0.05)、CD4+ PD-1(Wals 1.05,P=0.31)、CD8+ PD-1(Wals 0.11,P=0.06)、Tregs PD-1(Wals 0.95,P=0.32)、CD4+ CTLA-4(Wals 0.19,P=0.91)、CD8+ CTLA-4(Wals 3.86,P=0.05)、Tregs CTLA-4(Wals 0.36,P=0.55)与脓毒症组病死率不相关。
Logistic回归分析以上指标与脓毒症休克发生关系,PCT是脓毒症休克发生的危险因素(Wals 4.26,P=0.03,OR=1.23,95%CI: 1.01~1.51)。
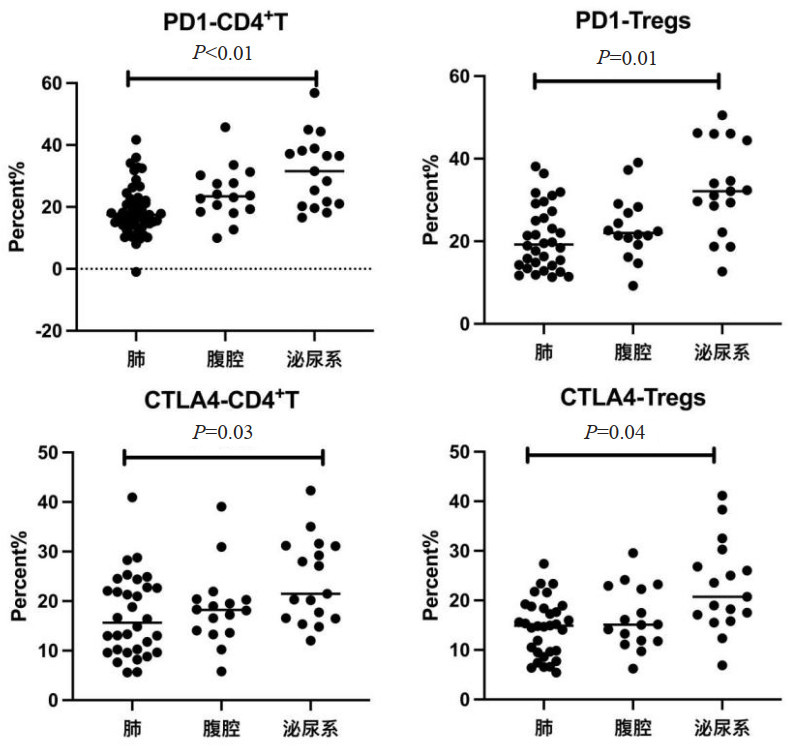
2.2 不同感染部位PD-1、CTLA-4表达按照不同感染部位分为肺部感染组32例,腹腔感染组16例,泌尿系感染组17例。在不同感染部位中,CD4+中PD-1、CTLA-4占比差异有统计学意义(F=5.33,P<0.01;F=4.08,P=0.03),以泌尿系感染升高明显(PD-1:均值差为11.21,P<0.01;均值差为7.23,P=0.03;CTLA-4:均值差为7.11,P<0.01;均值差为5.89,P=0.04)。三组在CD8+中PD-1、CTLA-4占比差异无统计学意义(F=0.97,P=0.38),Tregs中PD-1、CTLA-4占比差异有统计学意义(F=4.81,P=0.01;F=3.93,P=0.04),以泌尿系感染升高明显(PD-1:均值差为12.02,P<0.01;均值差为9.37,P<0.01;CTLA-4:均值差为8.28,P<0.01;均值差为6.25,P=0.01)。见图 2。
|
| 图 2 不同感染部位PD-1、CTLA-4相比 |
|
|
本研究中病原菌诊断明确者共39例,其中革兰阴性菌(G-)者25例,革兰阳性菌(G+)者10例,真菌者4例。三组在CD4+、CD8+、Tregs中PD-1、CTLA-4差异有统计学意义,其中以G-菌占比升高明显(均P<0.05)。G+菌组和真菌组相比差异无统计学意义(均P > 0.05)。见表 3。
| 指标 | G-组(n=25) | G+组(n=10) | 真菌组(n=4) | 总体(n=39) | 统计量 | P值 |
| CD4+ | ||||||
| PD-1 | 31.09±2.06 | 22.82±2.35a | 16.00±3.04a | 24.47±1.70 | 5.05 | 0.01 |
| CTLA-4 | 24.46±1.70 | 17.58±1.86a | 12.52±4.12a | 21.47±1.41 | 5.52 | 0.01 |
| CD8+ | ||||||
| PD-1 | 37.72±11.33 | 22.01±1.68a | 17.47±3.94 a | 27.77±1.74 | 6.09 | < 0.01 |
| CTLA-4 | 25.75±1.65 | 19.70±2.60a | 14.25±2.74a | 23.02±1.40 | 4.65 | 0.02 |
| Tregs | ||||||
| PD-1 | 30.31±1.92 | 21.91±3.15a | 17.54±3.38a | 26.84±1.67 | 4.92 | 0.01 |
| CTLA-4 | 21.67±1.55 | 14.67±2.18a | 11.40±1.98a | 18.82±1.30 | 5.54 | < 0.01 |
| 注:a为与G-组相比,P<0.05 | ||||||
脓毒症是急诊常见急危重症,其发病率及病死率高,每年可导致约1 100万人死亡,研究指出除了免疫激活状态在脓毒症中发挥作用以外,免疫抑制状态也在脓毒症早期发挥重要作用,并可导致患者病情恶化,其中主要以T细胞耗竭作为主要特征,在脓毒症患者中CD4+、CD8+、Tregs相比于正常组降低,而这一过程和PD-1和CTLA-4所介导的免疫抑制过程相关,且PD-1和CTLA-4表达占比上调。识别和结合T细胞受体(TCR)与抗原呈现细胞(APC)表面的主要组织相容性复合物(MHC)中显示的抗原是人体发挥免疫过程的重要途径。PD-1和CTLA-4是T淋巴细胞表面重要的抑制性分子,两者均可表达于活化的T淋巴细胞表面并通过影响APC发挥作用[2-5]。APC上的B7-1(CD80)或B7-2(CD86)分子与T细胞上的CD28分子结合而激活T细胞内的信号并引起T细胞增殖和细胞因子释放。PD-1主要通过与其配体、程序死亡配体1(PD-L1)和PD-L2的结合来调节T细胞激活,这些结合能抑制T细胞增殖,干扰素γ、肿瘤坏死因子-α和白细胞介素(IL)-2的产生,并抑制T细胞增殖。当T细胞的TCR和PD-1结合后,PD-1产生的信号会阻止关键TCR信号中间体的磷酸化,从而终止早期TCR信号并减少T细胞的激活。CTLA-4是一种CD28同源物,对B7具有更高的结合亲和力,可竞争性抑制CD28和APC上的配体结合。然而,与CD28不同,CTLA-4与B7的结合不会产生刺激信号。此外CTLA-4与B7结合也可能会产生抑制信号而抵消CD28:B7和TCR: MHC结合的刺激信号,从而阻止T淋巴细胞活化和增殖[6-10]。脓毒症患者中T细胞各亚群PD-1/CTLA-4的高表达能使T细胞比例减少、凋亡增加,从而引起免疫抑制对脓毒症预后起着关键作用。
现阶段有部分研究均指出CD4+ PD-1和CTLA-4和脓毒症患者预后有相关性,但关于CD8+、Tregs中PD-1和CTLA-4和脓毒症相关性结果尚无一致性评价[5, 11]。本研究中脓毒症组CD4+和Tregs中PD-1和CTLA-4较正常组均升高,而CD8+ PD-1和CTLA-4变化不大。SOFA评分、APACHE Ⅱ是评价脓毒症患者预后的关键指标,早期研究指出T细胞表达和脓毒症患者病情严重性相关,其中CD4+ PD-1、CD8+ PD-1、CD4+ CTLA-4和APACHE Ⅱ评分具有相关性[6]。本研究发现无论CD4+,还是CD8+、Tregs中PD-1和CTLA-4和SOFA存在正相关关系,即PD-1和CTLA-4越高,SOFA评分越高[5]。SOFA评分为预测脓毒症患者死亡的重要指标,该研究SOFA评分为(5.27±0.44)分,抽样偏倚导致较低SOFA评分可能和研究的低病死率相关。除此之外,对于脓毒症患者的重视和及时治疗,也是引起病死率偏低的原因。但在Wang等[5]的研究中进一步验证PD-1和CTLA-4是脓毒症SOFA评分、APACHE Ⅱ评分、28 d病死率的独立危险因素。本研究样本量较小,结合既往研究结果CTLA-4和PD-1在脓毒症患者中表达上调,并在其研究中强调两者表达水平和患者的预后存在相关性[12-13]。Patera等[14]的研究中阐明PD-1在T细胞上表达的增加与中性粒细胞和单核细胞功能的降低相关,从而对脓毒症患者产生免疫抑制作用,在此基础上其通过添加抗PD-1抗体发现患者中性粒细胞和单核细胞中缺乏的吞噬功能得以恢复并且增加细胞表达能力,从而改善患者预后。结合现阶段诸多研究我们推断出在脓毒症患者中CD4+、CD8+、Tregs中的PD-1和CTLA-4表达上调可作为脓毒症预后的新型指标,即PD-1和CTLA-4占比越高,患者病情越重。此外,在本研究中也发现PCT是脓毒症休克发生的危险因素,且和CD4+和Tregs中PD-1、CTLA-4表达存在正相关关系,即PCT数值越高,患者死亡风险越高,PD-1和CTLA-4在CD4+和Tregs中表达越高,免疫抑制越明显,所以当临床中难以即时得出PD-1和CTLA-4结果时,PCT数值也可作为免疫抑制评价的临床参考指标。
本研究进一步探究不同感染部位和PD-1和CTLA-4表达关系并得出结论:在不同感染部位中,CD4+、Tregs中PD-1、CTLA-4占比差异有统计学意义,在CD8+中PD-1、CTLA-4占比差异无统计学意义。在肺部感染、腹腔感染、泌尿系感染中,以泌尿系感染表达升高为著,腹腔感染次之,肺部感染较低。产生这一过程可能和致病菌相关。在不同病原体方面,本研究中以G-杆菌感染最多,且在不同感染部位中,泌尿系感染中G-菌占比最多相关。研究表明无论在SOFA及国家早期预警评分(NEWS评分)还是PCT、IL-6、IL-8、CRP、血小板等实验室检查方面,G-菌引起脓毒症比G+菌更为严重,这种差异性和两者引起脓毒症机制差异性相关,G-菌引起脓毒症主要是由于内毒素产生,G+菌脓毒症依靠外毒素产生[15-17]。本研究结果中G-菌、G+菌、真菌三组在CD4+、CD8+、Tregs中PD-1、CTLA-4表达具有差异性,且在G-菌中表达上调更明显,由此可以推断PD-1、CTLA-4所介导的严重免疫抑制效应也是引起G-菌脓毒症加重的重要原因,但本研究样本量较少,且现在关于不同感染部位、不同病原体和PD-1、CTLA-4相关性研究缺乏,因此还需要进一步探究。
临床中关于脓毒症的治疗主要是抗生素、液体复苏及器官支持等治疗。早前研究认为肾上腺皮质功能受损引起的糖皮质激素减少和脓毒症患者免疫失调有关,并建议以糖皮质激素治疗来改善脓毒症患者的免疫抑制状态[1, 18]。在本研究中和新近研究中已经在分子生物学层面验证PD-1、CTLA-4所介导的免疫抑制和脓毒症患者预后存在相关性,且诸多研究已经表明PD-1、CTLA-4的高表达和患者病情的严重性相关,因此针对PD-1、CTLA-4的靶向治疗为脓毒症的新型治疗提供临床思路。Meta分析中指出在脓毒症小鼠模型中,抗PD-1及抗CTLA-4的靶向治疗联合抗生素治疗能够明显改善脓毒症小鼠预后[11],在真菌感染小鼠模型中对照组生存率为31.5%,而抗PD-1组生存率为73.3%,抗CTLA-4组为68.4%,因此抗PD-1及抗CTLA-4能提高真菌感染脓毒症小鼠模生存率[3, 18-21]。Patil等[22]也指出在导管相关感染及铜绿假单胞菌感染中,PD-1及CTLA-4呈高表达状态,并与脓毒症肝损伤、肠损伤相关,同时抗PD-1及抗CTLA-4治疗能够降低两者的高表达状态并改善患者生存率。Nivolumab和IPilimumab分别为抗PD-1和抗CTLA-4的代表药物,IPilimumab主要在肿瘤患者中使用,也有研究表明IPilimumab在HIV感染者中能够增强宿主免疫反应[23],其在脓毒症中研究较少。药物Nivolumab的临床研究中指出脓毒症晚期人体可呈现免疫抑制和T细胞枯竭状态,而抗PD-1的治疗能够恢复T细胞功能并减少了细胞死亡,从而改善患者预后情况[24],但是其方案样本较少,现阶段关于该治疗方案的进一步研究也较少。
本研究未能探究抗PD-1及抗CTLA-4治疗在脓毒症患者中的获益情况,为本研究缺陷之一,但这也为今后的脓毒症治疗提供新的思路。
综上所述,PD-1、CTLA-4在脓毒症的免疫抑制过程发挥重要作用,其表达水平和病情严重程度具有相关性。在不同感染部位中,泌尿系感染中PD-1、CTLA-4上调更明显。在不同病原体中,G-菌PD-1、CTLA-4上调更明显,其免疫抑制效应更强。PD-1和CTLA-4表达上调引起的免疫抑制和脓毒症患者预后具有相关性,而抗PD-1和抗CTLA-4治疗对改善脓毒症患者的预后成为一种新的可能。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张陈光、吴圣:课题及研究设计、资金支持,论文撰写;张明强:实验方案设计及实施、资金支持;牟向东、陈旭岩、魏来:论文修改;陈妤、杨浩、李理:数据收集和整理
| [1] | Oczkowski S, Alshamsi F, Belley-Cote E, et al. Surviving sepsis campaign guidelines 2021:highlights for the practicing clinician[J]. Pol Arch Intern Med, 2022, 132(7/8): 16290. DOI:10.20452/pamw.16290 |
| [2] | Liu YC, Shou ST, Chai YF. Immune checkpoints in sepsis: New hopes and challenges[J]. Int Rev Immunol, 2022, 41(2): 207-216. DOI:10.1080/08830185.2021.1884247 |
| [3] | Zhang YY, Ning BT. Signaling pathways and intervention therapies in sepsis[J]. Signal Transduct Target Ther, 2021, 6(1): 407. DOI:10.1038/s41392-021-00816-9 |
| [4] | Liu D, Huang SY, Sun JH, et al. Sepsis-induced immunosuppression: mechanisms, diagnosis and current treatment options[J]. Mil Med Res, 2022, 9(1): 56. DOI:10.1186/s40779-022-00422-y |
| [5] | Wang L, Zhang ZQ, Chen XX, et al. Relationship between the expression of PD-1 and CTLA-4 on T lymphocytes and the severity and prognosis of sepsis[J]. Int J Gen Med, 2023, 16: 1513-1525. DOI:10.2147/IJGM.S402586 |
| [6] | Gao DN, Yang ZX, Qi QH. Roles of PD-1, Tim-3 and CTLA-4 in immunoregulation in regulatory T cells among patients with sepsis[J]. Int J Clin Exp Med, 2015, 8(10): 18998-19005. |
| [7] | Kaptein P, Jacoberger-Foissac C, Dimitriadis P, et al. Addition of interleukin-2 overcomes resistance to neoadjuvant CTLA4 and PD1 blockade in ex vivo patient tumors[J]. Sci Transl Med, 2022, 14(642): eabj9779. DOI:10.1126/scitranslmed.abj9779 |
| [8] | Brunner-Weinzierl MC, Rudd CE. CTLA-4 and PD-1 control of T-cell motility and migration: implications for tumor immunotherapy[J]. Front Immunol, 2018, 9: 2737. DOI:10.3389/fimmu.2018.02737 |
| [9] | Rowshanravan B, Halliday N, Sansom DM. CTLA-4:a moving target in immunotherapy[J]. Blood, 2018, 131(1): 58-67. DOI:10.1182/blood-2017-06-741033 |
| [10] | Buchbinder EI, Desai A. CTLA-4 and PD-1 pathways: similarities, differences, and implications of their inhibition[J]. Am J Clin Oncol, 2016, 39(1): 98-106. DOI:10.1097/COC.0000000000000239 |
| [11] | Busch LM, Sun JF, Cui XZ, et al. Checkpoint inhibitor therapy in preclinical sepsis models: a systematic review and meta-analysis[J]. Intensive Care Med Exp, 2020, 8(1): 7. DOI:10.1186/s40635-019-0290-x |
| [12] | Boomer JS, Shuherk-Shaffer J, Hotchkiss RS, et al. A prospective analysis of lymphocyte phenotype and function over the course of acute sepsis[J]. Crit Care, 2012, 16(3): R112. DOI:10.1186/cc11404 |
| [13] | Chang K, Svabek C, Vazquez-Guillamet C, et al. Targeting the programmed cell death 1:programmed cell death ligand 1 pathway reverses T cell exhaustion in patients with sepsis[J]. Crit Care, 2014, 18(1): R3. DOI:10.1186/cc13176 |
| [14] | Patera AC, Drewry AM, Chang K, et al. Frontline Science: Defects in immune function in patients with sepsis are associated with PD-1 or PD-L1 expression and can be restored by antibodies targeting PD-1 or PD-L1[J]. J Leukoc Biol, 2016, 100(6): 1239-1254. DOI:10.1189/jlb.4HI0616-255R |
| [15] | Mitchell E, Pearce MS, Roberts A. Gram-negative bloodstream infections and sepsis: risk factors, screening tools and surveillance[J]. Br Med Bull, 2019, 132(1): 5-15. DOI:10.1093/bmb/ldz033 |
| [16] | Wang QL, Li XJ, Tang WT, et al. Differential gene sets profiling in gram-negative and gram-positive sepsis[J]. Front Cell Infect Microbiol, 2022, 12: 801232. DOI:10.3389/fcimb.2022.801232 |
| [17] | Zhang J, Chen L, Yang Y, et al. Clinical and laboratory findings to differentiate late-onset sepsis caused by Gram-negative vs Gram-positive bacteria among perterm neonates: a retrospective cohort study[J]. Int Immunopharmacol, 2023, 116: 109769. DOI:10.1016/j.intimp.2023.109769 |
| [18] | Rudick CP, Cornell DL, Agrawal DK. Single versus combined immunoregulatory approach using PD-1 and CTLA-4 modulators in controlling sepsis[J]. Expert Rev Clin Immunol, 2017, 13(9): 907-919. DOI:10.1080/1744666X.2017.1357469 |
| [19] | Dovedi SJ, Elder MJ, Yang CN, et al. Design and efficacy of a monovalent bispecific PD-1/CTLA4 antibody that enhances CTLA4 blockade on PD-1+ activated T cells[J]. Cancer Discov, 2021, 11(5): 1100-1117. DOI:10.1158/2159-8290.CD-20-1445 |
| [20] | Chang KC, Burnham CA, Compton SM, et al. Blockade of the negative co-stimulatory molecules PD-1 and CTLA-4 improves survival in primary and secondary fungal sepsis[J]. Crit Care, 2013, 17(3): R85. DOI:10.1186/cc12711 |
| [21] | McBride MA, Patil TK, Bohannon JK, et al. Immune checkpoints: novel therapeutic targets to attenuate sepsis-induced immunosuppression[J]. Front Immunol, 2021, 11: 624272. DOI:10.3389/fimmu.2020.624272 |
| [22] | Patil NK, Guo Y, Luan LM, et al. Targeting immune cell checkpoints during sepsis[J]. Int J Mol Sci, 2017, 18(11): 2413. DOI:10.3390/ijms18112413 |
| [23] | Colston E, Grasela D, Gardiner D, et al. An open-label, multiple ascending dose study of the anti-CTLA-4 antibody ipilimumab in viremic HIV patients[J]. PLoS One, 2018, 13(6): e0198158. DOI:10.1371/journal.pone.0198158 |
| [24] | Hotchkiss RS, Colston E, Yende S, et al. Immune checkpoint inhibition in sepsis: a phase 1b randomized study to evaluate the safety, tolerability, pharmacokinetics, and pharmacodynamics of nivolumab[J]. Intensive Care Med, 2019, 45(10): 1360-1371. DOI:10.1007/s00134-019-05704-z |
 2025, Vol. 34
2025, Vol. 34