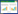急性坏死性脑病(acute necrotizing encephalopathy, ANE)是一种罕见的感染后急性脑病,自1995年后被首次命名,并逐渐得到人们对该病的重视,具有起病急、进展快、病死率高的特点,此病发病率低,且多见于幼儿及儿童报道,成人发病更罕见。笔者在此报道1例成人ANE患者。
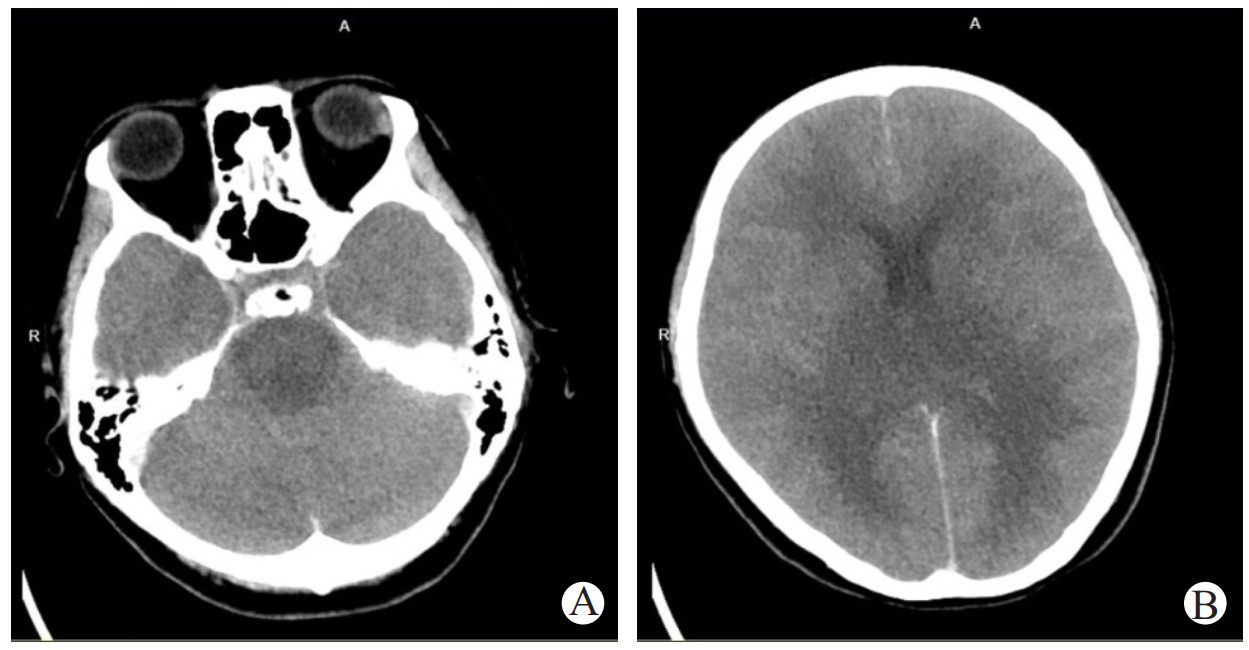
1 临床资料患者,青年女性,31岁,因“发热20 h意识模糊4 h”于2024-03-21 16:34入院治疗。20 h前患者出现咳嗽、头痛等上呼吸道感染症状,伴发热,最高体温为37.4 ℃。4 h前于工作期间出现意识模糊,于医院就诊,就诊期间患者神志清,后再次出现意识模糊,体温40.1 ℃。入院查体:体温39.5℃,GCS评分E4V1M5=10分,神经系统查体无阳性体征。辅助检查:血常规:超敏C反应蛋白2.26 mg/L,白细胞计数7.02×109/L,中性粒细胞比例66.4%,血红蛋白133 g/L,血小板计数196×109/L;急诊乳酸测定:乳酸5.20 mmol/L;肝肾功能:丙氨酸氨基转移酶32 IU/L,天门冬氨酸氨基转移酶26 IU/L;肌酐99.9 μmol/L。颅脑CT:未见明显异常(图 1)。初步诊断:病毒性脑炎。予以更昔洛韦针0.25 g ivgtt bid、奥司他韦75 mg bid抗病毒,地塞米松针10 mg ivgtt once抗炎治疗
|
| 注:A、B为颅脑CT影像,脑CT平扫未见明显异常;C、D为胸部CT影像,左肺下叶微小结节,建议年度复查 图 1 3月21日患者颅脑、胸部 CT |
|
|
之后抢救室转入急诊EICU进一步诊治,于17:30患者神志转清,可对答可遵嘱动作,主诉稍感头痛,于当日行腰椎穿刺术1次,脑脊液澄清,压力14 cmH2O(1 cmH2O=0.098 kPa),红细胞0,有核细胞1.0×106/uL,蛋白定量209 mg/L(参考值范围:150.0~450.0 mg/L),找隐球菌、脑脊液培养、自身免疫性脑病抗体均为阴性。
3月22日6:00护士巡视病房呼叫患者,患者再次出现呼之不应、意识模糊,GCS评分E2V1M5=8分,神经系统查体提示双侧巴氏征阳性。予加急颅脑MRI检查提示(见图 2):两侧额叶皮层下、半卵圆中心、侧脑室旁、背侧丘脑、两侧小脑半球、脑干见多发斑片状稍长T1长T2信号,DWI呈高、等信号,于FLAIR上呈高信号,表现为“同心环”样改变,中心低信号,周围环绕着高信号。其中两侧背侧丘脑肿胀明显,三脑室受压。
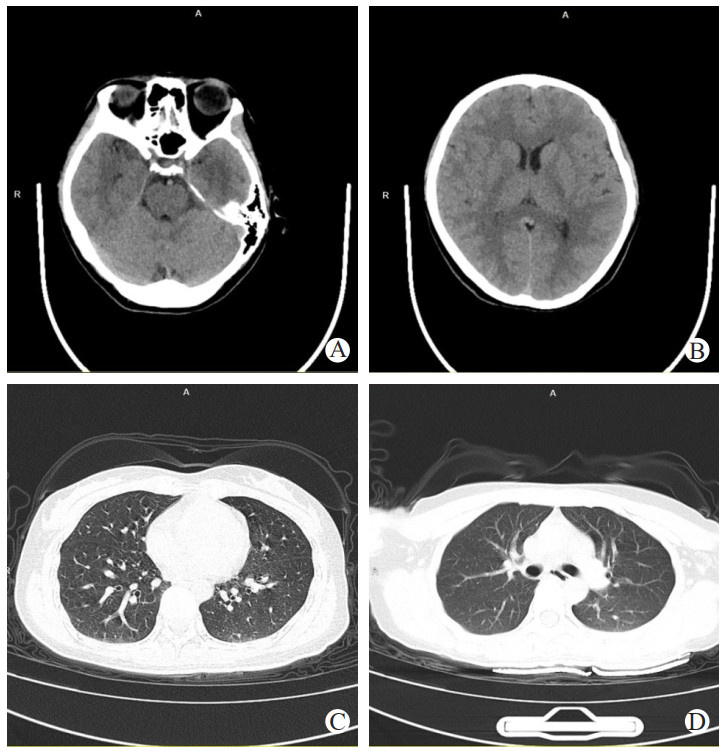
|
| 注:A为该患者颅脑MRI的T1加权图像,B为T2加权图像,C为弥散加权图像(DWI),D为液体衰减反转恢复序列图像(FLAIR);两侧额叶皮层下、半卵圆中心、侧脑室旁、背侧丘脑、两侧小脑半球、脑干见多发斑片状稍长T1(A)长T2信号(B),DWI呈高、等信号(C),于FLAIR上呈高信号(D),表现为“同心环”样改变,中心低信号,周围环绕着高信号,其中两侧背侧丘脑肿胀明显,三脑室受压 图 2 3月22日患者颅脑MRI和DWI检查 |
|
|
3月22日辅助检查:血清学回报:白介素(interleukin, IL)-6 > 5 000.00 pg/mL;急诊降钙素原:降钙素原7.55 ng/mL;肝肾功能(病区):丙氨酸氨基转移酶3 306 IU/L,天门冬氨酸氨基转移酶5 054 IU/L;急诊凝血四项:凝血酶原时间21.9 s,活化部分凝血活酶时间44.2 s;肌钙蛋白T 14 ng/L。咽拭子回报:乙型流感病毒核酸阳性;复查腰椎穿刺术提示脑脊液澄清,压力28 cmH2O,红细胞0,有核细胞1.0×106/uL,蛋白定量1 540 mg/L。之后脑脊液NGS回报:结核分枝杆菌复合群(序列2)。
患者病情进展极快,召集全院讨论后考虑诊断为“感染后急性坏死性脑病”,予临时加用甲泼尼龙500 mg ivgtt once大剂量冲击、人免疫球蛋白20 g ivgtt qd、美罗培南针2 g ivgtt q8h、复方甘草酸苷60 mL ivgtt qd、谷胱甘肽1.2 g ivgtt qd,并启用连续性肾脏替代治疗(continuous renal replacement therapy, CRRT)消除炎性因子治疗【模式:CVVHDF,滤器:百希瑞Oxiris(百特医疗用品贸易上海有限公司),处方:血流量:150 mL/min,置换量:1 200 mL/h(前稀释),透析液:1 500 mL/h,脱水量:150 mL/h】。16:53患者出现双眼向左凝视,牙关紧闭,四肢肌张力增高,四肢抖动,予镇静治疗、气管插管机械通气保持气道通畅。18:40患者出现双侧瞳孔散大,考虑为脑疝,立即予复查CT(见图 3)提示:两侧大脑半球白质、小脑及脑干多发低密度灶、脑肿胀。患者家属要求转上级医院进一步治疗,转入浙江大学附属邵逸夫医院治疗。
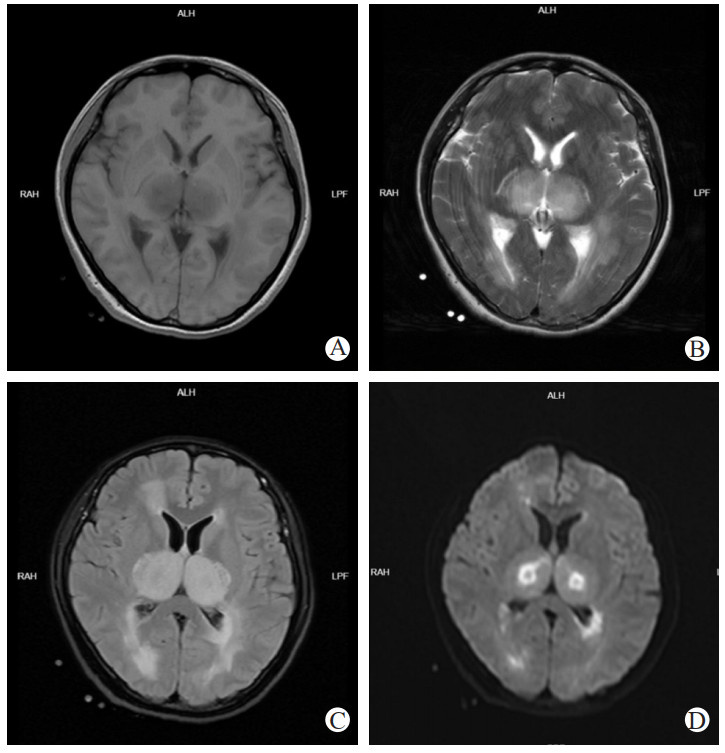
|
| 注:A、B为颅脑CT影像,两侧大脑半球白质、小脑及脑干多发低密度灶、脑肿胀,脑炎;C、D为胸部CT影像,提示两肺感染 图 3 3月22日患者颅脑、胸部CT |
|
|
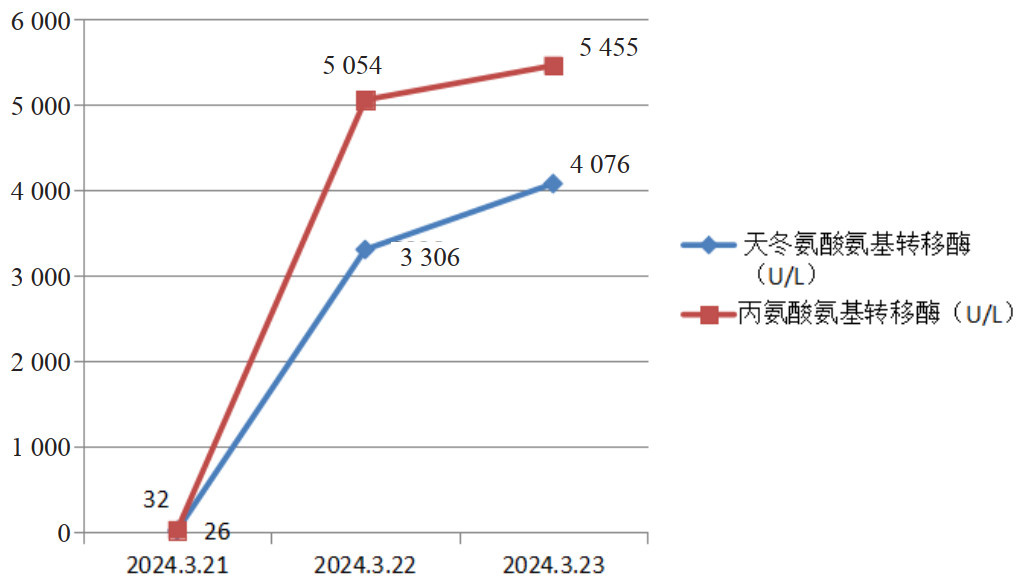
|
| 图 4 肝酶变化趋势图 |
|
|
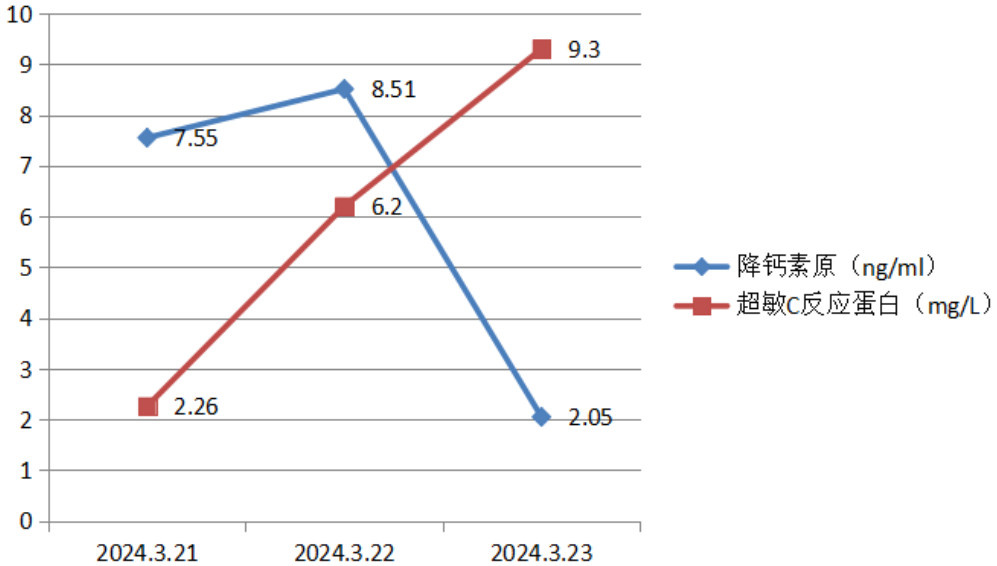
|
| 图 5 炎症指标变化趋势 |
|
|
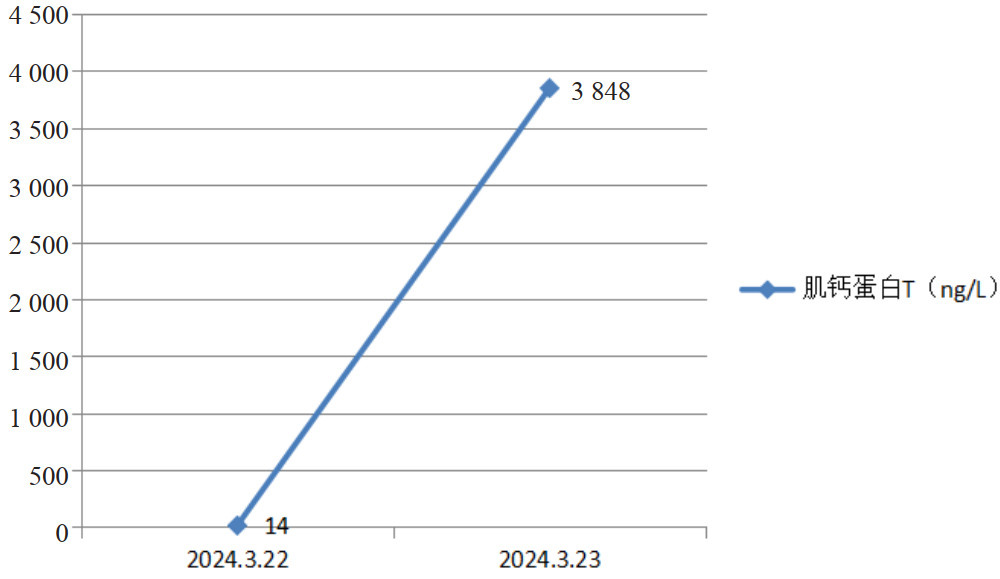
|
| 图 6 肌钙蛋白T变化趋势 |
|
|
患者转入浙大邵逸夫医院后继续激素大剂量冲击、护肝、免疫球蛋白、美罗培南抗感染治疗。3月23日,患者昏迷,气管插管机械通气状态,GCS评分E1VTM1=3分,检验回报肝酶继续升高ALT 4 076 U/L,AST 5 455 U/L;相关炎症指标IL-6 > 5 000 pg/mL,PCT 2.05 ng/mL;同时出现心肌损伤,肌钙蛋白T 3 848 ng/L。预后极差,浙大邵逸夫医院谈话后患者家属自动出院。
3月24日,患者昏迷,气管插管机械通气状态,GCS评分E1VTM1=3分,回嘉兴一院抢救室救治,复查CT(见图 7)提示:两侧大脑半球白质、小脑及脑干见多发斑片状低密度影,脑实质肿胀。脑室系统及脑沟、脑池变浅。患者预后极差,患者家属决定放弃治疗、回家,最终患者死亡。患者病情进展总结见图 8。
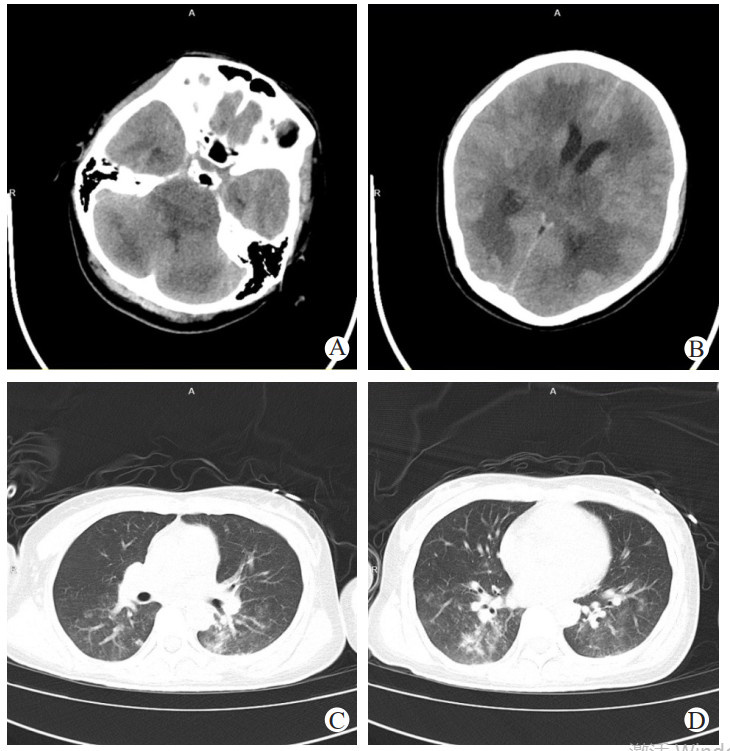
|
| 注:提示两侧大脑半球白质、小脑及脑干多发斑片状低密度影,脑实质肿胀,脑炎,脑室系统及脑沟、脑池变浅 图 7 3月24日患者颅脑align="center" |
|
|

|
| 图 8 患者病情进展时间轴 |
|
|
ANE最早于1995年由Mizuguchi等[1]提出,全年均可发病,多见于冬季,发病高峰年龄为6~18个月婴幼儿。随后西方国家也有报道,成人病例较为罕见[2]。本病多继发于病毒感染,其中最常见的是甲型、乙型流感病毒[3]和HHV-6[4]。上述感染可能导致免疫系统异常反应,引发所谓的“细胞因子风暴”,这是一种潜在的致命免疫反应,由细胞因子和白细胞之间的正反馈环组成。类似于全身炎性反应综合征[5]。在神经系统,细胞因子风暴通过改变血管壁通透性(血管壁未被破坏)而造成脑损伤[6],从而损害血脑屏障,导致脑水肿、点状出血和细胞坏死。ANE的病死率较高,根据不同的研究,病死率可能在30%以上。
ANE的诊断标准是在1995年由Mizuguchi等[1]首次提出的,后来Neilson等[7]又对诊断标准作出补充,包括:(1)病毒感染相关性发热后出现抽搐、意识障碍等急性脑病症状;(2)脑脊液蛋白升高,无细胞数增多;(3)影像学提示多部位对称性病变,主要累及双侧丘脑、基底节区、脑室周围白质、内囊、脑干等;(4)转氨酶不同程度升高,乳酸脱氢酶、肌酸激酶和尿素氮亦有增高,无高氨血症;(5)家族中有相似的神经系统感染症状者;(6)复发性脑病伴发热者;(7)脑MRI病灶也可累及下列部位:颞叶内侧病变、岛叶、屏状核、外囊、杏仁核、海马、乳状体、脊髓;(8)排除相似疾病。
而ANE主要需要鉴别的诊断是自身免疫性脑病(autoimmune encephalopathy, AE),AE同样发病于感染后,是一种由免疫反应介导的中枢神经系统炎症性疾病,自2007年Dalmau等[8]正式提出抗N-甲基-D-天门冬氨酸受体(NMDAR)脑炎以来,越来越多的特异性抗体相关脑炎被发现。近年又发现如抗GABA B受体抗体阳性、抗GlyR1抗体阳性的自身免疫性脑病患者[9],此类疾病也越来越受到神经内科、精神科以及外科医生的关注。但两者之间的临床表现、实验室检查、影像学表现及预后有显著的差异。见表 1。
| 条目 | 急性坏死性脑病(ANE) | 自身免疫性脑炎(AE) |
| 病因 | 感染细菌病毒后免疫系统异常反应,引发“细胞因子风暴”导致脑损伤 | 癌症、感染细菌病毒后出现免疫系统对脑组织的异常反应 |
| 临床表现 | 发热、抽搐、意识改变 | 精神行为异常、癫痫、运动障碍、意识改变、自主神经功能障碍 |
| 脑脊液 | 脑脊液蛋白升高,无细胞数增多 | 有核细胞数增多(> 5×106/L),蛋白正常或轻度升高,抗NMDAR抗体阳性 |
| 头颅MRI | 多部位对称性病变,主要累及双侧丘脑、基底节区、脑室周围白质、内囊、脑干等 | 无特异性表现,海马是最常见的受累部位 |
| 预后 | 病死率高,预后差 | 总体预后良好 |
本案例为青年女性患者,发病前有呼吸道感染症状、发热,起病急,神经系统体征为双侧巴氏征阳性,症状表现为意识障碍、继发性癫痫、转氨酶快速升高,脑脊液检查提示蛋白水平升高,有核细胞计数无明显变化。头颅MRI提示两侧额叶皮层下、半卵圆中心、侧脑室旁、背侧丘脑、两侧小脑半球、脑干不同程度受累。符合ANE的诊断标准。
由检验结果得知,脑脊液NGS提示结核分枝杆菌复合群,但为序列2,且患者脑脊液澄清,静置后无薄膜出现,脑脊液生化提示腺苷脱氨酶为正常范围,糖及氯化物无下降,结合患者发病过程,不支持结核性中枢神经系统感染;患者咽拭子培养结果提示乙型流感病毒核酸阳性,同时对比患者3月21日以及3月22日的肺部CT影像可以看出患者肺炎进展迅猛,考虑患者乙型流感病毒感染,病因符合ANE的病因学依据。
而患者在3月22日与3月23日之间肌钙蛋白T出现明显升高的情况,考虑为“神经源性心肌顿抑(neurogenic stunning myocardium,NSM)”,由于颅脑损伤等神经事件诱发“交感风暴”,释放儿茶酚胺类物质激增,引起左心室功能障碍以及对心肌细胞的毒性作用。结合2025年,由王耿焕等[10]对371例神经重症患者的研究,发现在神经重症患者中NSM的发病率可达29.1%,预后较无NSM出现的患者差。
本案例的治疗思路:大剂量糖皮质激素、免疫球蛋白进行免疫调节治疗、抑制过度的炎症反应,CRRT清除血中的炎症物质,并积极进行生命支持、控制惊厥、针对病因进行抗病毒治疗、降低颅内压等治疗。虽积极治疗,但患者病情发展迅猛,最终死亡。
根据2015年Yamamoto等[11]开发的用于评估ANE患者严重程度及预后的ANE-SS评分,本案例患者脑干受损、脑脊液蛋白量高,ANE-SS评分为6分,即使及时予以了免疫调节、炎症介质清除等治疗也很快临床死亡。
笔者认为要改善ANE的预后,需通过对症状的仔细鉴别和对脑部异常表现的认识,通过颅脑MRI等手段来早期诊断ANE,根据国家卫健委2023版《儿童急性坏死性脑病诊疗方案》并结合本案例,急性坏死性脑病机制复杂、病情凶险,在疾病的早期即需要对ANE患者进行生命支持、控制惊厥、降低颅内压、抗病毒、抗感染,早期、大剂量的糖皮质激素冲击等综合治疗。对于使用了糖皮质激素和丙种球蛋白仍难以控制的病情,可以考虑使用血浆置换或持续肾脏替代治疗,或加用抑制白介素-6的托珠单抗以清除血液中的炎症物质;可能是达到较好临床预后的更好的方法。
利益冲突 所有作者声明无利益冲突
| [1] | Mizuguchi M, Abe J, Mikkaichi K, et al. Acute necrotising encephalopathy of childhood: a new syndrome presenting with multifocal, symmetric brain lesions[J]. J Neurol Neurosurg Psychiatry, 1995, 58(5): 555-561. DOI:10.1136/jnnp.58.5.555 |
| [2] | Kobayashi Y, Kanazawa H, Hoshino A, et al. Acute necrotizing encephalopathy and a carnitine palmitoyltransferase 2 variant in an adult[J]. J Clin Neurosci, 2019, 61: 264-266. DOI:10.1016/j.jocn.2018.11.045 |
| [3] | Iizuka K, Suzuki K, Shiina T, et al. Two adult patients with acute necrotizing encephalopathy following influenza virus infection[J]. Rinsho Shinkeigaku, 2020, 60(2): 157-161. DOI:10.5692/clinicalneurol.cn-001381 |
| [4] | Stevanović V, Barušić Z, Višković K, et al. Acute necrotizing encephalopathy of childhood associated with human herpes virus 6 in Croatia[J]. Neurol Sci, 2019, 40(3): 639-641. DOI:10.1007/s10072-018-3623-8 |
| [5] | Kansagra SM, Gallentine WB. Cytokine storm of acute necrotizing encephalopathy[J]. Pediatr Neurol, 2011, 45(6): 400-402. DOI:10.1016/j.pediatrneurol.2011.09.007 |
| [6] | Yoshida T, Tamura T, Nagai Y, et al. MRI gadolinium enhancement precedes neuroradiological findings in acute necrotizing encephalopathy[J]. Brain Dev, 2013, 35(10): 921-924. DOI:10.1016/j.braindev.2012.11.011 |
| [7] | Neilson DE, Adams MD, Orr CMD, et al. Infection-triggered familial or recurrent cases of acute necrotizing encephalopathy caused by mutations in a component of the nuclear pore, RANBP2[J]. Am J Hum Genet, 2009, 84(1): 44-51. DOI:10.1016/j.ajhg.2008.12.009 |
| [8] | Dalmau J, Tüzün E, Wu HY, et al. Paraneoplastic anti-N-methyl-D-aspartate receptor encephalitis associated with ovarian teratoma[J]. Ann Neurol, 2007, 61(1): 25-36. DOI:10.1002/ana.21050 |
| [9] | 陈天文, 裘可凡, 桑红菲, 等. 新型冠状病毒感染合并抗GlyR1抗体阳性自身免疫性脑炎1例[J]. 中华急诊医学杂志, 2023, 32(10): 1407-1411. DOI:10.3760/cma.j.issn.1671-0282.2023.10.020 |
| [10] | 王耿焕, 林英聪, 颜羽, 等. 神经重症患者继发神经源性心肌顿抑的临床特点及影响因素分析[J]. 中华急诊医学杂志, 2025, 34(5): 729-732. DOI:10.3760/cma.j.issn.1671-0282.2025.05.018 |
| [11] | Yamamoto H, Okumura A, Natsume J, et al. A severity score for acute necrotizing encephalopathy[J]. Brain Dev, 2015, 37(3): 322-327. DOI:10.1016/j.braindev.2014.05.007 |
 2025, Vol. 34
2025, Vol. 34