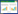单氰胺(cyanamide)是一种常用的植物生长调节剂,广泛用于农业中,促进植物发芽、开花、结果及成熟,提高产量[1]。尽管其农业用途广泛,但对人体毒性的研究较少[2]。单氰胺中毒多见于职业暴露,常见途径包括皮肤、黏膜接触及吸入,可引起皮炎和呼吸道症状[3]。口服中毒导致多脏器功能衰竭(multiple organ dysfunction syndrome, MODS)的病例罕见,且病死率较高。本研究报告了一例急性单氰胺中毒病例,详细分析了其临床表现、疾病进展、治疗策略及预后。
1 资料与方法病史/检查: 本研究已获得温州市人民医院伦理委员会审查批准及患者的书面知情同意,审批号为:KY-202509-103号。
患者,男性,64岁,既往健康。因误服约100 mL 50%单氰胺溶液后0.5 h昏迷入院,伴呕吐,无抽搐。入院查体:体温36.6℃,呼吸20次/min,血压123/77 mmHg(1 mmHg=0.133 kPa),心率75次/min,血氧饱和度100%。全身散发刺鼻气味,深度昏迷,格拉斯哥昏迷量表(Glasgow Coma Scale, GCS)评分5分(E1、V1、M3)。双侧瞳孔等大等圆(直径2 mm),对光反射减弱。其余查体无异常。辅助检查:头颅CT未见异常。动脉血气分析:pH 7.405,PaCO2 35.1 mmHg,PaO2 111.6 mmHg,BE -3 mmol/L,HCO3- 22 mmol/L,乳酸0.8 mmol/L。血常规、凝血功能、生化指标均未见明显异常。治疗经过
入院后立即脱去污染衣物并清洗全身,行保护性气管插管,洗胃(生理盐水12 000 mL)。入院1 h后出现休克(血压63/44 mmHg),予多巴胺升压及补液扩容。入院3 h后出现代谢性酸中毒(pH 7.259,HCO3- 15.9 mmol/L,BE -11.9 mmol/L),继续液体复苏。入院4 h后启动血液灌流(hemoperfusion, HP),因顽固性低血压需大剂量血管活性药物[去甲肾上腺素1.0 μg/(kg·min)+多巴胺20 μg/(kg·min)]维持。入院6 h后酸中毒加重,改为双重血液灌流+持续肾脏替代治疗(continuous renal replacement therapy, CRRT)。入院48 h后内环境紊乱纠正,第4天撤除所有血管加压药物,血压稳定。
入院24 h出现肝肾功能损害及无尿。第4天转氨酶达峰值,第6天胆红素达峰值,血小板降至最低(4×109/L)。治疗包括异甘草酸镁、谷胱甘肽、乙酰半胱氨酸、腺苷蛋氨酸、熊去氧胆酸、重组人血小板生成素,输注血小板及冰冻血浆。血小板及肝功能逐渐恢复(图 1),但持续无尿,需每日血液透析。
|
| 注:A为谷氨酸丙酮酸转氨酶;B为谷氨酸草酰乙酸转氨酶;C为血小板计数;D为血清胆红素 图 1 患者住院期间实验室参数的动态变化 |
|
|
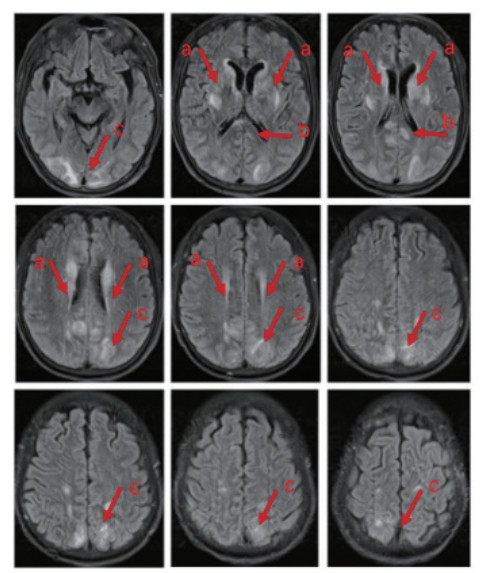
全程镇痛镇静,并行神经营养治疗(醒脑静针、甲钴胺针、四己糖神经节苷脂针、安宫牛黄丸)。第5天可呼唤睁眼,无遵嘱动作及四肢活动。第8天自主睁眼,仍无遵嘱表现,刺痛下肢屈曲,成功脱机拔管。第10天头颅MRI示“两侧基底节区、侧脑室旁、顶枕叶及胼胝体压部异常信号影,脑白质疏松,FazekasⅡ级”(图 2)。第13天自主睁眼,仍无遵嘱表现,发单音,刺痛定位,偶有自主活动,后行高压氧治疗。
|
| 注: 箭头a所指区域显示基底节区及侧脑室旁存在异常高信号影, 箭头b所指区域显示胼胝体存在异常高信号影, 箭头c所指区域显示枕叶顶叶存在异常高信号影 图 2 患者的头颅核磁共振影像 |
|
|
随访结果: 出院后20 d随访,患者肾功能基本恢复(Cr 177 μmol/L),无需维持性血液透析。40 d随访时可简单应答,反应迟钝,能缓慢行走并自行进食。90 d随访时完全自理,应答迅速准确并恢复劳动能力。
2 讨论单氰胺(CN2H2)极易溶于水,口服生物利用度高,吸收快,达峰时间约10.5~15.5 min,血浆蛋白结合率较低(约10%),表观分布容积为1.065 L/kg,消除半衰期约为1.963 h,总血浆清除率为5.856 mL/(kg·min)[21-22]。
单氰胺对人体毒性高,美国环境保护局(EPA)将其列为一级毒性物质(最高毒性类别)[4]。口服暴露病死率达33.3%[5],摄入量超100 mL时86% 的患者出现严重不良反应[2]。本例误服100 mL 50% 单氰胺后迅速进展为MODS,经积极救治后康复出院。
单氰胺的毒性机制尚不明确,可能涉及过氧化氢酶抑制。该酶主要清除过量过氧化氢,其抑制可导致氧化应激增强、氧化磷酸化解偶联,进而阻碍ATP合成,引发细胞能量代谢障碍[6-8]。单氰胺体内代谢主要通过N-乙酰化,大部分经尿液排出[9]。目前无证据表明其可转化为氰化物(CN-)[10]。
患者入院后持续昏迷,多次头颅CT检查未见异常。入院第10天,MRI显示双侧基底节、顶枕区及胼胝体压部异常信号,并伴脑白质病变。经治疗,患者意识逐步恢复,出院时GCS评分为E4、T2、M5,但仍存在明显意识内容障碍。研究表明,单氰胺中毒患者中73% 发生中至重度意识障碍(GCS < 13),其中80% 头颅CT正常,仅20% 出现不同程度脑水肿。严重脑水肿(≥ 4级)MRI影像常见双侧额叶、枕叶、脑室周围及深部白质信号异常,与本例MRI结果相符[11]。单氰胺中毒导致脑病的确切机制仍不明确,研究提示其可能与细胞缺氧应激反应相关。缺氧诱导因子-1α(HIF-1α)水平与GCS评分呈显著负相关,表明HIF-1α可能在单氰胺相关脑病的发生中起关键作用[11]。
低血压和休克是单氰胺中毒的早期临床表现,发生率约50%[5]。研究指出,这与硝基在过氧化氢酶作用下氧化单氰胺所产生的血管扩张效应有关[12]。此外,单氰胺为醛脱氢酶抑制剂,若患者合并大量酒精摄入,可能引发氰氨-乙醇反应,加剧低血压及休克[13]。
本例患者中毒后24 h内出现肝功能衰竭,谷草转氨酶(AST)和谷丙转氨酶(ALT)显著升高,第4天达峰,8 d后逐步恢复。转氨酶升高反映肝细胞损伤、溶解及坏死,伴随肝酶释放[14]。胆红素水平显著升高,主要为直接胆红素。研究表明,单氰胺可导致急性胆汁淤积,胆红素升高与胆汁流动受阻及胆汁淤积相关[15-16]。患者血常规检查提示血小板减少,可能与肝肾功能衰竭导致血小板生成素水平下降有关。血小板生成素由肝脏和肾脏合成,在调节骨髓血小板生成中起关键作用[17]。本研究发现,严重单氰胺中毒患者血清肌酐水平升高,提示可能存在直接肾毒性作用,肾功能损害通常预示较差的临床预后[2, 11, 18]。
与既往报道相比,本案有以下特点:首先,患者误服100 mL 50%单氰胺,属极高剂量暴露,以往类似剂量报告中存活率极低;本例经积极救治成功存活并在随访中恢复劳动能力,体现了救治策略的有效性。其次,治疗早期联合应用血液净化(HP+CRRT),显著提高了毒物清除效率。尽管患者出现了多脏器功能衰竭(累及肝、肾、血液及神经系统),通过多学科协作(包括急诊重症医学、肾内科、神经内科、康复科、血液科及影像学科等)实现了器官功能的有效支持与整体康复,突显综合救治的重要临床价值[23-24]。此外,患者第13天起接受高压氧治疗,其后神经功能恢复显著。研究表明,高压氧可通过提高血氧分压、改善脑组织氧供、减轻脑水肿及促进神经修复等多重机制,对中毒性脑病发挥积极治疗作用[25-26]。该病例的良好神经功能结局提示高压氧在单氰胺中毒神经损伤修复中可能具有重要价值,值得在今后的临床实践中进一步应用与验证。
3 结论综上所述,尽管急性单氰胺中毒起病急、症状重、病死率高,且缺乏特效解毒剂,但通过系统了解中毒过程并遵循关键治疗原则,可显著改善患者预后。首要措施是立即终止毒物接触。吸入中毒者应立即转移到新鲜空气中并进行吸氧;皮肤接触者应立即去除受污染的衣物,用水彻底冲洗至少15 min。曾有报道,一名患者在无防护条件下操作单氰胺且未及时更换衣物,导致严重中毒 [19],因此彻底清洗至关重要。其次,单氰胺的生物利用度极高,吸收和分布迅速[20]。对于尚未吸收的毒物,应尽快采取洗胃、导泻或灌肠等措施排毒。对于吸收的毒物,考虑到其分子量小、亲水性强、表观分布容积小、血浆蛋白结合率低的特点[21-22],可采用CRRT进行清除。鉴于早期单氰胺中毒常并发顽固性休克、内环境紊乱及急性肾功能损伤,建议尽早进行CRRT。最后,多脏器功能支持(包括循环、肝、肾、神经系统等)及并发症防治是救治成功的重要保障。患者可能存在长期意识障碍,待病情稳定后应尽早实施高压氧治疗,并结合神经康复干预,以促进神经功能恢复、改善远期预后。
利益冲突 所有作者声明无利益冲突
作者贡献声明 叶渊文:论文撰写;陈玲珑、杨宝华:数据收集及整理;李炳灿、朱鹏:数据管理、图片和表格编辑;姜盈盈:论文修改
| [1] | Liang D, Huang XJ, Shen YQ, et al. Hydrogen cyanamide induces grape bud endodormancy release through carbohydrate metabolism and plant hormone signaling[J]. BMC Genomics, 2019, 20(1): 1034. DOI:10.1186/s12864-019-6368-8 |
| [2] | Sharif AF, Fayed MM. Evaluation of Multiple Organ Dysfunction Score (MODS) and the Sequential Organ Failure Assessment (SOFA) score as in-hospital outcome predictors among cases of hydrogen cyanamide exposure: a cross-sectional study[J]. Environ Sci Pollut Res Int, 2021, 28(31): 42161-42176. DOI:10.1007/s11356-021-13655-6 |
| [3] | Foti C, Bonamonte D, Conserva A, et al. Allergic contact dermatitis with a fertilizer containing hydrogen cyanamide (Dormex)[J]. Cutan Ocul Toxicol, 2008, 27(1): 1-3. DOI:10.1080/15569520701598177 |
| [4] | Inamadar AC, Palit A. Cutaneous reactions simulating erythema multiforme and Stevens Johnson syndrome due to occupational exposure to a plant-growth regulator[J]. Indian J Dermatol Venereol Leprol, 2007, 73(5): 330-332. DOI:10.4103/0378-6323.35734 |
| [5] | Gamaluddin H, Mahmmoud S, Mosa MN, et al. A clinical study of acute hydrogen cyanamide toxicity in the period between 2006-2009 in the poison control center, ain shams university[J]. Ain Shams J Forensic Med Clin Toxicol, 2012, 19(2): 97-103. DOI:10.21608/ajfm.2012.19540 |
| [6] | de Zwart LL, Vermeulen NP, Hermanns RC, et al. Urinary excretion of biomarkers for radical-induced damage in rats treated with NDMA or diquat and the effects of calcium carbimide co-administration[J]. Chem Biol Interact, 1999, 117(2): 151-172. DOI:10.1016/s0009-2797(98)00106-9 |
| [7] | Teng Y, Zou LY, Huang M, et al. Molecular interaction of 2-mercaptobenzimidazole with catalase reveals a potentially toxic mechanism of the inhibitor[J]. J Photochem Photobiol B, 2014, 141: 241-246. DOI:10.1016/j.jphotobiol.2014.09.018 |
| [8] | Lee JN, Dutta RK, Maharjan Y, et al. Catalase inhibition induces pexophagy through ROS accumulation[J]. Biochem Biophys Res Commun, 2018, 501(3): 696-702. DOI:10.1016/j.bbrc.2018.05.050 |
| [9] | Mertschenk B, Bornemann W, Filser JG, et al. Urinary excretion of acetylcyanamide in rat and human after oral and dermal application of hydrogen cyanamide (H2NCN)[J]. Arch Toxicol, 1991, 65(4): 268-272. DOI:10.1007/BF01968960 |
| [10] | Dierolf D, Scheitza S, Bonifas J, et al. Cyanamide-mediated inhibition of N-acetyltransferase 1[J]. Toxicology, 2012, 302(1): 1-10. DOI:10.1016/j.tox.2012.06.019 |
| [11] | Rezk MNN, Beshreda GM, Meshref DA, et al. Hypoxia inducible factor-1α (HIF-1α) as an early predictor of acute hydrogen cyanamide (Dormex) poisoning[J]. Ecotoxicol Environ Saf, 2023, 256: 114847. DOI:10.1016/j.ecoenv.2023.114847 |
| [12] | Sheshadri SH, Sudhir U, Kumar S, et al. DORMEX-hydrogen cyanamide poisoning[J]. J Emerg Trauma Shock, 2011, 4(3): 435-437. DOI:10.4103/0974-2700.83894 |
| [13] | Bernasconi L, Carnovale M, Lonati D, et al. Hydrogen cyanamide exposure: a case series from Pavia Poison Control Centre[J]. Occup Med (Lond), 2023, 73(8): 500-506. DOI:10.1093/occmed/kqad108 |
| [14] | Smith AK, Ropella GEP, McGill MR, et al. Contrasting model mechanisms of alanine aminotransferase (ALT) release from damaged and necrotic hepatocytes as an example of general biomarker mechanisms[J]. PLoS Comput Biol, 2020, 16(6): e1007622. DOI:10.1371/journal.pcbi.1007622 |
| [15] | Kolarić TO, Ninčević V, Smolić R, et al. Mechanisms of hepatic cholestatic drug injury[J]. J Clin Transl Hepatol, 2019, 7(1): 86-92. DOI:10.14218/JCTH.2018.00042 |
| [16] | Woolbright BL, Jaeschke H. Novel insight into mechanisms of cholestatic liver injury[J]. World J Gastroenterol, 2012, 18(36): 4985-4993. DOI:10.3748/wjg.v18.i36.4985 |
| [17] | Cheung RC, McAuley RJ, Pollard JB. High mortality rate in patients with advanced liver disease independent of exposure to general anesthesia[J]. J Clin Anesth, 2005, 17(3): 172-176. DOI:10.1016/j.jclinane.2004.06.016 |
| [18] | Xie GX, Zheng XJ, Qi X, et al. Metabonomic evaluation of melamine-induced acute renal toxicity in rats[J]. J Proteome Res, 2010, 9(1): 125-133. DOI:10.1021/pr900333h |
| [19] | El Mahdy NM, Kharoub HS. Acute toxicity due to occupational exposure to the plant growth regulator hydrogen cyanamide (case report)[J]. Egypt J Occup Med, 2020, 44(1): 471-484. DOI:10.21608/ejom.2020.67632 |
| [20] | Schep L, Temple W, Beasley M. The adverse effects of hydrogen cyanamide on human health: an evaluation of inquiries to the New Zealand National Poisons Centre[J]. Clin Toxicol (Phila), 2009, 47(1): 58-60. DOI:10.1080/15563650802459254 |
| [21] | Xiong GL, Wu ZX, Yi JC, et al. ADMETlab 2.0: an integrated online platform for accurate and comprehensive predictions of ADMET properties[J]. Nucleic Acids Res, 2021, 49(W1): W5-W14. DOI:10.1093/nar/gkab255 |
| [22] | Dong J, Wang NN, Yao ZJ, et al. ADMETlab: a platform for systematic ADMET evaluation based on a comprehensively collected ADMET database[J]. J Cheminform, 2018, 10(1): 29. DOI:10.1186/s13321-018-0283-x |
| [23] | 吴莉娜, 丁溢姣, 胡颖颖, 等. 急性口服中毒患者院内急救管理最佳证据总结[J]. 中华急诊医学杂志, 2025, 34(2): 260-264. DOI:10.3760/cma.j.issn.1671-0282.2025.02.020 |
| [24] | 基于药代动力学的临床常见药物急性中毒血液净化治疗共识专家组. 基于药代动力学的临床常见药物急性中毒血液净化治疗共识[J]. 中华急诊医学杂志, 2024, 33(11): 1504-1513. DOI:10.3760/cma.j.issn.1671-0282.2024.11.006 |
| [25] | Wang HY, Li YH, Zhao M, et al. The effects of hyperbaric oxygen therapy on paroxysmal sympathetic hyperactivity after cardiopulmonary resuscitation: a case series[J]. World J Emerg Med, 2023, 14(6): 477-480. DOI:10.5847/wjem.j.1920-8642.2023.092 |
| [26] | Wu H, Zhou Y, Xu BG, et al. Assessment of rehabilitation treatment for patients with acute poisoning-induced toxic encephalopathy[J]. World J Emerg Med, 2024, 15(6): 441-447. DOI:10.5847/wjem.j.1920-8642.2024.095 |
 2025, Vol. 34
2025, Vol. 34