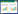2. 浙江省中医药研究院, 杭州 310007;
3. 浙江大学智能创新药物研究院, 杭州 310018
2. Zhejiang Academy of Traditional Chinese Medicine, Hangzhou 310007, China;
3. Innovation Institute for Artificial Intelligence in Medicine of Zhejiang University, Hangzhou 310018, China
脑心综合征(cerebral cardiac syndrome,CCS)是急性脑卒中常见并发症,尤其易在脑损伤发生3 d内出现[1]。CCS广义上涵盖各种脑部疾病引起的心脏损害[2-4],包括心律失常,心功能衰竭,左心室功能障碍等[3],其病理机制涉及自主神经紊乱、氧化应激级联反应及全身性炎症等[5-7]。
研究报道,25%~75%的卒中患者可发生CCS[8],已成为危重症领域亟待解决的临床难题。大脑与心脏存在多种生理和病理性相互作用,脑心交互损伤的早期诊断与干预已成为临床关注的重要议题[9-12]。
醒脑静注射液作为2023年《脑梗死中西医结合诊疗指南》推荐用药,由麝香、栀子、郁金、冰片四味中药组成,具有开窍醒脑,清热解毒的功效[13-17]。一项含38项RCT,共3 677例患者的Meta分析显示[18],醒脑静注射液联合常规治疗能有效改善脑卒中患者神经功能缺损,并提高患者日常生活能力。现代药理研究揭示,醒脑静注射液通过调节细胞能量代谢、抑制神经细胞凋亡发挥神经保护作用[18-20]。但现有研究大多聚焦于单一器官保护,其对脑心交互损伤的协同保护尚不明确。因此,本研究通过大鼠脑缺血-再灌注模型(middle cerebral artery occlusion,MCAO)结合斑马鱼血流障碍模型验证醒脑静注射液的心脑保护作用,以期为醒脑静注射液的临床精准应用提供更坚实的科学证据。
1 材料与方法 1.1 材料 1.1.1 实验动物30只体重200~220 g的SPF级雄性SD大鼠,购自上海斯莱克实验动物有限公司,动物许可证号:SCXK(沪)2017-0005。自由饮水和进食,饲养环境温度22~25 ℃,相对湿度40%~70%。红细胞荧光标记转基因斑马鱼Tg(LCR: EGFP)来源于浙江大学医学院公共技术平台斑马鱼分平台,28.5℃培养箱恒温培养,发育至56 hpf时进行实验。
1.1.2 主要仪器和试剂血流动力学检测仪(AD Instrument,澳大利亚),荧光显微镜(徕卡,德国);醒脑静注射液(大理药业股份有限公司,云南,药品批号1901062),2, 2, 2-三溴乙醇(Sigma-Aldrich,美国),2, 3, 5-三苯基氯化四氮唑(TTC)(Sigma-Aldrich,美国),多聚甲醛溶液(生工生物,上海),苯肼(阿拉丁,上海)。
1.2 实验方法 1.2.1 MCAO模型的建立及实验分组SD大鼠经腹腔注射1.25%三溴乙醇麻醉后固定,碘伏和酒精消毒颈部皮肤,于颈部皮肤正中切口,分离并游离右颈总动脉、右颈内动脉和颈外动脉。颈外动脉剪口,将线栓插入血管并沿颈内动脉插入约18~20 mm以堵塞大脑中动脉。缺血2 h后,将线栓重新拔出恢复血流灌注,动物苏醒后进行神经功能评分,并将造模成功动物随机分为假手术组(尾静脉注射同等剂量生理盐水)、模型组(尾静脉注射同等剂量生理盐水)、醒脑静低剂量组(尾静脉注射1 mL/kg XNJ)和醒脑静高剂量组(尾静脉注射10 mL/kg XNJ),每天给药1次,连续给药7 d。
1.2.2 神经功能评分分别于造模后第1、第4和第7天,按照Zea Longa评分标准对各组动物进行神经功能评分。无神经缺损症状记0分;不能完全伸展对侧前肢记1分;行走时向偏瘫侧转圈记2分;行走时向偏瘫侧倾倒记3分;不能自发行走且意识丧失记4分。
1.2.3 TTC染色评价大鼠脑梗死面积于再灌注7 d后,重新麻醉并固定大鼠,经心脏灌注预冷生理盐水。取下大脑置于-80 ℃冰箱冷冻,沿横断面将大脑均匀切成6片,置于2% TTC染液中,于37 ℃避光染色15 min,后经多聚甲醛固定24 h后拍照,Image J软件分析梗死面积。
1.2.4 HE染色和尼氏染色观察大鼠脑组织病理变化再灌注7 d后,每组取3只大鼠,麻醉固定并经心脏灌注预冷生理盐水。取下大脑置于多聚甲醛溶液中固定,经脱水、包埋、石蜡切片后进行HE染色和尼氏染色,观察大鼠脑组织的形态学改变和神经元损伤。
1.2.5 血流动力学检测于再灌注7 d后,麻醉动物并固定于鼠板,于右侧颈总动脉剪口,将Millar压力导管[21]逆向插入左心室,记录各组大鼠的左心室收缩压(LVSP),左心室舒张末压(LVEDP),左心室压力最大上升速率(+dp/dt)和左心室压力最大下降速率(-dp/dt)等指标变化。
1.2.6 HE染色和Masson染色观察大鼠心脏病理变化于再灌注7 d后,麻醉大鼠,经心脏灌注预冷生理盐水。完整取下心脏后置于多聚甲醛溶液中固定,经脱水、包埋、石蜡切片后进行HE染色和Masson染色,观察大鼠心脏组织的病理改变。
1.2.7 醒脑静注射液对苯肼诱导斑马鱼血流障碍的影响采用苯肼诱导建立斑马鱼血流障碍模型,收集56 hpf绿色荧光蛋白标记红细胞的转基因斑马鱼Tg(LCR: EGFP)胚胎至24孔板中,分别将1/100稀释和1/200稀释的醒脑静注射液和对照溶剂与斑马鱼胚胎孵育24 h,用含有PTU的E3 buffer冲洗胚胎3次,然后加入苯肼(PHZ)造模,12 h后清洗胚胎3次,并换成每孔1 mL E3 buffer。麻醉斑马鱼后,使用徕卡荧光显微镜拍摄斑马鱼胚胎脑部血流。按照血流受阻的不同程度进行评分,血栓最严重的评分为5分。
1.3 统计学方法计量资料以均数±标准差(x±s)表示,采用GraphPad Prism 8软件统计,多组间两两比较采用SNK-q检验分析,以P < 0.05为差异具有统计学意义。
2 实验结果 2.1 神经功能评分如图 1所示,再灌注后各组大鼠神经功能严重受损,神经功能评分较高,表明大脑中动脉栓塞造模成功。醒脑静注射液给药能够剂量依赖地降低神经功能评分;与模型组相比,给药4 d和7 d后醒脑静注射液高剂量组能显著降低大鼠神经功能评分(P < 0.05),对大鼠神经功能具有明显的保护作用。
|
| 注:MCAO,脑缺血-再灌注损伤;XNJ,醒脑静注射液;vs. MCAO,aP < 0.05 图 1 大鼠神经功能评分 Fig 1 Neurological function score in rats |
|
|
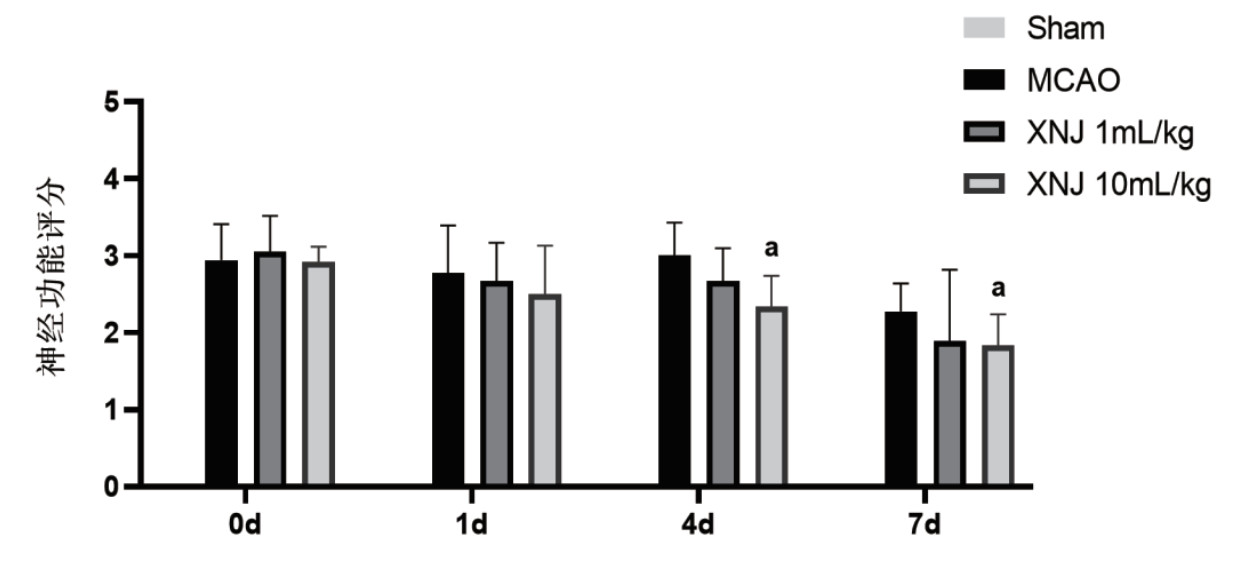
TTC染色结果如图 2,模型组大鼠脑组织呈现显著缺血性损伤并形成大面积梗死灶,而醒脑静注射液干预组表现出剂量依赖性保护效应。醒脑静高剂量组较模型组的脑梗死面积百分比显著降低(P < 0.01),提示醒脑静注射液能够缩小脑梗死范围,改善缺血脑组织的血液供应,保护大脑免受损伤。
|
| A:各组大鼠脑组织TTC染色图;B:梗死面积统计;vs. MCAO,aP < 0.01 图 2 大鼠脑梗死(TTC)染色 Fig 2 TTC Staining of cerebral infarction in rats |
|
|
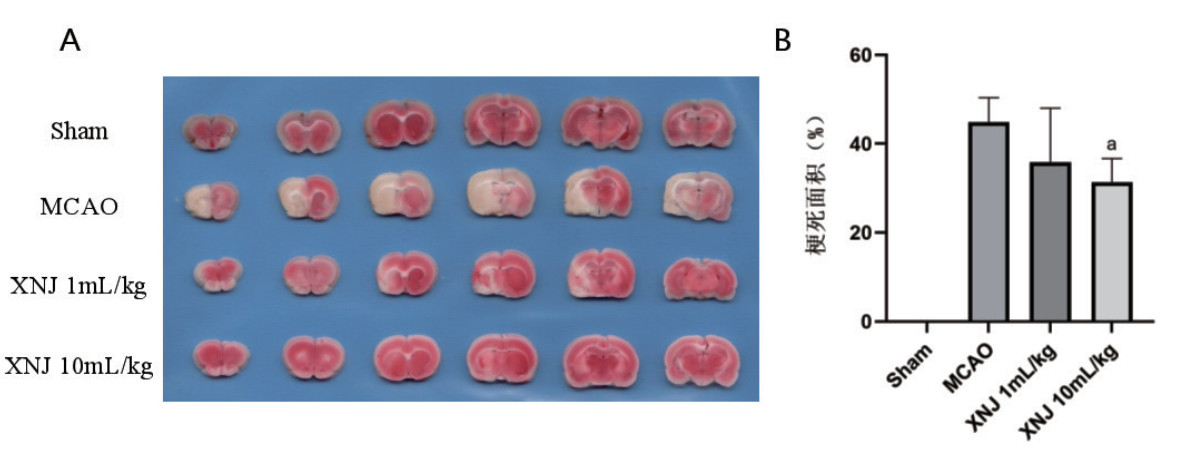
HE染色和尼氏染色结果显示,与假手术组相比,模型组大鼠脑组织细胞核致密深染,脑组织中尼氏小体数目明显减少,且染色较浅,说明神经细胞严重受损。而醒脑静注射液高剂量组HE染色趋于正常,尼氏染色也显示尼氏小体数量明显增加,染色加深,说明醒脑静注射液对缺血-再灌注导致的神经细胞损伤有明显的保护作用(图 3)。
|
| 图 3 大鼠脑组织HE染色和尼氏染色(200×) Fig 3 HE and Nissl staining of rat brain tissue (200×) |
|
|
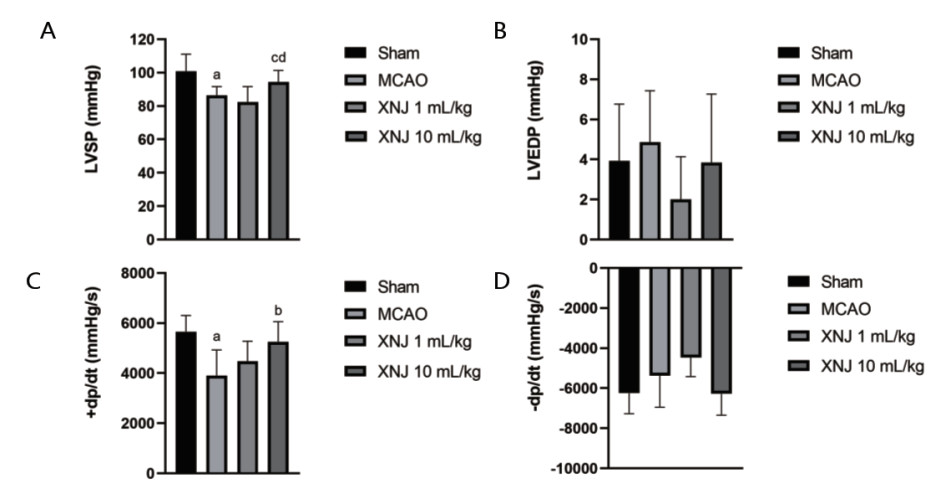
血流动力学检测结果如图 4所示,脑缺血-再灌注后,大鼠心功能受到明显影响,左心室收缩压(LVSP)和左心室压力最大上升速率(+dp/dt)明显减低。醒脑静注射液10 mL/kg干预显著改善血流动力学指标,恢复LVSP和+dp/dt(P < 0.01)。
|
| A:左心室收缩压;B:左心室舒张末压;C:左心室压力最大上升速率;D:左心室压力最大下降速率;vs. Sham,aP < 0.05;vs. MCAO,bP < 0.01;vs. MCAO,cP=0.063;vs. XNJ 1 mL/kg,dP < 0.05 图 4 醒脑静注射液对MCAO大鼠血流动力学的影响 Fig 4 Effect of XNJ Injection on hemodynamics in MCAO rats |
|
|
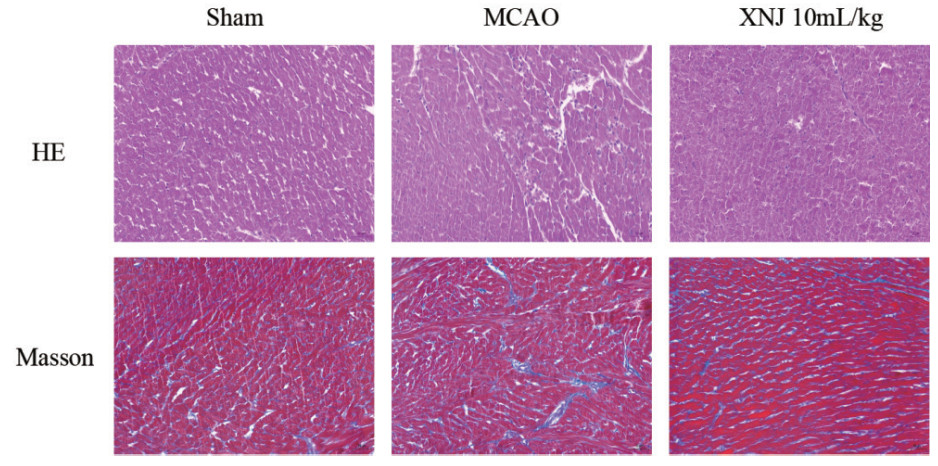
心脏组织病理学显示(图 5),模型组心肌纤维排列紊乱,核固缩明显。醒脑静注射液高剂量组与模型组相比异常细胞数目明显减少。Masson染色结果显示,与假手术组相比,模型组心肌组织蓝染加重,纤维化程度明显,而醒脑静注射液组与模型组相比明显改善蓝染程度,提示醒脑静注射液对脑缺血-再灌注导致的心肌纤维化具有良好的保护作用。
|
| 图 5 大鼠心脏HE染色和Masson染色(200×) Fig 5 HE and Masson staining of rat heart tissue (200×) |
|
|
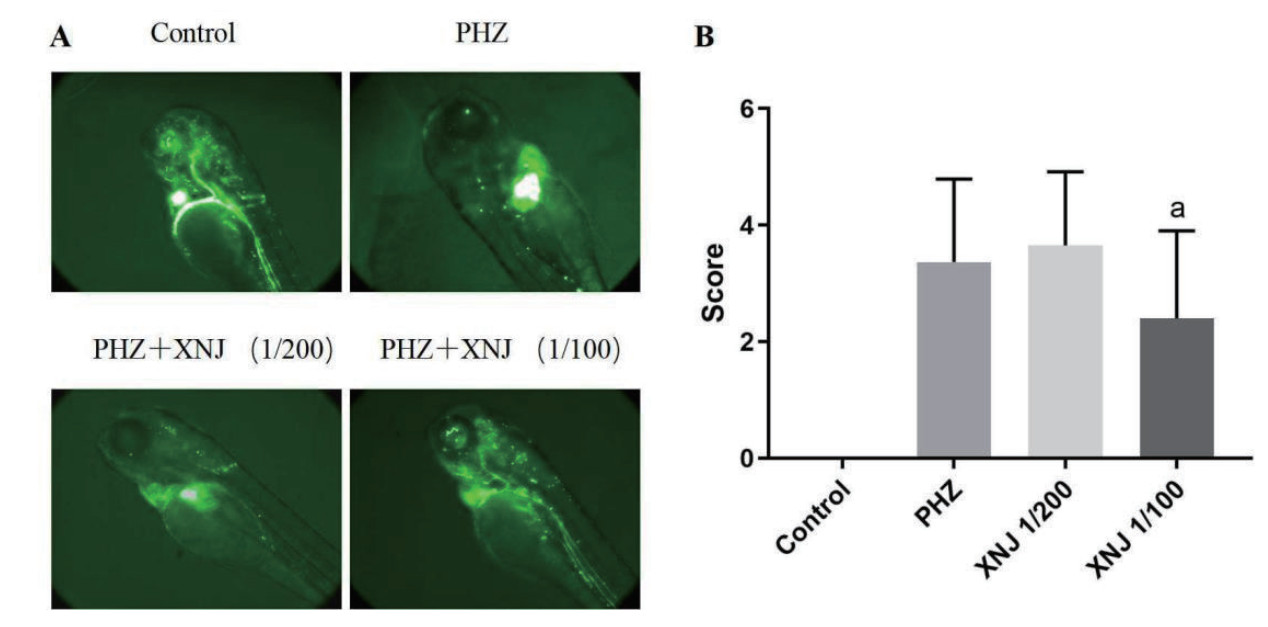
在苯肼诱导斑马鱼血流障碍模型中,模型组斑马鱼脑部血流速度、血管充盈度显著下降,经1/100稀释浓度醒脑静注射液干预后,斑马鱼脑部血流显著恢复(P < 0.05)。见图 6。
|
| A:各组斑马鱼脑部血流代表性荧光图像;B:斑马鱼脑部血流受阻情况评分;vs. PHZ,aP < 0.05 图 6 醒脑静注射液对斑马鱼脑部血流的影响 Fig 6 Effect of XNJ Injection on cerebral blood flow in zebrafish |
|
|
脑心综合征属中医“中风”并发“胸痹、心悸”的并病范畴[22],病机在于气血亏虚或肝肾亏虚,气血运行失和致心脑共病。醒脑静注射液以麝香为君药,辛散温通,开经通窍,配伍郁金、栀子清热凉血、解郁活血,佐以冰片通诸窍、散郁火,全方共奏清解心脑邪毒、通达气血经络之效。研究采用大鼠MCAO模型、斑马鱼血流障碍模型系统评估醒脑静注射液对脑缺血-再灌注损伤并发脑心综合征的治疗效果与通路,为治疗脑心综合征的药物干预提供了新的实验依据。
脑缺血引发的血流动力学紊乱可通过神经-体液调节诱发心脏负荷异常,而心肌功能障碍又会进一步加剧脑灌注不足,形成共损的恶性循环[23-24]。神经结构完整性维系与缺血损伤范围控制,是脑心综合征病理链条中的关键干预点,两者的协同优化可直接改善神经功能预后并阻断脑-心交互损伤[25-28]。动物神经功能评分与脑组织TTC染色结果一致表明,XNJ高剂量组显著改善运动功能障碍并缩小梗死面积,能够改善原发性脑损伤,这与既往研究报道结果相符[29-30]。尼氏染色结果进一步揭示,XNJ可以逆转脑缺血导致的神经元尼氏小体丢失,提示其可能维持神经元蛋白合成能力,减轻神经细胞损伤,对急危重症中易损的自主神经核团形成“精准保护”,这可能从源头上阻断自主神经紊乱引发的心脏应激反应。
血流动力学紊乱导致的灌流不足、心肌纤维化导致的结构重构以及脑部血栓负荷加重造成的缺血级联损伤,是脑心综合征的重要病理环节[31-33]。研究采用将Millar压力导管检测心脏血流动力学情况,评估脑缺血-再灌注后大鼠整体血流状态。结果显示大鼠左心室功能显著受损,心肌纤维化加重,而XNJ干预后大鼠心功能参数恢复,心肌纤维化程度减轻。此外,斑马鱼血流障碍模型显示XNJ改善脑部血流并抑制血栓形成,表明其抗血小板聚集及血管内皮保护作用可能协同改善脑缺血区再灌注,降低继发性心脏应激负荷。
综上所述,本研究证实了XNJ对脑缺血-再灌注损伤并发的脑心损伤具有显著的保护作用,其可能通过“脑内稳态维持-调控血流动力学-保护心肌细胞”的多环节作用,显示出治疗CCS的临床潜力。但对于XNJ的作用通路是通过改善脑损伤从而能减轻心脏应激还是直接保护心肌细胞并不十分明确,醒脑静注射液调控脑心综合征的具体分子机制仍需进一步深入探索。
利益冲突 所有作者声明无利益冲突
作者贡献声明 周小娟:研究设计、实验操作、统计学分析、论文撰写;许雪莹:统计学分析、论文撰写;薛晴:数据收集及整理;赵琴琴:数据整理、论文修改;王迎超:实验操作、论文修改;辛传伟:研究设计、论文修改
| [1] | Ripoll JG, Blackshear JL, Díaz-Gómez JL. Acute cardiac complications in critical brain disease[J]. Neurosurg Clin N Am, 2018, 29(2): 281-297. DOI:10.1016/j.nec.2017.11.007 |
| [2] | Chen ZL, Venkat P, Seyfried D, et al. Brain-heart interaction: cardiac complications after stroke[J]. Circ Res, 2017, 121(4): 451-468. DOI:10.1161/CIRCRESAHA.117.311170 |
| [3] | Lian HJ, Xu XM, Shen XH, et al. Early prediction of cerebral-cardiac syndrome after ischemic stroke: the PANSCAN scale[J]. BMC Neurol, 2020, 20(1): 272. DOI:10.1186/s12883-020-01833-x |
| [4] | 刘雅明, 董均树, 吴绥生. 脑心综合征的研究进展[J]. 中华急诊医学杂志, 2007, 16(12): 1341-1342. DOI:10.3760/j.issn.1671-0282.2007.12.032 |
| [5] | Lin HB, Li FX, Zhang JY, et al. Cerebral-cardiac syndrome and diabetes: cardiac damage after ischemic stroke in diabetic state[J]. Front Immunol, 2021, 12: 737170. DOI:10.3389/fimmu.2021.737170 |
| [6] | Shao R, Hang CC, Wang XS, et al. The "SOOTEST-ICU" bundle for optimizing cerebral hypoxia and reperfusion to minimize brain injury after resuscitation from cardiac arrest[J]. World J Emerg Med, 2025, 16(3): 206-211. DOI:10.5847/wjem.j.1920-8642.2025.050 |
| [7] | Yang ZY, Liu HR, Lu DZ, et al. Effects of high-dose glucose-insulin-potassium on acute coronary syndrome patients receiving reperfusion therapy: a meta-analysis[J]. World J Emerg Med, 2024, 15(3): 181-189. DOI:10.5847/wjem.j.1920-8642.2024.048 |
| [8] | 龚佳俊, 王文敏. 脑心综合征的临床特点及其对急性卒中患者临床预后的影响[J]. 新医学, 2021, 52(5): 371-375. DOI:10.3969/j.issn.0253-9802.2021.05.014 |
| [9] | 张志强, 郑利群, 白伟杰, 等. "脑心同治"理论和临床应用进展[J]. 中国实用医药, 2023, 18(17): 169-171. DOI:10.14163/j.cnki.11-5547/r.2023.17.047 |
| [10] | Zhao BX, Li TF, Fan ZR, et al. Heart-brain connections: Phenotypic and genetic insights from magnetic resonance images[J]. Science, 2023, 380(6648): abn6598. DOI:10.1126/science.abn6598 |
| [11] | Kim MS, Kim JJ. Heart and brain interconnection - clinical implications of changes in brain function during heart failure[J]. Circ J, 2015, 79(5): 942-947. DOI:10.1253/circj.CJ-15-0360 |
| [12] | Egerer E, Siemonsen S, Erbguth F. Acute diseases of the brain and heart: a reciprocal culprit-victim relationship[J]. Med Klin Intensivmed Notfmed, 2018, 113(6): 456-463. DOI:10.1007/s00063-018-0465-3 |
| [13] | 陈玉清, 张艳娟. 醒脑静注射液的作用机制、临床应用和不良反应的研究[J]. 中国药物滥用防治杂志, 2023, 29(10): 1764-1767. DOI:10.15900/j.cnki.zylf1995.2023.10.021 |
| [14] | 张继翱. 醒脑静注射液在临床急症中的应用进展[J]. 现代中西医结合杂志, 2013, 22(17): 1937-1938. DOI:10.3969/j.issn.1008-8849.2013.17.053 |
| [15] | 宋晓杰. ICU急性脑出血患者应用醒脑静注射液辅助治疗的效果及血清学分析[J]. 数理医药学杂志, 2022, 35(10): 1577-1580. |
| [16] | 刘琳琳. 醒脑静联合纳络酮对ICU脑出血患者神经功能及GCS评分的影响[J]. 药品评价, 2020, 17(08): 56-58. |
| [17] | 陈俊峰, 李炳, 刘明, 等. 醒脑静注射液对全脑缺血-再灌注大鼠脑内Caveolin-1表达的影响[J]. 中华急诊医学杂志, 2015, 24(5): 501-505. DOI:10.3760/cma.j.issn.1671-0282.2015.05.012 |
| [18] | Wang LD, Fan XM, Chen YF, et al. Efficacy and safety of Xingnaojing injection for emergency treatment of acute ischemic stroke: a systematic review and meta-analysis[J]. Front Pharmacol, 2022, 13: 839305. DOI:10.3389/fphar.2022.839305 |
| [19] | Zhang YM, Qu XY, Zhai JH, et al. Xingnaojing injection protects against cerebral ischemia reperfusion injury via PI3K/Akt-mediated ENOS phosphorylation[J]. Evid Based Complement Alternat Med, 2018, 2018: 2361046. DOI:10.1155/2018/2361046 |
| [20] | Ma R, Ma X, Wen JX, et al. Preclinical evidence and mechanism of Xingnaojing injection for cerebral ischemia: a systematic review and meta-analysis of animal studies[J]. Evid Based Complement Alternat Med, 2018, 2018: 9624175. DOI:10.1155/2018/9624175 |
| [21] | Hoang JD, van Weperen VYH, Kang KW, et al. Antiarrhythmic mechanisms of epidural blockade after myocardial infarction[J]. Circ Res, 2024, 135(3): e57-e75. DOI:10.1161/CIRCRESAHA.123.324058 |
| [22] | 初世荣. 中医药治疗脑心综合征研究进展[J]. 湖南中医杂志, 2019, 35(9): 151-154. DOI:10.16808/j.cnki.issn1003-7705.2019.09.066 |
| [23] | Tahsili-Fahadan P, Geocadin RG. Heart-brain axis: effects of neurologic injury on cardiovascular function[J]. Circ Res, 2017, 120(3): 559-572. DOI:10.1161/CIRCRESAHA.116.308446 |
| [24] | Abohashem S, Grewal SS, Tawakol A, et al. Radionuclide imaging of heart-brain connections[J]. Cardiol Clin, 2023, 41(2): 267-275. DOI:10.1016/j.ccl.2023.01.013 |
| [25] | Fan XH, Cao JY, Li MX, et al. Stroke related brain-heart crosstalk: pathophysiology, clinical implications, and underlying mechanisms[J]. Adv Sci (Weinh), 2024, 11(14): e2307698. DOI:10.1002/advs.202307698 |
| [26] | Arakaki X, Arechavala RJ, Choy EH, et al. The connection between heart rate variability (HRV), neurological health, and cognition: a literature review[J]. Front Neurosci, 2023, 17: 1055445. DOI:10.3389/fnins.2023.1055445 |
| [27] | Silvani A, Calandra-Buonaura G, Dampney RAL, et al. Brain-heart interactions: physiology and clinical implications[J]. Philos Trans A Math Phys Eng Sci, 2016, 374(2067): 20150181. DOI:10.1098/rsta.2015.0181 |
| [28] | Sposato LA, Hilz MJ, Aspberg S, et al. Post-stroke cardiovascular complications and neurogenic cardiac injury: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2020, 76(23): 2768-2785. DOI:10.1016/j.jacc.2020.10.009 |
| [29] | Wang M, Jia M, Du WQ, et al. Overview of systematic reviews/Meta-analysis of Xingnaojing Injection in treatment of intracerebral hemorrhage[J]. Zhongguo Zhongyao Zazhi, 2021, 46(18): 4633-4643. DOI:10.19540/j.cnki.cjcmm.20210622.501 |
| [30] | Ma X, Yang YX, Chen N, et al. Meta-analysis for clinical evaluation of Xingnaojing injection for the treatment of cerebral infarction[J]. Front Pharmacol, 2017, 8: 485. DOI:10.3389/fphar.2017.00485 |
| [31] | Rossi A, Mikail N, Bengs S, et al. Heart-brain interactions in cardiac and brain diseases: why sex matters[J]. Eur Heart J, 2022, 43(39): 3971-3980. DOI:10.1093/eurheartj/ehac061 |
| [32] | Zheng C, Cui YD, Gu SS, et al. Myocardial fibrosis is associated with brain microstructural alterations in patients with heart failure: a diffusion MRI study[J]. Eur J Radiol, 2025, 182: 111813. DOI:10.1016/j.ejrad.2024.111813 |
| [33] | Reich B, Heye KN, Tuura RO, et al. Interrelationship between hemodynamics, brain volumes, and outcome in hypoplastic left heart syndrome[J]. Ann Thorac Surg, 2019, 107(6): 1838-1844. DOI:10.1016/j.athoracsur.2018.12.012 |
 2025, Vol. 34
2025, Vol. 34