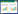脓毒症是当前危重症领域研究的难点,据统计,全世界估计每年4 890万脓毒症和1 100万脓毒症导致的死亡病例[1],高发病率和病死率是当前重大的医学科学问题和社会民生问题[2],随着人口老龄化进程,预计2050年,60岁及以上人口比例将达33%,80岁以上人口增加2倍[3]。有研究显示,年龄是脓毒症患者死亡的独立危险因素 [4]。关于脓毒症患者死亡预测模型国内外学者进行了初步探索。相关研究[5]报道年龄增长、认知功能障碍、衰弱、低平均动脉压、低前白蛋白、高尿素氮、高降钙素原是高龄脓毒症患者28d死亡的独立危险因素。国外一项[6]关于ESM模型在脓毒症风险预测的外部验证,AUC仅为0.63 (95% CI: 0.62 ~0.64),其敏感度及特异度差, 无法为脓毒症临床救治提供可靠指导。
糖尿病患者的长期高血糖状态会导致免疫功能受损,进而增加脓毒症死亡风险[7-9]。然而,糖尿病患者常用于治疗的胰岛素和二甲双胍具有免疫调节作用,可改善脓毒症预后[10]。与合并糖尿病的脓毒症患者相比,非糖尿病脓毒症患者存在全身炎症、内皮细胞和凝血功能被严重激活的迹象[11],基于以上原因,本研究旨在探讨非糖尿病老年脓毒症患者预后相关因素,构建90 d死亡风险预测模型,寻求特异度及敏感度高的脓毒症预警评估模型用于指导临床。
1 资料与方法 1.1 研究对象所有研究对象均来自宁波市医疗中心李惠利医院住院病区的成年脓毒症患者,共纳入2021年1月1日至2024年11月30日期间所有诊断为脓毒症的患者2 876名,其中年龄≥65周岁的老年脓毒症患者1 471名(占比51.15%),其中合并糖尿病365例,占比24.81%%。根据纳排标准,纳入标准:≥65岁且首次入院的新发患者;根据sepsis 3.0诊断为脓毒症。排除标准:(1)患者在入院前已确诊糖尿病或入院后相关症状体征、血糖、糖化血红蛋白等符合糖尿病诊断者;(2)住院时间不足24 h;(3)数据不足如缺乏甘油三酯、空腹血糖、糖化血红蛋白的记录;(4)合并影响血糖的基础疾病如肿瘤活动期、免疫功能低下;(5)研究者判断患者不适合纳入的其他情况(图 1)。

|
| 图 1 研究对象筛选流程图 Fig 1 Flowchart of participants inclusion |
|
|
本研究经宁波市医疗中心李惠利医院医学伦理委员会批准(伦理号:YJZ2025SL174),免除患方知情同意,根据赫尔辛基宣言进行。
经纳排标准筛选后非糖尿病的老年脓毒症患者1 106例(占比75.19%),男性696例(占比62.93%),女性410例(占比37.07%),年龄65~100岁,年龄(76.66±7.79)岁。其中脓毒症休克79.66%,MODS 36.44%,心力衰竭19.26%,呼吸衰竭45.93%,肾脏衰竭15.91%(其中急性肾损伤34.27%),肝衰竭15.19%,呼吸机支持率44.21%,CRRT使用率19.71%, ICU入住率43.49%,院内病死率24.23%,28 d病死率24.41%,90 d病死率35.35%,180 d病死率39.15%。
1.2 研究方法收集纳入研究的患者临床资料,包括:(1)一般资料:年龄、性别、感染部位(呼吸系统、腹腔感染、胆道感染、泌尿道感染、血流感染、其他)、基础疾病(高血压、2型糖尿病、脑卒中、肿瘤);(2)入院后生命体征:体温、脉搏、呼吸、平均动脉压(mean arterial pressure, MAP)、急诊预检分诊等级;(3)入院24 h实验室检查指标:乳酸、血常规(白细胞、中性粒细胞计数、淋巴细胞计数、红细胞、血红蛋白、血细胞比容、血小板),肝功能(总蛋白、白蛋白、前白蛋白、总胆红素),肾功能(尿素氮、肌酐、尿酸),脂代谢(总胆固醇、甘油三酯、低密度脂蛋白),电解质(总钙、钠、钾),空腹血糖,血浆纤维蛋白原、D-二聚体、APTT、C反应蛋白(C-reactive protein,CRP);(4)入院24 h SOFA评分、APACHEⅡ评分。记录ICU入住率、院内病死率、随访28 d病死率、90 d病死率。
1.3 统计学方法采用R 4.4.3统计学软件分析数据,计数资料以n(%)表示,组间差异分析采用χ2检验;正态分布的计量资料以均数±标准差(x±s)表示,组间差异分析采用t检验。采用随机数方法,按照7∶3比例将研究对象随机分为建模组和验证组。采用双向法逐步多因素COX回归确定非糖尿病老年脓毒症患者死亡的危险因素和保护因素。双向法逐步的引入水准αin =0.05、剔除水准αout =0.10,以空模型为起点,先引入P < α in的变量,再剔除当前模型中P > αout的变量,重复操作至无变量可引入/剔除。使用“rms”包绘制死亡风险预测模型的列线图,绘制受试者工作特征(ROC)曲线、校准曲线和决策曲线。采用ROC曲线和校准曲线对模型的区分度和准确度进行评价,采用决策曲线对模型的临床有效性进行评价,以P <0.05为差异有统计学意义。
2 结果 2.1 患者一般资料搜集的资料包括患者一般资料年龄、性别、感染部位,基础疾病病史:高血压、脑梗死、脑出血、肿瘤,入院生命体征,急诊预检分诊等级等指标。统计分析发现,死亡组年龄高于生存组(P = 0.03), 性别,合并创伤、高血压、脑出血、脑梗死、肿瘤等发病率,两组差异无统计学意义。急诊预检分诊等级,死亡组Ⅰ级占比高于生存组(19.03% vs. 15.39%, P = 0.036)。见表 1。
| 指标 | 生存组 (n=838) |
死亡组 (n=268) |
t / Z / χ2值 | P值 |
| 一般资料 | ||||
| 年龄 | 76.37±7.69 | 77.55±8.04 | -2.17 | 0.03 |
| 男性(n, %) | 182(26.16) | 514(73.85) | 159.26 | < 0.001 |
| 感染部位(n, %) | ||||
| 肺部感染 | 291(34.73) | 81(30.22) | 1.843 | 0.175 |
| 腹腔感染 | 130(15.51) | 38(14.18) | 0.281 | 0.596 |
| 胆道感染 | 230(27.45) | 78(29.1) | 0.278 | 0.598 |
| 泌尿道感染 | 93(11.1) | 29(10.82) | 0.016 | 0.900 |
| 血流感染 | 53(6.32) | 27(10.07) | 25.89 | <0.001 |
| 其他 | 22(2.63) | 10(3.73) | 0.292 | 0.589 |
| 基础疾病(n, %) | ||||
| 创伤 | 13(1.55) | 5(1.87) | 0.006 | 0.939 |
| 高血压 | 291(34.73) | 110(41.04) | 3.509 | 0.061 |
| 脑出血 | 15(1.79) | 10(3.73) | 3.464 | 0.063 |
| 脑梗死 | 112(13.37) | 27(10.07) | 2.001 | 0.157 |
| 肿瘤 | 251(29.95) | 74(27.61) | 0.536 | 0.464 |
| 生命体征 | ||||
| T(℃) | 37.14±1.05 | 36.84±2.87 | 2.900 | 0.004 |
| 心率(次/min) | 89(77, 104) | 92(79, 106) | -1.731 | 0.083 |
| MAP(mmHg) | 92.44±20.70 | 94.83±21.10 | -1.637 | 0.102 |
| 急诊预检分诊等级(n, %) | 8.563 | 0.036 | ||
| 1 | 129(15.39) | 51(19.03) | ||
| 2 | 336(40.1) | 84(31.34) | ||
| 3 | 108(12.89) | 31(11.57) | ||
| 4 | 265(31.62) | 102(38.06) | ||
包括入院24 h炎症指标、血生化指标、凝血功能、疾病严重程度、侵入性干预手段等,分析发现院内死亡组TG、FBG、AST、BUM、SCr、LDH指标,及凝血相关指标如PT、APTT、TT高于生存组(P均<0.05),而Fib低于生存组(P<0.001)。死亡组SOFA值高于生存组(P = 0.013),其呼吸机治疗率、CRRT支持率、ICU入住率,均显著高于生存组(P<0.001)(表 2)。
| 指标 | 生存组(n=838) | 死亡组(n=268) | Z/ χ2值 | P值 |
| 炎症指标 | ||||
| WBC (×109/L), M (IQR) | 9.15(5.7, 14.73) | 9.4(5.93, 14.6) | -0.036 | 0.971 |
| CRP (mg/L), M (IQR) | 126.36(62.08, 178) | 118(49.39, 174.25) | -1.115 | 0.265 |
| N (×109/L), M (IQR) | 7.6(4.3, 13.13) | 7.75(4.5, 12.38) | -0.539 | 0.590 |
| L (×109/L), M (IQR) | 0.7(0.4, 1.1) | 0.7(0.4, 1.18) | -0.421 | 0.674 |
| M (×109/L), M (IQR) | 0.5(0.3, 0.8) | 0.5(0.2, 0.7) | -0.693 | 0.488 |
| PLT (×109/L), M (IQR) | 155.5(102, 222) | 159(98, 213) | -0.219 | 0.827 |
| PCT, M(IQR) | 4.28(0.52, 21.41) | 1.55(0.39, 14.24) | -3.322 | 0.001 |
| 血生化指标 | ||||
| Lac (mmol/L), M (IQR) | 2.71(1.9, 3.43) | 2.6(1.7, 4.12) | -0.459 | 0.646 |
| TG (mmol/L),M (IQR) | 1.17(0.83, 1.63) | 1.28(0.91, 1.75) | -2.040 | 0.041 |
| FBG (mmol/L),M (IQR) | 7.4(5.79, 9.05) | 8.47(6.52, 9.96) | -4.864 | 0.000 |
| AMY (U/L),M (IQR) | 64(38, 166.5) | 67.5(39, 184.09) | -1.129 | 0.259 |
| ALT (U/L),M (IQR) | 24(14, 52) | 23(14, 44.75) | -1.134 | 0.257 |
| AST (U/L),M (IQR) | 33(21, 69) | 38(24, 88.75) | -2.617 | 0.009 |
| PAB (mg/L),M (IQR) | 107.42(70, 130) | 107.42(64.18, 128.63) | -0.192 | 0.848 |
| Alb (g/L),M (IQR) | 29.3(26.2, 33.3) | 28.95(25.53, 33.15) | -0.946 | 0.344 |
| TBil (mmol/L) | 14.15(8.9, 25.83) | 15.05(9.8, 29.63) | -1.784 | 0.074 |
| BUN (mmol/L),M (IQR) | 8.65(5.94, 13.56) | 11.74(6.96, 19.7) | -5.472 | 0.000 |
| SCr (mmol/L),M (IQR) | 89.8(65.35, 147.45) | 99(67.1, 182.33) | -2.272 | 0.023 |
| LDH (U/L),M (IQR) | 254.5(184.75, 424.34) | 363.5(239.25, 434.5) | -7.228 | 0.000 |
| 凝血功能 | ||||
| PT (s),M (IQR) | 13.7(12.1, 15.6) | 14.5(12.73, 16.88) | -3.687 | 0.000 |
| APTT (s),M (IQR) | 33.15(29.58, 39.2) | 35.35(30, 44.65) | -2.298 | 0.022 |
| TT (s),M (IQR) | 16(14.4, 17.51) | 17.05(15.3, 18.8) | -5.986 | 0.000 |
| FIB (g/L),M (IQR) | 4.44(3.5, 5.85) | 3.93(3.04, 4.9) | -4.570 | 0.000 |
| D-二聚体,M (IQR) | 832.5(256.75, 1930.5) | 710.5(46.51, 2574.75) | -0.182 | 0.856 |
| 疾病严重程度 | ||||
| SOFA,M (IQR) | 4(3, 6) | 5(3, 7) | -2.489 | 0.013 |
| ICU入住率(n, %) | 256,(30.55) | 225(83.96) | 15.2 | <0.001 |
| 侵入性干预手段 | ||||
| 呼吸机治疗(n, %) | 280(33.41) | 209(77.99) | 163.556 | <0.0001 |
| CRRT (n, %) | 96(11.46) | 122(45.52) | 148.909 | <0.0001 |
| 注:SOFA,序贯器官衰竭评估,CRRT,连续性血液净化 | ||||
采用随机数字表法,随机选取数据建模组774例非糖尿病老年脓毒症患者,其中生存组287人(37.08%),死亡组487人(62.92%),男性483人(62.40%),女性291人(37.60%)。两组合并性别,合并的基础疾病如创伤、肾脏疾病、肿瘤、脑出血、脑梗死等无差异。两组患者的SOFA、PCT、Lac、FBG、前白蛋白、BUN、PT、APTT、TT、FIB、合并高血压、呼吸机支持、CRRT等13项指标差异有统计学意义(P均<0.05),见表 3。
| 变量 | 总数 (n = 774) |
生存组 (n = 287) |
死亡组 (n = 487) |
t /χ2 | P值 |
| 人口学特征 | |||||
| 年龄 | 76.73 ± 7.82 | 75.67 ± 7.44 | 77.36 ± 7.97 | -2.92 | 0.004 |
| 性别 (n, %) | 2.41 | 0.121 | |||
| 男 | 483 (62.40) | 169 (58.89) | 314 (64.48) | ||
| 女 | 291 (37.60) | 118 (41.11) | 173 (35.52) | ||
| 基础疾病(n, %) | |||||
| 创伤(n, %) | 0.13 | 0.716 | |||
| 否 | 763 (98.58) | 284 (98.95) | 479 (98.36) | ||
| 是 | 11 (1.42) | 3 (1.05) | 8 (1.64) | ||
| 高血压病(n, %) | 4.22 | 0.040 | |||
| 否 | 490 (63.31) | 195 (67.94) | 295 (60.57) | ||
| 是 | 284 (36.69) | 92 (32.06) | 192 (39.43) | ||
| 肾脏疾病(n, %) | 0.80 | 0.372 | |||
| 否 | 763 (98.58) | 281 (97.91) | 482 (98.97) | ||
| 是 | 11 (1.42) | 6 (2.09) | 5 (1.03) | ||
| 肿瘤(n, %) | 1.44 | 0.230 | |||
| 否 | 551 (71.19) | 197 (68.64) | 354 (72.69) | ||
| 是 | 223 (28.81) | 90 (31.36) | 133 (27.31) | ||
| 脑出血(n, %) | 1.63 | 0.202 | |||
| 否 | 753 (97.29) | 282 (98.26) | 471 (96.71) | ||
| 是 | 21 (2.71) | 5 (1.74) | 16 (3.29) | ||
| 脑梗死(n, %) | 2.22 | 0.136 | |||
| 否 | 681 (87.98) | 246 (85.71) | 435 (89.32) | ||
| 是 | 93 (12.02) | 41 (14.29) | 52 (10.68) | ||
| 病原类型(n, %) | 1.31 | 0.860 | |||
| 阴性 | 444 (57.36) | 169 (58.89) | 275 (56.47) | ||
| 细菌 | 248 (32.04) | 87 (30.31) | 161 (33.06) | ||
| 病毒 | 30 (3.88) | 12 (4.18) | 18 (3.70) | ||
| 支原体 | 51 (6.59) | 19 (6.62) | 32 (6.57) | ||
| 其他 | 1 (0.13) | 0 (0.00) | 1 (0.21) | ||
| 侵入性干预 | |||||
| 呼吸机治疗(n, %) | 21.56 | < 0.001 | |||
| 否 | 426 (55.04) | 189 (65.85) | 237 (48.67) | ||
| 是 | 348 (44.96) | 98 (34.15) | 250 (51.33) | ||
| CRRT (n, %) | 25.12 | < 0.001 | |||
| 否 | 624 (80.62) | 258 (89.90) | 366 (75.15) | ||
| 是 | 150 (19.38) | 29 (10.10) | 121 (24.85) | ||
| 实验室指标 | |||||
| SOFA | 4.67 ± 2.36 | 4.34 ± 2.26 | 4.87 ± 2.39 | -3.07 | 0.002 |
| PCT | 17.14 ± 28.97 | 21.27 ± 31.70 | 14.67 ± 26.94 | 2.87 | 0.004 |
| Lac(mmol/L) | 3.11 ± 2.30 | 2.77 ± 1.65 | 3.31 ± 2.59 | -3.35 | < 0.001 |
| FBG(mmol/L) | 8.78 ± 4.95 | 8.30 ± 3.88 | 9.07 ± 5.47 | -2.23 | 0.026 |
| BUN(mmol/L) | 12.64 ± 10.14 | 11.12 ± 8.73 | 13.54 ± 10.79 | -3.39 | < 0.001 |
| PT(s) | 15.02 ± 5.25 | 14.35 ± 3.70 | 15.42 ± 5.95 | -2.71 | 0.007 |
| APTT(s) | 36.63 ± 11.34 | 35.35 ± 9.63 | 37.38 ± 12.19 | -2.54 | 0.011 |
| TT(s) | 17.02 ± 7.22 | 16.30 ± 6.20 | 17.45 ± 7.73 | -2.13 | 0.033 |
| FIB(g/L) | 4.56 ± 1.84 | 4.87 ± 1.84 | 4.38 ± 1.81 | 3.65 | < 0.001 |
| 注:SOFA为序贯器官衰竭评分,qSOFA为快速序贯器官衰竭评分,CRRT为连续性肾脏替代治疗 | |||||
将13项自变量纳入多因素COX回归分析中,采用双向法筛选出5项老年脓毒症患者死亡的危险因素:Age(HR=1.016, 95%CI=1.002~1.030),Lac(HR=1.070, 95%CI=1.024~1.117),BUN(HR=1.017, 95%CI=1.005~1.028),呼吸机治疗(HR=1.576, 95%CI=1.248~1.990),CRRT(HR=1.622, 95%CI=1.233~2.133)和2项保护因素:前白蛋白(HR=0.998, 95%CI=0.996~0.999),纤维蛋白原(HR=0.905, 95%CI=0.849~0.964),7个变量的VIF值范围为1.034到1.283,各变量间无共线性(表 4)。
| 变量 | β | S.E | Z | P值 | OR (95%CI) |
| 年龄 | 0.016 | 0.007 | 2.228 | 0.026 | 1.016 (1.002 ~ 1.030) |
| Lac | 0.067 | 0.022 | 3.045 | 0.002 | 1.070 (1.024 ~ 1.117) |
| Prealbumin | -0.002 | 0.001 | -2.406 | 0.016 | 0.998 (0.996 ~ 0.999) |
| BUN | 0.016 | 0.006 | 2.800 | 0.005 | 1.017 (1.005 ~ 1.028) |
| FIB | -0.100 | 0.032 | -3.104 | 0.002 | 0.905 (0.849 ~ 0.964) |
| 呼吸机支持 | |||||
| 否 | 1.000 (Reference) | ||||
| 是 | 0.455 | 0.119 | 3.817 | < 0.001 | 1.576 (1.248 ~ 1.990) |
| CRRT | |||||
| 否 | 1.000 (Reference) | ||||
| 是 | 0.483 | 0.140 | 3.458 | < 0.001 | 1.622 (1.233 ~ 2.133) |
基于上述7个独立危险因素绘制患者28 d和90 d死亡风险的列线图,列线图可直观展示每个预测因子对应分值和其相加的总分,总分对应的死亡风险则代表预测非糖尿病老年脓毒症患者的死亡概率,见图 2。
|
| 图 2 非糖尿病老年脓毒症患者28 d和90 d死亡风险预测列线图 Fig 2 Nomogram for predicting 28-day and 90-day mortality in non-diabetic elderly patients with sepsis |
|
|
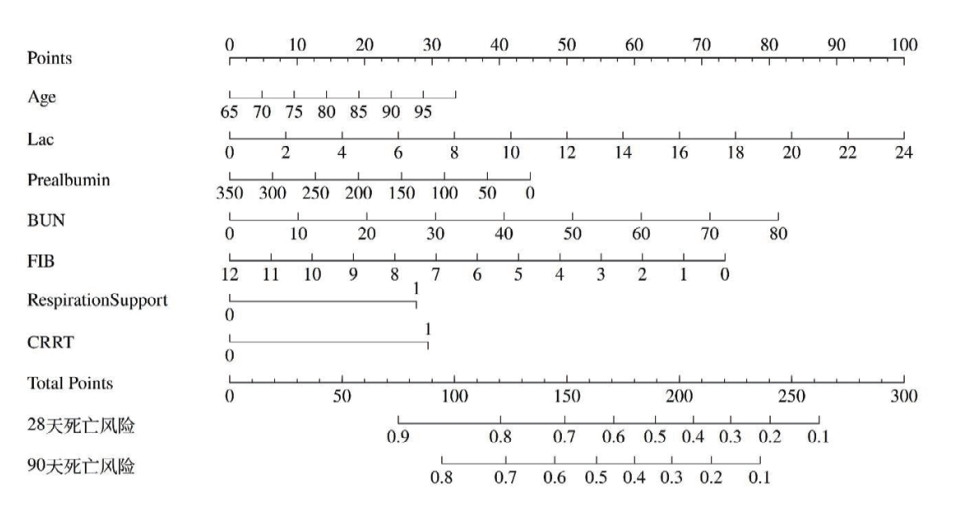
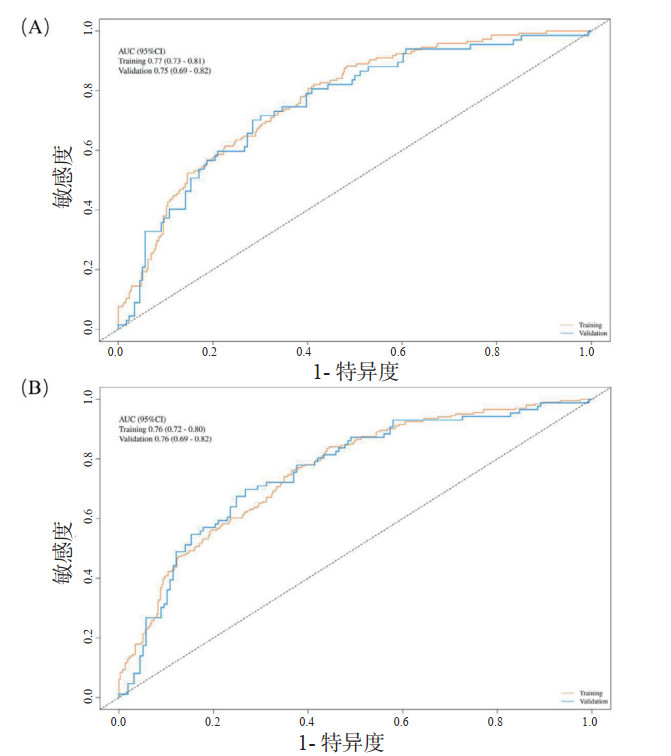
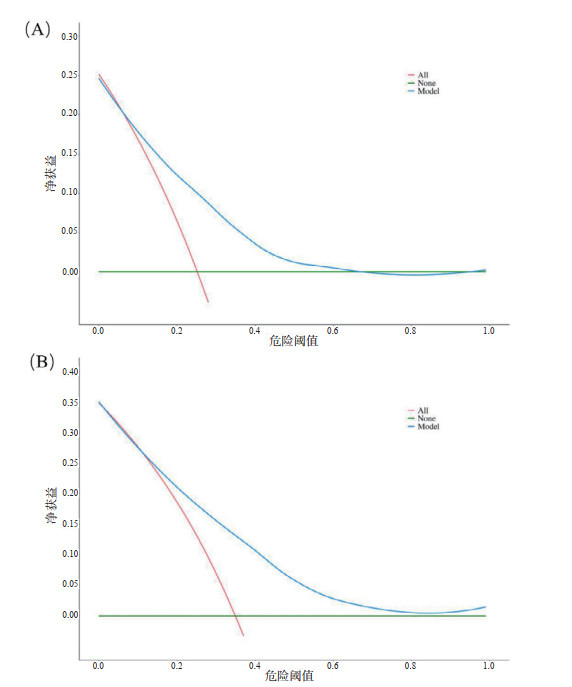
采用随机数方法,按照7:3比例将研究对象随机分为建模组和验证组,两组间变量具有可比性。AUC曲线显示,28 d死亡风险预测模型在建模组和验证组中AUC无差异,分别为0.77和0.75,Z=0.54,P > 0.05;90 d死亡风险预测模型在建模组和验证组中AUC无差异,均为0.76,Z=0.18,P > 0.05,提示该预测模型在建模组和验证组均具有较好的区分度(图 3)。校准曲线中的横坐标和纵坐标分别代表预测和实际的死亡概率,在建模组与验证组中的预测曲线均接近对角线,H-L拟合优度检验P值均大于0.05,提示该预测模型具有较好的准确性(图 4)。DCA曲线显示,建模组中的预测模型曲线均在两条极端曲线之上,表明该预测模型具有较好的临床有效性(图 5)。
|
| 图 3 列线图在建模组和验证组中AUC曲线(A)28 d;(B)90 d Fig 3 Area under the receiver operating characteristic curve (AUC) of the nomogram in the derivation and validation cohorts for (A) 28-day and (B) 90-day mortality |
|
|
|
| 图 4 列线图的校准曲线:(A)建模组中28 d;(B)验证组中28 d;(C)建模组中90 d;(D)验证组中90 d Fig 4 Calibration curves of the nomogram for (A) 28-day and (C) 90-day mortality in the derivation cohort, and for (B) 28-day and (D) 90-day mortality in the validation cohort |
|
|
|
| 图 5 列线图在建模组中决策曲线:(A)28 d;(B)90 d Fig 5 Decision curve analysis for the nomogram in the derivation cohort predicting (A) 28-day and (B) 90-day mortality |
|
|
近年来,老年脓毒症患者受到学者广泛关注。印明珠等[12]收集脓毒症患者临床资料,观察临床指标对老年脓毒症患者预后的影响,发现Angle、CI、ATⅢ、D-二聚体、MPV/PLT是影响老年脓毒症患者预后的独立预测因素。本研究发现≥80岁高龄组院内生存率(71.47% vs. 77.91%)、28 d生存率(74.73% vs. 76.02%)、90 d生存率差异(57.88% vs. 68.16%)均低于老年组(P均 < 0.05),推测年龄是脓毒症预后不良的独立危险因素。构建死亡模型774例患者,其死亡组年龄高于生存组(76.99±7.86 vs. 75.93±7.28),差异无统计学意义(P>0.05)。
脓毒症患者临床表现异质性一直是脓毒症研究中的突出难题[13]。一项研究[14]纳入20189例脓毒症患者,表型α、β、γ、δ四种亚型,其中δ型肝衰竭和脓毒性休克发生率较高且28d和365d病死率最高。关于脓毒症预后指标,有研究[15]报道PCT/PLT比值可预警脓毒症心肌损伤。ICU内AP并发脓毒症的独立危险因素为BMI、APACHE Ⅱ评分、血小板,IL-6、总胆红素,据此建立的Nomogram图风险预测模型具有较高的预测价值[16]。以上研究关注的是脓毒症患者临床合并症及院内结局。本研究发现,脓毒症死亡组SOFA值高于生存组(P=0.013), 其呼吸机治疗率、CRRT支持率、ICU入住率更高(P<0.001),推测高的初始SOFA评分、入住ICU、使用呼吸机治疗或CRRT干预的脓毒症患者院内死亡风险高。推测,以上指标的整合可用于指导临床早期诊断及预测院内死亡风险,接受呼吸机支持、CRRT治疗为老年脓毒症患者90 d死亡的独立风险。
近期Yan等[17]从MIMIC-Ⅳ(2.2)数据库中提取了2 312例脓毒症患者,发现应激性高血糖可预测脓毒症28 d死亡风险(AUC=0.8322)(HR > 1,P < 0.05),有学者[18]从MIMIC-Ⅲ、MIMIC-Ⅳ和eICU-CRD数据库共筛选出7 746例脓毒症诱发凝血功能障碍(SIC)患者,SHAP分析发现初始SOFA评分、红细胞分布宽度和年龄这3各指标可预测SIC患者28 d死亡风险。近期Zhou等[19]纳入MIMIC-Ⅳ数据库27 134例和中国医院487例脓毒症患者,筛选出52项临床指标构建模型预测院内死亡风险(AUROC 0.873、敏感度0.818、准确率0.777、特异度0.768、F1分数0.551)。Rahman等[20],筛选15种生物标志物,预测脓毒症患者30 d病死率。当前,死亡风险预测模型[21-27]构建越来越得到广泛关注未来。然而,非糖尿病老年脓毒症人群占比高不容忽视,关于这类人群不良预后的研究目前较少,结合机器学习构建死亡风险预测模型为脓毒症的早期干预和预后改善提供新思路。
本研究采用本土脓毒症数据库,研究发现入院高龄、高乳酸、高尿素氮、APTT延长,使用呼吸机治疗及CRRT治疗,低前白蛋白水平及低纤维蛋白原7项指标是非糖尿病老年脓毒症患者90 d死亡的独立危险因素。李志华等[27]提出白蛋白/纤维蛋白原(AFR)与APACHE Ⅱ评分强相关(r=-0.462,P < 0.001),推测营养状况及凝血指标与脓毒症预后相关。陈文胜等[28]分析了503例脓毒症患者临床资料,指出乳酸/前白蛋白比值(lactate/ PAB ratio,L/P)是SALI的早期独立危险因素(AUC 0.808),初始高乳酸及低前白蛋白提升脓毒症不良预后。也有学者[29]筛选出16个最佳预测变量,包括pH值、白蛋白、体温、Lac、SCr、Ca2+、血红蛋白、白细胞计数、年龄、SAPS Ⅲ评分、APS Ⅲ评分、Na+、BMI和APTT,与脓毒症休克患者28 d死亡风险相关。与本研究发现院内死亡组SCr、PT、APTT、TT高于生存组(P均<0.05),而Fib低于生存组(P<0.001),结果类似。目前国内外鲜有关于老年脓毒症90 d死亡风险预测模型的构建,本研究回顾性分析774例非糖尿病老年脓毒症患者临床资料,构建了90 d预测模型,在建模组和验证组中AUC均为0.76,该模型有较好的预测效能,有望辅助临床医师指导临床决策及病情评估。
本研究有一定的局限性:(1)本研究纳入样本量有限,可能影响模型的统计效力,导致结果普适性不足,后续研究需进一步扩大样本量、开展多中心研究进一步提高模型的准确性与特异度。(2)数据测量工具不完善可能导致分析结果出现偏差,如90 d生存数据主要依赖电话随访与病历回顾,可能存在失访或信息不全的情况,以及出院后的治疗差异(如是否继续ICU治疗、家庭护理质量等)未纳入分析,可能对结果产生影响。(3)本研究为单中心回顾性研究,建模与验证集虽经随机分组,但仍存在人群同质性问题,后续计划开展多中心外部验证以提升模型的泛化能力。
综上所述,入院高龄、高乳酸、高尿素氮、APTT延长、低前白蛋白、低纤维蛋白原是预测非糖尿病老年脓毒症患者死亡的危险因素,接受侵入性干预措施如呼吸机支持及CRRT治疗与脓毒症患者死亡风险直接相关,围绕死亡风险进行早期预警及早期干预,有望阻断老年脓毒症患者脓毒症进程,进一步降低死亡风险,后续需要多中心的研究进一步验证。
利益冲突 所有作者声明无利益冲突
作者贡献 应泽亮、李增攀:数据整理分析,论文撰写;朱立军、马洪昆、蒋坚:临床资料和数据收集整理,制作图表;许国栋、赵益栋:预测模型构建与验证、统计分析、图表制作;杨诺南、徐家男、刘雪兰:研究设计,论文撰写与修改
| [1] | Meyer NJ, Prescott HC. Sepsis and septic shock[J]. N Engl J Med, 2024, 391(22): 2133-2146. DOI:10.1056/nejmra2403213 |
| [2] | 刘峰宇, 李想, 孙同文. 中国脓毒症十年研究进展回顾及展望[J]. 中华急诊医学杂志, 2023, 32(10): 1291-1295. DOI:10.3760/cma.j.issn.1671-0282.2023.10.002 |
| [3] | Xie JF, Wang HL, Kang Y, et al. The epidemiology of sepsis in Chinese ICUs: a national cross-sectional survey[J]. Crit Care Med, 2020, 48(3): e209-e218. DOI:10.1097/CCM.0000000000004155 |
| [4] | Martin-Loeches I, Guia MC, Vallecoccia MS, et al. Risk factors for mortality in elderly and very elderly critically ill patients with sepsis: a prospective, observational, multicenter cohort study[J]. Ann Intensive Care, 2019, 9(1): 26. DOI:10.1186/s13613-019-0495-x |
| [5] | 李秋敬, 商娜, 王真, 等. 高龄脓毒症患者28天死亡预测模型的构建级验证[J]. 中华急诊医学杂志, 2024, 33(4): 542-548. DOI:10.3760/cma.j.issn.1671-0282.2024.04.015 |
| [6] | Wong A, Otles E, Donnelly JP, et al. External validation of a widely implemented proprietary sepsis prediction model in hospitalized patients[J]. JAMA Intern Med, 2021, 181(8): 1065-1070. DOI:10.1001/jamainternmed.2021.2626 |
| [7] | Trevelin SC, Carlos D, Beretta M, et al. Diabetes mellitus and sepsis: a challenging association[J]. Shock, 2017, 47(3): 276-287. DOI:10.1097/SHK.0000000000000778 |
| [8] | Angriman F, Lawler PR, Shah BR, et al. Prevalent diabetes and long-term cardiovascular outcomes in adult sepsis survivors: a population-based cohort study[J]. Crit Care, 2023, 27(1): 302. DOI:10.1186/s13054-023-04586-4 |
| [9] | Margalin B, Arfijanto MV, Hadi U. Effector function and neutrophil cell death in the severity of sepsis with diabetes mellitus[J]. Narra J, 2024, 4(1): e532. DOI:10.52225/narra.v4i1.532 |
| [10] | Liang HF, Ding XF, Li LF, et al. Association of preadmission metformin use and mortality in patients with sepsis and diabetes mellitus: a systematic review and meta-analysis of cohort studies[J]. Crit Care, 2019, 23(1): 50. DOI:10.1186/s13054-019-2346-4 |
| [11] | van Vught LA, Scicluna BP, Hoogendijk AJ, et al. Association of diabetes and diabetes treatment with the host response in critically ill sepsis patients[J]. Crit Care, 2016, 20(1): 252. DOI:10.1186/s13054-016-1429-8 |
| [12] | 印明珠, 孙明, 燕宪亮. 血栓弹力图凝血功能与平均血小板体积/血小板计数比值的联合监测对脓毒症患者预后的评估[J]. 中华急诊医学杂志, 2022, 31(10): 1347-1352. DOI:10.3760/cma.j.issn.1671-0282.2022.10.009 |
| [13] | 刘辉, 童森, 姚咏明. 脓毒症异质性研究与现状[J]. 中华急诊医学杂志, 2025, 34(2): 129-132. DOI:10.3760/cma.j.issn.1671-0282.2025.02.001 |
| [14] | Shald EA, Erdman MJ, Ferreira JA. Impact of clinical sepsis phenotypes on mortality and fluid status in critically ill patients[J]. Shock, 2022, 57(1): 57-62. DOI:10.1097/SHK.0000000000001864 |
| [15] | 刘梦婷, 钟文宏, 文茵, 等. PCT/PLT比值对脓毒症心肌损伤的预警价值[J]. 中华急诊医学杂志, 2022, 31(8): 1071-1076. DOI:10.3760/cma.j.issn.1671-0282.2022.08.010 |
| [16] | 李壮丽, 李跃东, 苑俊, 等. 重症监护病房内急性胰腺炎并发脓毒症的风险[J]. 中华急诊医学杂志, 2024, 33(10): 1390-1397. DOI:10.3760/cma.j.issn.1671-0282.2024.10.008 |
| [17] | Yan FJ, Chen XH, Quan XQ, et al. Association between the stress hyperglycemia ratio and 28-day all-cause mortality in critically ill patients with sepsis: a retrospective cohort study and predictive model establishment based on machine learning[J]. Cardiovasc Diabetol, 2024, 23(1): 163. DOI:10.1186/s12933-024-02265-4 |
| [18] | Wong A, Otles E, Donnelly JP, et al. External validation of a widely implemented proprietary sepsis prediction model in hospitalized patients[J]. JAMA Intern Med, 2021, 181(8): 1065-1070. DOI:10.1001/jamainternmed.2021.2626 |
| [19] | Zhou S, Lu Z, Liu Y, et al. Interpretable machine learning model for early prediction of 28-day mortality in ICU patients with sepsis-induced coagulopathy: development and validation[J]. Eur J Med Res, 2024, 29(1): 14. DOI:10.1186/s40001-023-01593-7 |
| [20] | Rahman MS, Islam KR, Prithula J, et al. Machine learning-based prognostic model for 30-day mortality prediction in Sepsis-3[J]. BMC Med Inform Decis Mak, 2024, 24(1): 249. DOI:10.1186/s12911-024-02655-4 |
| [21] | Zhang Y, Hu JJ, Hua TF, et al. Development of a machine learning-based prediction model for sepsis-associated delirium in the intensive care unit[J]. Sci Rep, 2023, 13(1): 12697. DOI:10.1038/s41598-023-38650-4 |
| [22] | Hou NZ, Li MZ, He L, et al. Predicting 30-days mortality for MIMIC-Ⅲ patients with sepsis-3: a machine learning approach using XGboost[J]. J Transl Med, 2020, 18(1): 462. DOI:10.1186/s12967-020-02620-5 |
| [23] | Zhang LM, Huang T, Xu FS, et al. Prediction of prognosis in elderly patients with sepsis based on machine learning (random survival forest)[J]. BMC Emerg Med, 2022, 22(1): 26. DOI:10.1186/s12873-022-00582-z |
| [24] | Meng H, Guo L, Pan YC, et al. Machine learning based clinical prediction model for 1-year mortality in Sepsis patients with atrial fibrillation[J]. Heliyon, 2024, 10(21): e38730. DOI:10.1016/j.heliyon.2024.e38730 |
| [25] | Zheng YX, Wang JP, Ling ZY, et al. A diagnostic model for sepsis-induced acute lung injury using a consensus machine learning approach and its therapeutic implications[J]. J Transl Med, 2023, 21(1): 620. DOI:10.1186/s12967-023-04499-4 |
| [26] | Zhang Y, Xu WW, Yang P, et al. Machine learning for the prediction of sepsis-related death: a systematic review and meta-analysis[J]. BMC Med Inform Decis Mak, 2023, 23(1): 283. DOI:10.1186/s12911-023-02383-1.=105 |
| [27] | 李志华, 成慧昕, 王毅, 等. 白蛋白/纤维蛋白原比值对脓毒症患者28 d死亡风险预测[J]. 中华急诊医学杂志, 2023, 33(2): 180-185. DOI:10.3760/cma.j.issn.1671-0282.2023.02.009 |
| [28] | 陈文胜, 杨巧云, 俞建峰, 等. 早期乳酸/前白蛋白比值对脓毒症相关性肝损伤的预测价值分析[J]. 中华急诊医学杂志, 2024, 33(11): 1559-1565. DOI:10.3760/cma.j.issn.1671-0282.2024.11.015 |
| [29] | 谢政, 金晶, 刘东松, 等. 基于监督机器学习算法构建脓毒性休克患者死亡风险的预测模型[J]. 中华危重病急救医学, 2024, 36(04): 345-352. DOI:10.3760/cma.j.cn121430-20230930-00832 |
 2025, Vol. 34
2025, Vol. 34