手足口病是由20多种病毒引起的、在全球不同地区多次流行的常见传染病。近年在我国流行且引起重症及死亡的绝大多数为肠道病毒71型(enterovirus 71,EV71)C4亚型所致手足口病,主要临床特征为发热,手、足、口、臀部出现疱疹样皮疹,重症者可出现神经系统症状,少数病例可迅速发展为重症危重型,出现肺出血、心肺功能衰竭所致的顽固性休克及脑功能衰竭。EV71所致手足口病正持续威胁我国低年龄儿童的健康和生命安全。
1 手足口病流行概况
1969年美国科学家首次分离出EV71病毒[1]。此后美国、澳大利亚、保加利亚、匈牙利、新加坡、日本、马来西亚、及我国台湾地区[2, 3, 4]均发生EV71所致手足口病流行。其中有几次较大规模暴发流行,1975年,保加利亚出现705例手足口病患儿,其中149例患儿为重症手足口病,出现弛缓性瘫痪,死亡44例;1978年匈牙利有45例患儿死于EV71感染;1997年马来西亚出现EV71流行,39例重症手足口病患儿出现脊髓灰质炎样麻痹或无菌性脑膜炎,30多例死亡;1998年我国台湾地区出现EV71手足口病大流行,30多万人致病,合并神经系统症状的重症患儿405例,死亡78例。
2008年安徽阜阳爆发肠道病毒71型手足口病疫情以来,我国各地相继爆发了严重的手足口病疫情,安徽、河南、山东、广西、云南、江苏先后成为手足口病重灾区。据不完全统计,2008年至2013年,我国大陆地区已有900余万儿童罹患该病,2 700余例患儿死亡,构成了我国近数十年来最大的儿童公共卫生突发事件[5](图 1,图 2)。
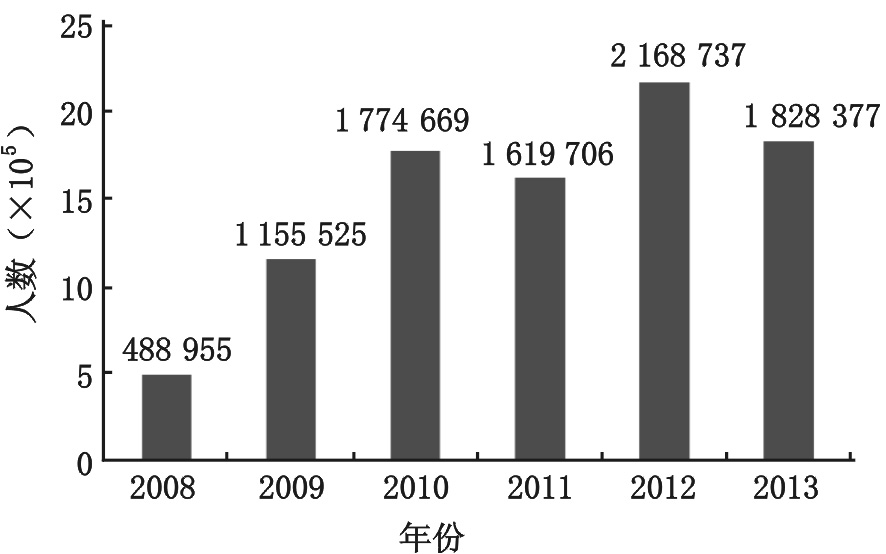 |
| 图 1 2008-2013年中国大陆手足口病发病人数 |
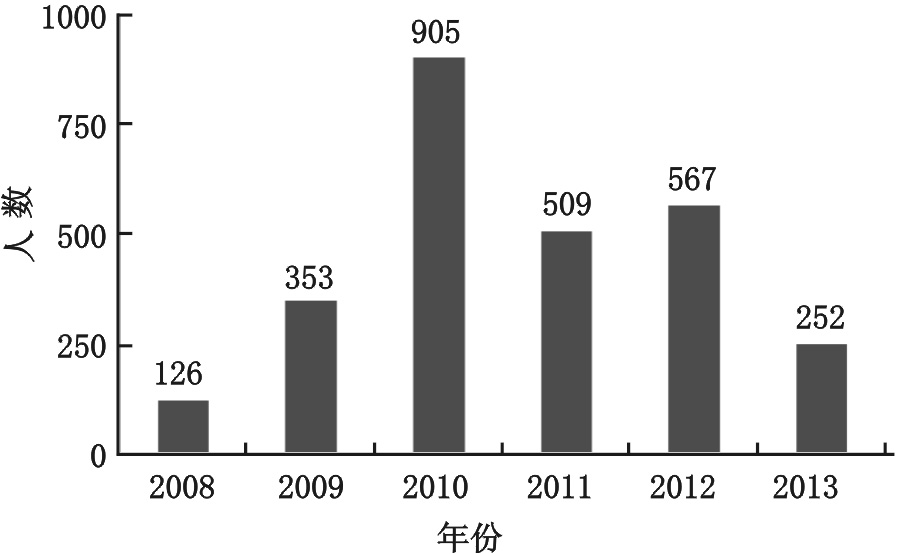 |
| 图 2 2008-2013年中国大陆手足口病死亡人数 |
在地域特征上,中国EV71所致手足口病尤其是重症手足口病流行区域分为两大块,安徽、河南、山东、江苏四省交界及临近区域是目前中国大陆发病病例数最多的区域,这一区域历来即为手足口病高发区。广东、广西、湖南、江西是国内发病数另一个较为集中的区域。
2012年,我国手足口病为流行的最高峰,此后手足口病有下降趋势,但仍呈局部高发态势。以南京儿童医院为例,近三年手足口病就诊人数、重症患儿数、死亡人数均有增加趋势(图 3),去年手足口病门诊人次达到12 351人次,手足口病门诊人次、重症手足口病住院人次均为历史新高。研究、探讨手足口病尤其是重症手足口病的发生发展机制与救治策略,降低病死率与病残率,已成为每一位儿科医师的重要任务。
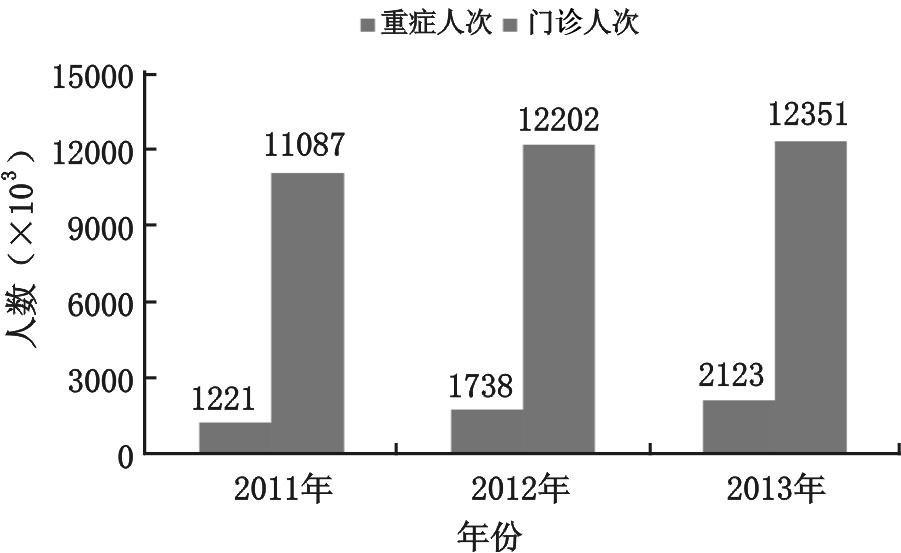 |
| 图 3 南京儿童医院近三年手足口病门诊人次及重症手足口病收治人次 |
由于EV71所致手足口病的现实威胁及广泛流行,几十年来,临床医师、研究者一直在探索重症手足口病的发生发展机制及临床救治策略。科学家们对重症手足口病的发病机制提出了许多假说,试图解释重症手足口病患儿临终前出现的危重征象,但一直无法完整系统地解答重症手足口病的发病机制,对其救治亦无有效措施,以致造成一些国家和地区的病死率高达20%以上,但是近两年出现一些重要进展。具体表现在以下几个方面。
病毒结构的研究。2012年,美国普渡大学研究小组在Science发布了他们的研究发现,他们发现EV71病毒结构与其他肠道病毒类似,EV71病毒表面有一个峡谷样结构,但EV71病毒表面的峡谷结构更表浅[6]。
几乎与美国普渡大学同时,我国饶子和院士及其团队在Nature公布其在手足口病病毒结构方面的重大发现[7]。研究人员利用X射线衍射晶体分析技术确定了EV71病毒的精确结构。EV71病毒有两种结构,一种是实心结构,另一种是空心结构。其中只有实心结构的病毒颗粒才会与人体细胞结合,在人体中复制,对人体产生危害。空心病毒颗粒是实心病毒颗粒的一个发展阶段,其体积比实心病毒颗粒要大4%左右,表面分布着90个规则小孔洞,病毒的基因可能通过这些孔洞出来,然后进入人体细胞内。研究还发现EV71与其他相关肠道病毒例如脊髓灰质炎病毒具有的一些相似特征,他们发现EV71具有一种通常定位在病毒保护壳口袋内的一种称为“口袋因子”的分子在EV71病毒中部分暴露出来。“口袋因子”可维持并调节病毒颗粒稳定性,口袋因子亦是抗病毒药物的结合点[7]。该研究首次揭示了手足口病病毒EV71的结构,为研究人员开发出治疗手足口病的化合物提供了重要的研究数据。
病毒传播机制的研究。在临床中,几乎所有重症手足口病患儿脑脊液检查均显示细胞数增高,但极少患儿能从脑脊液中分离出EV71病毒,这些一直困扰着临床医师,EV71所致病毒性脑膜脑炎究竟是病毒感染所致还是免疫反应所致。有研究者通过动物实验发现EV71病毒传播大脑并非通过血液而是通过逆向轴突传播,他们给小鼠口服EV71,发现EV71首先在小肠复制,然后形成病毒血症,此后相继在胸髓、颈髓、最后在脑干发现EV71的VP1抗原[8]。逆向轴突传播可能是EV71病毒在体内传播的主要机制。
神经源性肺水肿机制的认识。EV71所致手足口病危重症其特征性表现为肺出血或神经源性肺水肿(neurogenic pulmonary edema,NPE)、脑干脑炎及休克。其肺出血机制迄今研究不多。针对EV71所致肺出血或NPE的机制研究国际上几乎没有,但针对外伤、蛛网膜下腔出血所致NPE的相关研究却很多,这些研究应有助于我们对NPE的认识。
NPE触发带。目前研究[9]认为在延髓区域有一个NPE触发带,它涵盖迷走神经背核、网状核内侧区的延髓部分、延髓头端腹外侧、A1-A5区神经元、延髓孤束核等区域。延髓两侧受损可引起严重的肺水肿。刺激这些区域可引起血压增高、心率减慢及肺水肿肺出血。这些与EV71所致手足口病合并NPE相似,但不完全一样,例如EV71所致手足口病出现NPE时多以肺出血为主,在出现肺出血前其心率多增快,且心率极快。这两点与脑外伤引起的NPE不一样,但尚无报道脑干的某一区域受损后可同时引起心率增快、血压增高及NPE。
NPE相关理论。神经-心脏NPE理论[10],NPE一直被认为是非心源性肺水肿,但临床发现至少有一部分病患在神经源性损害时出现直接心肌损伤且发展为肺水肿,有临床医师发现既往无心脏病的NPE患者心肌酶谱轻度增高、节段性心室壁运动异常、心电图异常、肺动脉楔压增高。推测神经源性损害后引起大量交感神经释放,儿茶酚胺直接损害心肌细胞,引起肺水肿。
神经-血液动力学性NPE理论[11]。该理论推定出现神经源性损害时,全身动脉血压及肺动脉压增高,影响了心脏室壁顺应性,引起NPE。有学者将血凝素注入动物犬枕大池后发现,随着交感兴奋上冲,左室已达到衰竭负荷,不能有效对抗全身血管阻力泵出血液。结果发生了血液从高阻力的全身循环转移至低阻力的肺循环,产生静水压增高型肺水肿。同时左房及肺静脉内径增大,这亦佐证了该理论的可行性。此实验已为其他学者所重复证实。
“冲击伤”理论。前述两理论共同的推定均为神经源性肺水肿是静水压增高型肺水肿。可事实上许多患者在其肺泡液中发现含有红细胞及蛋白。而肺泡液中出现红细胞及蛋白说明肺泡毛细血管屏障破坏,这样就需要一种理论能同时解释静水压增高型肺水肿及蛋白渗出型肺水肿。于是Theodore和Robin[12]提出“冲击伤”理论。
该理论假定,在出现儿茶酚胺风暴后,全身血压及肺动脉压突然急剧增高,导致血液由全身循环向低阻力的肺循环转移。该理论进一步推定毛细血管压力的急剧增高,导致一定程度的气压伤,损伤肺泡毛细血管屏障。肺血管内皮的结构性损伤最终导致血管渗漏,出现持续富含蛋白肺水肿。根据“冲击伤”理论,NPE是两种机制共同作用的结果:静水压增高及肺血管内皮损伤。有研究证实当犬神经源性损害致肺动脉压力急剧增高超过70 mmHg(1 mmHg=0.133 kPa)时,出现肺气压伤及毛细血管通透性增高。
“冲击伤”理论的特点在于“冲击”,其含义是儿茶酚胺风暴后的全身循环及肺循环压力的急剧增高可能是很短时间,可能在临床上根本监测不到,可能血压及肺动脉压力很快恢复正常。但这种急剧增高对肺血管内皮形成“冲击”性损害是持久的,形成内皮损伤和血管渗漏。曾有病例报告一例颅内出血的成年患者其血压急剧增高到410/200 mmHg(1 mmHg=0.133 kPa),其平均肺动脉压增高到48 mmHg,持续仅4 min,接着出现血氧水平急剧下降,72 h后胸片仍未正常[13]。笔者在临床上也曾遇到类似病例。
肺静脉肾上腺能高反应性[14]。上述理论仍不能解释一些患者有血压增高但无NPE,另一些患者有NPE无血压增高及左心房受累,故有学者提出了肺静脉肾上腺能高反应性理论,即神经源性损害引起交感神经介质释放风暴,直接作用于肺血管床,进而产生肺水肿。这一理论的特点是肺水肿的出现与全身循环压力无关。肺血管床含有α及β肾上腺能受体,可以合理地解释神经诱导的血管内皮完整性破坏。
具有潜在临床价值的技术与药物。
麻醉[9]。有研究证实如果给予动物麻醉,可使模型动物避免出现NPE。美国医师亦发现越南战争时伤兵若单纯出现颅脑外伤可出现NPE,若同时出现颅脑外伤及脊髓损伤则不会出现NPE。说明当脊髓通路因麻醉或损伤而不发挥功能时,不会出现NPE,亦说明交感兴奋儿茶酚胺释放可能以颈髓为通道发挥作用。但是否能将麻醉这一外科手段用于手足口病的临床急救,目前尚无研究证实,在临床中我们很难断定某一位正处于儿茶酚胺风暴期并给予紧急麻醉,在伦理上亦很难将每一位有潜在肺出血风险的患儿先给予麻醉,即使这样做,很难获得家长认可,麻醉本身的风险亦足以使我们放弃这一选择。但是,这是一个有用的选项,我们在万不得已时可能会这样做,它有待我们的临床研究去探索求证。
内源性一氧化氮[15]。有研究发现若延髓头端腹外侧(rostral ventrolateral medulla,RVLM)暴露于内源性一氧化氮,可避免出现纤维素(fibrin)诱导的NPE。内源性一氧化氮的主要作用是抑制交感介质释放。关于内源性一氧化氮可以扩张肺血管,维持通气血流比例的平衡,有研究认为其亦可降低全身血管的紧张度,改善神经损伤后的心率减慢。但在临床上是否可以应用外源性NO救治手足口病,迄今尚无研究。
纳络酮[16]。内源性阿片样物质,如内啡呔可增加肺血管渗透性及颅压增高动物的血管外肺水,这种作用可为纳络酮所拮抗。在研究中亦发现纳络酮对NPE发展有抑制性保护作用。临床中亦未有研究报告将其运用于手足口病。
血容量再分布。NPE时静脉回流增加、中央大血管血容量增大。有学者认为其机制在于全身血管收缩时,血液从内脏血管流向肺循环。为验证此假说,有研究从在NPE造模时从体内抽去15%的血液,发现可成功阻止NPE的发生。这一研究从一个侧面说明目前手足口病采取的强脱水策略是正确的,手足口病采取强脱水其本意在于降低颅内压,其实它也降低了体循环血容量,减轻了肺循环负担,避免了肺循环过负荷。有学者认为高剂量异氟醚麻醉之所以能阻止肺水肿发生[17],是因为麻醉可能扩张肠系膜血管增加了内脏血管床的容量,减少了内脏血流向肺循环的流动,避免了肺循环的过负荷[18]。
其他药物。有学者认为阿托品在颅脑外伤患者可以升高降低的心率,阻断NPE的发生,但亦有学者反对,认为无须心率降低即可出现NPE,因而用不用阿托品不重要[9]。在危重症手足口病,小儿最多的表现为血压增高伴心率急剧增快。用阿托品显然不合适。这也从另一个侧面说明,尽管手足口病神经源性损害与颅脑外伤相似,但仍有不同的地方。最大的不同就是颅脑外伤及其他神经损害所致的NPE均表现为心率下降,而手足口病则表现为心率上升,是否是EV71侵犯脑干的部位有细微差异导致不同的反应,值得去研究探讨。
α受体阻滞剂。从理论上讲,硝普钠[19]、酚妥拉明[20]可阻断α受体,减少儿茶酚胺的释放,是一个理想的药物,在颅脑外伤等疾患引起的神经源性肺水肿中有一定作用。但在手足口病临床实践上,虽有报道说它有效,但临床应用效果不一致,且用硝普钠时多与肾上腺素及去甲肾上腺素合用,其扩血管作用本身即被抵销。至于其效果如何,需要我们去组织多中心临床研究来探讨其可能价值。
米力农。米力农[21]是目前临床验证的确有疗效的药物。它是一个磷酸二酯酶Ⅲ抑制剂,具有负性心率、强心、扩张冠状动脉的作用,目前已广泛应用于手足口病临床,其应用时需注意须先给予负荷量,然后给予维持量。
重症手足口病临床研究面临的问题与救治困境据不完全统计,截止到2014年2月16日,经pubmed检索,以手足口病作为临床和实验研究的论文约有1 128篇,大多为临床流行病学、临床特征及临床治疗的观察性、描述性研究,只有23篇为临床试验,23篇中仅有4篇为临床对照研究,在这4篇临床对照研究中,有2篇针对普通手足口病,1篇针对手足口病疫苗,仅有1篇临床对照研究针对重症手足口病,为我国台湾地区学者进行的米力农救治手足口病合并肺水肿的历史性对照研究。由此可见,尽管临床医师进行了不懈的努力,但由于缺少规范的临床研究,目前重症手足口病的救治多依赖于缺乏循证医学证据的指南及专家共识,对临床医师最关注的临终前肺出血、顽固性休克及脑功能衰竭鲜有建议方案,均依赖于儿科医师各自为战的摸索。
重症手足口病起病隐匿急骤,变化迅捷,从正常转为危重多在倾刻之间,危重者多于几小时到数天内死亡。根据国家CDC对2 457例手足口病死亡病例统计,患儿从诊断为手足口病到死亡的时间平均为0.5 d,从起病到死亡时间平均为3.5 d[5]。即儿科临床医师一旦确认手足口病诊断后,重症患儿多救治不及即死亡或患儿在转运上级医院途中即死亡,这就使得针对重症手足口病尤其是危重症手足口病的临床干预研究很难建立;这也能解释欧洲及中国台湾地区手足口病虽曾暴发流行,却为何缺乏有价值的临床研究。可能原因在于他们无法获得具有统计学力度的样本,无法进行有效的临床研究。
我国拥有全球最多的重症手足口病临床病例,从图 1、图 2可以看出,EV71在我国的流行将为长期趋势,我国EV71患儿临床病例数比全球临床病例总和还要多。我们有着任何一个国家和地区不具有的临床研究优势,我们有理由在手足口病救治方面作出更大的、独特的贡献。
3 手足口病疫苗,新的曙光
自2008年安徽阜阳手足口病暴发,迄今已有7年,从那时起,我国即启动了疫苗研制,目前国内已有三家公司完成了EV71灭活疫苗的三期临床试验[22, 23, 24],三期临床试验已经证明疫苗具有良好的安全性和有效性,三家公司疫苗均可预防90%以上的EV71所致手足口病和80%以上EV71相关疾病。目前正在进行四期临床试验,相信不久的将来,手足口病暴发流行的态势在中国将成为历史,我们有理由期待这一天的到来。
| [1] | Bible JM, Pantelidis P, Chan PK, et al. Genetic evolution of enterovirus 71: epidemiological and pathological implications[J]. Rev Med Virol, 2007,17(6):371-379. |
| [2] | Lin TY, Twu SJ, Ho MS, et al. Enterovirus 71 outbreaks, Taiwan: occurrence and recognition[J]. Emerg Infect Dis, 2003, 9(3):291-293. |
| [3] | Huang CC, Liu CC, Chang YC, et al, Neurologic complications in children with enterovirus 71 infection[J]. N Engl J Med, 1999, 341(13): 936-942. |
| [4] | World Health Organization, Western Pacific Region. A Guide to Clinical Management and Public Health Response for Hand, Foot and Mouth Disease (HFMD)[N/OL]. http://www.wpro.who.in/emerging_diseases/documents/HFMDGuidance/en |
| [5] | Xin WX, Liao QH, Viboud C, et al. Hand, foot, and mouth disease in China, 2008-12:an epidemiological study[J]. Lancet Infect Dis, 2014, 14 (4) : 308-318. |
| [6] | Plevka P, Perera R, Cardosa J, et al. Crystal structure of human enterovirus 71[J]. Science, 2012, 336(6086):1274. |
| [7] | Wang, X, Peng W, Ren J, et al. Sensor - adaptor mechanism for enterovirus uncoating from structures of EV71[J]. Nat Struct Mol Biol, 2012, 19(4):424-429. |
| [8] | Chen CS, Yao YC, Lin SC, et al. Retrograde axonal transport: a major transmission route of enterovirus 71 in mice[J]. J Virol, 2007,81(17):8996-9003. |
| [9] | ed J,Kune J,Zicha J. Pathogenetic mechanisms of neurogenic pulmonary edema[J]. J Neurotrauma, 2014 Dec 13.[Epub ahead of print]. |
| [10] | Mayer SA, Lin J, Homma S, et al. Myocardial injury and left ventricular performance after subarachnoid hemorrhage[J]. Stroke, 1999, 30(4):780-786. |
| [11] | Sarnoff SJ, Sarnoff LC. Neurohemodynamics of pulmonary edema. II. The role of sympathetic pathways in the elevation of pulmonary and systemic vascular pressures following the intracisternal injection of fibrin[J]. Circulation, 1952, 6(1):51-62. |
| [12] | Theodore J, Robin ED. Speculations on neurogenic pulmonary edema(NPE)[J]. Am Rev Respir Dis, 1976, 113(4):405-411. |
| [13] | Wray NP, Ni‘cotra MB. Pathogenesis of neurogenic pulmonary edema[J]. Am Rev Respir Dis, 1978, 118(4):783-786. |
| [14] | McClellan MD, Dauber IM, Weil JV. Elevated intracranial pressure increases pulmonary vascular permeability to protein[J]. J Appl Physiol, 1989, 67(3):1185-1191. |
| [15] | Shinohara K, Hirooka Y, Kishi T, et al. Reduction of nitric oxide-mediated γ-amino butyric acid release in rostral ventrolateral medulla is involved in superoxide-induced sympathoexcitation of hypertensive rats[J]. Circ J, 2012, 76(12):2814-2821. |
| [16] | Peterson BT, Ross JC, Brigham KL. Effect of naloxone on the pulmonary vascular responses to graded levels of intracranial hypertension in anesthetized sheep[J]. Am Rev Respir Dis, 1983, 128(6): 1024-1029. |
| [17] | ed J, Zicha J, Kune J, et al. The role of nitric oxide in the development of neurogenic pulmonary edema in spinal cord injured rats: the effect of preventive interventions[J]. Am J Physiol Regul Integr Comp Physiol, 2009, 297(4): R1111-R1117. |
| [18] | Stekiel TA, Kokita N, Yamazaki M, et al. Effect of isoflurane on in situ smooth muscle transmembrane potential in spontaneous hypertension[J]. Anesthesiology, 1999, 91(1): 207-214. |
| [19] | 邹映雪, 傅红娜, 郭永盛, 等. 硝普钠对肠道病毒71型感染手足口病低血压期临床疗效分析[J]. 中国小儿急救医学, 2011, 18(1): 24-26. |
| [20] | Davision DL, Chawla LS, Selassie L, et al. Neurogenic pulmonary edema: successful treat with iv phentolamine[J]. Chest, 2012, 141(3): 793-795. |
| [21] | Wang SM, Lei HY, Huang MC, et al. Therapeutic efficacy of mirilone in management of enterovirus 71 induced pulmonary edema[J]. Pediatr Pulmonol, 2005, 39(3):219-223. |
| [22] | Zhu F, Xu W, Xia J, et al. Efficacy, safety and immunogenicity of an enterovirus 71 vaccine in China[J]. New Engl J Med, 2014, 370(9): 818-828. |
| [23] | Zhu FC, Meng FY, Li JX, et al. Efficacy, safety and immunology of an inactivated alum-adjuvant enterovirus 71 vaccine in children in China: a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet, 2013, 381(9882):2024-2032. |
| [24] | Li R, Liu L, Mo Z, et al. An inactivated enterovirus 71 vaccine in healthy children[J]. New Engl J Med, 2014, 370(9): 829-837. |
 2015, Vol. 24
2015, Vol. 24


