内毒素血症是现代临床危重病医学面临的棘手问题,也是导致危重症的常见原因和对预后产生严重影响的重要因素,内毒素血症患者往往因为严重感染和应激,处于一个高分解、高消耗的状态。这种能量消耗增加的高分解代谢状态和对代谢底物利用的改变共同构成了此类患者的代谢特征。蛋白质是人体三大能量物质之一,也是各种代谢活动的基础和构成人体的最重要的物质之一。蛋白质的代谢调控也是各种代谢调控中最重要之一。其中磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)通路是近年来比较受关注的一种非胰岛素依赖的能量代谢途径。AMPK通过自身的磷酸化来使下游的哺乳类动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和延伸因子2(elongation factor 2,eEF2)的磷酸化状态改变来调节蛋白的合成[1-2]。
肝脏是人体主要的蛋白合成的器官,是人体三大营养物质之一,也是重要的供能物质[3],而心脏是ATP消耗最大的地方。因此这两个器官的分子蛋白变化可以表现机体的总变化。因此本研究选取了肝脏和心脏为研究的目标,并通过Western blot的方法测定各蛋白的变化。
1 材料与方法 1.1 实验材料脂多糖(LPS):Escherichia coli 0111: B4(Sigma 公司)。LPS 溶液配置浓度:2 mg/mL。p-AMPK,p-mTOR(ser2448),p-eEF2(Thr56)抗体均购于cell-signaling公司,HRP购于联科公司。EZ-ECL购于Sigma公司
1.2 实验动物健康雄性Wistar大鼠24只,7~8 周龄,体质量200~250 g,由上海斯莱克斯公司提供。适应性饲养3 d,实验前禁食12 h,不禁水,随机分为6 h对照组,6 h实验组,24 h对照组,24 h实验组,共4组,每组6只。根据并改进Christ等[3]的内毒素血症造模方法,内毒素组给予LPS 5 mg/kg,LPS浓度为2 mL/mg采用尾静脉注射。正常对照组给予生理盐水(NS)2.5 mL/kg尾静脉注射。注射LPS 或NS 后禁食不禁水,分别于6 h,24 h后留取血标本,液氮冻存肝脏,心脏组织,并转至-80 ℃低温冰箱保存。
1.3 检测指标及方法 1.3.1 血清总蛋白、白蛋白、球蛋白测定大鼠注射LPS后,分别于6 h,24 h留取血标本,及时送检于生化室,以2 500 r/min离心5~10 min,分离后取血清,采用日立7600生化自动分析仪测定血清总蛋白、白蛋白,两者之差为球蛋白。
1.3.2 AMPK/p-AMPK、mTOR/p-mTOR(ser2448)、eEF2/p-eEF2(Thr56)蛋白表达测定[1-2, 4]取肝脏/心脏组织100 mg,加入裂解液(按照100 mg/mL比例),PMSF(1 mmol/L),放入玻璃匀浆器中充分裂解。匀浆液移入离心管,4 ℃ 12 000 g离心5 min ,取上清液即为待测蛋白,进行BCA法测定蛋白质浓度,根据浓度取相同质量已裂解的样品蛋白,并加等体积的5×电泳加样缓冲液 ,100 ℃ 沸水浴3 min,取10 μL上样,电泳(浓缩胶60 V,分离胶120 V)1 h 。 电转膜仪转膜(300 mA 40 min),转膜后用牛奶室温封闭1 h,取一抗[抗p-AMPK,抗p-mTOR(ser2448)抗体,抗p-eEF2(Thr56)抗体]1∶ 1 000稀释,将膜置于一抗4 ℃过夜,用TBST清洗,山羊抗兔过氧化辣根二抗1∶ 2 000稀释,膜置于二抗,室温孵育1 h,ECL试剂盒显色,采用Alpha Innotech Corporation & Analysis system凝胶成像系统进行检测,并用Labworks软件对各阳性条带的密度进行测定,并进行分析比较记录。
1.4 统计学方法采用SPSS16.0 统计软件处理,计量资料结果以均数±标准差(x±s)表示,组间比较采用方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
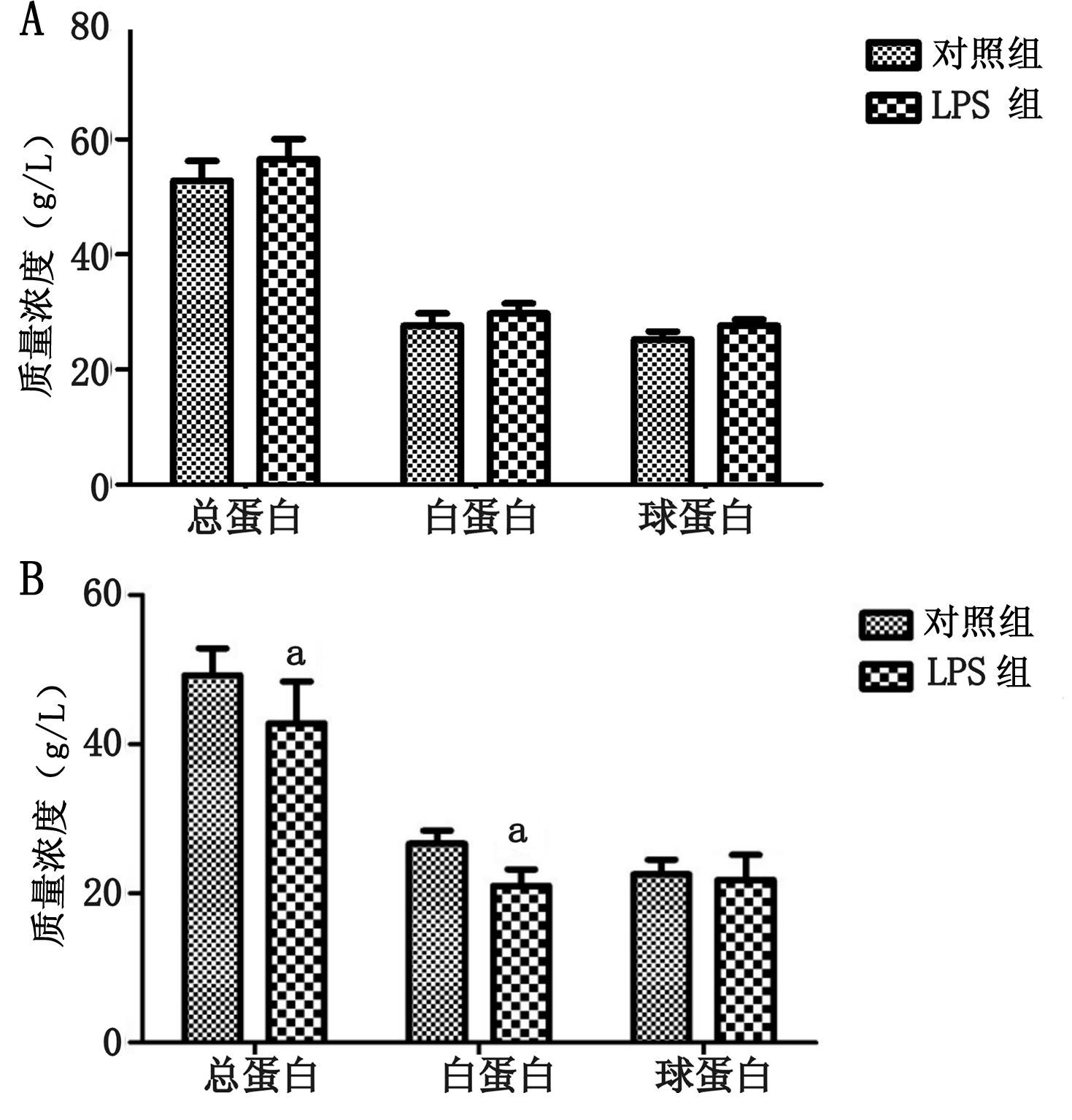
2 结果 2.1 血清总蛋白、白蛋白、球蛋白的变化大鼠注射LPS 6 h后,LPS组血清总蛋白较对照组差异无统计学意义(P>0.05);白蛋白差异无统计学意义(P>0.05); 球蛋白差异无统计学意义(P>0.05)。注射LPS 24 h后,LPS组血清总蛋白较对照组水平低(P<0.05);白蛋白水平较低(P<0.05); 球蛋白差异无统计学意义(P>0.05)。见图 1。
|
| A:注射LPS 6 h;B:注射LPS 24 h;与对照组比较,aP<0.05 图 1 注射LPS 6 h,24 h后血清总蛋白,白蛋白,球蛋白变化 |
|
|
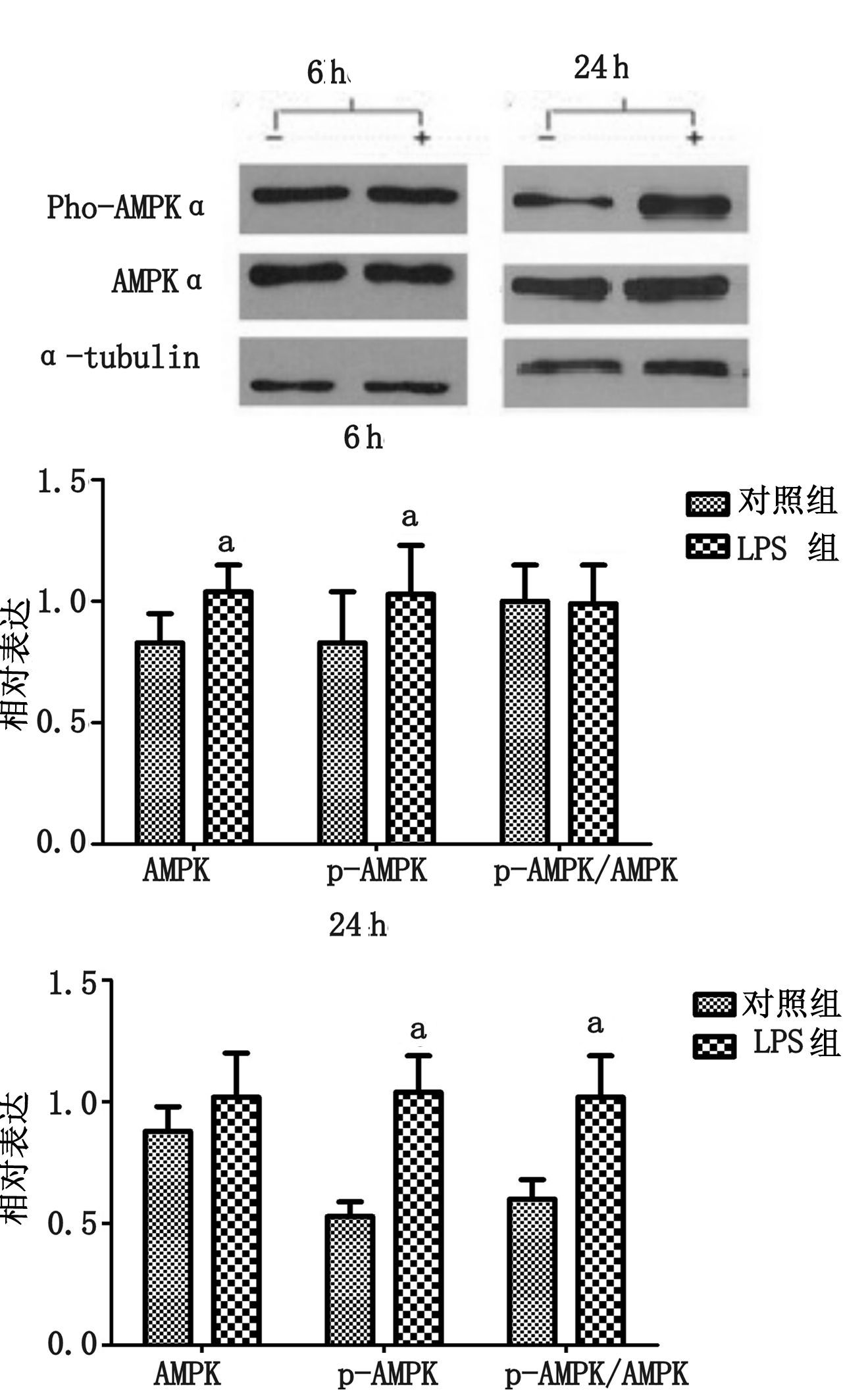
大鼠尾静脉注射LPS 6 h,使用Western blot方法显示AMPK和p-AMPK蛋白表达。AMPK比较对照组在心脏组织中有所上升(P<0.05),p-AMPK比较对照组也有所上升(P<0.05),但两者比例(p-AMPK/AMPK)差异无统计学意义(P>0.05)。
大鼠尾静脉注射LPS 24 h后,AMPK差异无统计学意义(P>0.05),p-AMPK比较对照组却有明显上升,差异具有统计学意义(P<0.05),而p-AMPK/AMPK比例比较对照组同样也明显上升,差异具有统计学意义(P<0.05),见图 2。
|
| —:对照组;+:实验组;Pho-AMPKα:磷酸化AMP激活的蛋白激酶α;AMPKα:AMP激活的蛋白激酶α;a-tublin:内参;与对照组比较,aP<0.05 图 2 注射LPS后6 h、24 h后,大鼠心脏组织中AMPK、p-AMPK、p-AMPK/AMPK的变化和westernblot表达 |
|
|
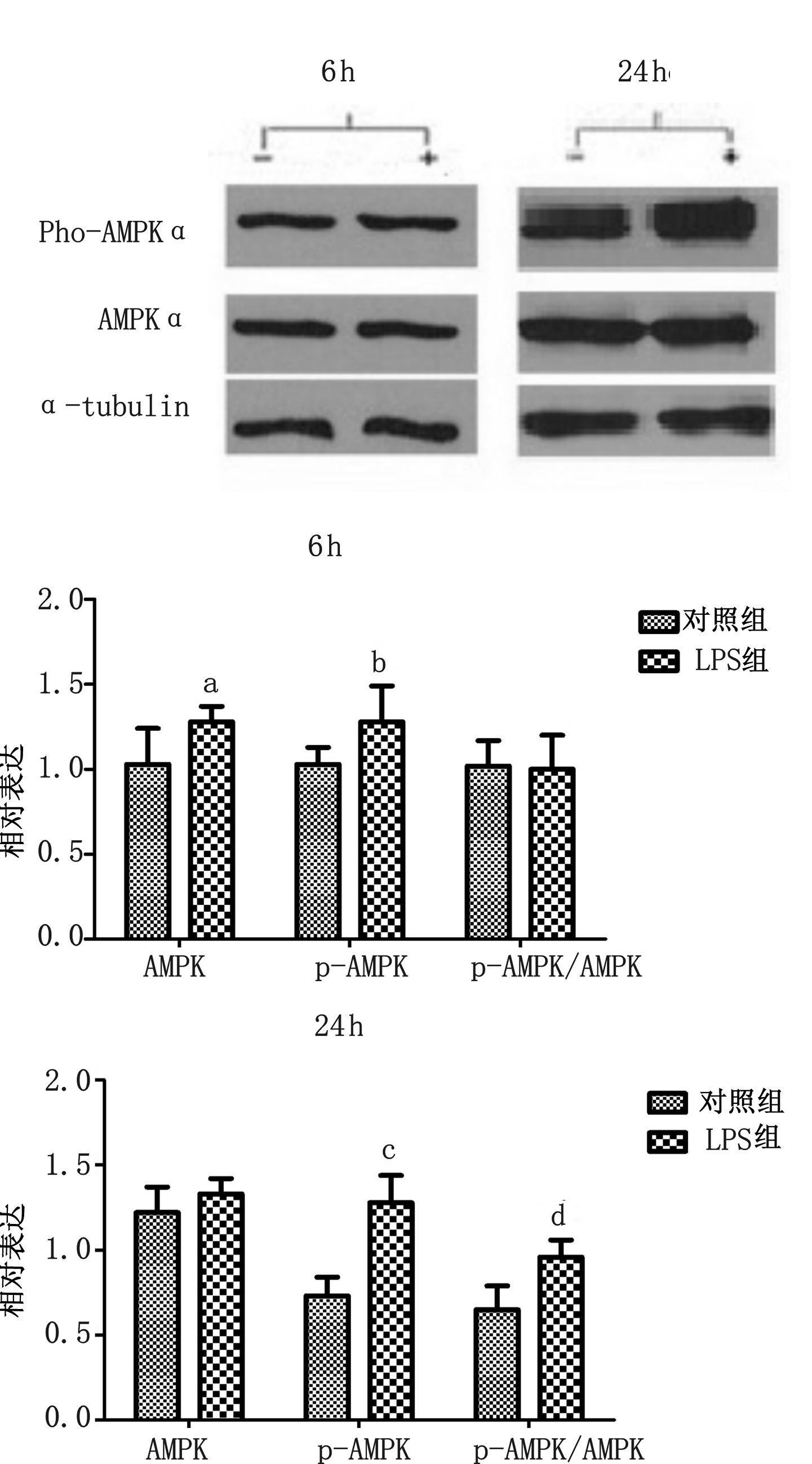
大鼠尾静脉注射LPS 6 h,使用Western blot方法显示AMPK和p-AMPK蛋白表达。AMPK比较对照组在肝脏中有所上升( P<0.05),p-AMPK比较对照组有所上升(P<0.05),但两者比例(p-AMPK/AMPK)差异无统计学意义(P>0.05)。
大鼠尾静脉注射LPS 24 h后,AMPK比较对照组差异无统计学意义(P>0.05),p-AMPK比较对照组却有明显上升,差异具有统计学意义(P<0.05),而p-AMPK/AMPK比例比较对照组同样也明显上升,差异具有统计学意义(P<0.05)。见图 3。
|
| —:对照组;+:实验组;Pho-AMPKα:磷酸化AMP激活的蛋白激酶α;AMPKα:AMP激活的蛋白激酶α;a-tublin:内参;与对照组比较,aP<0.05 图 3 注射LPS后6 h、24 h,大鼠肝脏组织中AMPK、p-AMPK、p-AMPK/AMPK的变化和Western blot表达 |
|
|
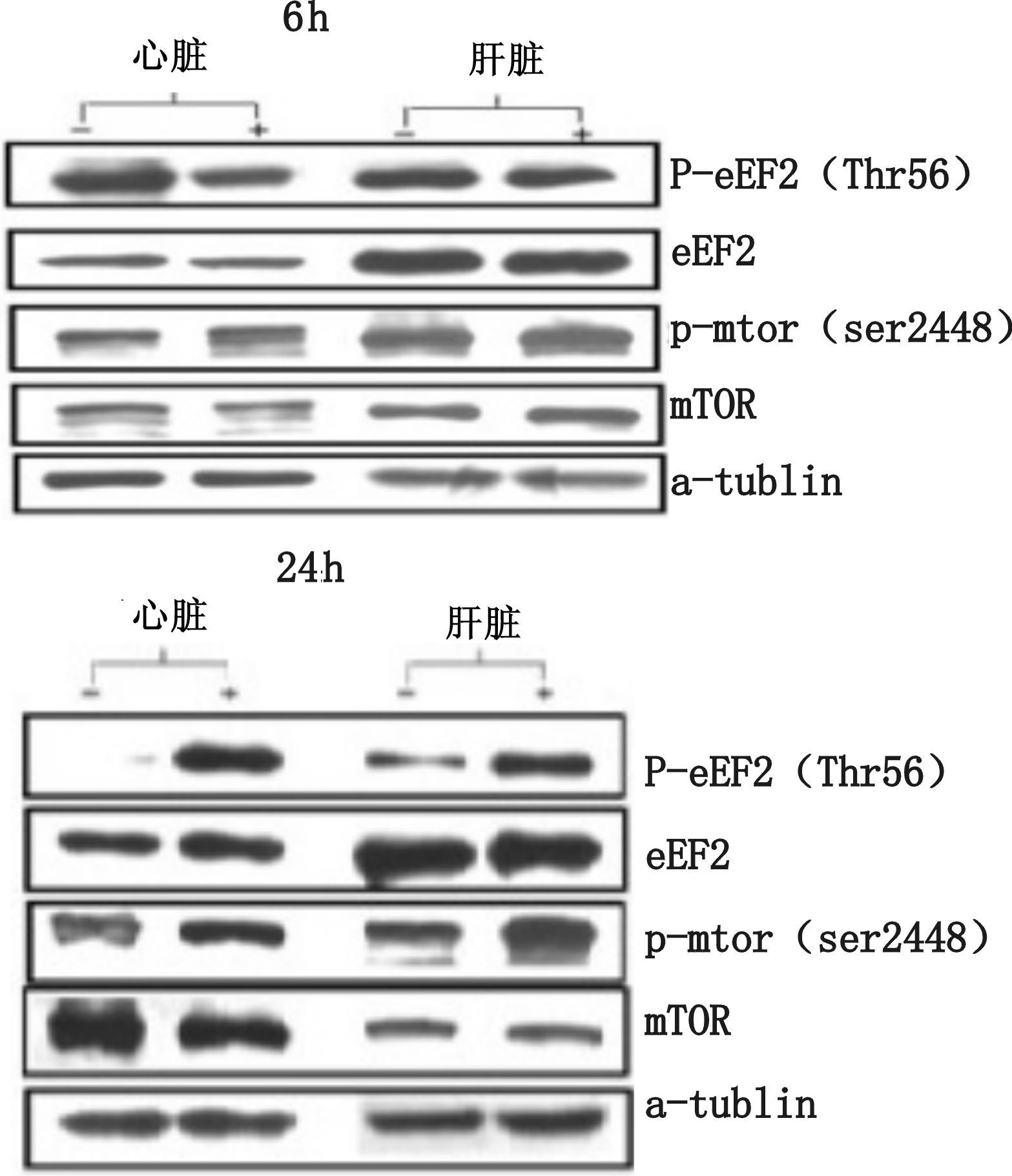
大鼠尾静脉注射LPS 6 h,24 h后,分别使用westernblot方法显示各蛋白表达见图 4。
|
| —:对照组;+:实验组;eEF2:延伸因子2;p-eEF2(Thr56):磷酸化延伸因子2;mTOR:哺乳类动物雷帕霉素靶蛋白;p-mTOR(ser2448):磷酸化哺乳类动物雷帕霉素靶蛋白;a-tublin:内参 图 4 注射LPS 6 h,24 h后各蛋白的表达 |
|
|
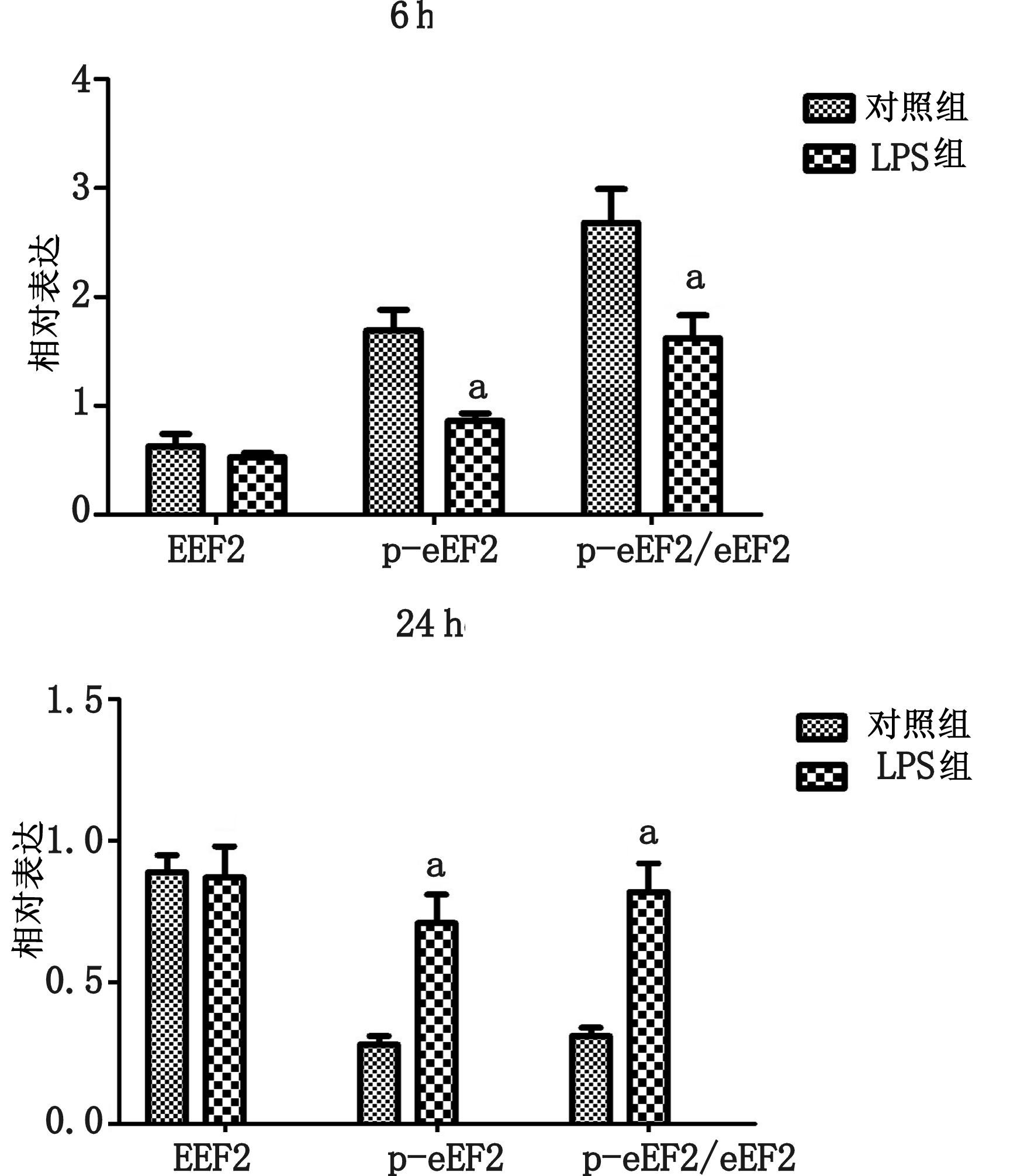
大鼠注射LPS 6 h后,在心脏组织中eEF2蛋白表达较对照组差异无统计学意义(P>0.05),磷酸化p-eEF2(Thr56)则在LPS组中表达有所减少(P<0.05)。p-eEF2(Thr56)/eEF2的比例在LPS组中明显减少,差异具有统计学意义(P<0.05)。
注射LPS 24 h后,在心脏中eEF2蛋白表达较对照组差异无统计学意义(P>0.05),磷酸化p-eEF2(Thr56)则在LPS组中表达明显升高,差异具有统计学意义( P<0.05)。p-eEF2(Thr56)/eEF2的比例在LPS组中明显升高,差异具有统计学意义(P<0.05),见图 5。
|
| 与对照组比较,aP<0.05 图 5 注射LPS 6 h,24 h后,心脏组织中eEF2、p-eEF2(Thr56)以及p-eEF2(Thr56)/eEF2比例的变化 |
|
|
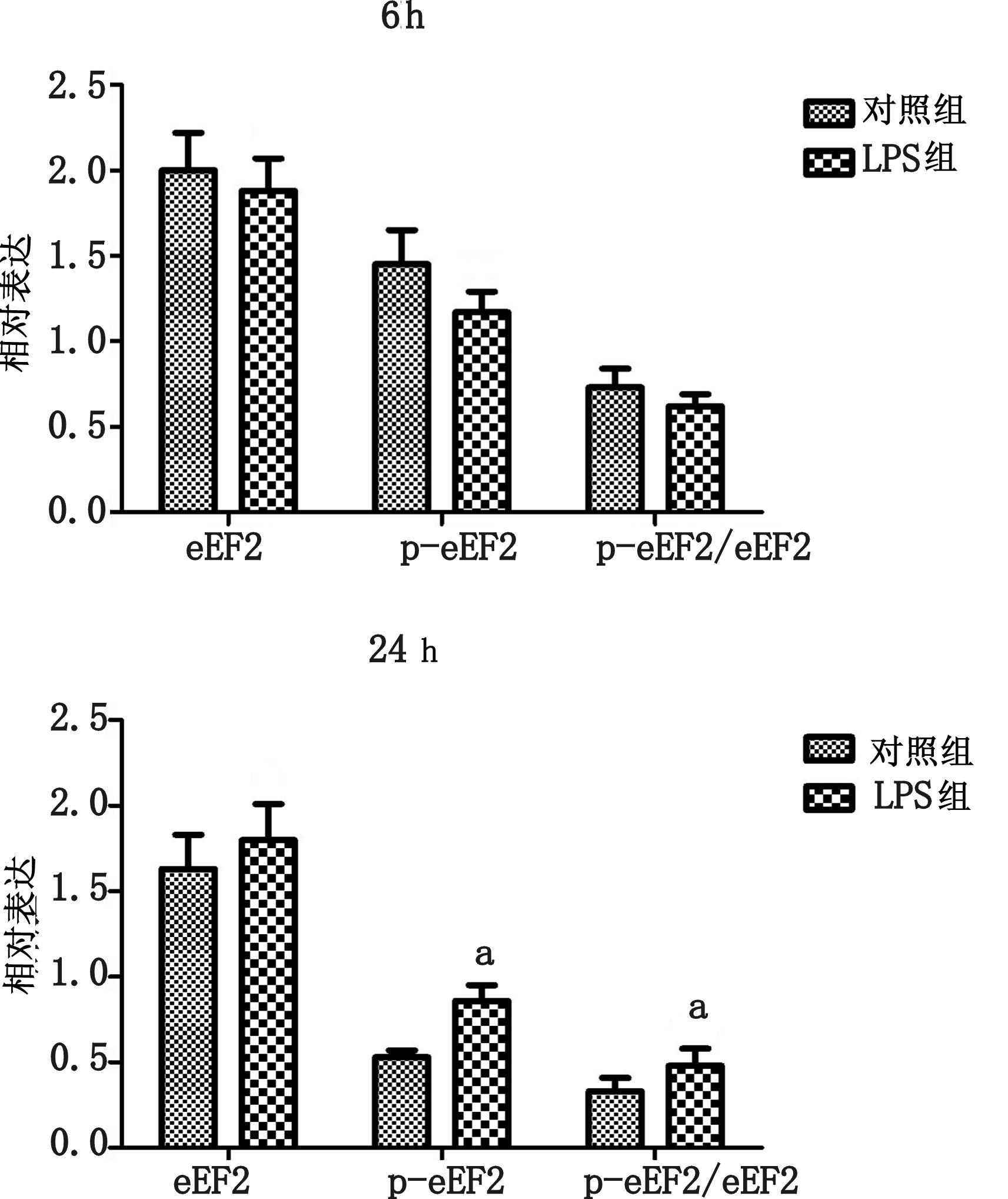
大鼠注射LPS 6 h后,在肝脏中eEF2蛋白表达较对照组差异无统计学意义(P>0.05),磷酸化p-eEF2(Thr56)则在LPS组中表达略有减少,但差异无统计学意义(P>0.05)。p-eEF2(Thr56)/eEF2的比例在LPS组中略有减少,但差异无统计学意义(P>0.05)。
注射LPS 24 h后,在肝脏中eEF2蛋白表达较对照组差异无统计学意义(P>0.05),磷酸化p-eEF2(Thr56)则在LPS组中表达明显升高,差异具有统计学意义(P<0.05)。p-eEF2(Thr56)/eEF2的比例在LPS组中明显升高,差异具有统计学意义(P<0.05),eEF2活性受到抑制。见图 6。
|
| 与对照组比较,aP<0.05 图 6 注射LPS6 h,24 h后,肝脏组织中eEF2、p-eEF2(Thr56)以及p-eEF2(Thr56)/eEF2比例的变化 |
|
|
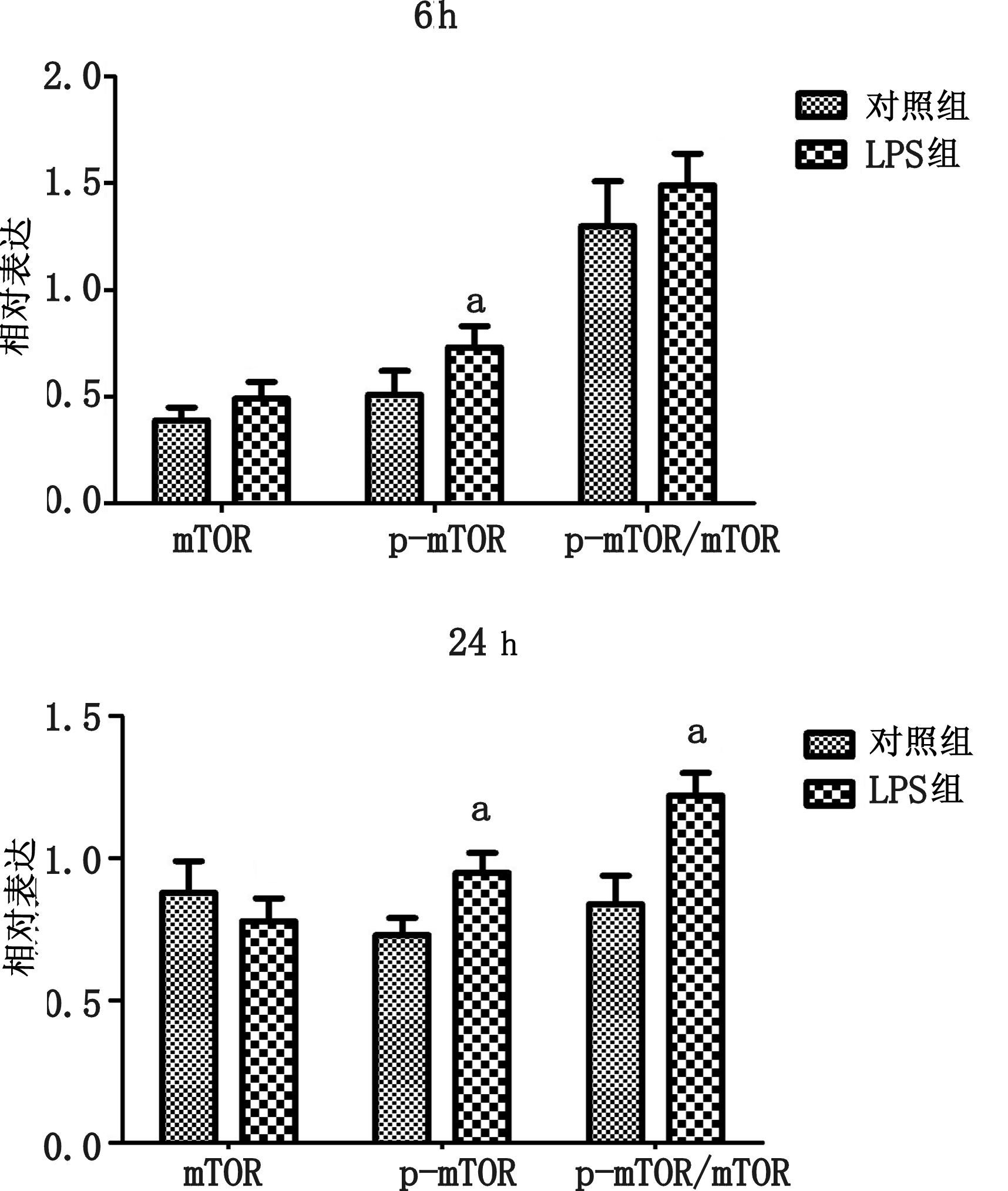
大鼠注射LPS 6 h后,在心脏组织中mTOR较对照组略有上升,但差异无统计学意义(P>0.05),磷酸化p-mTOR(ser2448)在LPS组中表达有所增加,差异具有统计学意义(P<0.05)。p-mTOR(ser2448)/mTOR比例在LPS组中虽有所增加,但差异无统计学意义(P>0.05)。
大鼠注射LPS 24 h后,在心脏组织中mTOR蛋白表达较对照组差异无统计学意义(P>0.05),磷酸化mTOR则在LPS组中表达明显升高,差异具有统计学意义(P<0.05)。p-mTOR(ser2448)/mTOR的比例在LPS组中明显升高,差异具有统计学意义(P<0.05),见图 7。
|
| 与对照组比较,aP<0.05 图 7 注射LPS6 h,24 h后,心脏组织中mTOR、p-mTOR(ser2448)以及p-mTOR(ser2448)/mTOR的变化 |
|
|
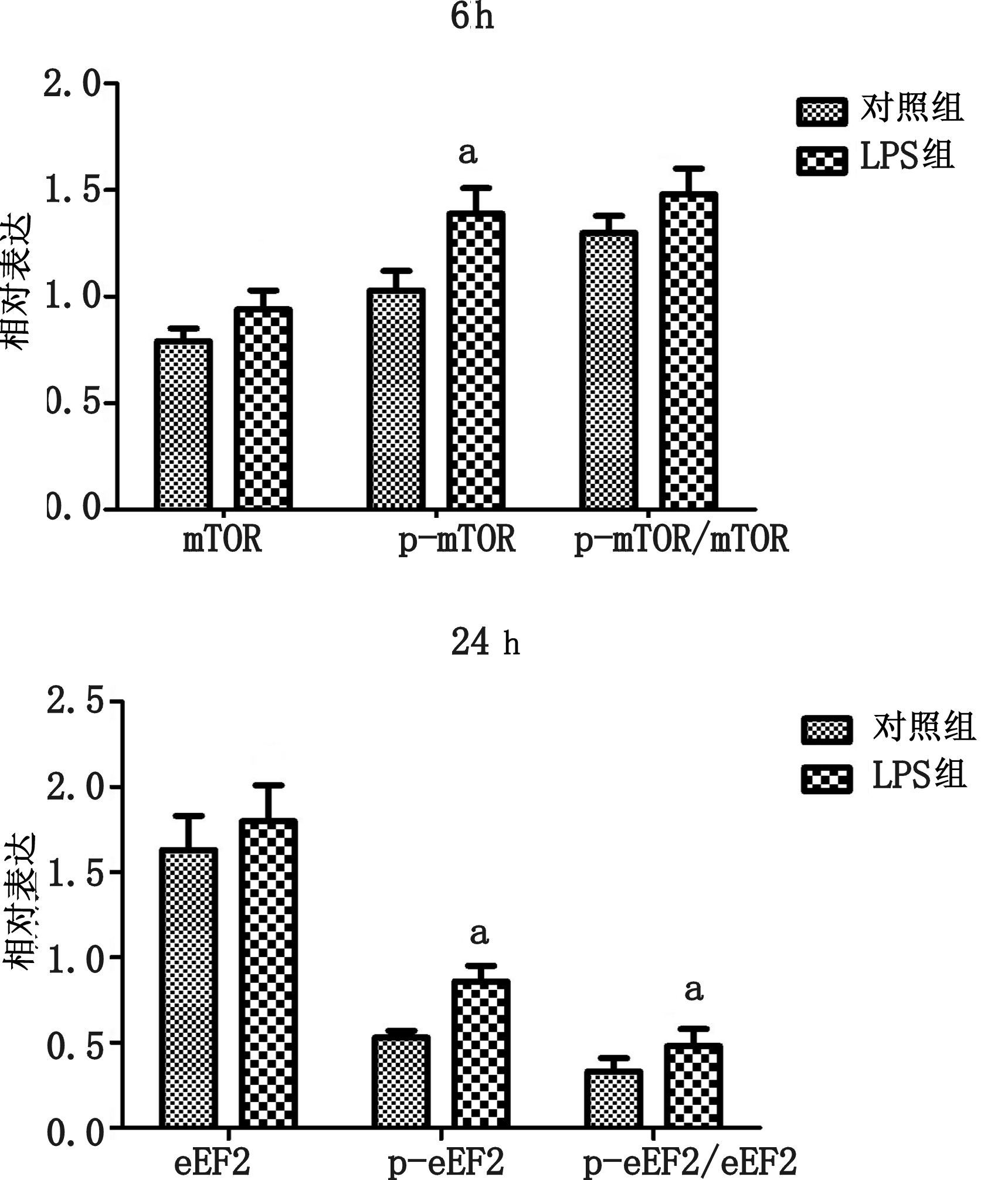
大鼠注射LPS 6 h后,在肝脏中mTOR蛋白表达较对照组略有上升,但差异无统计学意义(P>0.05),磷酸化p-mTOR(ser2448)则在LPS组中表达有所增加,差异具有统计学意义(P<0.05)。但p-mTOR(ser2448)/mTOR的比例差异无统计学意义(P>0.05)。
大鼠注射LPS 24 h后,在肝脏中mTOR蛋白表达较对照组差异无统计学意义(P>0.05),磷酸化p-mTOR(ser2448)则在LPS组中表达明显升高,差异具有统计学意义(P<0.05)。p-mTOR(ser2448)/mTOR的比例在LPS组中明显升高,差异具有统计学意义(P<0.05),见图 8。
|
| 与对照组比较,aP<0.05 图 8 注射LPS6 h,24 h后,肝脏组织中mTOR、p-mTOR(ser2448)以及p-mTOR(ser2448)/mTOR比例的变化 |
|
|
内毒素血症是ICU中常见的危重病,在内毒素血症中营养代谢往往紊乱,其调节机制尚未完全明了,其中蛋白的调节是最重要的环节之一,蛋白是人体必需的营养物质,也是组成人体各部分必不可少的部分,更是各种免疫机制的必需环节。其中AMP激活的蛋白激酶(AMPK)在蛋白调节方面的作用日趋受到关注,AMPK通过自身的磷酸化来使得下游的eEF2和mTOR蛋白的磷酸化,使蛋白合成下降。
AMPK是在进化上高度保守的蛋白质分子,广泛存在于真核生物的细胞中。由一个催化亚基 a和两个节亚基B,构成异三聚体。AMPK被称为真核细胞的“代谢感受器”,受细胞AMP/ATP的比值调控的“燃料开关”[5-6],主要功能是据机体的需能状况而调节产能和耗能(ATP的生成与消耗)代谢。AMPK 的作用主要是通过调节mTOR,eEF2,p-羟基-p-甲基-戊二酸单酰CoA还原酶(HMGR)、乙酰辅酶A羧化酶(ACC)、激素敏感脂酶(HSL)等酶活性从而改变脂肪和碳水化合物,和蛋白代谢实现的[7]。蛋白调节中AMPK既可以通过激活eEF2激酶的活性进而增加磷酸化eEF2(Thr56)来降低eEF2的活性,也可以通过mTOR通路直接或者间接磷酸化mTOR(Ser2488)来使其活性降低,来最终达到降低蛋白合成的目的。
mTOR是细胞内高度保守的Ser/Thr蛋白激酶,在促有丝分裂素及营养物质(包括氨基酸等)的存在下,促蛋白质合成,同时抑制细胞的自噬作用,在肿瘤相关中被广泛研究[8]。mTOR磷酸化调节下游作用底物,如控制蛋白转录的P70核糖体S6激酶(pTOS6)、真核启始因子4E结合蛋白1(4E-BP1)和真核起始因子4G(EIF4G)。AMPK激活后通过磷酸化mTOR的ser2448而抑制其活性,进而抑制其对p70S6激酶的活化,抑制蛋白质的合成[9]。
真核翻译延长因子2(eEF2)是一个相对分子质量为110的蛋白,相当于原核细胞中的eEF-G,是蛋白合成的一个非常重要的因素,在翻译过程中介导和催化GTP水解,使aa-tRNA从A位转移至P位,最后在mRNA中的不稳定结构重新返回,进入下一个循环。是蛋白翻译过程中的重要一环,AMPK通过磷酸化eEF2使翻译过程效率降低[10]。通过对eEF2的Thr56位点的磷酸化,来使其活性下降[11]。有研究表明,ATP耗竭时,磷酸化eEF2增加,蛋白合成受到抑制[12]。同时通过5-aminoimidazole-4-carboxamide 1-D-ribofuranoside (AICAR)来刺激AMPK的增加也增加了磷酸化eEF2的表达,并降低了蛋白的合成[13]。有进一步的研究表明在大鼠肝细胞[12]和心肌细胞中缺氧中[14],也出现了磷酸化eEF2的增加和蛋白的合成[14]。
在本实验中,LPS诱导的内毒素血症模型,p-AMPK/AMPK的比例无论在心脏还是肝脏,在6 h无明显变化,但是到24 h时有明显增加。说明在内毒素血症早期(24 h),AMPK的磷酸化增加,AMPK通路的开放,并且随着时间的增加开放逐渐增强。众所周知,在内毒素血症中,早期机体将会大量消耗ATP,AMPK通路的开放一方面降低ATP消耗,一方面降低各种营养物质的合成来进一步降低能量消耗,调节能量和营养物质的平衡。但是在内毒素血症中,随着后期病情的改善,营养的需求大大增加,但在ICU中,营养补给常常入不敷出,希望可能通过阻断AMPK通路来改变蛋白合成不足的情况。
本实验中,6 h LPS组的两种组织中AMPK磷酸化比例(p-AMPK/AMPK)较对照组无明显变化,同时6 h组中无论心脏还是肝脏mTOR磷酸化比例(p-mTOR/mTOR)比较对照组都无明显变化,同时肝脏组织中eEF2的磷酸化比例也无显著变化(p-eEF2/eEF2),这与AMPK的趋势相一致。说明AMPK通路在6 h之前并没有明显开放,并没有激活下游的mTOR的磷酸化和肝脏组织中eEF2的磷酸化增加,也没有其他通路激活这一过程。但在心脏组织中eEF2的磷酸化比例(p-eEF2/eEF2)比较对照组却有所降低,eEF2在蛋白合成的翻译延长中起了重要的作用,磷酸化的eEF2使其活性降低[11],抑制蛋白合成。在此处,p-eEF2比例的减少,抑制活性的作用减弱,使其蛋白合成活性增加。众所周知,内毒素血症早期往往人体还处于应激状态,各种免疫机制反应强烈[16],各种球蛋白是免疫蛋白的重要组成部分,短暂的蛋白合成上升与应激反应可能非常重要的关联。有研究报道在应激反应时心脏容易发生心肌肥厚来应对心输出量的增大,而其中的主要机制就是蛋白的增加[12]。此外血糖和AKT通路也能同时调控eEF2[11],因此笔者推测,此时的EF2的磷酸化比例下降可能与应激和AKT通路有关,而非受AMPK通路的调节。同时6 hLPS组的总蛋白,白蛋白及球蛋白并没有显著改变,笔者推测可能心脏eEF2磷酸化增加只局限在心脏组织,同时受到内毒素血症早期蛋白消耗的影响,最终并没有导致血清中总蛋白、白蛋白和球蛋白的变化。但相关的机制仍不明确,本实验中未涉及其他通路的研究,需要进一步探索。
24 hLPS组中,总蛋白,白蛋白,球蛋白较对照组明显降低。两种组织中p-AMPK比较对照组明显增加,总AMPK差异无统计学意义,说明AMPK的活性增加,AMPK活性的提高也表明了AMPK同路的逐渐的开放,p-mTOR比较对照组,在两种组织中都明显增加,p-mTOR/mTOR比例也明显增加,mTOR活性下调,这跟AMPK的趋势相一致。mTOR是AMPK通路蛋白调节的下游分子之一[17],AMPK可以通过直接磷酸化mTOR(ser2448)来使其活性下降进而抑制蛋白合成的通路[9],笔者考虑mTOR活性的降低与AMPK通路的开放有很大的关系。此时总蛋白及白蛋白较对照组下降与此有很大的联系。此时的p-eEF2跟6 h组比较,却出现了截然不同的结果,在两种组织中较对照组都出现明显的增加,p-eEF2/eEF2的比例也明显增加,说明eEF2的活性被大大抑制了,而AMPK可以通过激活eEF2激酶来增加p-eEF2来使其活性下降,笔者推测AMPK也可以通过eEF2通路来抑制蛋白的合成,此时总蛋白和白蛋白明显下降与eEF2的活性下降趋势一致,也进一步说明了可能AMPK起了主要作用,而应激状态已经不是主导地位。
本研究通过对AMPK通路的研究发现,在内毒素血症早期(24 h),AMPK通路的开放与蛋白的调节之间有很大的关系。AMPK可以通过对mTOR和eEF2两条通路来调控蛋白的合成减少。未来希望进一步研究找到一种可以干预并有效的方法来调节AMPK的作用,进而调节ICU内毒素血症患者的蛋白营养失衡问题。试验中对于6 h心脏组织中的p-eEF2降低的调控通路尚未十分明确,拟在以后的实验中进一步研究。
| [1] | Yoshizawa F, Mochizuki S, Doi M, et al. Ethionine-induced ATP depletion represses mTOR signaling in the absence of increases in AMP-activated protein kinase activity in the rat liver[J]. Biosci Biotechnol Biochenm , 2009, 73 (9) : 1984-1988 DOI:10.1271/bbb.90154 |
| [2] | Wong AK, Howie J, Petrie JR, et al. AMP-activated protein kinase pathway: a potential therapeutic target in cardiometabolic disease[J]. Clin Sci (Lond) , 2009, 116 (8) : 607-620 DOI:10.1042/CS20080066. |
| [3] | Christ WJ, Asano O, Robidoux AL, et al. O Asano E5531, a pure endotoxin antagonist of high potency[J]. Science , 1995, 268 (5207) : 80-83 DOI:10.1126/science.7701344 |
| [4] | Guo D, Hildebrandt IJ, Prins RM, et al. The AMPK agonist AICAR inhibits the growth of EGFRvIII-expressing glioblastomas by inhibiting lipogenesis[J]. Proc Natl Acad Sci USA , 2009, 106 (31) : 12932-12937 DOI:10.1073/pnas.0906606106. |
| [5] | Towler MC, Hardie DG. AMP-activated protein kinase in metabolic control and insulin signaling[J]. Circ Res , 2007, 100 (3) : 328-341 DOI:10.1161/01.RES.0000256090.42690.05. |
| [6] | Shaw RJ. LKB1 and AMP-activated protein kinase control of mTOR signalling and growth[J]. Acta Physiol (Oxf) , 2009, 196 (1) : 65-80 DOI:10.1111/j.1748-1716.2009.01972.x |
| [7] | Viollet B, Guigas B, Leclerc J, et al. AMP-activated protein kinase in the regulation of hepatic energy metabolism: from physiology to therapeutic perspectives[J]. Acta Physiol , 2009, 196 (1) : 81-98 DOI:10.1111/j.1748-1716.2009.01970.x |
| [8] | Memmott RM, Dennis PA. Akt-dependent and independent mechanisms of mTOR regulation in cancer[J]. Cell Signal , 2009, 21 (5) : 656-664 DOI:10.1016/j.cellsig.2009.01.004 |
| [9] | Bolster DR, Crozier SJ, Kimball SR, et al. AMP-activated protein kinase suppresses protein synthesis in rat skeletal muscle through down-regulated mammalian target of rapamycin (mTOR) signaling[J]. J Biol Chem , 2002, 277 (27) : 23977-23980 DOI:10.1074/jbc.C200171200. |
| [10] | Carlberg U, Nilsson A, Nygard O. Functional properties of phosphorylated elongation factor 2[J]. Eur J Biochem , 1990, 191 (3) : 639-645 DOI:10.1111/j.1432-1033.1990.tb19169.x. |
| [11] | Redpath NT, Proud CG. Cyclic AMP-dependent protein kinase phosphorylates rabbit reticulocyte elongation factor-2 kinase and induces calcium-independent activity[J]. Biochem J , 1993, 293 (1) : 31-34 DOI:10.1042/bj2930031 |
| [12] | Chan AY, Dyck JR. Activation of AMP-activated protein kinase (AMPK) inhibits protein synthesis: a potential strategy to prevent the development of cardiac hypertrophy[J]. Can J Physiol Pharmacol , 2005, 83 (1) : 24-28 DOI:10.1139/y04-107 |
| [13] | Horman S, Browne G, Krause U, et al. Activation of AMP-activated protein kinase leads to the phosphorylation of elongation factor 2 and an inhibition of protein synthesis[J]. Curr Biol , 2002, 12 (16) : 1419-1423 DOI:10.1016/S0960-9822(02)01077-1 |
| [14] | Horman S, Beauloye C, Vertommen D, et al. Myocardial Ischemia and Increased Heart Work Modulate the Phosphorylation State of Eukaryotic Elongation Factor-2[J]. J Biol Cchem , 2003, 278 (43) : 41970-41976 DOI:10.1074/jbc.M302403200. |
| [15] | Viollet B, Guigas B, Leclerc J, et al. AMP-activated protein kinase in the regulation of hepatic energy metabolism: from physiology to therapeutic perspectives[J]. Acta Physiol , 2009, 196 (1) : 81-98 DOI:10.1111/j.1748-1716.2009.01970.x. |
| [16] | Bornstein SR, Ziegler CG, Krug AW, et al. The role of toll-like receptors in the immune-adrenal crosstalk[J]. Ann N Y Acad Sci , 2006, 1088 : 307-318 DOI:10.1196/annals.1366.027. |
| [17] | Fu L, Huang L, Cao C, et al. Inhibition of AMP-activated protein kinase alleviates focal cerebral ischemia injury in mice: Interference with mTOR and autophagy[J]. Brain Res , 2016, 1650 : 103-111 DOI:10.1016/j.brainres.2016.08.035 |
 2016, Vol. 37
2016, Vol. 37




