肠上皮细胞及其相邻的紧密连接是肠黏膜屏障的重要组成部分,一旦紧密连接受损,肠上皮细胞间通透性增加,细菌、内毒素和大分子物质就可能通过紧密连接进入体循环,诱发全身炎症反应综合征,危及远端器官与功能[1]。因此,维持肠黏膜屏障功能完整极为重要。目前对脓毒症肠黏膜屏障的损伤缺乏深入基础理论研究,临床缺乏有效的药物与方法,减轻病理状态下肠黏膜结构与功能损害。近期研究显示,外源性一氧化碳释放分子(carbon monoxide-releasing molecules-2,CORM-2)可抑制肠道上皮细胞的炎症反应[2],减轻肠黏膜屏障损伤。本实验以LPS刺激Caco-2细胞单层损害,模拟脓毒症肠黏膜屏障损伤体外模型,探讨CORM-2减轻肠黏膜屏障功能损伤的作用及机制。
1 材料与方法 1.1 主要材料与试剂人结肠癌Caco-2细胞株(中国科学院上海细胞库);CORM-2、LPS(美国Sigma公司);兔抗大鼠ZO-1、Occludin、Claudin-1、Claudin-4多克隆抗体(美国Santa Cruz公司);DMEM(Dulbecco' s modified eagle medium)培养基、胰酶(美国HyClone公司);胎牛血清(FBS)(杭州四季青生物工程材料有限公司);二甲基亚枫(Dimethyl sulfoxide或DMSO)、PBS、Marker、牛血清白蛋白、BSA、细胞凋亡检测试剂盒、ELISA试剂盒、全蛋白提取试剂盒、增强型ECL发光试剂盒、HRP标记的羊抗兔IgG、BCA法蛋白浓度检测试剂盒(南京凯基生物科技发展有限公司)。
1.2 实验方法 1.2.1 细胞的常规培养人结肠癌细胞株Caco-2经细胞复苏后,选择DMEM高糖液体培养基,另加10%胎牛血清,1%非必需氨基酸、1%谷氨酰胺,1×105 U/L青霉素,100 mg/L链霉素,在50 mL/L CO2饱和湿度37℃条件下培养,当细胞生长至80%~90%融合时,用2.5 g/L胰酶+0.3 g/L EDTA液消化细胞,按1:3传代培养,实验所用细胞在10代以内.将细胞接种于六孔细胞培养板内经明胶处理无菌玻片及Millicell插入式培养皿,细胞浓度为5×104/cm2,生长7~10 d至细胞成单层后进行实验。
1.2.2 Caco-2损伤模型建立及实验分组将Caco-2细胞接种于六孔细胞培养板内经明胶处理无菌玻片或Millicell插入式培养皿,细胞浓度为5×104细胞/cm2,生长7~10 d至细胞形成单层后进行实验。实验分正常对照组、LPS损伤组(50μg/mL)、CORM-2干预+LPS损伤组3个实验组,其中CORM-2干预+LPS损伤组按CORM-2不同浓度10 μmol、50 μmol、100 μmol以及无活性CORM-2分4个亚组。实验步骤,首先将CORM-2用二甲基亚枫(DMSO)溶解成CORM-2母液,然后使用不含血清的DMEM高糖培养基配制10 μmol、50 μmol、100 μmol不同浓度的CORM-2子液,iCORM-2组将配制好的100 μmol /L CORM-2母液置于37℃、5%CO2的细胞培养箱中18 h,其中的CO已全部释放,即为无活性(inactive)的CORM-2。LPS损伤组处理,用50 μg/mL LPS刺激24 h后收集细胞用于检测,CORM-2干预+LPS损伤组处理,先用不同浓度(10 μmol、50 μmol、100 μmol)的CORM-2预处理1 h,PBS水洗三遍,然后50 μg/mL LPS刺激24 h后收集细胞用于检测。
1.3 流式细胞术检测Caco-2细胞凋亡将各实验组处理完毕Caco-2细胞用胰蛋白酶消化收集,PBS洗涤细胞两次,每次5 000 r/min,离心2 min。弃上清,余少量PBS吹打成细胞悬液,加70%冷乙醇2 mL固定,保存在4℃条件下备用。细胞凋亡检测按照FITC-PI细胞凋亡检测试剂盒操作说明进行,流式细胞仪分析细胞存活和凋亡情况,每组实验重复6次。
1.4 ELISA法检测Caco-2细胞因子浓度收集各实验组Caco-2细胞培养上清液,3 000 r/min,4 ℃离心10 min后去除沉淀,取上清液,分装入冻存管,-80 ℃冰箱保存,按照酶联免疫吸附试验试剂盒操作,用酶标仪检测血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、高迁移率族蛋白-1(high mobility group box-1,HMGB-1)的浓度,计算出标准曲线和回归方程,将样品吸光度值代入标准曲线,计算出样品中细胞因子的蛋白浓度。每组实验重复6次。
1.5 蛋白印迹法检测紧密连接相关蛋白表达按预定实验方案处理各实验组细胞完毕后,用预冷含有0.1 mmol/L乙二胺四乙酸(EDTA)不含钙、镁离子的磷酸盐缓冲液(PBS)在冰上冲洗3次。细胞铲小心刮取细胞,倒入l mL细胞裂解液(2 mmol/L EDTA,10 mmol/L乙二醇双醚四乙酸(EGTA),0.4%NaF,20 mmol/L Tis-HCl,蛋白酶抑制剂混合物,苯甲基磺酰氟(PMSF)。1%Titon X-100, pH 7.5),4 ℃匀浆,离心,上清液为蛋白样品液。按照全蛋白提取试剂盒步骤提取全蛋白,BCA法蛋白定量。取样品蛋白质50 μg,SDS-PAGE电泳分离蛋白,ZO-1采用湿转法,Occludin、Claudin-1与Claudin-4采用半干转法将分离的蛋白转印至PVDF膜上,5%BSA-TBST缓冲液室温封闭2 h,加入一抗ZO-1(1:250),Occludin、Claudin-1、Claudin-4均为(1:1 000),4℃摇床孵育过夜,在羊抗兔辣根过氧化物标记的IgG二抗中37℃孵育45 min,化学发光(ECL),X线片曝光、显像,所得胶片用Chemi Imager 5500 V3.0软件扫描,通过Fluor Chen 2.0软件进行定量分析,测得相应数值。以目的条带和内参条带β-actin的光密度(OD)比值表示ZO-1、Occludin、Claudin-1、Claudin-4蛋白的表达水平。
1.6 免疫荧光法镜下观察紧密连接蛋白的表达和分布按照实验分组分别处理细胞,将生长在盖玻片上Caco-2单层用4%的多聚甲醛固定30 min,用0.5%Triton X-100透化5 min,用5%牛血清白蛋白(BSA)封闭1 h。抗体稀释度: ZO-1(1:20),Occludin(1:50),阴性对照用0.01 mol/L PBS代替一抗,4℃孵育过夜。应用异硫氰酸荧光素(FITC)标记的荧光二抗(1:100)孵育1 h,避光操作,甘油封片,荧光显微镜观察,采集图像。
1.7 统计学方法应用SPSS 18.0统计分析软件,数据以均数±标准差(x±s)表示,组内比较采用成组t检验,组间比较采用单因素方差分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 Caco-2细胞凋亡的情况各组Caco-2细胞的凋亡率如表 1所示。结果显示, 正常对照组Caco-2细胞凋亡水平较低,数值为(0.87±0.13)%。LPS损伤组显示Caco-2细胞凋亡显著增加,数值为(31.00±4.93)%。与正常对照组相比,两组差异无统计学意义(P < 0.05)。预先经CORM-2干预处理的各个亚组,LC1、LC2、LC3组Caco-2细胞凋亡率,较正常对照组增加。与LPS损伤组相比明显下降,两组间数据差异有统计学意义(P < 0.05),且随着CORM-2浓度逐步越高,Caco-2细胞凋亡率下降越明显。而其中无活性iCORM-2组Caco-2细胞凋亡率与LPS损伤组相比则差异无统计学意义。
| 组别 | 凋亡细胞百分率/(%) |
| 正常对照组 | 0.87±0.13b |
| LPS损伤组 | 31.00±4.93a |
| CORM-2干预组 | |
| 10 μmol/L(LC1) | 9.73±1.09ab |
| 50 μmol/L(LC2) | 6.44±0.78ab |
| 100 μmol/L(LC3) | 4.17±0.52ab |
| iCORM-2(LC4) | 27.86±3.07ab |
| 注:与正常对照组相比较,aP < 0.05;与LPS损伤组相比较,bP < 0.05; | |
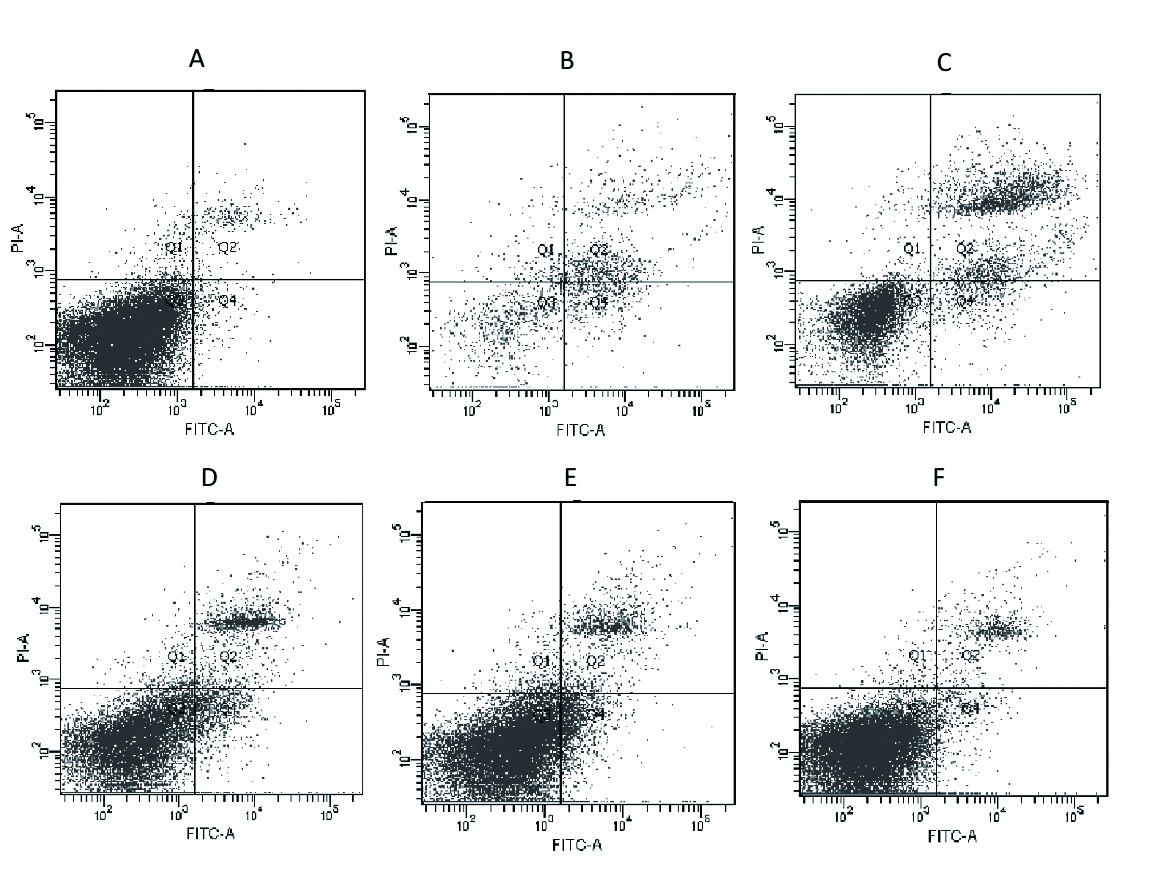
|
| A:正常对照组;B: LPS损伤组;C: iCORM-2组;D: 10μmml/L CORM-2组;E: 50μmml/L CORM-2组;F: 100μmml/L CORM-2组 图 1 CORM-2对LPS诱导Caco-2细胞凋亡的影响 Figure 1 Effects of CORM-2 on Caco-2 cells apoptosis induced by LPS |
|
|
CORM-2对LPS诱导Caco-2细胞炎症因子TNF-α、IL-1β和HMGB-1的的影响如表 2所示。结果显示:正常对照组炎症因子TNF-α、IL-1β和HMGB-1的分泌水平较低,数值分别为(47.81±4.46)pg/mL;(76.82±6.27)pg/mL;(100.19±14.14)pg/mL;LPS损伤组炎症因子TNF-α、IL-1β和HMGB-1分泌水平显著增加,数值为(665.39±30.53)pg/mL;(360.71±37.85)pg/mL;(1441.18±68.43)pg/mL;与正常对照组相比,两组差异有统计学意义(P < 0.05)。预先经CORM-2干预处理的各个亚组,LC1、LC2、LC3组Caco-2细胞炎症因子TNF-α、IL-1β和HMGB-1分泌水平,较正常对照组增加。与LPS损伤组相比明显下降,两组间数据差异有统计学意义(P < 0.05),且随着CORM-2浓度逐步增加,Caco-2细胞炎症因子TNF-α、IL-1β和HMGB-1分泌水平下降越明显。而其中无活性iCORM-2组Caco-2细胞炎症因子TNF-α、IL-1β和HMGB-1分泌水平与LPS损伤组相比,差异无统计学意义。
| 组别 | n | TNF-α | IL-1β | HMGB-1 |
| 正常对照组 | 6 | 47.81±4.46 | 76.82±6.27 | 100.19±14.14 |
| LPS损伤组 | 6 | 665.39±30.53a | 360.71±37.85a | 1441.18±68.43a |
| CORM-2干预组 | ||||
| 10 μmol/L(LC1) | 6 | 561.78±39.97ab | 268.98±29.34ab | 1263.45±60.61ab |
| 50 μmol/L(LC2) | 6 | 455.26±37.42ab | 166.23±27.95ab | 879.20±61.50ab |
| 100 μmol/L(LC3) | 6 | 314.27±17.13ab | 119.51±14.72ab | 565.94±64.93ab |
| iCORM-2 | 6 | 661.86±22.23a | 355.81±9.66a | 1385.87±19.54a |
| 注:与正常对照组相比较,aP < 0.05;与LPS损伤组相比较,bP < 0.05; | ||||
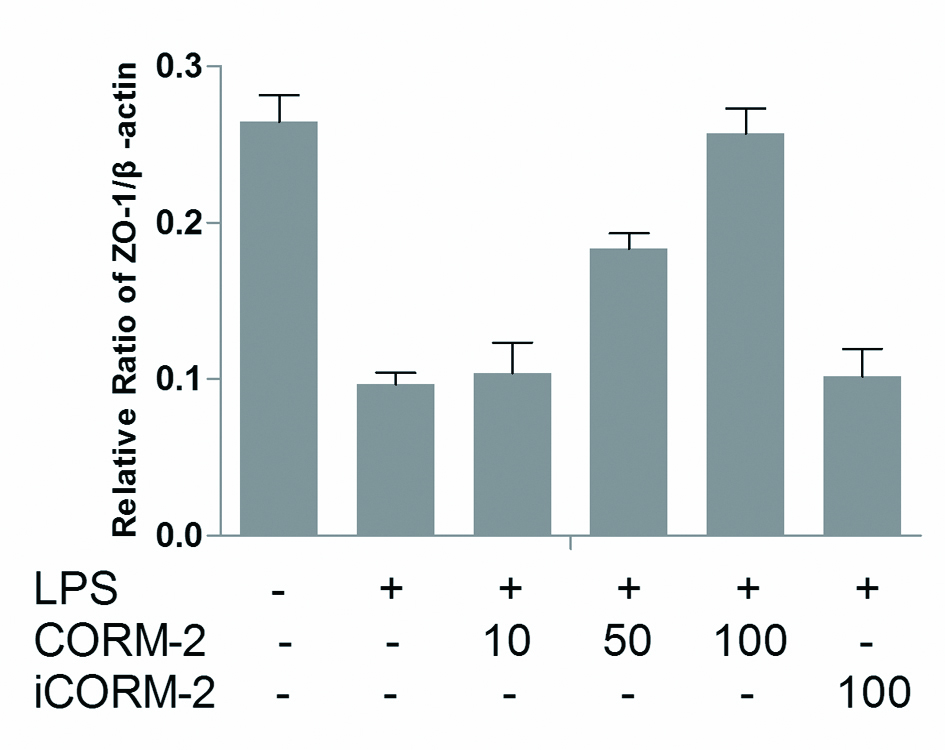
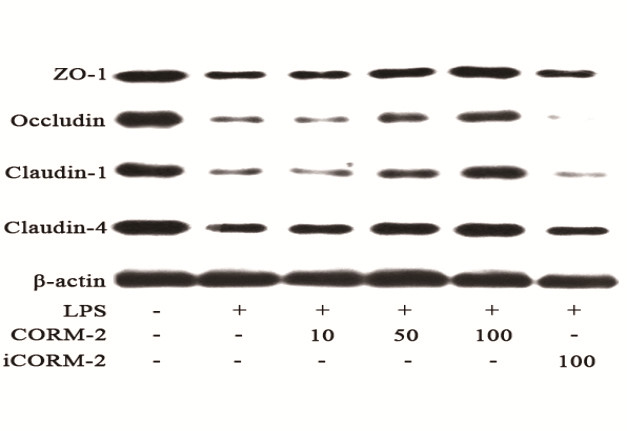
各组ZO-1、Occludin、Claudin-1、Claudin-4蛋白表达以目的蛋白(ZO-1、Occludin、Claudin-1、Claudin-4)条带和内参β-actin蛋白条带的吸光度(OD)比值表示。结果显示,LPS损伤组ZO-1、Occludin、Claudin-1、Claudin-4蛋白较正常对照组明显降低,数值分别为(0.097 0±0.017 3)vs.(0.264 7±0.041 5);(0.069 2±0.016 0)vs.(0.330 4±0.030 6);(0.086 3±0.007 5)vs.(0.253 5±0.019 8);(0.107 2±0.017 7)vs.(0.425 0±0.029 0);两组差异有统计学意义(P < 0.05)。经CORM-2干预处理LC2、LC3亚组,Caco-2细胞ZO-1、Occludin、Claudin-1、Claudin-4蛋白表达,与LPS损伤组相比明显升高,两组间数据差异有统计学意义(P < 0.05),且随着CORM-2浓度逐步增加,Caco-2细胞ZO-1、Occludin、Claudin-1、Claudin-4蛋白表达升高越明显。而其中预先经CORM-2干预处理LC1组,无活性iCORM-2组Caco-2细胞ZO-1、Occludin、Claudin-1、Claudin-4蛋白表达与LPS损伤组相比差异无统计学意义。如图 3~7。
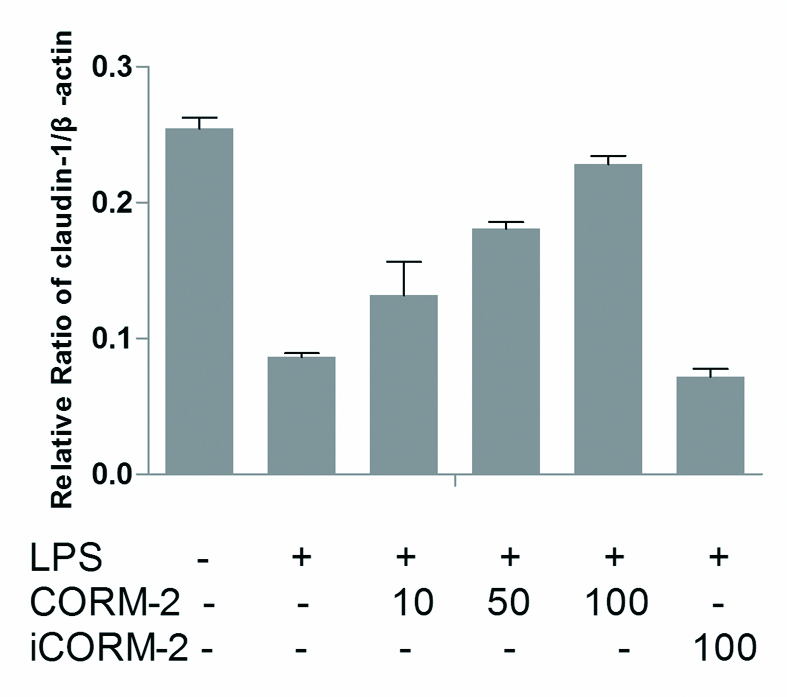
|
| 与对照组相比较,aP < 0.05;与LPS损伤组相比较, bP < 0.05 Figure 3 Comparsion of claudin-1/β-actin between different groups |
|
|
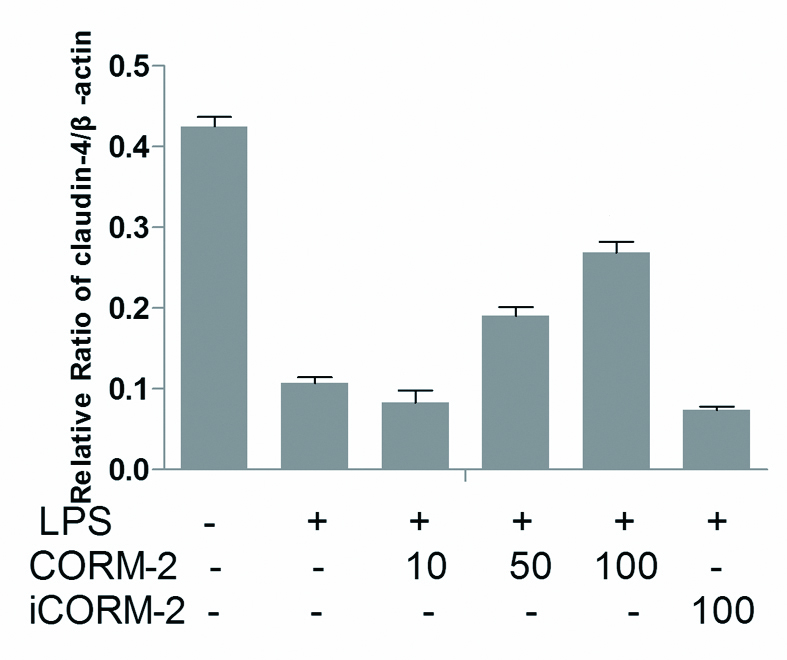
|
| 与对照组相比较,aP < 0.05;与LPS损伤组相比较, bP < 0.05 Figure 4 Comparsion of claudin-4/β-actin between different group |
|
|
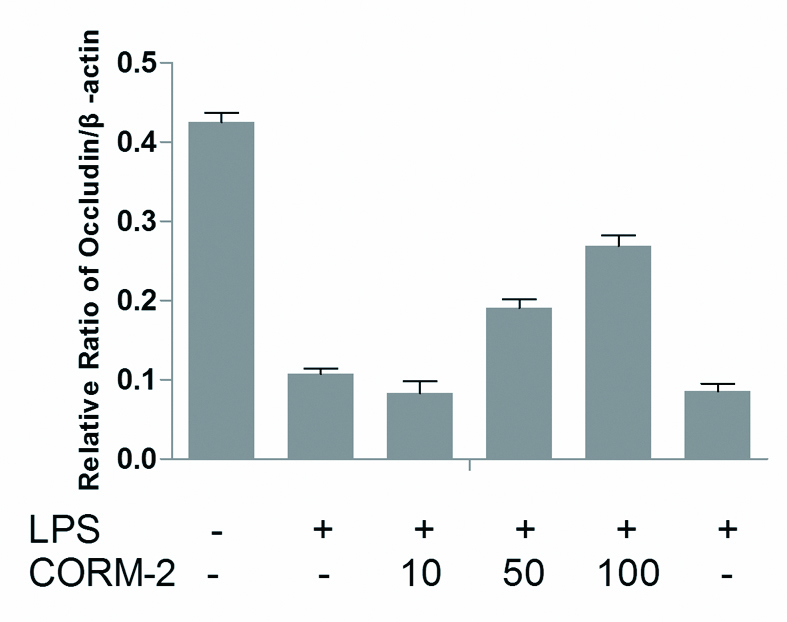
|
| 与对照组相比较,aP < 0.05;与LPS损伤组相比较,bP < 0.05 Figure 5 Comparsion of Occludin/β-actin between different groups |
|
|
|
| 与对照组相比较,aP < 0.05;与LPS损伤组相比较,bP < 0.05 Figure 6 Comparsion of ZO-1/β-actin between different groups |
|
|
|
| 图 7 各组ZO-1、occludin、claudin-1、claudin-4蛋白表达情况 Figure 7 Epression of ZO-1, occludin, claudin-1 and claudin-4 in different groups |
|
|
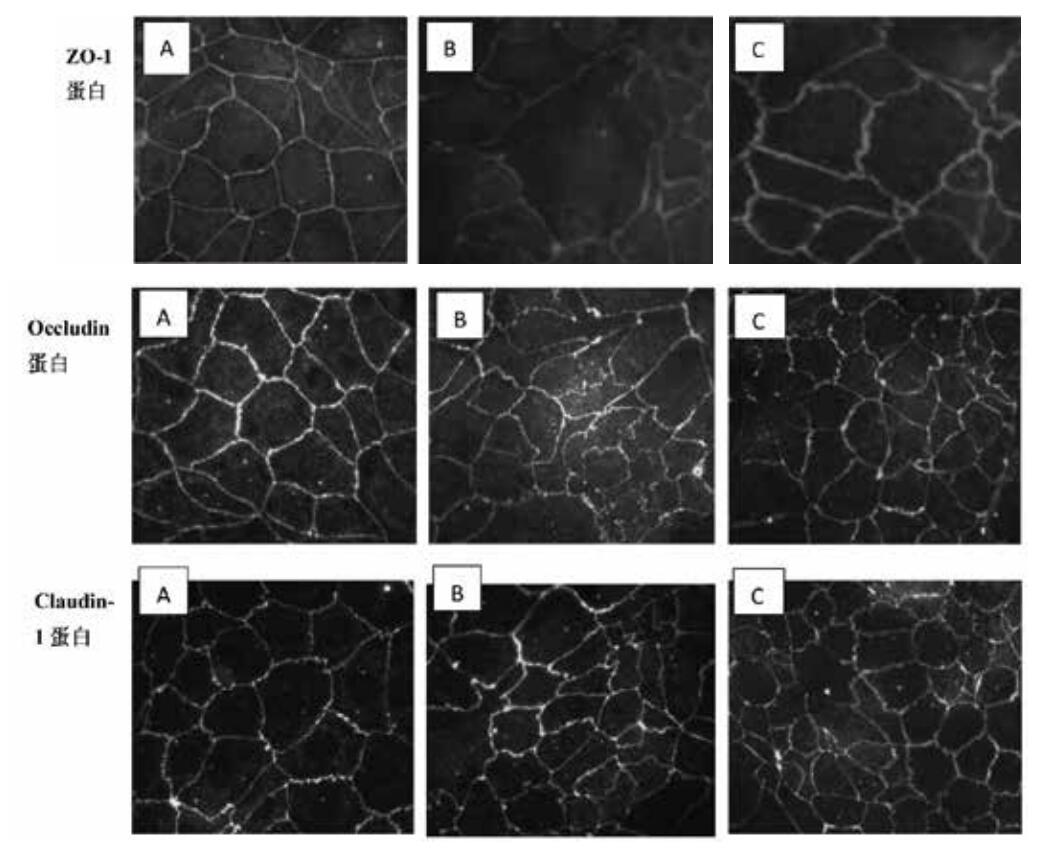
TJ结构位于相邻细胞之间。TJ相关蛋白(Claudin-1蛋白、Occludin蛋白、ZO-1蛋白)沿细胞膜连续分布,勾勒出细胞轮廓。正常对照组Caco-2细胞的Claudin-1,Occludin,ZO-1蛋白表达可见荧光沿胞膜分布,边界清楚,呈网状结构。细胞间连接紧密,无明显间隙。
LPS刺激Caco-2细胞后,发生明显改变,表现为细胞间的荧光分布不规则,强度减弱.有明显皱褶、圆滑排列程度减弱,甚至有断裂及锯齿等不连续现象。预先经CORM-2干预处理组(浓度为100 μmmol/L),Caco-2细胞近似于正常对照组,TJ蛋白的荧光强度稍减弱,但仍沿胞膜分布,排列较规则,皱褶及锯齿状改变较LPS损伤组减少或消失。见图 8。
|
| A:正常对照组TJ蛋白表达可见荧光沿胞膜分布,边界清楚,呈网状结构;B:LPS损伤组TJ蛋白表达细胞间的荧光分布不规则,强度减弱,有明显皱褶、圆滑排列程度减弱,甚至有断裂及锯齿等不连续现象;C: CORM-2干预处理组(100ummol/L)TJ蛋白的荧光强度稍减弱,但仍沿胞膜分布,排列较规则,皱褶及锯齿状改变较LPS损伤组减少或消失 图 8 各组免疫荧光染色结果(×400) Figure 8 Immunofluorescence staining results of all groups(×400) |
|
|
肠黏膜机械屏障是肠黏膜屏障最为重要的部分,具有防止肠道内病原微生物及毒素由肠腔侵入肠外器官的作用,其结构基础为单层肠上皮细胞和细胞间的紧密连接[3]。脓毒症时,炎症细胞因子(如TNF-α、IL-1β、HMGB-1)大量产生和释放,肠道缺血缺氧、氧化应激等多种因素,引起肠上皮细胞凋亡增加,以及细胞间紧密连接崩解,引起肠上皮细胞旁通透性增加,导致肠黏膜屏障断裂破坏[4]。
脓毒症的发病机制十分复杂,包括炎症、免疫和凝血功能障碍等多个方面,涉及细胞功能、代谢和微循环等各种改变[5]。近期研究表明,CORM-2具有重要的生物学功能,包括保护缺血-再灌注损伤、抗炎、抗凝、抗菌,从多途径、多靶点作用于脓毒症病理过程,减轻脓毒症导致组织器官损害[6-10]。已有多项研究发现显示CORM-2通过直接抑制肠道病原菌,抑制炎症信号通路关键信号分子NF-κB活性,从而抑制炎症细胞因子TNF-α、IL-6、IL-1β和IL-18分泌,下调炎症相关复合体NLRP3,Caspases-1mRNA和蛋白,以及粘附分子ICAM-1的表达,减少器官组织中性粒细胞过度浸润、活性氧自由基(ROS)和一氧化氮(NO)的产生,减轻脓毒症氧化应激和炎症反应,提高脓毒症小鼠生存率[6-9]。本研究结果显示,LPS刺激Caco-2细胞后,细胞培养液中早期炎症介质TNF-α、IL-1β浓度均显著升高,晚期炎症介质HMGB-1也明显升高,而CORM-2预处理能够有效抑制这类促炎细胞因子的释放(图 2)。由于促炎细胞因子TNF-α、IL-1β以及HMGB1常引起肠黏膜屏障结构与功能破坏。因此,推测CORM-2通过有效抑制促炎细胞因子TNF-α、IL-1β以及HMGB1分泌与释放,减轻炎症细胞因子对机体肠黏膜屏障损害,亦是其维护肠黏膜屏障完整性的机制之一。
肠上皮细胞是肠机械屏障的基础,其凋亡增加直接导致肠屏障功能障碍。紧密连接是肠黏膜上皮细胞之间的主要连接方式,对维持肠黏膜屏障机械结构完整和正常功能发挥起重要作用。紧密连接由咬合蛋白Occludin、闭合蛋白Claudins和连接黏附分子(junction adhesion moleucule,JAMs)3种完整的膜蛋白和闭合小环蛋白(ZO-1、ZO-2和ZO-3)等外周胞浆蛋白组成。其中Claudins为跨膜蛋白,功能最为重要,是构成紧密连接的主要骨架蛋白[4]。ZO-1和ZO-2蛋白构成稳定的复合体,与Occludin蛋白结合,构成一个网络支架,将Occludin和肌动蛋白系统连接在一起,控制细胞周围屏障。有研究发现,使用TNF-α、IL-1β刺激Caco-2细胞后,Caco-2细胞凋亡增加,细胞间紧密连接结构遭到破坏,肠道上皮紧密连接通透性增加,屏障功能随之降低[10-12]。有文献报道CORM-2明显抑制脓毒症诱导的肠黏膜炎症反应,抑制促炎细胞因子(IL-1β、TNF-α)分泌和释放,减轻脓毒症所致肠黏膜紧密连接蛋白(ZO-1、Claudin、Occludin)减少,肌球蛋白轻链磷酸化和肠黏膜屏障通透性增加,恢复肠黏膜屏障。降低脓毒症模型大鼠的病死率[4]。在本研究中发现预先经CORM-2干预处理,LPS诱导的Caco-2细胞凋亡显著降低,且随着CORM-2浓度逐步越高,Caco-2细胞凋亡率下降越明显。从而说明CORM-2对Caco-2细胞的凋亡具有保护作用,且这种保护作用呈浓度依耐性。用Western blotting方法观察CORM-2对紧密连接结构蛋白的影响,发现CORM-2明显抵消LPS导致的ZO-1、Occludin、Claudin-1、Claudin-4表达量的下降作用,且CORM-2抵消作用也是呈浓度依赖性的。在免疫荧光试验中,可观察到肠上皮细胞间紧密连接蛋白分布的改变(图 4)。实验结果提示我们,CORM-2可通过维护紧密连接蛋白的表达与分布,部分恢复肠上皮细胞的屏障功能。
综上所述,本研究发现CORM-2呈浓度依赖性减轻LPS诱导的肠上皮细胞(Caco-2)屏障功能障碍。其机制可能是通过降低Caco-2细胞凋亡率、抑制促炎细胞因子的释放、改善紧密连接结构的变化和相关蛋白的表达与分布而实现。
| [1] | Shimizu K, Ogura H, Hamasaki T, et al. Altered gut flora are associated with septic complications and death in critically ill patients with systemic inflammatory response syndrome[J]. Dig Dis Sci, 2011, 56(4): 1171-1177. DOI:10.1007/s10620-010-1418-8 |
| [2] | Katada K, Bihari A, Mizuguchi S, et al. Carbon monoxide liberated from CO-releasing molecule (CORM-2) attenuates ischemia/reperfusion (I/R)-induced inflammation in the small intestine. Inflammation[J]. Inflammation, 2010, 33(2): 92-100. DOI:10.1007/s10753-009-9162 |
| [3] | 赵允召, 龚冠交, 李宁, 等. 腹腔间隙综合征小肠黏膜显微和超微结构改变的观察[J]. 医学研究生学报, 2011, 24(5): 456-459. DOI:10.3969/j.issn.1008-8199.2011.05.003 |
| [4] | Zhang S, Zheng S, Wang X, et al. Carbon Monoxide-releasing molecule-2 reduces intestinal epithelial tight-Junction damage and mortality in septic rats[J]. PLoS One, 2015, 10(12): e0145988. DOI:10.1371/journal.pone.0145988 |
| [5] | Rizzo AN, Dudek SM. Endothelial glycocalyx repair: building a Wall to Protect the Lung during sepsis[J]. am J Respir Cell Mol Biol, 2017, 56(6): 687-688. DOI:10.1165/rcmb.2017-0065ED |
| [6] | Shen WC, Wang X, Qin WT, et al. Exogenous carbon monoxide suppresses Escherichia coli vitality and improves survival in an Escherichia coli-induced murine sepsis model[J]. Acta Pharmacol Sin, 2014, 35(12): 1566-1576. DOI:10.1038/aps.2014.99 |
| [7] | Wang X, Qin W, Song M, et al. Exogenous carbon monoxide inhibits neutrophil infiltration in LPS-induced sepsis by interfering with FPR1 via p38 MAPK but not GRK2[J]. Oncotarget, 2016, 7(23): 34250-34265. DOI:10.18632/oncotarget.9084 |
| [8] | Qin W, Zhang J, Lv W, et al. Effect of carbon monoxide-releasing molecules II-liberated CO on suppressing inflammatory response in sepsis by interfering with nuclear factor kappa B activation[J]. PLoS One, 2013, 8(10): e75840. DOI:10.1371/journal.pone.0075840 |
| [9] | Jiang L, Fei D, Gong R, et al. CORM-2 inhibits TXNIP/NLRP3 inflammasome pathway in LPS-induced acute lung injury[J]. Inflamm Res, 2016, 65(11): 905-915. DOI:10.1007/s00011-016-0973-7 |
| [10] | Al-Sadi R, Guo S, Ye D, et al. TNF-α Modulation of Intestinal Tight Junction Permeability Is Mediated by NIK/IKK-α Axis Activation of the Canonical NF-κB Pathway[J]. Am J Pathol, 2016, 186(5): 1151-1165. DOI:10.1016/j.ajpath.2015.12.016 |
| [11] | Al-Sadi RM, Ma TY. IL-1beta causes an increase in intestinal epithelial tight junction permeability[J]. J Immunol, 2007, 178(7): 4641-4649. DOI:10.4049/jimmunol.178.7.4641 |
| [12] | Al-Sadi R, Ye D, Dokladny K, et al. Mechanism of IL-1beta-induced increase in intestinal epithelial tight junction permeability[J]. J Immunol, 2008, 180(8): 5653-5661. DOI:10.4049/jimmunol.180.8.5653 |
 2018, Vol. 27
2018, Vol. 27




