脓毒症(sepsis)是指机体对感染反应失调所引起的致命性器官功能障碍[1],脓毒症诱发多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)与凝血功能异常密切相关,50%~70%脓毒症患者发生凝血功能障碍[2]。研究表明脂多糖(lipopolysaccharide,LPS)等致病因子可破坏细胞稳态,激活内质网应激(endoplasmic reticulum stress, ERS),其中肌醇需求酶1α(inositol-requiring enzyme 1α,IRE1α)信号通路活化可增加蛋白质二硫化物异构酶(protein disulfide isomerase,PDI)表达,后者则增强组织因子(tissue factor, TF)凝血活性[3-5]。据此推测脓毒症时ERS在增加TF凝血活性,诱导凝血功能障碍中发挥重要作用。血必净注射液(简称血必净)主要由红花、赤芍、川芎、丹参、当归等五味中药提取而成,可有效改善脓毒症患者凝血功能[5-6]。本研究拟进一步探讨血必净改善凝血功能紊乱的信号机制,旨在为临床应用血必净防治脓毒症状态下凝血功能障碍提供实验依据。
1 材料与方法 1.1 实验动物、试剂和仪器清洁级雄性SD大鼠,购自北京华阜康生物科技股份有限公司;内皮细胞培养基、内皮细胞生长因子及胎牛血清均购自美国Sciencell公司;CCK-8试剂(货号CK04)和乳酸脱氢酶(lactic dehydrogenase,LDH)试剂购自东仁化学科技有限公司;LPS购自美国Sigma公司;SP免疫组化试剂盒和DAB显色试剂盒购自北京中杉金桥生物技术有限公司;血必净注射液(天津红日药业股份有限公司生产,国药准字Z20040033)。IRE1抗体(货号ab37073)、X盒结合蛋白(box binding protein-1, XBP-1)抗体(货号ab37152)和PDI抗体(货号ab2792)及FⅩa检测试剂盒(货号ab204711)均购自Abcam公司。
1.1.1 内皮细胞分和培养颈椎脱臼法处死大鼠,充分暴露胸、腹主动脉,从近心端分离主动脉至髂总动脉分支处,无菌剥离血管外膜的脂肪组织和纤维组织。将主动脉切成约1.5 mm×1.5 mm小块,置于0.25%的Ⅳ型胶原酶中,37℃消化15 min,小心吸走消化液,再加入1.0%中性蛋白酶,37℃消化15 min,吸走消化液,补充内皮细胞培养基(ECM),离心,弃上清液,保留碎块。将组织块平铺于10 cm的培养皿底部,加入适量ECM,以没入组织块为宜。7 d左右可见内皮细胞由组织块边缘爬出,呈扁平短梭形或多角形,此时去除组织块,用0.25%胰蛋白酶消化,按1:3的比例在25 cm2的培养瓶中传代,用第3~4代细胞进行实验。
1.1.2 鉴定内皮细胞纯度采用免疫细胞化学法检测FⅧ表达,鉴定内皮细胞纯度, 接种细胞至6孔板(内置灭菌载玻片),待细胞铺满70%状态时,弃上清,严格按照说明书处理细胞,显微镜下观察。阳性细胞选择:细胞DAB显色,棕色铺路石样细胞即为内皮细胞,根据阳性细胞分布情况,在400倍镜下选择1~2个阳性视野,计算200个细胞中阳性细胞数作为内皮细胞纯度。计算方式为(阳性细胞数/细胞总数)×100%。
1.1.3 细胞培养和分组5%胎牛血清ECM培养基重悬内皮细胞,调整细胞浓度为1.2×105/mL,培养12 h。实验分组:对照组、LPS组、血必净组和LPS+血必净组,每组设6个平行孔。对照组不给予刺激,正常培养;LPS组加入浓度为500 ng/mL的LPS诱导模拟脓毒症环境;血必净组分别加入1、5、25 μL/mL血必净注射液;LPS+血必净组分别加入1、5、25 μL/mL血必净注射液,预处理60 min后加入LPS,调整LPS浓度为500 ng/mL,将培养板放入37℃、5%CO2培养箱内,分别培养24、48、72 h后留取上清液和细胞,检测各项指标。
1.1.4 检测细胞增殖和损伤程度采用CCK-8法测定细胞增殖能力,以细胞上清中LDH释放量评价细胞损伤程度。制备细胞悬液,以1.2×105/mL接种细胞,将100μL细胞悬液接种于96孔板中,分别于刺激后24、48、72 h后收集上清,按说明书即时测各组OD值。
1.1.5 Western blot检测IRE1α、uXBP-1、sXBP-1及PDI表达水平收集各组细胞,按照普利莱细胞提取说明书,提取蛋白,采用BCA法检测蛋白浓度。蛋白上样量为30 μg,SDS聚丙烯酰胺胶电泳浓缩胶质量分数为4%,uXBP-1、sXBP-1及PDI分离胶质量分数为10%,IRE1α分离胶质量分数为8%。采用恒流25 mA,电泳至溴酚蓝跑至玻璃板底面时,即停止电泳,约2 h,进行转膜,90 mA电泳1 h,ECL显影。采用Imaage J软件对条带进行分析,计算出灰度值,用目标条带灰度值分别于对应内参β-actin灰度值的比值来衡量表达情况,作为IRE1α、uXBP-1、sXBP-1及PDI的相对表达量。
1.1.6 发色底物法检测FⅩa含量在生理状态下,多数TF无促凝功能,即处于“加密状态”,有促凝活性的TF为“解密状态”,两种形式TF均可和FⅦa结合。“加密状态”TF无法活化FⅩa,FⅩ被Ⅶa-TF复合物激活成为FⅩa,因此以FⅩa生成量反映TF凝血活性[8]。
1.3 统计学方法采用GRAPH6.01统计软件分析,计量资料以均数±标准差(x±s)表示,进行单因素方差分析,两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 内皮细胞纯度如图 1所示,FⅧ由内皮细胞特异性释放,根据此原理采用免疫组化法检测FⅧ,作为鉴定内皮细胞纯度依据。内皮细胞纯度达96%,可进行下一步实验。
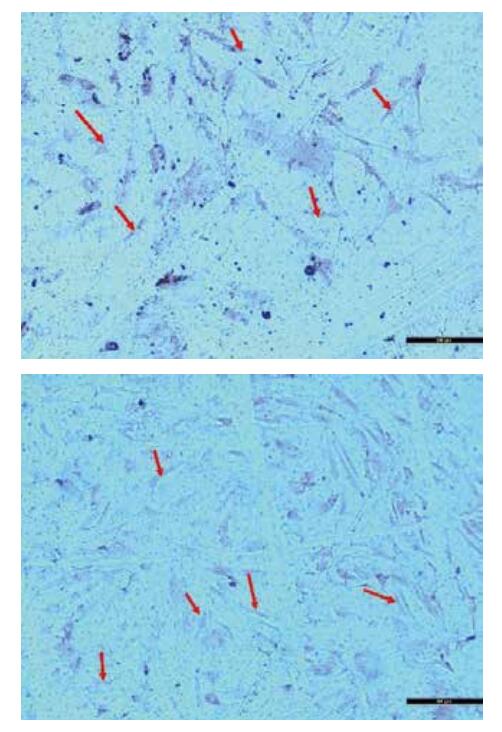
|
| 图 1 上图红色箭头所指棕色铺路石样细胞即为内皮细胞 Figure 1 Cells arrowed by red points with brown paving flagstone were endothelial cells |
|
|
与对照组比较,各血必净组细胞增殖能力无明显变化,差异均无统计学意义(P > 0.05);与对照组比较,LPS组细胞增殖活性下降,随着时间延长,抑制效应逐渐增强(P < 0.05或P < 0.01);与LPS组比较,LPS+血必净组(1、5、25 μl/m1)24和48 h增殖能力增强,差异具有统计学意义(P < 0.05),72 h时差异更为显著(P < 0.01);与LPS+5 μl/m1血必净组比较,48 h和72 h时LPS+1 μl/m1和LPS+25 μl/m1血必净组差异具有统计学意义(P < 0.05)。见表 1。
| 组别 | 组数 | CCK-8 | ||
| 24 h | 48 h | 72 h | ||
| 对照组 | 6 | 1.663±0.184 | 1.723±0.131 | 1.873±0.038 |
| LPS组 | 6 | 1.540±0.032a | 1.522±0.334a | 1.389±0.008b |
| 1μL/mL血必净组 | 6 | 1.646±0.122c | 1.663±0.056c | 1.793±0.051c |
| 5μL/mL血必净组 | 6 | 1.651±0.058c | 1.695±0.122c | 1.880±0.076c |
| 25μL/mL血必净组 | 6 | 1.638±0.218c | 1.652±0.325c | 1.781±0.045c |
| LPS+1μL/mL血必净组 | 6 | 1.398±0.054d | 1.591±0.254df | 1.694±0.069ef |
| LPS+5μL/mL血必净组 | 6 | 1.512±0.124d | 1.694±0.361d | 1.791±0.057e |
| LPS+25μL/mL血必净组 | 6 | 1.417±0.092d | 1.676±0.158df | 1.683±0.086ef |
| 注:与对照组相比,aP < 0.05, bP < 0.01;与对照组相比,cP > 0.05;与LPS组比较,dP < 0.05, eP < 0.01;与LPS+5μL/mL血必净组比较,fP < 0.05 | ||||
与对照组比较,各浓度血必净组LDH释放无明显变化(P > 0.05);与对照组比较,LPS组释放LDH增多,随着时间延长该效应逐渐增强(P < 0.05或P < 0.01);与LPS组比较,LPS+1 μL/mL血必净组LDH释放减少(P < 0.05),LPS+5 μL/mL血必净和LPS+25 μL/mL血必净组在24、48 h释放减少(P < 0.05),72 h时差异有统计学意义(P < 0.01);与LPS+5 μL/mL血必净组比较,48、72 h时LPS+1 μL/mL和LPS+25 μL/mL血必净组差异有统计学意义(P < 0.05)。见表 2。
| 组别 | 组数 | LDH | ||
| 24 h | 48 h | 72 h | ||
| 对照组 | 6 | 0.514±0.011 | 0.531±0.007 | 0.489±0.020 |
| LPS组 | 6 | 0.814±0.024b | 0.877±0.035b | 0.932±0.047b |
| 1μL/mL血必净组 | 6 | 0.532±0.020a | 0.539±0.030a | 0.510±0.038a |
| 5μL/mL血必净组 | 6 | 0.521±0.024a | 0.524±0.019a | 0.502±0.037a |
| 25μL/mL血必净组 | 6 | 0.604±0.078a | 0.564±0.016a | 0.652±0.020a |
| LPS+1μL/mL血必净组 | 6 | 0.677±0.024c | 0.752±0.038ce | 0.675±0.047ce |
| LPS+5μL/mL血必净组 | 6 | 0.569±0.029c | 0.549±0.027c | 0.516±0.038d |
| LPS+25μL/mL血必净组 | 6 | 0.694±0.024c | 0.691±0.031ce | 0.621±0.037de |
| 注:与对照组比较,aP > 0.05;与对照组比较,bP < 0.01;与LPS组比较,cP < 0.05,deP < 0.01;与LPS+5μL/mL血必净组比较,eP < 0.05 | ||||
与对照组相比,LPS组IRE1α、uXBP1、sXBP1和PDI表达均明显上调(P < 0.05);与LPS组比较,各浓度血必净组IRE1α、uXBP1、sXBP1和PDI表达均下调,差异具有统计学意义(P < 0.05)。见图 2,图 3。
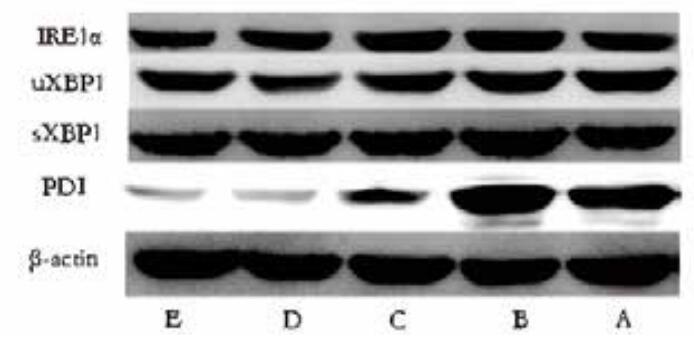
|
| 图 2 各组蛋白表达情况 Figure 2 The protein expression of various markers in each group |
|
|
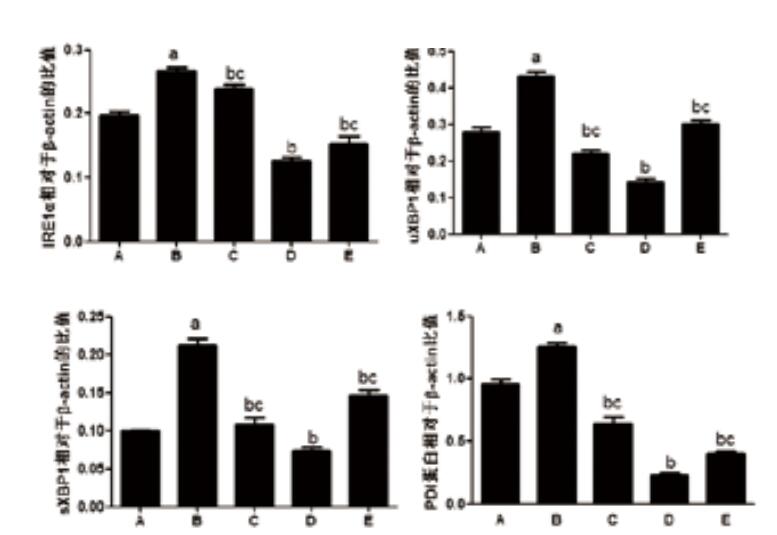
|
|
与对照组相比较,aP < 0.05;与LPS组比较,bP < 0.05;与LPS+5μL/mL比较,cP < 0.05。 A:对照组;B: LPS组;C: LPS+1 μL/mL血必净组;D: LPS+5 μL/mL血必净组;E: LPS+25 μL/mL血必净组 图 3 IRE1α、uXBP1、sXBP1、PDI与β-actin的比值 Figure 3 Changes in the ratio of IRE1α, uXBP1, sXBP1, and PDI to β-actin |
|
|
与对照组比较,LPS组FⅩ活化水平升高,FⅩa产生增多(P < 0.05);与LPS组比较,各浓度血必净组FⅩ活化水平显著降低(P < 0.05或P < 0.01);与LPS+5 μL/mL血必净组比较,LPS+1 μL/mL血必净组和LPS+25 μL/mL血必净组FⅩa产生减少,差异有统计学意义(P < 0.05)。见表 3。
| 组别 | 组数 | 72 h |
| 对照组 | 6 | 0.526±0.017 |
| LPS组 | 6 | 1.367±0.142a |
| LPS+1μL/mL血必净组 | 6 | 0.854±0.091bd |
| LPS+5μL/mL血必净组 | 6 | 0.611±0.031c |
| LPS+25μL/mL血必净组 | 6 | 0.938±0.052bd |
| 注:与对照组比较,aP < 0.05;与LPS组比较,bP < 0.05,cP < 0.01;与LPS+5μL/mL血必净组比较,dP < 0.05 | ||
内皮细胞不仅是脓毒症发生时受损的靶器官,而且通过其广泛的生物学效应主动参与组织损害,是引起凝血功能障碍的关键环节[8-9]。脓毒症所致凝血功能障碍机制尚未完全清楚,内皮细胞在LPS直接或间接作用下出现损伤,可释放多种炎症因子和凝血因子,活化凝血系统[10]。中药血必净注射液具有拮抗炎症介质、清除内毒素、改善凝血功能的作用。本研究证实单纯给予血必净处理不会影响内皮细胞增殖活性;LPS刺激内皮细胞后细胞增殖能力下降,LDH释放增多;细胞经血必净预处理60 min后再给予LPS刺激,其增殖能力较LPS组明显改善,LDH释放减少,且随着时间延长,血必净保护细胞效应逐渐增强。进一步分析发现,血必净干预呈现一个最适浓度,浓度过低或过高其保护效应均有所减弱,在本实验中血必净在5μL/mL时效应最为明显。
脓毒症病理过程中,由于细菌及其毒素直接作用诱发炎症反应,机体处于严重应激状态,内环境失衡,内质网通过激活未折叠蛋白反应保护细胞,恢复细胞稳态;若刺激因素过强,则不能恢复细胞平衡状态[11]。本组资料中,LPS刺激内皮细胞可诱导细胞损伤,激活ERS,使细胞持续处于失衡状态。IRE1α是镶嵌在内质网膜上的一种跨膜蛋白,在维持内质网稳态方面发挥重要作用[12],通过合成uXBP1来剪切26个碱基,形成一个开放阅读框架,以合成一个新的转录因子sXBP1。我们观察到在LPS刺激内皮细胞72 h后,IRE1α、uXBP1和sXBP1的表达均上调,说明ERS激活;而1、5、25 μL/mL浓度血必净处理组RE1α、uXBP1和sXBP1表达水平均明显下调,说明血必净可有效抑制ERS,且在5 μL/mL剂量时血必净抑制IRE1α信号通路效应最强,此效应与恢复内皮细胞增殖能力,减少LDH释放结果相符。已有研究表明,激活IRE1α-XBP1通路可引起PDI表达增加[13-15],而PDI进一步通过调控TF膜外Cys186-Cys209间二硫键的形成,增强TF的凝血活性[8]。本实验结果显示,LPS刺激活化ERS,随着IRE1α通路激活,PDI和FⅩa表达均增加;而LPS+血必净组IRE1α、uXBP1、sXBP1和PDI表达降低,FⅩa活性亦相应降低,且在5 μL/mL时血必净抑制FⅩa效果最佳,与IRE1α通路改变基本一致。因此,笔者推测血必净可能通过阻断IRE1α-XBP1通路,降低PDI的表达,减弱TF促凝活性,从而防止脓毒症时外源性凝血途径的激活,纠正脓毒症所致凝血功能紊乱。
| [1] | Fiusa MM, Carvalho-Filho MA, Annichino-Bizzacchi JM, et al. Causes and consequences of coagulation activation in sepsis: an evolutionary medicine perspective[J]. BMC Med, 2015, 13: 105. DOI:10.1186/s12946-015-0327-2 |
| [2] | Okamoto K, Tamura T, Sawatsubashi Y. Sepsis and disseminated intravascular coagulation[J]. Intensive Care, 2016, 4: 23. DOI:10.1186/s40560-016-0149-0 |
| [3] | Wang SL, Chen Z, Lam V, et al. IRE1α-XBP1s induces PD1 expression to increase MTP activity for hepatic VLDL assembly and lipid homeostasis[J]. Cell Metab, 2012, 16(4): 473-486. DOI:10.1016/j.cmet.2012.09.003 |
| [4] | Reinhardt C, von BML, Manukyan D, et al. Protein disulfide isomerase acts as an injury response signal that enhances fibrin generation via tissue factor activation[J]. J Clin Invest, 2008, 118(3): 1110-1122. DOI:10.1172/JCI32376 |
| [5] | Kiouptsi K, Reinhardt C. Protein disul?de-isomerase: a trigger of tissue factor-dependent thrombosis[J]. Clin Hemorheol Microcirc, 2016, 64(3): 279-286. DOI:10.3233/CH-168106 |
| [6] | 归咏刚, 姚咏明, 柴艳芬. 血必净对脓毒症大鼠IL-6表达及血小板的影响[J]. 中国急救复苏与灾害医学杂志, 2009, 4(l): 13-16. |
| [7] | Langer F, Spath B, Fischer C, et al. Rapid activation of monocyte tissue factor by antithymocyteglobulin is dependent on complement and protein disulfide isomerase[J]. Blood, 2013, 121(12): 2324-2335. DOI:10.1182/blood-2012-10-460493 |
| [8] | Chen VM, Hogg PJ. Encryption and decryption of tissue factor[J]. Thromb Haemost, 2013, 11(Suppl.1): 277-284. DOI:10.1111/jth.12228 |
| [9] | Yi L, Huang X, Guo F, et al. Yes-associated protein (YAP) signaling regulates lipopolysacc-haride-induced tissue factor expression in human endothelial cells[J]. Surgery, 159(5): 1436-1448. DOI:10.1016/j.surg.2015.12.008 |
| [10] | Nimah M, Brilli RJ. Coagulation dysfunction in sepsis and multiple organ system failure[J]. Crit Care Clin, 2003, 19(3): 441-458. DOI:10.1016/S0749-0704(03)00008-3 |
| [11] | 陶永康, 张国强. 脓毒症与内质网应激[J]. 中华急诊医学杂志, 2017, 26(4): 367-369. DOI:10.3760/10.3760/cma.j.issn.1671-0282 |
| [12] | Dicks N, Gutierrez K, Michalak M, et al. Endoplasmic reticulum stress, genome damage, and cancer[J]. Front Oncol, 2015, 5: 11. DOI:10.3389/fonc.2015.00011 |
| [13] | Langer F, Ruf W. Synergies of phosphatidylserine and protein disulfide isomerase in tissue factor activation[J]. Thromb Haemost, 2014, 111(4): 590-597. DOI:10.1160/TH13-09-0802 |
| [14] | Popescu NI, Lupu C, Lupu F. Extracellular protein disulfide isomerase regulates coagulation on endothelial cells through modulation of phosphatidylserine exposure[J]. Blood, 2010, 116(6): 993-1001. DOI:10.1182/blood-2009-10-249607 |
| [15] | Bowley SR, Fang C, Merrill-Skoloff G, et al. Protein disulfide isomerase secretion following vascular injury initiates a regulatory pathway for thrombus formation[J]. Nat Commun, 2017, 8: 14151. DOI:10.1038/ncomms14151 |
 2018, Vol. 27
2018, Vol. 27




