感染性休克是机体对感染的反应失调导致的危及生命的急性循环功能障碍[1]。感染性休克的本质是有效循环血量不足及血流分布异常引起的组织缺血缺氧,可进展为多脏器功能障碍综合征甚至死亡[2]。改善组织灌注是感染性休克治疗的首要目标,因此组织灌注状态评价对于指导感染性休克的治疗和预后评估至关重要。经皮氧分压监测具有无创、快速、准确判断组织灌注的能力,其在感染性休克治疗和预后判断方面应当具有良好的前景,但目前尚缺乏相关研究[3]。本研究旨在探讨经皮氧分压监测在感染性休克预后判断中的价值。
1 资料与方法 1.1 一般资料前瞻性选取2013年1月至2015年12月无锡人民医院重症医学科(intensive care unit, ICU)收治的确诊为感染性休克并行经皮氧分压监测的成年患者53例,排除标准:(1)年龄 < 18岁或妊娠患者;(2)收治ICU前即诊断为感染性休克并行液体复苏患者;(3)有行经皮氧分压监测禁忌证如前胸部皮肤溃烂、疤痕、色素沉着或重度水肿等;(4)拒绝签署知情同意或放弃进一步治疗患者。本研究方案经南京医科大学附属无锡人民医院临床伦理委员会批准,所有纳入研究患者家属均签署知情同意书。
1.2 感染性休克的诊断标准采用2001年国际脓毒症联席会议制定的诊断标准, 伴有以下任意1项或2项的严重全身感染即为感染性休克:(1)充分补液后仍不能纠正的低血压(收缩压 < 90 mmHg或收缩压下降 > 40 mmHg,1 mmHg=0.133 kPa); (2)血管活性药物或正性肌力药物纠正低血压后, 组织灌注仍存在异常[4]。
1.3 治疗方案所有入选的患者均接受常规重症监护,留置中心静脉导管及动脉导管,在明确诊断后按2012年《国际严重全身感染和感染性休克管理指南》的要求立即开始早期目标导向性治疗(early goal directed therapy, EGDT)[5]。其他治疗如必要的病灶引流、抗感染、免疫调节及脏器功能支持等均参照国内外相关指南或我科诊疗规范。
1.4 经皮氧分压监测和氧负荷试验使用丹麦Radiometer公司TCM400经皮氧监测仪,使用O2/CO2联合探测电极,室温为22~25 ℃,电极温度选择44 ℃。选择前胸部第二肋间皮肤菲薄处为测定部位;安置探测器前以70%乙醇擦拭清洁皮肤,取传感器,放入导联液,排尽空气,将探头与传感器相连,放在机器指定位置进行校零,再用专用贴膜将传感器黏贴于患者皮肤。局部加热平衡10~15 min,待经皮氧分压(PtO2)读数逐步稳定后(5 min内波动 < 10 mmHg),记录基础PtO2,然后增加呼吸机供氧体积分数至100 %,记录增氧后10 min的PtO2,分别在测定PtO2同时留取动脉血气分析测定动脉血氧分压(PaO2)。10 min氧负荷值(10 min OCT)=吸入纯氧10 min后PtO2-基础PtO2,氧负荷指数(OCI)=10 min OCT/(吸入纯氧后PaO2-基础PaO2) [6]。
1.5 临床资料收集收集患者年龄、性别、感染部位、基础疾病等资料。在EGDT 0 h和6 h行经皮氧分压监测和氧负荷试验,记录0 h和6 h的10 min OCT、OCI、血流动力学指标(平均动脉压、中心静脉压)、全身氧代谢指标[中心静脉氧饱和度(ScvO2)、动脉血乳酸(Lac)]、血管活性药物(去甲肾上腺素、多巴胺、多巴酚丁胺)剂量,并统计急性生理和慢性健康状况评分Ⅱ(acute physiology and chronic health evaluationⅡ, APACHEⅡ)、序贯器官功能衰竭评分(sequential organ failure assessment, SOFA)、机械通气参数及时间等。
1.6 患者分组依据患者确诊后28 d的生存情况分为存活组和死亡组。比较两组患者基本情况、10 min OCT、OCI、血流动力学指标、全身氧代谢指标、血管活性药物剂量、APACHEⅡ、SOFA及机械通气时间等临床指标。
1.7 统计学方法采用SPSS 22.0统计学软件,计量资料如服从正态分布以均数±标准差(x±s)表示,两组间比较采用独立样本t检验;计量资料如服从偏态分布用中位数(四分位间距)[M(QL,QU)]表示,两组间比较用秩和检验;计数资料以率(%)表示,两组间比较采用χ2检验或Fisher确切概率法;采用ROC曲线分析相关指标对患者预后的预测价值;采用Kaplan-Meier法绘制患者生存曲线,Log-rank法分析患者生存情况,logistic回归分析影响患者预后的危险因素。以P < 0.05为差异有统计学意义。
2 结果 2.1 患者的基本资料共入选53例患者,其中男27例,女26例,年龄28~71岁,(49.51±13.55)岁。原发感染包括:肺部感染30例, 血流感染11例,尿路感染5例,其他部位感染7例。所有患者的APACHEⅡ(14.64±7.57),SOFA(7.74±3.00),28 d病死率为45.28 %。存活组患者29例,死亡组患者24例,两组患者的年龄、性别构成、原发感染来源、基础疾病构成、机械通气患者比例及机械通气参数等均差异无统计学意义(P > 0.05),但死亡组APACHEⅡ、SOFA较存活组更高(P < 0.01),机械通气时间较存活组更长(P < 0.01),见表 1。
| 指标 | 存活组(n=29) | 死亡组(n=24) | t/χ2/Z值 | P值 |
| 年龄(岁) | 49.01±17.94 | 50.04±12.41 | 0.22 | 0.82 |
| 男性(例,%) | 15(51.72) | 12(50.00) | 0.02 | 0.89 |
| 原发感染灶(例,%) | ||||
| 肺部感染 | 17(58.62) | 13(54.17) | 0.11 | 0.74 |
| 血流感染 | 4(13.79) | 7(29.17) | 1.89 | 0.17 |
| 尿路感染 | 3(10.34) | 2(8.33) | 0.06 | 0.80 |
| 其他感染 | 5(17.24) | 2(8.33) | 0.91 | 0.34 |
| 基础疾病(例,%) | ||||
| 糖尿病 | 5(17.24) | 4(16.67) | 0.01 | 0.96 |
| 肿瘤 | 2(6.89) | 3(12.50) | 0.48 | 0.49 |
| 免疫性疾病 | 2(6.89) | 3(12.50) | 0.48 | 0.49 |
| 机械通气患者(例,%) | 17(58.62) | 16(66.67) | 1.09 | 0.29 |
| 机械通气参数 | ||||
| 吸氧体积分数(%) | 46.95±5.12 | 55.27±6.48 | 0.64 | 0.51 |
| 潮气量(mL/kg) | 6.43±1.98 | 6.04±1.51 | 1.15 | 0.27 |
| 呼气末正压(cmH2O) | 8.44±2.78 | 10.25±3.83 | 0.78 | 0.45 |
| 平台压(cmH2O) | 25.11±8.85 | 30.87±8.22 | 0.17 | 0.86 |
| 机械通气时间(d) [M (Q1, Q3)] | 4.87(2.08, 8.38) | 9.55(5.69, 15.41) | 3.08 | < 0.01 |
| APACHEⅡ | 12.48±5.69 | 17.25±8.79 | 2.87 | < 0.01 |
| SOFA | 5.79±1.72 | 10.10±2.52 | 3.08 | < 0.01 |
| 注:除特别注明外,均采用(x±s)表示;1 cmH2O=0.098 kPa;APACHEⅡ,急性生理和慢性健康状况评分Ⅱ;SOFA,序贯器官功能衰竭评分 | ||||
两组患者液体复苏0 h和6 h的血流动力学指标、全身氧代谢指标及血管活性药物剂量均差异无统计学意义,但存活组6 h的10 min OCI、OCI显著高于死亡组,此外各组患者液体复苏6 h的平均动脉压、中心静脉压、ScvO2、10 min OCT、OCI均显著高于其0 h,但各组患者6 h Lac均较0 h显著降低,其差异均有统计学意义(P < 0.05),见表 2。
| 指标 | 0 h | 6 h | |||
| 存活组(n=29) | 死亡组(n=24) | 存活组(n=29) | 死亡组(n=24) | ||
| 平均动脉压(mmHg) | 60.11±17.93 | 58.83±16.71 | 82.04±15.08b | 78.23±13.49c | |
| 中心静脉压(mmHg) | 5.74±3.03 | 4.48±2.65 | 11.68±3.31b | 10.14±3.11c | |
| ScvO2(%) | 62.03±18.39 | 57.61±15.43 | 81.31±14.65b | 74.38±16.91c | |
| Lac(mmol/L) | 4.84±2.22 | 5.58±3.31 | 1.80±1.74b | 2.25±2.50c | |
| 去甲肾上腺素[μg/min, M (Q1, Q3] | 6.58(3.11, 14.67) | 8.23(5.79, 19.88) | 4.35(2.55, 15.68) | 7.10(5.91, 17.72) | |
| 多巴胺[μg/(kg·min), M (Q1, Q3] | 3.90(2.58, 7.57) | 5.10(4.45, 11.79) | 4.78(3.08, 8.01) | 4.50(3.45, 10.38) | |
| 多巴酚丁胺[μg/(kg·min), M (Q1, Q3] | 10.55(6.78, 17.32) | 8.65(5.43, 15.11) | 7.40(5.18, 14.32) | 9.87(6.65, 13.38) | |
| 10 min OCT(mmHg) | 43.73±27.64 | 36.50±22.71 | 77.55±18.48ab | 51.30±21.60c | |
| OCI | 0.53±0.28 | 0.47±0.29 | 0.78±0.13ab | 0.59±0.15c | |
| 注:除特别注明外,均采用(x±s)表示;与6 h死亡组比较,aP < 0.05;与0 h存活组比较,bP < 0.05;与0 h死亡组比较,cP < 0.05;1 mmHg=0.133 kPa;ScvO2,中心静脉血氧饱和度;Lac,动脉血乳酸;10 min OCT,10 min氧负荷值;OCI,氧负荷指数 | |||||
6 h 10 min OCT预测患者28 d死亡的ROC曲线下面积为(0.86±0.05), 以72.00 mmHg为最佳界值点;6 h OCI值预测患者28 d死亡的ROC曲线下面积为(0.79±0.08), 以0.76为最佳界值点;APACHEⅡ预测患者28 d死亡的ROC曲线下面积为0.89±0.04, 以17.00为最佳界值点;SOFA预测患者28 d死亡的ROC曲线下面积为(0.86±0.06), 以9.00为最佳界值点,见图 1、表 3。
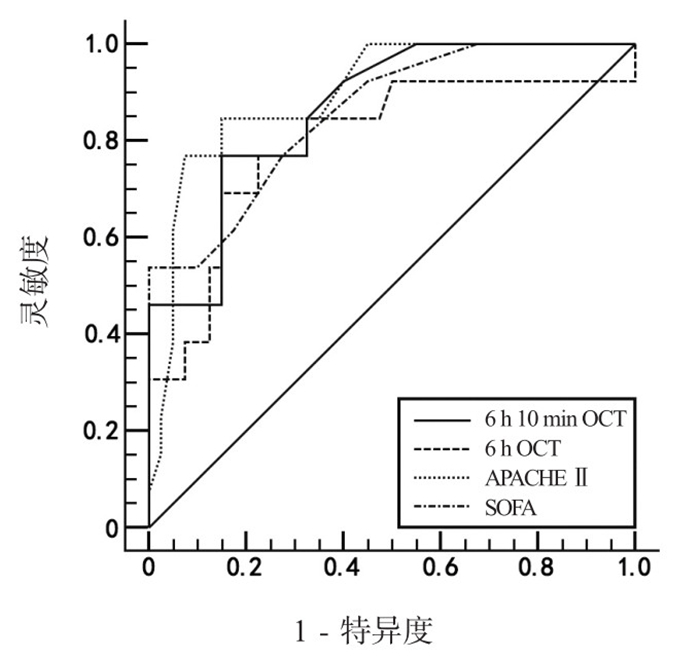
|
| 图 1 6 h 10 min OCT、6 h OCI、APACHEⅡ及SOFA预测患者28 d死亡ROC曲线 Figure 1 ROC curves of 6 h 10 min OCT, 6 h OCI, APACHEⅡ and SOFA for predicting 28 d mortality |
|
|
| 指标 | AUC | 标准误 | 95%CI | P值 | 最佳界值 | 灵敏度(%) | 特异度(%) |
| 6 h 10 min OCT | 0.86 | 0.05 | 0.76~0.87 | < 0.01 | 72.00 mmHg | 76.84 | 85.03 |
| 6 h OCI | 0.79 | 0.08 | 0.64~0.95 | < 0.01 | 0.76 | 76.84 | 77.47 |
| APACHEⅡ | 0.89 | 0.04 | 0.78~0.96 | < 0.01 | 17.00 | 84.61 | 85.03 |
| SOFA | 0.86 | 0.06 | 0.73~0.93 | < 0.01 | 9.00 | 53.78 | 99.57 |
| 注:AUC ROC曲线下面积;10 min OCT,10 min氧负荷值;OCI,氧负荷指数;APACHEⅡ,急性生理和慢性健康状况评分Ⅱ;SOFA,序贯器官功能衰竭评分 | |||||||
高6 h 10 min OCT患者31例,存活22例(70.86 %);低6 h 10 min OCT患者22例,存活7例(31.82 %)。Kaplan-Meier生存曲线分析显示,高6 h 10 min OCT患者28 d生存率显著高于低6 h 10 min OCT患者(70.86% vs. 31.82%, χ2=7.96, P < 0.01),见图 2。
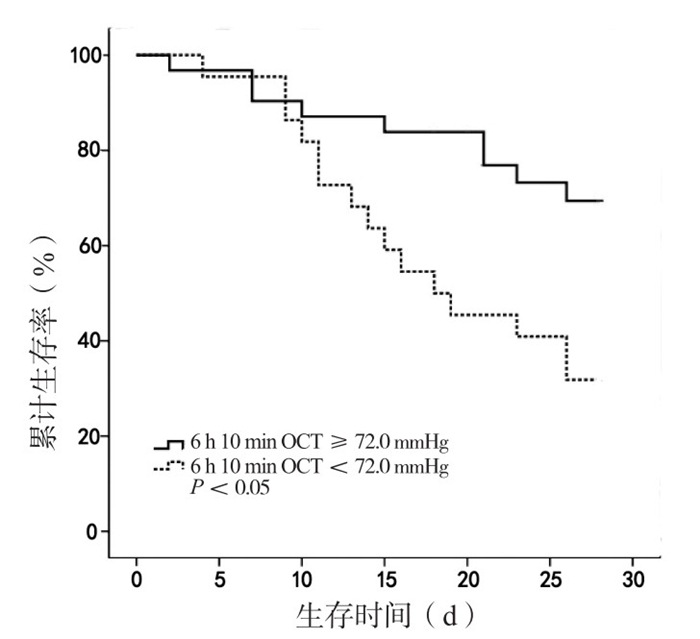
|
| 图 2 依据6 h 10 min OCT最佳界值点分组患者28 d生存率比较 Figure 2 Comparison of 28 d survival rate between groups divided by best cutoff value of 6 h 10 min OCT |
|
|
高6 h OCI患者28例,存活21例(75.00%);低6 h OCI患者25例,存活8例(32.00 %)。Kaplan-Meier生存曲线分析显示,高6 h OCI患者28 d生存率显著高于低6 h OCI患者(75.00% vs. 32.00%, χ2=9.86, P < 0.01),见图 3。
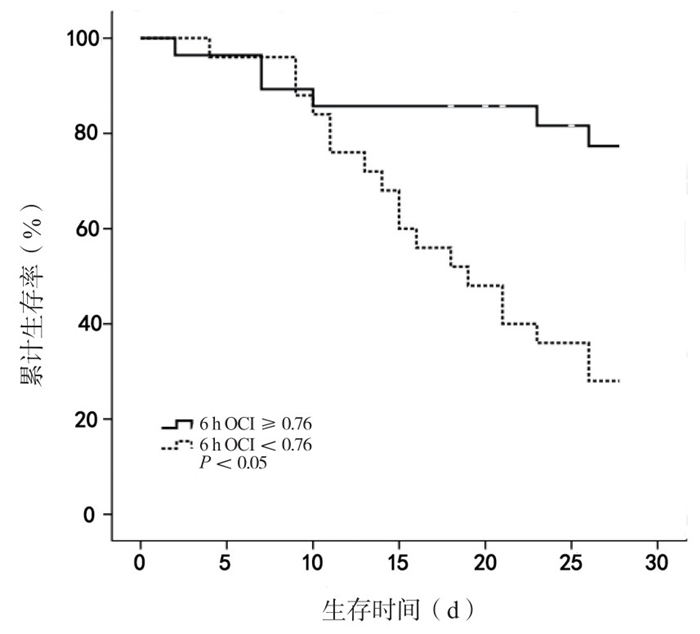
|
| 图 3 依据6 h OCI最佳界值点分组患者28 d生存率比较 Figure 3 Comparison of 28 d survival rate between groups divided by best cutoff value of 6 h OCI |
|
|
logistic单因素分析结果显示,患者死亡的危险因素包括机械通气时间、Lac、APACHEⅡ、SOFA、6 h 10 min OCT和6 h OCI。进一步logistic多因素回归分析显示APACHEⅡ、SOFA、6 h 10 min OCT和6 h OCI均是患者28 d内死亡的独立危险因素,见表 4。
| 因素 | B值 | χ2值 | OR值 | 95%CI | P值 |
| 机械通气时间 | 0.45 | 7.42 | 5.13 | 0.39~9.06 | 0.16 |
| Lac | 2.66 | 19.92 | 17.14 | 0.82~36.67 | 0.52 |
| APACHEⅡ | 0.09 | 5.40 | 1.09 | 1.01~1.18 | 0.03 |
| SOFA | 0.80 | 33.69 | 2.22 | 1.50~3.29 | < 0.01 |
| 6 h 10 min OCT | -0.09 | 25.55 | 0.92 | 0.88~0.96 | < 0.01 |
| 6 h OCI | -8.33 | 18.05 | 0.01 | 0.001~0.03 | < 0.01 |
| 注:B,回归系数;OR,比值比;Lac,动脉血乳酸;APACHEⅡ,急性生理和慢性健康状况评分Ⅱ;SOFA,序贯器官功能衰竭评分;10 min OCT,10 min氧负荷值;OCI,氧负荷指数 | |||||
感染性休克是ICU最常见的急危重症,近年来随着“拯救脓毒症行动”指南特别是EGDT的广泛应用,感染性休克患者的预后较以前有所改善,但其60 d病死率仍高达30%左右[7-9]。EGDT是目前公认的唯一能够降低感染性休克病死率的治疗措施,通过液体复苏和升压药应用改善组织灌注是EGDT改善预后的关键,因此评估组织灌注状态有利于指导感染性休克患者的治疗和预后评估。心率、尿量、神智和皮肤灌注等传统组织灌注指标的灵敏度和特异度均较差;而氧输送、氧消耗、中心静脉血氧饱和度、Lac等指标则有赖于有创性操作和专门设备[10-11]。经皮氧分压监测能够无创、快速、定量地判断组织灌注,因此成为评估感染性休克疗效和预后的最佳选择[12]。
氧负荷试验是经皮氧分压监测应用的衍生,其具体原理如下[13]:(1)局部组织灌注良好时PtO2呈PaO2依赖性,吸入纯氧后仅6~10 min PtO2即随PaO2上升;(2)依据Fick原则,局部组织缺氧时通过吸入纯氧增加的游离氧可被缺氧的细胞摄取,短时间内PtO2升高幅度降低,导致其10 min OCT较组织灌注良好的患者降低,而OCI则进一步排除了吸氧体积分数差异的影响,较10 min OCT能够更准确评估组织灌注。
本研究表明,各组患者EGDT 6 h的全身血流动力学和氧代谢指标均较其0 h显著改善,表明两组患者EGDT治疗基本达标,但存活组6 h血流动力学和全身氧代谢指标与死亡组差异无统计学意义,仅10 min OCI、OCI显著高于死亡组,这一结果不难理解,因EGDT主要关注的是平均动脉压、中心静脉压、ScvO2、Lac等全身血流动力学和氧代谢指标,而10 min OCI、OCI主要反映局部组织灌注和氧代谢,既往研究表明全身血流动力学和氧代谢指标并不能反映局部微循环和组织氧代谢情况,两者无法相互替代。如Lu等[14]研究表明感染性休克患者EGDT达标前后PtO2与氧输送、氧消耗、ScvO2及Lac均无相关性;Leone等[15]监测EGDT达标前后感染性休克患者微循环也表明灌注血管比例和微循环血流量没有差异。
本研究表明6 h 10 min OCT、6 h OCT预测患者28 d死亡的ROC曲线下面积均在0.8左右,仅略低于APACHEⅡ和SOFA,而logistic回归分析也表明6 h 10 min OCT、6 h OCI均是预测患者28 d死亡的危险因素。此前研究也得到相似结论,如何怀武等[16]研究发现对于感染性休克患者,氧负荷试验时通过10 min OCT < 57 mmHg能预测ScvO2 < 70%及心指数 < 3 L/(min·m2),而以10 min OCT=66 mmHg为最佳界值预测患者ICU死亡的灵敏度和特异度分别为65.0 %和96.2 %。此外值得关注的是,虽然两组患者的基础Lac均高于正常,但EGDT 6 h两组Lac值差异无统计学意义,回归分析也证明6 h Lac并非影响感染性休克患者预后的危险因素,究其原因可能是Lac取决于其产生和清除的动态平衡,其影响因素较多,既往多项研究也表明单次Lac值无法判断休克患者预后[17-18]。
本研究结果表明死亡组入组时APACHEⅡ、SOFA显著高于存活组,且APACHEⅡ、SOFA是预测患者28 d死亡的独立危险因素。且ROC曲线分析也提示APACHEⅡ及SOFA评估患者预后的价值仍高于6 h 10 min OCT和6 h OCT,提示临床应用中可将氧负荷试验和危重病评分结合起来用于感染性休克患者预后的判断[19]。
综上所述,氧负荷试验可早期评估ICU感染性休克患者的预后。经皮氧分压监测可用于优化感染性休克患者的治疗。
| [1] | Angus DC, Van der Poll T. Severe sepsis and septic shock[J]. N Engl J Med, 2013, 369(9): 840-851. DOI:10.1056/NEJMra1208623 |
| [2] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [3] | Lima A. Current status of tissue monitoring in the management of shock[J]. Curr Opin Crit Care, 2016, 22(3): 274-278. DOI:10.1097/MCC.0000000000000300 |
| [4] | Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference[J]. Intensive Care Med, 2003, 29(4): 530-538. DOI:10.1007/s00134-003-1662-x |
| [5] | Surviving Sepsis Campaign Guidelines Committee including The Pediatric Subgroup. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012[J]. Intensive Care Med, 2013, 39(2): 165-228. DOI:10.1007/s00134-012-2769-8 |
| [6] | Trignano E, Fallico N, Chen HC, et al. Evaluation of peripheral microcirculation improvement of foot after tarsal tunnel release in diabetic patients by transcutaneous oximetry[J]. Microsurgery, 2016, 36(1): 37-41. DOI:10.1002/micr.22378 |
| [7] | Arise Investigators, ANZICS Clinical Trials Group. Goal-directed resuscitation for patients with early septic shock[J]. N Engl J Med, 2014, 2014(371): 1496-1506. DOI:10.1056/NEJMoa1404380 |
| [8] | ProCESS Investigators. A randomized trial of protocol-based care for early septic shock[J]. N Engl J Med, 2014, 2014(370): 1683-1693. DOI:10.1056/NEJMoa1401602 |
| [9] | Mouncey PR, Osborn TM, Power GS, et al. Trial of early, goal-directed resuscitation for septic shock[J]. N Engl J Med, 2015, 372(14): 1301-1311. DOI:10.1056/NEJMoa1500896 |
| [10] | Ait-Oufella H, Bakker J. Understanding clinical signs of poor tissue perfusion during septic shock[J]. Intensive Care Med, 2016, 42(12): 2070-2072. DOI:10.1007/s00134-016-4250-6 |
| [11] | Zhang XW, Xie JF, Liu AR, et al. Hepatic perfusion alterations in septic shock patients: impact of early goal-directed therapy[J]. Chin Med J, 2016, 129(14): 1666-1673. DOI:10.4103/0366-6999.185865 |
| [12] | 卢院华, 刘玲, 邱晓华, 等. 早期目标导向治疗对感染性休克组织灌注和氧代谢的影响[J]. 中华急诊医学杂志, 2013, 22(4): 346-351. DOI:10.3760/cma.j.issn.1671-0282.2013.04.003 |
| [13] | He HW, Liu DW, Long Y, et al. The transcutaneous oxygen challenge test: a noninvasive method for detecting low cardiac output in septic patients[J]. Shock, 2012, 37(2): 152-155. DOI:10.1097/SHK.0b013e31823cc1c0 |
| [14] | Lu Y, Liu L, Qiu X, et al. Effect of early goal directed therapy on tissue perfusion in patients with septic shock[J]. World J Emerg Med, 2013, 4(2): 117-122. DOI:10.5847/wjem.j.issn.1920-8642.2013.02.006 |
| [15] | Leone M, Blidi S, Antonini F, et al. Oxygen tissue saturation is lower in nonsurvivors than in survivors after early resuscitation of septic shock[J]. Anesthesiology, 2009, 111(2): 366-371. DOI:10.1097/ALN.0b013e3181aae72d |
| [16] | 何怀武, 刘大为, 隆云, 等. 感染性休克患者经皮氧负荷试验和中心静脉血氧饱和度的相关性[J]. 中华医学杂志, 2011, 91(35): 2449-2452. DOI:10.3760/cma.j.issn.0376-2491.2011.35.001 |
| [17] | Suetrong B, Walley KR. Lactic acidosis in sepsis: it' s not all anaerobic: implications for diagnosis and management[J]. Chest, 2016, 149(1): 252-261. DOI:10.1378/chest.15-1703 |
| [18] | 袁志, 沈华浩, 张根生, 等. 早期乳酸清除率对重症慢性阻塞性肺疾病患者预后的评估[J]. 中华急诊医学杂志, 2011, 20(7): 742-745. DOI:10.3760/cma.j.issn.1671-0282.2011.07.016 |
| [19] | Xiao H, Ma S, Qi H, et al. A scoring system for assessing the severity of acute diarrhea of adult patients[J]. World J Emerg Med, 2016, 7(2): 130-134. DOI:10.5847/wjem.j.1920–8642.2016.02.008 |
 2018, Vol. 27
2018, Vol. 27




