脓毒症(sepsis)是一种严重感染、烧伤、创伤、休克及大手术后常见的并发症,其发病机制复杂且病死率较高[1]。2016国际指南已把脓毒症定义为机体对感染的反应失调而导致危及生命的器官功能障碍[2]。肺脏是脓毒症时最易受损的器官,急性肺损伤(acute lung injury,ALI)往往是脓毒症患者出现早、发生率高且严重致命的并发症。有研究证实,脓毒症后肺损伤患者的病死率高达70%~90%[3]。尽管对脓毒症致ALI的机制研究较多, 其确切机制尚不完全清楚。多数研究表明炎症因子和细胞凋亡在脓毒症急性肺损伤发病机制中占据重要作用[4-5]。
研究表明,组蛋白乙酰化/去乙酰化与肺部疾病密切相关[6]。而负责组蛋白乙酰化和去乙酰化的是一对功能相互拮抗的蛋白酶:乙酰化酶(histone acetyltransferases, HATs)和组蛋白去乙酰化酶(histone deacetylases, HDACs)。多项研究表明,HATs/HDACs平衡的紊乱不仅会使基因表达失控,导致肿瘤的发生,而且与炎症、氧化应激、凋亡等密切相关[7]。而组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors, HDACIs)是一类化合物,有抑制组蛋白去乙酰化酶的功能。有报道称,HDACIs可以通过降低炎症反应来提高烫伤休克大鼠生存率[8]。曲古霉素A(trichostatin A, TSA)是HDACIs的一种,源自链霉素代谢产物,对肺癌、胃癌、宫颈癌及神经母细胞瘤均具有明显的抗肿瘤作用,但对急性肺损伤鲜有报道。本研究通过构建盲肠结扎穿孔(cecal ligation and puncture, CLP)诱导的脓毒症小鼠模型,检测肺泡灌洗液炎症因子TNF-α、IL-1β浓度,分析肺湿干质量比及肺组织病理学改变,检测肺组织凋亡情况,评估TSA对脓毒症急性肺损伤的保护作用。
1 材料与方法 1.1 实验主要材料和试剂TSA和DMSO(Sigma公司,圣路易市,美国),TNF-α和IL-1β的ELISA试剂盒(西唐生物科技有限公司,上海,中国),TUNEL测试试剂盒(凯基生物科技发展有限公司,南京,中国),BCA蛋白浓度测定试剂盒(碧云天生物技术研究所,上海,中国),CytC(细胞色素C)、天冬半胱氨酸特异性蛋白酶-9 (cysteinyl aspartate specific protease-9, caspase-9)和天冬半胱氨酸特异性蛋白酶-3(cysteinyl aspartate specific protease-3, caspase-3)单克隆抗体(Cell Signaling Technology公司,波士顿,美国),羊抗兔二抗(碧云天生物技术研究所,上海,中国),超纯RNA提取试剂(TaKaRa公司,大连,中国), 反转录试剂盒(TaKaRa公司,大连,中国),Real-time PCR试剂盒(TaKaRa公司,大连,中国),RNA Loading Buffer(TaKaRa公司,大连,中国)。
1.2 动物分组与处理健康雄性清洁级BALB/c小鼠90只,体质量20~25 g,由上海斯莱克实验动物有限责任公司提供,许可证号:SCXK(沪)2012-0002。小鼠饲养及动物实验在温州医科大学实验动物中心进行,使用许可证号:SYXK (浙)2010.0150。实验遵循国际通行的动物福利和伦理准则。将90只BALB/c小鼠随机(随机数字法)分为假手术组(Sham组)、脓毒症组(CLP组)、CLP+DMSO组(DMSO组)、CLP+TSA(1 mg/kg)组、CLP+TSA(5 mg/kg)组和CLP+TSA(10 mg/kg)组,每组15只。脓毒症CLP模型采用清洁级小鼠[9],禁食1 d,自由饮水,腹腔注射1%戊巴比妥钠10 mg/kg麻醉后采用正中切口1~2 cm,3-0丝线在血管弓结扎末端1/3盲肠,20号针头穿透结扎线远端盲肠的两侧肠壁,使肠内容物少量自穿刺孔溢出,将盲肠还纳回腹腔,用1-0丝线逐层缝合关腹,术毕立即皮下注射生理盐水复苏;假手术组只开腹、牵引盲肠、复位、关腹、复苏,但盲肠既不结扎,也不穿孔;DMSO组在CLP造模前12 h腹腔注射500 μL生理盐水稀释的10%DMSO,CLP+TSA(1、5、10 mg/kg)组则是在造模前12 h分别在腹腔注入10% DMSO稀释不同剂量的TSA成500 μL的TSA溶液。
1.3 小鼠肺组织干湿比检测造模24 h后开胸取左肺吸干表面液体,称湿质量,然后放入80 ℃烤箱烘干至恒重,称干质量;计算肺组织含水量:肺含水量=(湿质量-干质量)/湿质量×100%。
1.4 小鼠肺泡灌洗液中炎症因子检测造模后24 h,麻醉小鼠,沿胸骨正中劈开,暴露气管及双肺。将右肺门结扎,沿气管前壁插入注射器针头,注入冰PBS 0.5 mL,2 min后吸出冲洗液并将其再次注射入肺组织,按此方法行支气管肺泡灌洗5次,回收率为90%。将回收的肺泡灌洗液立即放入低温高速离心机中,4 ℃、500×g离心10 min,留取上清,采用ELISA法检测TNF-α及IL-1β浓度,具体操作严格按试剂盒说明书进行。
1.5 小鼠肺组织病理学观察指定时间点收集左肺脏,置于体积分数为10%中性甲醛溶液中固定,石蜡包埋,制作5 μm切片,常规苏木精-伊红染色(HE),光学显微镜下观察肺组织病理变化。每只小鼠肺脏切片随机选取10个视野观察,由病理专家通过观察肺泡水肿、出血及中性粒细胞浸润,从正常到严重病变为0~4分,计算总得分,进行评估。
1.6 TUNEL法检测肺组织凋亡采用TUNEL法按试剂盒说明操作进行。取小鼠肺脏后以4%多聚甲醛固定,脱水后石蜡包埋制备石蜡切片,二甲苯脱蜡,梯度酒精水化后,PBS冲洗(2×3)min;蛋白酶K消化15 min,PBS冲洗(2×3)min;擦干组织周围的水份,每片加50 μL的0.3% H2O2甲醇溶液,阻断内源性过氧化酶,PBS冲洗(2×3)min;擦干组织周围的水份。每片加25 μL的TUNEL反应液。于孵育盒中37 ℃,60 min,PBS冲洗(3×3)min;擦干组织周围的水份,每片加25 μL的辣根过氧化酶抗体,孵育盒中37 ℃,30 min,PBS冲洗(3×3)min;擦干组织周围的水份,每片加一滴新鲜配制的DAB室温孵育5~10 min,PBS冲洗(3×3)min。苏木精复染,酒精脱水,干燥,中性树胶封片。细胞核呈棕色的细胞为凋亡阳性细胞。每组随机取10张切片,每张切片在高倍镜下(×400)随机观察5个不重叠视野,计算阳性细胞数和总细胞数的比值,取其平均数为凋亡指数(apoptotic index,AI)。
1.7 蛋白免疫印迹法(Western blotting)检测小鼠肺脏组织Caspase-3、Caspase-9和CytC蛋白表达水平取小鼠肺脏组织,按核蛋白抽提试剂盒说明书提取肺组织核蛋白,BCA法测蛋白浓度。制备上样缓冲液,蛋白上样量为50 μg,制备SDS-PAGE分离胶(10%),浓缩胶(3%),80 V电泳45 min,当样品进入分离胶时,将电压调至110 V,电泳60 min,转膜,封闭60 min,加入Caspase-3、Caspase-9和CytC单克隆抗体(1:l 000),4 ℃孵育过夜用PBST洗膜,加入二抗,37 ℃孵育2 h,再用TBST洗膜,ECL显影,用图像分析系统分析蛋白条带灰度值。
1.8 小鼠生存率观察为进一步观察TSA对脓毒症小鼠生存率的影响,另取120只小鼠随机(随机数字法)分为假手术组(sham组)、脓毒症组(CLP组)、脓毒症+DMSO组(二甲基亚砜组)、脓毒症+TSA(1 mg/kg组)、脓毒症+TSA(5 mg/kg组)、脓毒症+TSA(10 mg/kg组),每组20只小鼠,动物处理如上所述。造模后1、3、5、7 d时统计小鼠死亡数。进行统计学分析。
1.9 统计学方法实验结果数据若服从正态分布则以均数±标准差(x±s)表示,应用SPSS 23.0统计软件进行数据处理,样本若服从正态分布,多组均数比较若服从正态分布采用单因素方差分析(ANOVA),药物干预组与对照组比较若服从正态分布采用Dunnett-t检验。小鼠生存率采用Log-rank检验进行分析,以P < 0.05为差异有统计学意义。
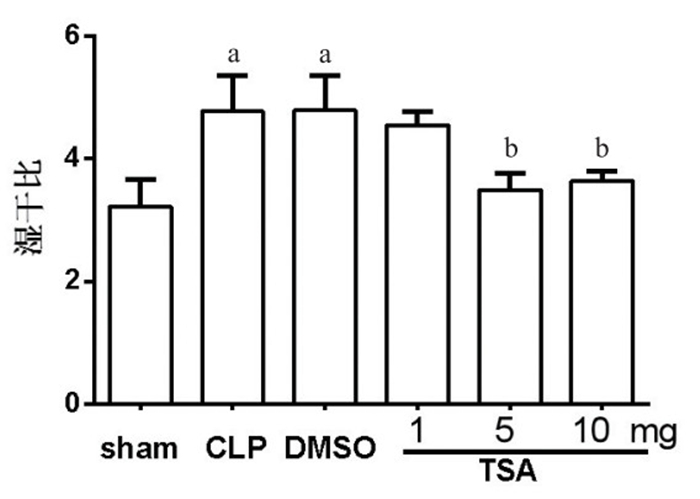
2 结果 2.1 TSA对脓毒症小鼠肺组织湿干比的影响假手术组小鼠W/D值为3.22±0.44,与假手术组相比,CLP组小鼠W/D明显升高(t=3.655,P=0.021),差异有统计学意义。与CLP组比较,DMSO组W/D值差异无统计学意义(t=0.042,P=0.968),说明DMSO对其湿干比无明显影响。单因素方差分析显示干预组之间差异有统计学意义(F=19.67,P=0.002)。Dunnett-t检验发现,与DMSO组比较,TSA干预组W/D值降低,差异有统计学意义(P < 0.05)。
|
| 图 1 TSA对脓毒症小鼠肺组织W/D值的影响 Figure 1 Effects of TSA on lung W/D in septic mice |
|
|
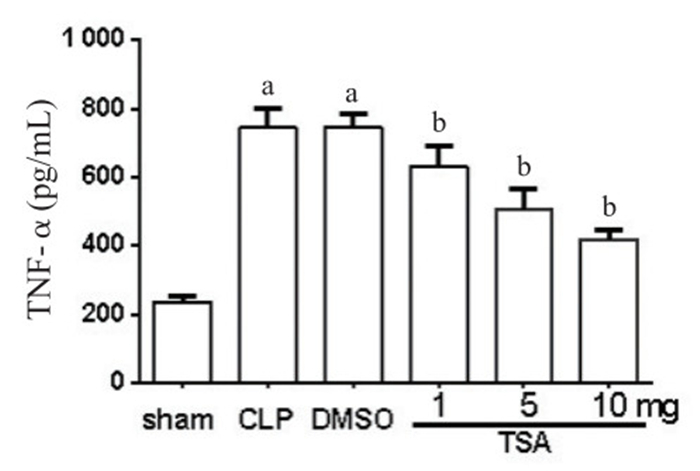
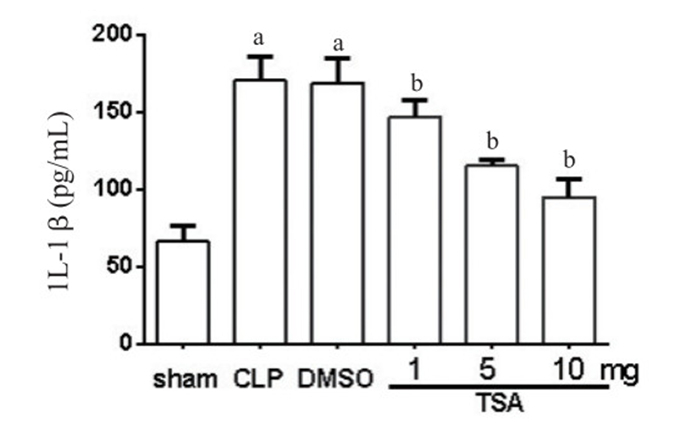
假手术组小鼠支气管肺泡灌洗液TNF-α水平为(237.23±15.72)pg/mL,与假手术组相比,CLP组小鼠TNF-α明显升高(t=14.59,P=0.0001),差异有统计学意义。与CLP组比较,DMSO组TNF-α值差异无统计学意义(t=0.01,P=0.99),说明DMSO对TNF-α无明显影响。单因素方差分析显示干预组之间差异有统计学意义(F=3.38,P=0.006)。Dunnett-t检验发现,与DMSO组比较,TSA干预组TNF-α水平降低,差异有统计学意义(P < 0.05),且在10 mg剂量时差异最显著(图 2)。假手术组小鼠支气管肺泡灌洗液IL-1β水平为(66.33±10.02)pg/mL,与假手术组比较,CLP组小鼠IL-1β明显升高(t=9.938,P=0.000 6),差异有统计学意义。与CLP组比较,DMSO组IL-1β水平差异无统计学意义(t=0.10,P=0.921),说明DMSO对IL-1β无明显影响。单因素方差分析显示干预组之间差异有统计学意义(F=20.66,P=0.002)。Dunnett-t检验发现,与DMSO组比较,TSA干预组IL-1β水平降低,差异有统计学意义(P < 0.05),且在10 mg剂量时差异最显著(图 3)。
|
| 与sham组比较,aP < 0.05;与DMSO组比较,bP < 0.05 图 2 支气管肺泡灌洗液中TNF-α水平比较 Figure 2 Concentrations of TNF-α in BALF |
|
|
|
| 与sham组比较,aP < 0.05;与DMSO组比较,bP < 0.05 图 3 支气管肺泡灌洗液中IL-1β水平比较 Figure 3 Concentrations of IL-1β in BALF |
|
|
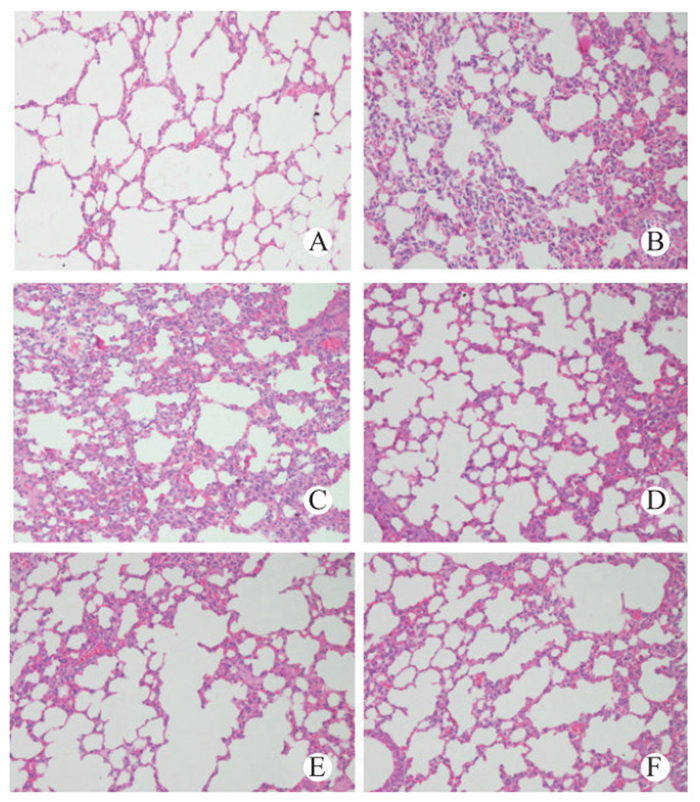
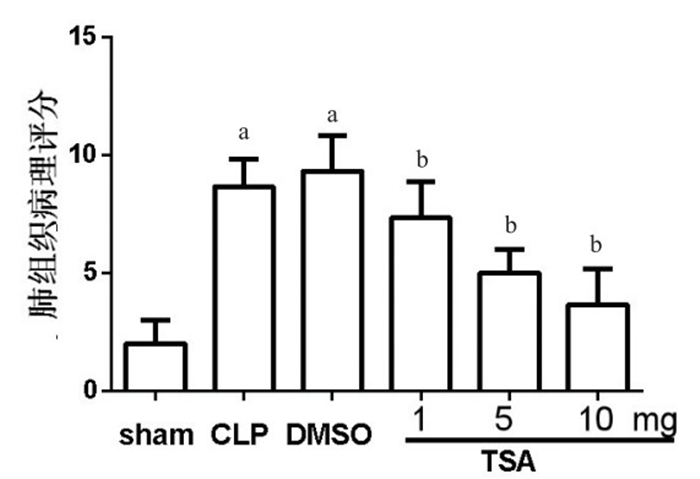
假手术组肺脏组织结构完整,肺泡间隔基本无水肿、炎症,肺泡腔清晰,CLP组及DMSO组小鼠大部分肺泡腔内可见渗出、水肿、出血,肺间质有大量炎性细胞浸润,而TSA干预组小鼠上述病变减轻,其中TSA 10 mg组最明显(图 4)。病理评分显示:与假手术组相比,CLP组小鼠肺组织病理评分明显升高(t=7.559,P=0.0016),差异有统计学意义。与CLP组比较,DMSO组评分值差异无统计学意义(t=0.603,P=0.579)。单因素方差分析显示干预组之间差异有统计学意义(F=5.47,P=0.044)。Dunnett-t检验发现,与DMSO组比较,TSA干预组肺组织病理评分降低,差异有统计学意义(P < 0.05),且在10 mg剂量时差异最显著(图 5)。
|
| A:sham组;B:CLP组;C:DMSO组;D:TSA 1 mg组;E:TSA 5 mg组;F:TSA 10 mg组 图 4 各组光镜下肺组织病理学改变(HE×400) Figure 4 Pulmonary histopathotogic features(HE×400) |
|
|
|
| 与sham组比较,aP < 0.05;与DMSO组比较,bP < 0.05 图 5 各组小鼠肺组织病理评分比较 Figure 5 Phathological scores of lung tissues in eath group |
|
|
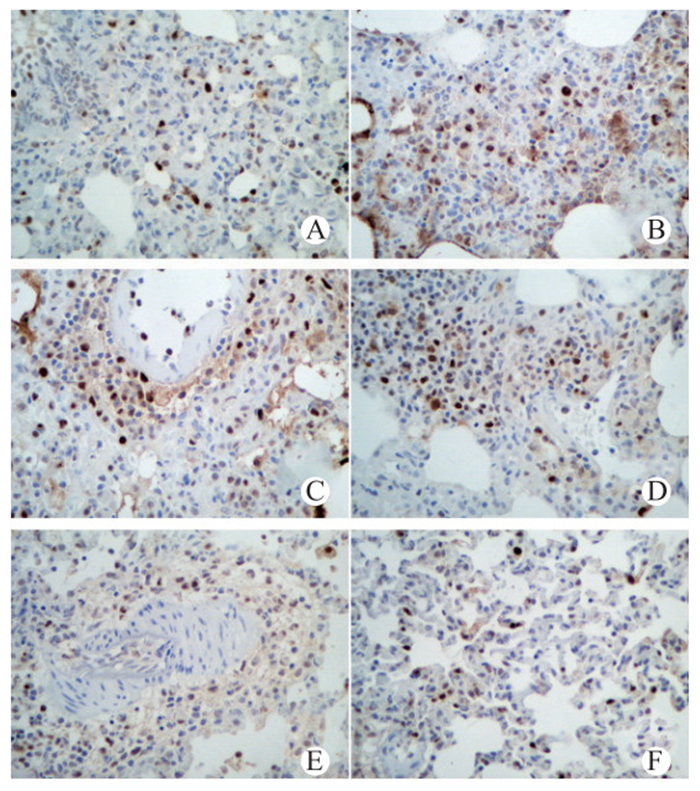
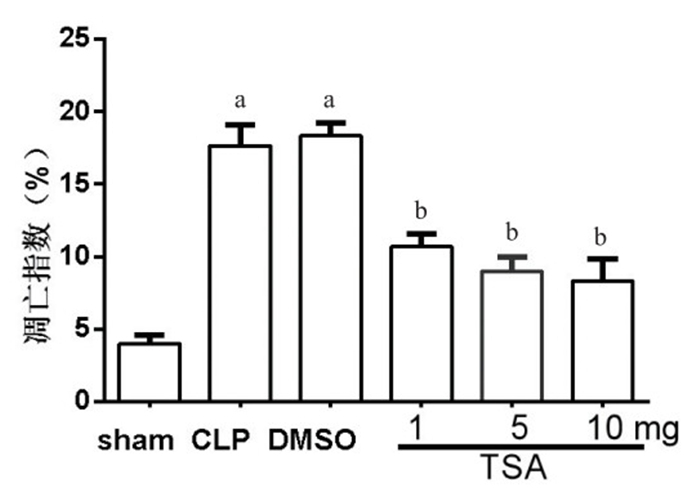
TUNEL法检测小鼠肺脏细胞凋亡,正常肺脏细胞核呈蓝色,凋亡心肌细胞核呈深浅不一的棕色,各组小鼠肺脏细胞凋亡见图 6。与假手术组凋亡指数(4.21±0.54)%相比,CLP组小鼠肺组织凋亡指数明显升高(17.1±2.34)%,t=8.741,P=0.000 9,差异有统计学意义。与CLP组比较,DMSO组评分值差异无统计学意义(t=0.392,P=0.715)。
|
| A:sham组;B:CLP组;C:DMSO组;D:TSA 1 mg组;E:TSA 5 mg组;F:TSA 10 mg组 图 6 各组肺组织凋亡情况(TUNEL×400) Figure 6 Lung tissues apoptosis in each group(TUNEL×400) |
|
|
单因素方差分析显示干预组之间差异无统计学意义(F=2.29,P=0.18)。Dunnett-t检验发现,与DMSO组比较,TSA干预组肺组织病理评分降低,差异有统计学意义(P < 0.05),且在10 mg剂量时[AI=(8.33±0.88)%]差异最显著(图 7)。
|
| 与sham组比较,aP < 0.05;与DMSO组比较,bP < 0.05 图 7 各组小鼠肺组织凋亡指数比较 Figure 7 Apoptotic index of lung tissues in eath group |
|
|
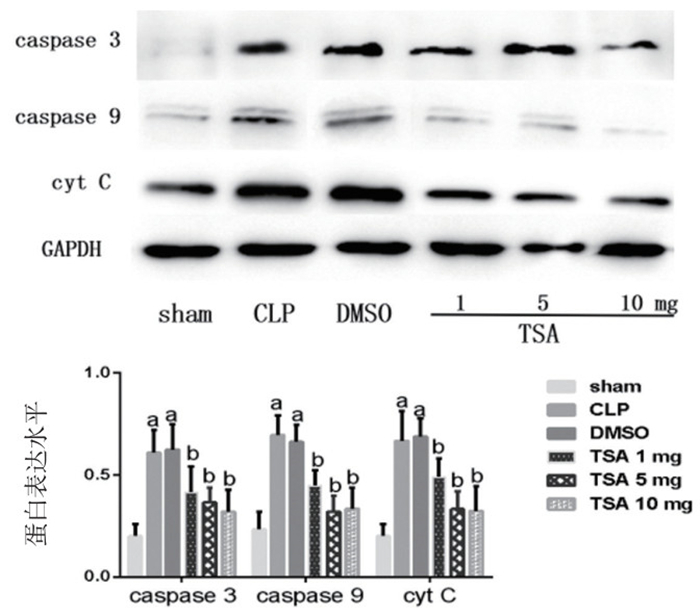
与假手术组相比,CLP组小鼠caspase 3、caspase9、CytC蛋白表达水平明显升高(P < 0.05),差异有统计学意义。与CLP组比较,DMSO组caspase 3、caspase9、CytC蛋白表达水平差异无统计学意义(P > 0.05)。Dunnett-t检验发现,与DMSO组比较,TSA干预组caspase 3、caspase9、CytC蛋白表达水平降低,差异有统计学意义(P < 0.05)(图 8)。
|
| 与sham组比较,aP < 0.05;与DMSO组比较,bP < 0.05 图 8 各组小鼠肺组织caspase 3、caspase 9、CytC蛋白表达水平比较 Figure 8 The protein expression of caspase 3, caspase 9, CytC detected by Western blot |
|
|
各组造模后观察7 d内小鼠生存率变化,假手术组7 d内未见小鼠死亡,CLP模型组20只小鼠第1天死亡6只,第2天死亡4只,第3天死亡2只,第4天死亡2只,第5天死亡2只,第6天和第7天未见死亡小鼠。统计学分析示CLP模型组7 d内小鼠生存率明显下降(P=0.000 1)。与CLP模型组相比,DMSO组小鼠生存率差异无统计学意义(P=0.898)。与DMSO组相比,TSA 1 mg组和TSA 5 mg组生存率差异无统计学意义(P=0.114,P=0.068),而TSA 10 mg组小鼠第1天死亡2只,第2天死亡2只,第3天死亡2只,第4天死亡2只,第5天、第6天和第7天未见死亡小鼠。生存分析示TSA 10 mg组较DMSO组生存率升高,差异有统计学意义(P=0.007 2)(图 9)。
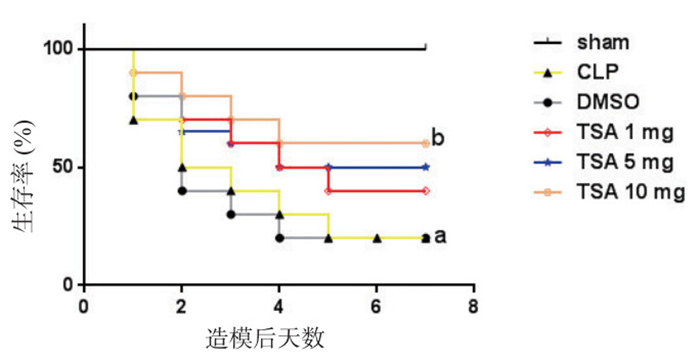
|
| 与sham组比较,aP < 0.05;与DMSO组比较,bP < 0.05 图 9 TSA对脓毒症小鼠生存率影响 Figure 9 Effect of TSA on the survival of mice after CLP |
|
|
在脓毒症易受损器官中,肺脏是脓毒症最易被攻击的靶器官,患者常较早并发急性肺损伤,是脓毒症患者死亡的主要原因之一。国内外学者在脓毒症急性肺损伤发病机制方面进行了大量的基础及临床研究,但是迄今为止尚未形成统一共识。目前,关于脓毒症急性肺损伤发病机制多集中在炎症反应、细胞凋亡、氧化应激损伤等。本实验采用盲肠结扎穿孔(CLP)的方法制备脓毒症模型,这是目前公认的与临床相关性较强的脓毒症模型。造模后,在内毒素或内毒素样物质的作用下,机体中性粒细胞、单核巨噬细胞、血管内皮发生复杂的免疫网络反应,释放出大量的内源性炎症介质,造成多脏器包括肺脏的损害。多数研究显示CLP术后24 h急性肺损伤较明显[10-11],故本实验于术后24 h采集标本检测。
本研究结果显示,CLP术后急性肺损伤符合临床急性肺损伤特点。首先,CLP术后肺组织病理学观察可见肺泡腔渗出、水肿、出血,肺间质有大量炎性细胞浸润。其次,广泛、严重的炎症反应可导致细胞外基质的破坏和肺泡膜损伤,是ALI发展的关键环节。在众多参与脓毒症ALI的炎症介质中,TNF-α、IL-1β是最早释放的因子之一[12]。TNF-α可激活多条信号转导通路,引起促炎细胞因子和炎症介质失控性释放[13];IL-1β则主要通过促进巨噬细胞的成熟和分化,上调黏附分子的表达来加强炎性反应[14]。在本实验中,CLP小鼠BALF内TNF-α、IL-1β浓度较假手术组明显升高,说明脓毒症急性肺损伤炎症反应加重。
组蛋白乙酰化酶与组蛋白去乙酰化酶可通过调节染色体结构而影响炎症基因的表达,亦可以通过调节非组蛋白的乙酰化和去乙酰化参与疾病的进程。在肺部疾病中,两者的相互平衡导致基因的异常表达或者相关调控因子的异常表达与肺癌、COPD、哮喘、激素抵抗等疾病密切相关[6]。近年来,HDACIs作为抗炎药物用于自身免疫性疾病的治疗也逐渐受到重视。其抗炎作用主要是通过抑制炎症反应中具有重要作用的细胞因子及一氧化氮(nitric oxide,NO)的生成而实现的[15-16]。TSA是应用最广泛的一种组蛋白去乙酰化酶抑制剂。有报道TSA和辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)能抑制小鼠脾细胞及人狼疮细胞中IL-6、IL-10、IL-12、IFN-γ的产生[17];TSA可抑制IL-1β诱导的NO和前列腺素PGE2的产生及一氧化氮合酶(inducible nitric oxide synthase,iNOS)和COX-2的表达,并可抑制IL-17和TNF-α诱导的NO及PGE2的生成[18]。也有研究称TSA抑制TNF-α和IL-1β的产生可减轻LPS诱导的ALI小鼠模型肺组织的损伤[19]。本研究发现TSA能抑制CLP术后小鼠BALF中TNF-α和IL-1β,这与大多数研究结果一致,而其具体机制目前仍不清楚。有研究证实HDACIs可通过影响NF-κB和MAPK的表达, 在抑制TLR4-MyD88信号通路中有重要作用[20]。其具体抗炎机制有待进一步深入研究。
肺泡上皮细胞(alveolar epithelial cell,AEC)的凋亡是ALI患者肺泡细胞死亡的主要机制之一[21]。虽然ALI/ARDS中AEC的凋亡机制尚不明确,但已有研究发现与外源性死亡受体途径Fas/FasL和内源性线粒体系统有关[22]。CytC是一个由线粒体释放的促凋亡蛋白,正常情况下存在于线粒体膜间隙和细胞核内,内毒素刺激后,导致CytC从线粒体内释放至胞质[23],激活Caspase家族。Caspase-3的活化是细胞凋亡进入不可逆阶段的标志。活化的Caspase-3能对拓朴异构酶Ⅱ、核纤层蛋白B、组蛋白H切割而使DNA上的核酸酶切位点暴露,使DNA更容易受到氧自由基和核酸内切酶的破坏,最终导致DNA片段化,细胞出现凋亡[24]。本研究发现TSA可以抑制脓毒症肺组织cytC、caspase3、caspase9蛋白表达,说明TSA可以通过线粒体途径减轻脓毒症肺组织凋亡。这与另一项研究结果一致,Takebe等[25]研究也发现组蛋白去乙酰化酶抑制剂能够减轻脓毒症肺脏和脾脏凋亡,但不能抑制炎症反应,这可能是其抑制剂不同的原因所致。
综上所述,TSA可通过抑制炎症反应及肺组织凋亡减轻脓毒症急性肺损伤,提示TSA可能成为脓毒症治疗的新靶点。然而其具体机制有待进一步探讨。
| [1] | Lin JC, Spinella PC, Fitzgerald JC, et al. New or progressive multiple organ dysfunction syndrome in pediatric severe sepsis: a sepsis phenotype with higher morbidity and mortality[J]. Pediatr Crit Care Med, 2017, 18(1): 8-16. DOI:10.1097/PCC.0000000000000978 |
| [2] | Freund Y, Lemachatti N, Krastinova E, et al. Prognostic accuracy of sepsis-3 criteria for in-hospital mortality among patients with suspected infection presenting to the emergency department[J]. JAMA, 2017, 317(3): 301-308. DOI:10.1001/jama.2016.20329 |
| [3] | Hsitsma JJ, Lachmann B. Lung protective ventilation in ARDS:the open lung maneuver[J]. Minerva Anestesiologica, 2006, 72(3): 1117-1132. DOI:10.1111/j.1440-1754.2012.02532.x |
| [4] | Gill SE, Rohan M, Mehta S. Role of pulmonary microvascular endothelial cell apoptosis in murine sepsis-induced lung injury in vivo[J]. Respir Res, 2015, 16(1): 109. DOI:10.1186/s12931-015-0266-7 |
| [5] | Hirano Y, Aziz M, Yang WL, et al. Neutralization of osteopontin attenuates neutrophil migration in sepsis-induced acute lung injury[J]. Crit Care, 2015, 19(1): 53. DOI:10.1186/s13054-015-0782-3 |
| [6] | 冯秋琴, 宋诗雨, 田曼, 等. 组蛋白乙酰化酶及去乙酰化疾病酶与肺部[J]. 国际呼吸杂志, 2014, 34(22): 1752-1756. DOI:10.3760/cma.j.issn.1673-436X.2014.22.017 |
| [7] | Barnes PJ. New therapies for chronic obstructive pulmonary disease[J]. Med Princ Pract, 2010, 19(5): 330-338. DOI:10.1136/thx.53.2.137 |
| [8] | 周国勇. 组蛋白去乙酰化酶抑制剂对烫伤休克大鼠肺微血管内皮细胞活化和通透性的影响[D]. 北京: 解放军医学院, 2010. |
| [9] | Rittirsch D, Huber-Lang MS, Flierl MA, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4(1): 31-36. DOI:10.1038/nprot.2008.214 |
| [10] | 曹天辉, 蒋磊, 康凯, 等. 青蒿琥酯上调血红素氧合酶-1对脓毒症小鼠急性肺损伤的作用研究[J]. 中华急诊医学杂志, 2015, 24(11): 1227-1233. DOI:10.3760/cma.j.issn.1671-0282.2015.11.009 |
| [11] | 卞佳兰, 莫清飞, 罗欢, 等. 生长停滞特异性蛋白6对脓毒症小鼠急性肺损伤的保护研究[J]. 中华急诊医学杂志, 2017, 26(2): 161-167. DOI:10.3760/cma.j.issn.1671-0282.2017.02.008 |
| [12] | Frost RA, Nystrom GJ, Lang CH. Lipopolysaccharide regulates proinflammatory eytokine expression in mouse myoblasts and skeletal muscle[J]. Am J Physiol Regul Integr Comp Physiol, 2002, 283(3): R698-709. DOI:10.1152/ajprefu.00039.2002 |
| [13] | 温前宽, 李彦, 杨建萍, 等. 严重脓毒症患者炎症因子的动态变化及预后意义[J]. 中华急诊医学杂志, 2015, 24(7): 779-783. DOI:10.3760/cma.j.issn.1671-0282.2015.07.020 |
| [14] | 陈璐, 冯伟, 郭轶男, 等. 右美托咪啶对脓毒症急性肺损伤大鼠IL-1β和IL-4表达的作用[J]. 解剖科学进展, 2016, 22(2): 133-135. DOI:10.16695/j.cnki.1006-2947.2016.02.004 |
| [15] | Säemann MD, Parolini O, Böhmig GA, et al. Bacterial metabolite interference with maturation of human monocyte-derived dendritic cells[J]. J Leukoc Biol, 2002, 71(2): 238-246. |
| [16] | Diakos C, Prieschl EE, Saemann M, et al. Novel mode of interference with nuclear factor of activated T-cells regulation in T-cells by the bacterial metabolite n-butyrate[J]. J Biol Chem, 2002, 277(27): 24243-24251. DOI:10.1074/jbc.M200191200 |
| [17] | Adcock IM. HDAC inhibitors as anti-inflammatory agents[J]. Br J Pharmacol, 2007, 150(7): 829-831. DOI:10.1038/sj.bjp.0707166 |
| [18] | Chabane N, Zayed N, Afif H. Histone deacetylase inhibitors supress interleukin-1 beta-induced nitricoxide and prostaglandin E2 production in human chondrocytes[J]. Osteoarthritis Cartilage, 2008, 16(10): 1267-1274. DOI:10.1016/j.joca.2008.03.009 |
| [19] | 雷鸣, 倪云峰, 李小飞, 等. 曲古菌素A对脂多糖致急性肺损伤小鼠的保护作用观察[J]. 解放军医学杂志, 2012, 37(4): 283-287. |
| [20] | Petri S, Kiaei M, KipianiK, et al. Additiveneuroprotective effects of a Histone deacetylase inhibitor and a catalytic antioxidant in a transgenic mouse model of amyotrophic lateral sclerosis[J]. Neurobiol Dis, 2006, 22(1): 40-49. DOI:10.1016/j.nbd.2005.09.013 |
| [21] | Martin TR, Nakamura M, MatuteBello G. The role of apoptosis in acute lung injuIy[J]. Crit Care Med, 2003, 3(4 Suppl): S184-188. DOI:10.1097/01.ccm.0000057841.33876.b1 |
| [22] | Kitamura Y, Hashimoto S, Mizuta N, et al. Fas/FasL-dependent apoptosis of alveolar cells after lipopolysaccharide-induced lung injury in mice[J]. Am J Respir Crit Care Med, 2001, 163(3): 762-769. DOI:10.1164/ajrccm.163.3.2003065 |
| [23] | Lim ML, Chen B, Beart PM, et al. Relative timing of redistribution of cytochrome c and Smac/DIABLO from mitochondria during apoptosis assessed by double immunocytochemistry on mammalian cells[J]. Exp Cell Res, 2006, 312(7): 1174-1184. DOI:10.1016/j.yexcr.2006.01.026 |
| [24] | 肖艳, 吕回. 高氧对新生大鼠肺细胞色素C和caspase-3表达及细胞凋亡的影响[J]. 医学综述, 2011, 17(13): 2053-2055. DOI:10.3969/j.issn.1006-2084.2011.13.047 |
| [25] | Takebe M, Oishi H, Taguchi K, et al. Inhibition of histone deacetylases protects septic mice from lung and splenic apoptosis[J]. J Surg Res, 2014, 187(2): 559-570. DOI:10.1016/j.jss.2013.10.050 |
 2018, Vol. 27
2018, Vol. 27




