近年来尽管危重病救治技术有所提高,但脓毒症仍然严重威胁人类健康,其病死率高达20%[1]。肺脏是脓毒症最易累及的靶器官,其诱导的急性肺损伤(ALI)是脓毒症导致的最常见的器官功能障碍[2-3]。有研究表明p38 MAPK信号转导通路参与了脓毒症与内毒素诱发的肺损伤,抑制该信号通路的表达可以明显减轻ALI[4-5]。溴环己胺醇(商品名:沐舒坦,ambroxol),作为一种黏液溶解剂进入临床,有研究发现其可以减少大鼠吸入性的肺损伤、气道高反应性以及炎症反应[6-8]。但沐舒坦减轻肺损伤的具体生物学机制尚未阐明。本研究拟评价沐舒坦预处理对小鼠脓毒症所致肺损伤时p38丝裂原活化蛋白激酶(p38 MAPK)通路的影响,为明确其机制提供参考。
1 材料与方法 1.1 实验动物与分组健康成年雄性C57BL/6J (NM-CKO-00081)小鼠60只,体质量20~25 g,由南华大学动物医学中心提供,于室温22~25℃安静环境下常规饲养,昼夜交替,可自由饮水,适应环境1周。采用随机数字表法,将其分为3组(n=20):假手术组(S组)、脓毒症肺损伤组(CLP组)和脓毒症肺损伤+沐舒坦预处理组(AMB组)。
1.2 试剂与仪器注射用沐舒坦由上海勃林格殷格翰医药股份有限公司提供。血气分析仪(GEM3000,IL公司,美国)。多通道生理记录仪(Drager公司,德国)。离心机(AllegraTM 6,BECKMAN公司,美国)。显微镜(BX51T,OLYMPUS公司,日本)。ELISA双抗夹心法试剂盒(SHINO-TEST公司,日本)。
1.3 模型制备AMB组以沐舒坦(规格2 mL/15 mg)50 mg/kg于造模前腹腔注射预处理3 d,每天一次,S组和CLP组给予等容量生理盐水腹腔注射。实验前禁食8 h,自由饮水。CLP组与AMB组参照文献[9]介绍的方法制作脓毒症肺损伤模型。小鼠麻醉后固定于手术台上,常规消毒,于前腹正中作1 cm切口,游离盲肠和肠系膜,以4号丝线环形结扎盲肠根部,12号针头于盲端部位贯通穿孔,挤出少许粪便,还纳肠管,4号丝线逐层缝合关腹。术毕皮下注射生理盐水20 mL/kg补充体液丢失,肌肉注射青霉素80万U/kg防止切口感染,术后自由饮水。S组仅做开腹、盲肠游离及关腹。
1.4 PaO2测定及支气管肺泡灌洗造模后24 h,采集颈动脉血样2~3 mL,采用全自动血气分析仪(i-STAT公司,美国)测定并记录PaO2,然后颈动脉放血处死动物。迅速取出肺组织,用4 ℃生理盐水反复灌洗左肺3次,回收全部支气管肺泡灌洗液(BALF),4 ℃下2 000 r/min离心10 min。取上清液-70℃冻存,采用ELISA法(试剂盒购自美国A & D公司)测定白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和细胞间黏附分子-1(ICAM-1)浓度。
1.5 肺组织湿/干质量比(W/D)比取右肺上叶,用滤纸吸干肺组织表面水分,称湿质量,置于80 ℃烘干箱48 h至恒重(2次测定值差小于0.05 mg)后测定干质量(D),计算肺组织湿/干质量比(W/D)。
1.6 肺组织病理学检查右肺中叶置于4 ℃的4%多聚甲醛PBS溶液中固定48 h,常规石蜡包埋、切片(厚度约4 μm)、HE染色,光镜下观察肺组织病理学改变,并对肺损伤进行评分。观察肺间质水肿、肺泡水肿、中性粒细胞浸润和肺泡内充血4项指标进行评分[10],无改变或非常轻微改变为0分;轻度、中度、重度、极重度改变依次为1分、2分、3分、4分,4项累计总分即为肺损伤评分。右肺下叶置于液氮中保存。
1.7 RT-PCR检测肺组织细胞间IL-1β、TNF-α、IL-6和ICAM-1 mRNA表达水平测定取左肺上叶部分组织,加液氮研磨,提取肺组织总RNA,以β-actin为内参,半定量RT-PCR法检测IL-1β、TNF-α、IL-6和ICAM-1 mRNA表达水平。
RT-PCR试剂盒(一步法)由大连宝生物公司提供。IL-1β、TNF-α、IL-6、ICAM-1及β-actin引物由上海生工生物工程技术服务有限公司合成,引物序列如下:IL1-β上游:5' -GGTCCAATACCAAAAGAA-3' ;下游:5' -ACAAAGGGAGTACGCCAGTC-3' ,扩增产物长度400 bp。TNF-α上游:5' -CAGGCGGTGCCTATGTCTC-3' ;下游:5' -CGATCACCCCGAAGTTCAGTAG-3' ,扩增产物长度400 bp。IL-6上游:5' -TCTATACCACTTCACAAGTCGGA-3' ;下游:5' -GAATTGCCATTGCACAACTCTTT-3' ,扩增产物长度400 bp。ICAM-1上游:5' -GTATGAACTGAGCAATGTGCAAG-3' ;下游:5' -GTTCCACCCGTTCTGGAGTC-3' ,扩增产物长度400 bp。β-actin上游:5' -CCGGTAATGAGGGCCCAGAG-3' ;下游:5' -CTCTTGCAGAAATTGATGGC -3' ,扩增产物长度400 bp。取总RNA 10 µg,采用Taqman逆转录试剂盒克隆cDNA,-20 ℃保存。RT-PCR循环参数设置:预变性95 ℃,2 min;95℃,30 s;58℃,30 s;72 ℃,90 s;循环30次。采用LightCycler480荧光定量PCR仪(Roche公司,美国)检测各样本的域值循环数,以2-ΔΔCT反映目的基因的相对表达[11]。
1.8 蛋白质免疫印迹法(Western blot)检测p38 MAPK、p-p38 MAPK的表达取左肺下叶组织,采用Western blot法检测p38 MAPK、p-p38 MAPK的表达水平。取冻存的左肺下叶组织,加入裂解液和酶抑制剂后匀浆。4 ℃离心,12 000 r/min离心15 min,离心半径8 cm,丢弃沉淀,采用BCA法定量检测上清液蛋白浓度。取50 µg样品,加上样缓冲液,使蛋白变性后行SDS-PAGE电泳,电泳分离的蛋白转至PVDF膜。用5%的脱脂牛奶室温中封闭2 h,TBST洗膜10 min,重复3次。加入兔抗鼠单克隆抗体p38 MAPK (1:1 000,Abcam公司,美国)、p-p38 MAPK抗体(1:1 000,Abcam公司,美国)4 ℃孵育过夜。TBST洗膜10 min,重复3次。分别加入相应的辣根过氧化物酶标记的山羊抗兔lgG二抗(1:2 000,北京中杉金桥生物技术有限公司),室温下摇床杂交1 h。ECL底物发光A、B显色剂(Thermo Scientic Pierce公司,美国)按照1:1比例混匀后滴加于膜上,显色曝光。并使用Image J图像分析软件测定蛋白条带灰度值,计算p-p38/p38灰度值的比值反映p38 MAPK的磷酸化程度,即p-p38 MAPK的表达水平。
1.9 统计学方法采用SPSS 18.0统计学软件进行分析。计量资料以均数±标准差(x±s)表示,组间比较在符合正态性分布和方差齐性下采用单因素方差分析,组间两两比较采用SNK-q检验。计数资料组间比较采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 肺组织病理学检查光镜下,S组肺组织结构基本正常,肺泡腔及肺间质结构清晰,肺泡间偶见炎性细胞浸润(图 1A);CLP组肺泡内与肺间质允血、水肿明显,肺间质有大量炎症细胞浸润,肺泡间隔明显增宽,局灶的肺泡塌陷和肺不张,肺泡结构紊乱(图 1B);AMB组肺组织损伤程度较CLP组明显减轻,肺泡间隔有稍许增宽,炎症细胞浸润较CLP组明显减少,肺泡有充气扩张(图 1C)。
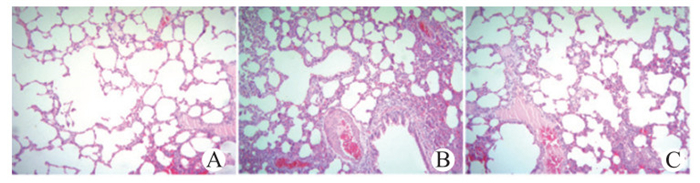
|
| A:S组;B:CLP组;C:AMB组 图 1 各组光镜下肺组织HE染色(×100) Figure 1 Henntoxylin and eosin stain in lung tissue of rats (×100) |
|
|
与S组比较,CLP组和AMB组PaO2明显降低,W/D和肺损伤评分明显升高(P < 0.05);与CLP组比较,AMB组PaO2明显升高,W/D和肺损伤评分明显降低(P < 0.05)。见表 1。
| 组别 | 只数 | PaO2(mmHg) | W/D | 肺损伤评分(分) |
| S组 | 20 | 99.4±5.6 | 3.8±1.0 | 2.8±0.7 |
| CLP组 | 20 | 63.7±9.2a | 9.8±2.5a | 11.9±2.5a |
| AMB组 | 20 | 85.7±8.3ab | 6.3±1.9ab | 7.2±2.3ab |
| F值 | 68.67 | 89.34 | 93.56 | |
| P值 | < 0.01 | < 0.01 | < 0.01 | |
| 注:与S组比较,aP < 0.05;与CLP组比较,bP < 0.05;1 mmHg=0.133 kPa | ||||
与S组比较,CLP组和AMB组BALF中总蛋白浓度、IL-1β、TNF-α、IL-6及ICAM-1浓度均明显升高(P < 0.05);与CLP组比较,AMB组BALF中总蛋白浓度、IL-1β、TNF-α、IL-6及ICAM-1浓度均明显降低(P < 0.05)。见表 2。
| 组别 | 只数 | 总蛋白浓度 | IL-1β浓度 | TNF-α浓度 | IL-6浓度 | ICAM-1浓度 |
| S组 | 20 | 378.6±69.2 | 46.3±11.3 | 83.2±15.4 | 77.5±12.6 | 171.6±29.3 |
| CLP组 | 20 | 1258.4±105.8a | 108.7±19.0a | 191.6±25.4a | 145.4±21.6a | 309.8±56.4a |
| AMB组 | 20 | 799.1±81.2ab | 82.5±17.1ab | 132.3±18.7ab | 106.7±23.8ab | 231.5±37.2ab |
| F值 | 45.37 | 51.66 | 52.79 | 71.45 | 66.76 | |
| P值 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | |
| 注:与S组比较,aP < 0.05;与CLP组比较,bP < 0.05 | ||||||
与S组比较,CLP组和AMB组肺组织IL-1β mRNA、TNF-α mRNA、IL-6 mRNA和ICAM-1 mRNA表达量明显增加(P < 0.05);与CLP组比较,AMB组肺组织IL-1β mRNA、TNF-α mRNA、IL-6 mRNA和ICAM-1 mRNA表达量明显减少(P < 0.05)。见表 3。
| 组别 | 只数 | IL-1β | TNF-α | IL-6 | ICAM-1 |
| S组 | 20 | 0.75±0.09 | 0.93±0.12 | 1.11±0.12 | 0.60±0.03 |
| CLP组 | 20 | 3.08±0.41a | 2.99±0.27a | 2.69±0.26a | 2.36±0.25a |
| AMB组 | 20 | 1.88±0.25ab | 1.65±0.19ab | 1.91±0.22ab | 1.75±0.18ab |
| F值 | 66.45 | 94.56 | 83.67 | 51.45 | |
| P值 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | |
| 注:与S组比较,aP < 0.05;与CLP组比较,bP < 0.05 | |||||
三组肺组织p38 MAPK表达水平差异均无显著性(P > 0.05);与S组比较,CLP组和AMB组大鼠肺组织p-p38 MAPK平均吸光度值均明显升高(P < 0.05);与CLP组比较,AMB组大鼠肺组织p-p38 MAPK平均吸光度值明显明显降低(P < 0.05)。CLP组和AMB组A p-p38 / A p38的比值明显高于S组,且以CLP组的比值最高(P < 0.05)。见表 4与图 2。
| 组别 | 只数 | p38 MAPK | p-p38 MAPK | A p-p38 / A p38 |
| S组 | 20 | 0.64±0.07 | 0.47±0.08 | 0.77±0.12 |
| CLP组 | 20 | 0.73±0.04 | 1.22±0.17a | 1.81±0.27a |
| AMB组 | 20 | 0.69±0.08 | 0.89±0.13ab | 1.32±0.18ab |
| F值 | 1.78 | 53.72 | 86.35 | |
| P值 | < 0.01 | < 0.01 | < 0.01 | |
| 注:与S组比较,aP < 0.05;与CLP组比较,bP < 0.05 | ||||
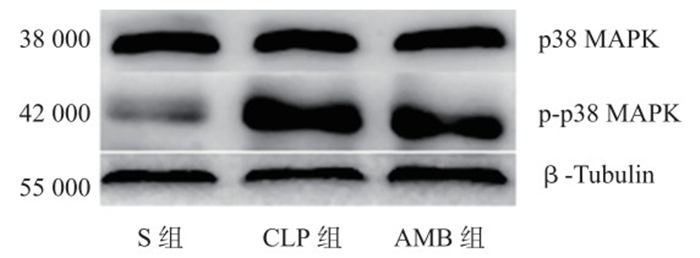
|
| 图 2 Western blot检测各组肺组织p38 MAPK、p-p38 MAPK的表达 Figure 2 Western blot detects the expression of p38 MAPK, p-p38 MAPK in lung tissue |
|
|
本研究照文献[9]介绍的造模方法,采用盲肠结扎并穿孔法制备脓毒症肺损伤模型。研究结果显示,造模后24 h与S组相比,CLP组肺组织中IL-1β、IL-6和TNF-α等炎症因子的表达明显升高,BALF中炎症介质浓度升高,W/D比值升高,病理学检查肺损伤显著,有明显的炎症细胞浸润,部分肺泡腔出血、广泛渗出,表明肺通透性增加,病理损伤加重,综合以上结果充分提示本研究实验条件下脓毒症肺损伤模型制备成功。
肺脏是脓毒症早期最易受损的靶器官,急性肺损伤以肺泡毛细血管膜损伤,肺微血管通透性持续增加为基础,病理特征为肺水肿和肺不张[12]。ALI的临床特征为进行性低氧血症和呼吸窘迫综合征。严重脓毒症患者ALI的发生率为25%~50%,尽管进行积极的治疗,ALI的病死率仍然高达70%~90%[13-14]。P38 MAPK通路激活的特征性表现为p38 MAPK发生磷酸化形成p-p38 MAPK。ICM-1在ALI的发生发展过程中发挥重要作用,其可调节中性粒细胞向肺组织内皮细胞黏附。本研究结果显示S组肺组织病理结构基本正常,W/D比、肺损伤评分、BALF总蛋白、IL-1β、TNF-α、IL-6均处于较低水平;p-p38MAPK与ICM-1也仅有较低水平的表达。而脓毒症肺损伤的CLP组和AMB组较S组肺组织病理结构损伤较为严重,W/D比、肺损伤评分、BALF总蛋白、IL-1β、TNF-α、IL-6均明显著增加;p-p38MAPK与ICM-1的表达也明显升高。以上结果说明脓毒症可激活肺内p38 MAPK信号通路,导致致炎因子的表达增加,中性粒细胞向肺组织浸润,最终导致肺损伤程度加重。
沐舒坦能减少黏液腺分泌,增加呼吸道黏膜浆液腺的分泌降低痰液黏度,促进肺泡表面活性物质的分泌,增加支气管纤毛运动,具有较高的安全性与稳定的疗效,因此目前广泛应用于临床。沐舒坦的主要活性成分盐酸氨溴索能作用于分泌细胞,分泌肺表面活性物质(PS),降低肺表面活性张力;增强纤毛的摆动,促进痰液排出;抗氧自由基,降低炎症细胞的活性;雾化吸入使局部药物浓度增高,并延长药物的作用时间[15-16]。众多临床研究表明,大剂量的沐舒坦能减轻胸外伤所致的肺挫伤以及感染引起的细菌性肺炎,减少肺部并发症和加快肺功能的恢复[17-19]。本研究参照文献[7]并结合本课题组前期预试验,最终选择沐舒坦给药剂量为50 mg/kg腹腔注射。结果显示,与CLP组比较,AMB组肺W/D比下降,BALF总蛋白、IL-1β、TNF-α、IL-6及ICM-1浓度下降,肺组织IL-1β、TNF-α、IL-6及ICM-1 mRNA表达水平降低,病理学损伤减轻,提示沐舒坦可减轻脓毒症所致肺损伤。同时AMB组p-p38MAPK的表达较CLP组明显降低,说明沐舒坦可以抑制p38 MAPK通路的活化,从而减轻肺损伤的炎症反应与中性粒细胞的聚集。
综上所述,笔者推测沐舒坦可减轻小鼠脓毒症肺损伤,其机制可能与抑制p38 MAPK信号通路的活化有关。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Villar J, Sulemanji D, Kacmarek RM. The acute respiratory distress syndrome: incidence and mortality, has it changed?[J]. Curr Opin Crit Care, 2014, 20(1): 3-9. DOI:10.1097/MCC.0000000000000057 |
| [3] | Schouten LR, Schultz MJ, van Kaam AH, et al. Association between maturation and aging and pulmonary responses in animal models of lung injury: a systematic review[J]. Anesthesiology, 2015, 123(2): 389-408. DOI:10.1097/ALN.0000000000000687 |
| [4] | 张桂诚, 余剑波, 宫丽荣, 等. p38丝裂原活化蛋白激酶通路在电针减轻兔内毒素休克诱发急性肺损伤中的作用[J]. 中华麻醉学杂志, 2013, 33(8): 989-992. DOI:10.3760/cma.j.issn.0254-1416.2013.08.022 |
| [5] | 郑君刚, 侯金超, 张凯, 等. 苏拉明对脂多糖致小鼠急性肺损伤的防治作用[J]. 中华急诊医学杂志, 2015, 24(12): 1412-1416. DOI:10.3760/cma.j.issn.1671-0282.2015.12.019 |
| [6] | Ge LT, Liu YN, Lin XX, et al. Inhalation of ambroxol inhibits cigarette smoke-induced acute lung injury in a mouse model by inhibiting the Erk pathway[J]. Int Immunopharmacol, 2016, 33: 90-98. DOI:10.1016/j.intimp.2016.02.004 |
| [7] | Takeda K, Miyahara N, Matsubara S, et al. Immunomodulatory effects of ambroxol on airway hyperresponsiveness and inflammation[J]. Immune Netw, 2016, 16(3): 165-175. DOI:10.4110/in.2016.16.3.165 |
| [8] | 邵小玲. 肝素联合沐舒坦雾化吸入对慢性阻塞性肺病急性加重期的治疗[J]. 中华急诊医学杂志, 2007, 16(7): 756-758. DOI:10.3760/j.issn.1671-0282.2007.07.021 |
| [9] | 金惠铭. 盲肠结扎穿刺后的大鼠败血症模型[J]. 中国病理生理杂志, 1990, 6(2): 126-127. |
| [10] | Kozian A, Schilling T, Freden F, et al. One-lung ventilation induces hyperperfusion and alveolar damage in the ventilated lung: an experimental study[J]. Br J Anaesth, 2008, 100(4): 549-559. DOI:10.1093/bja/aen021 |
| [11] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [12] | Cannon JW, Gutsche JT, Brodie D. Optimal strategies for severe acute respiratory distress syndrome[J]. Crit Care Clin, 2017, 33(2): 259-275. DOI:10.1016/j.ccc.2016.12.010 |
| [13] | Calfee CS, Eisner MD, Ware LB, et al. Trauma-associated lung injury differs clinically and biologically from acute lung injury due to other clinical disorders[J]. Crit Care Med, 2007, 35(10): 2243-2250. DOI:10.1097/01.CCM.0000280434.33451.87 |
| [14] | Fleischmann C, Scherag A, Adhikari NK, et al. Assessment of global incidence and mortality of hospital-treated sepsis. Current estimates and limitations[J]. Am J Respir Crit Care Med, 2016, 193(3): 259-272. DOI:10.1164/rccm.201504-0781OC |
| [15] | Gupta PR. Ambroxol -resurgence of an old molecule as an anti-inflammatory agent in chronic obstructive airway diseases[J]. Lung India, 2010, 27(2): 46-48. DOI:10.4103/0970-2113.63603 |
| [16] | Refai M, Brunelli A, Xiumé F, et al. Short-term perioperative treatment with ambroxol reduces pulmonary complications and hospital costs after pulmonary lobectomy: a randomized trial[J]. Eur J Cardiothorac Surg, 2009, 35(3): 469-473. DOI:10.1016/j.ejcts.2008.11.015 |
| [17] | 吴俊峰, 段俊峰, 张耀森, 等. 大剂量沐舒坦对胸部创伤所致肺损伤的治疗的作用[J]. 临床肺科杂志, 2008, 13(11): 1420-1422. DOI:10.3969/j.issn.1009-6663.2008.11.016 |
| [18] | 吴红涛, 麻晓林, 蒋耀光. 沐舒坦针剂治疗兔创伤性急性肺损伤的实验研究[J]. 创伤外科杂志, 2005, 7(1): 57-60. DOI:10.3969/j.issn.1009-4237.2005.01.019 |
| [19] | 叶胜捷, 张文振, 庞淑光, 等. 早期大剂量乌司他丁与沐舒坦联合使用对特重度烧伤肺功能保护的临床研究[J]. 中国医药导刊, 2014(2): 284-285. |
 2018, Vol. 27
2018, Vol. 27




