随着人口老龄化、肿瘤发病率上升以及侵入性医疗手段的增加,脓毒症在住院患者的发病率不断上升,而一经发展为脓毒性休克,其病死率平均高达42.9%[1-2]。去甲肾上腺素(norepinephrine,NE)是2014版脓毒性休克指南推荐治疗脓毒性休克的首选血管活性药物[1],但临床上常见大剂量应用去甲肾上腺素和其他儿茶酚胺类药物不能维持平均动脉压(mean arterial pressure,MAP)≥65 mmHg(1 mmHg=0.133 kPa)。有研究显示,在NE基础上联合应用特利加压素(terlipressin,TP)可以有效地治疗儿茶酚胺无反应性休克,并能显著减少NE的使用剂量[3-4]。且2007年Luckner等[5]认为,当血管加压素(vasopressin, AVP)的泵速达到0.067 U/min时,其维持血流动力学稳定及减少儿茶酚胺用量方面的作用要明显高于其泵速为0.033 U/min时,且不增加不良事件发生率。作为AVP的衍生物,TP在维持血流动力学方面也可能有相应的优势。为此,笔者组织了单中心随机双盲对照研究以观察TP治疗脓毒性休克的有效性与安全性。
1 资料与方法 1.1 一般资料选取2015年6月1日至2016年5月31日入住郑州大学第一附属医院综合ICU的28例脓毒性休克患者,所有患者或家属签署知情同意书。入选标准:符合最新脓毒性休克指南诊断标准[1, 6],排除标准:(1)器官移植后;(2)怀孕或哺乳中;(3)年龄 < 18岁或 > 80岁;(4)基础疾病预后恶劣,并可能成为患者死亡主因;(5)急性冠脉综合征;(6)急性肠系膜动脉缺血;(7)雷诺现象,全身性硬化,或者血管痉挛体质患者。本研究经郑州大学第一附属医院伦理委员会批准同意。
1.2 研究设计 1.2.1 试验分组本研究采用随机双盲对照研究方法,利用计算机产生的随机数将入选患者随机分为TP组和NE组。本研究于www.clinicaltrial.gov注册,临床试验注册号为NCT01697410。
1.2.2 试验药物注射用TP由深圳市翰宇药业有限公司生产,国药准字H20093804,规格为1 mg/mL。注射用NE由远大医药有限公司生产,国药准字H42021301,规格为2 mg/mL。
1.2.3 用药方案所有入选患者均给予及时处理感染源、早期抗微生物治疗量复苏、器官功能支持等一般治疗[1]。TP组和NE组分别接受1 mg TP和11 mg NE微量泵持续泵入;两组研究药物均配制于50 mL 5%葡萄糖注射液中,并统一外观标签,对临床医师及患者设盲。研究药物泵速可在2~8 mL/h范围内调整,假设患者体质量为60 kg,经计算TP的泵速约为0.6~2.6 μg/(kg·h),而NE的泵速则约为7~30 μg/min。本研究中TP和NE的量效关系参考了2008年的VASST研究[7]和2009年的TERLIVAP[8]研究,该两项研究通过滴定的方法得出0.03 U/min的VAP大致相当于1.3 μg/(kg·h)的TP或15 μg/min的NE。若MAP不能维持65 mmHg以上时,由临床医师决定加用开放标签的NE或其他儿茶酚胺类药物(如多巴胺,多巴酚丁胺,肾上腺素等)。开放标签的NE或者其他儿茶酚胺类药物剂量单位采用μg/(kg·min),保留小数点后3位。
1.2.4 观察目标本研究终点为休克纠正、死亡或退出研究,主要观察目标是休克纠正,定义为停用研究药物及其他开放标签的升压药物后,MAP维持在65 mmHg以上至少24 h,且动脉血乳酸水平小于2.0 mmol/L[9]。次要观察目标是开放标签NE需要量、28 d生存率及不良事件发生率。
1.3 统计学方法本研究包括如下3个分析集:(1)全分析集(full analysis set,FAS):包括符合入选标准并且接受至少1次药物治疗的受试者,剔除无试验数据的受试者。(2)符合方案集(per-protocol set,PPS):包括符合下列要求的受试者:①符合入选标准,不符合排除标准②完成实验方案并具有完整试验数据③排除中途退出试验者。(3)安全数据集:包括接受至少1次药物治疗的受试者。
SPSS 22.0软件用于数据的统计学分析, 计量资料的正态性检验采用Kolmogorov-Smirnov检验,符合正态分布的计量资料以(x±s)表示,非正态分布的计量资料以中位数(四分位数)[M(Q1,Q3)]表示。两组计量资料的比较采用t检验或Wilcoxon秩和检验,计数资料比较采用χ2检验或Fisher确切概率法。生存资料分析采用Kaplan-Meier法。以P < 0.05为差异有统计学意义。
2 结果 2.1 病例情况TP组和NE组分别随机入选13和15例患者,均符合入选标准并且接受至少1次药物治疗,无试验数据缺失,故FAS人群为28例:TP组13例,NE组15例。TP组有2例因不良事件退出研究,NE组有1例因放弃治疗退出研究,故PPS人群为25例:TP组11例,NE组14例。所有患者均进入安全性分析集,评价其安全性。入组时两组患者一般临床资料差异无统计学意义。见表 1。
| 基线资料 | NE组(n=13) | TP组(n=15) | P值 |
| 年龄(岁,x±s) | 50.46±15.76 | 52.33±13.58 | 0.738 |
| 男性(例,%) | 10(76.92) | 9(60.00) | 0.293 |
| 体质量(kg,x±s) | 68.46±7.47 | 63.08±7.53 | 0.069 |
| 慢性疾病史(例,%) | |||
| 心血管疾病 | 3(23.08) | 1(6.67) | 0.244 |
| 肝病 | 2(15.38) | 2(13.33) | 0.644 |
| 慢性呼吸系统疾病 | 1(7.69) | 0(0.00) | 0.464 |
| 神经系统疾病 | 3(23.08) | 0(0.00) | 0.087 |
| 创伤 | 4(30.77) | 5(33.33) | 0.604 |
| 肿瘤 | 2(15.38) | 1(6.67) | 0.444 |
| 感染部位(例,%) | |||
| 肺部 | 6(46.15) | 7(46.67) | 0.638 |
| 腹部 | 6(46.15) | 4(26.67) | 0.249 |
| 血流 | 6(46.15) | 10(66.67) | 0.239 |
| 其他 | 1(7.69) | 3(20.00) | 0.356 |
| 14天内手术史(例,%) | 5(38.46) | 7(46.67) | 0.479 |
| APACHEⅡ评分(x±s) | 16.39±8.29 | 18.94±8.89 | 0.457 |
| SOFA评分(x±s) | 10.46±3.62 | 12.07±4.03 | 0.281 |
| MAP(mmHg,x±s) | 71.97±14.00 | 73.42±19.44 | 0.823 |
| 乳酸(mmol/L)a | 3.10(2.00,5.40) | 4.00(1.75,5.25) | 0.980 |
| 血肌酐(μmol/L,x±s) | 96.39±60.59 | 98.16±49.64 | 0.933 |
| ALT(U/L)a | 35.00(25.00,2.00) | 30.00(14.50,5.50) | 0.408 |
| INR(x±s) | 1.36±0.35 | 1.34±0.43 | 0.892 |
| 总胆红素(μmol/L)a | 19.70(14.50,53.70 | 21.80(9.70,6.10) | 0.433 |
| 注:APACHE Ⅱ评分,急性生理和慢性健康评分(acute physiology-and chronic health-evaluation score); SOFA评分,序贯器官衰竭估计评分(sequential organ failure assessment score); ALT,谷丙转氨酶(alanine transaminase); INR,国际标准化比值(international normalized ratio);a以中位数(四分位数)表示 | |||
分析FAS和PPS人群,用药结束时两组患者休克纠正率差异均无统计学意义(P > 0.05)。见表 2。
| 指标 | TP组(%) | NE组(%) | P值 |
| FAS人群(例,%) | n=13 | n=15 | |
| 休克纠正 | 9(69.23) | 8(53.33) | 0.453 |
| 休克未纠正 | 2(15.38) | 6(40.00) | |
| PPS人群(例,%) | n=11 | n=14 | |
| 休克纠正 | 9(81.82) | 8(57.14) | 0.190 |
| 休克未纠正 | 2(18.18) | 6(42.86) |
FAS人群中,两组均有7例患者需要联合应用开放标签NE;PPS人群中,TP组和NE组分别有5例和7例患者需要联合应用开放标签NE。分析FAS和PPS人群,用药期间两组开放标签NE的需要量差异无统计学意义(P > 0.05)。见表 3、4。
| 组别 | 0 | 6 h | 12 h | 24 h | 48 h |
| TP组(n=7) | 0.601±0.518 | 1.579±2.736 | 1.611±2.730 | 0.777±0.936 | 0.440±0.483 |
| NE组(n=7) | 0.916±0.613 | 1.240±0.599 | 1.373±1.039 | 1.257±1.035 | 0.996±0.782 |
| t值 | -1.027 | 0.320 | 0.216 | -0.910 | -1.591 |
| P值 | 0.325 | 0.755 | 0.832 | 0.381 | 0.138 |
| 注:数据来源于需要开放标签NE的患者 | |||||
| 组别 | 0 | 6 h | 12 h | 24 h | 48 h |
| TP组(n=5) | 0.664±0.609 | 2.196±3.109 | 2.136±3.146 | 1.066±1.014 | 0.370±0.440 |
| NE组(n=7) | 0.921±0.670 | 1.240±0.656 | 1.373±0.987 | 1.257±0.957 | 0.996±0.709 |
| t值 | -0.703 | 0.679 | 0.607 | -0.318 | -1.598 |
| P值 | 0.498 | 0.533 | 0.557 | 0.757 | 0.141 |
| 注:数据来源于需要开放标签NE的患者 | |||||
对于FAS人群,TP组和NE组的28 d生存率分别为8/13和8/15,经Fisher确切概率法检验,差异无统计学意义(P=0.479);对于PPS人群,TP组和NE组的28天生存率分别为7/11和7/14,经Fisher确切概率法检验,差异无统计学意义(P=0.393)。图 1、2分别为FAS人群和PPS人群采用Kaplan-Meier法绘制的28 d生存曲线。FAS人群Log-Rank检验结果:χ2=0.207,P=0.649;PPS人群Log-Rank检验结果:χ2=0.522,P=0.470。两组生存曲线分析差异均无统计学意义。
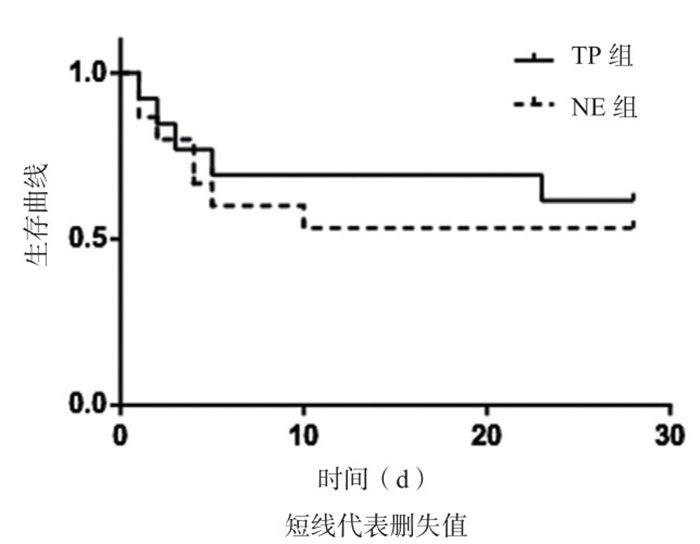
|
| 图 1 FAS人群两组患者28 d生存曲线(Kaplan-Meier法) Figure 1 28-day survival curve of two groups in the FAS population (Kaplan-Meier) |
|
|
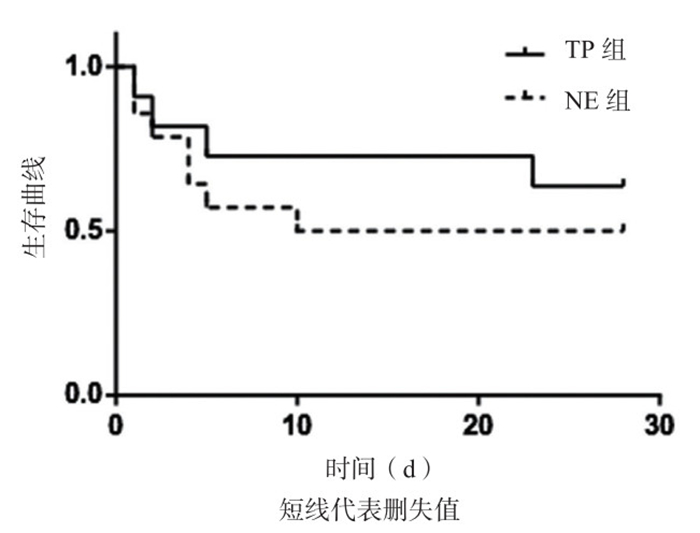
|
| 图 2 PPS人群两组患者28 d生存曲线(Kaplan-Meier法) Figure 2 28-day survival curve of two groups in the PPS population (Kaplan-Meier) |
|
|
所有28例患者进入安全性分析,TP组与NE组不良事件发生率分别为4/13和1/15,用Fisher确切概率法分析两组差异无统计学意义(P=0.122)。TP组不良事件共4例:1例并发严重低钠血症及肠缺血,停用研究药物后症状缓解,2例发生指端缺血,其中1例停用研究药物,另1例给予补液等对症处理好转,继续应用研究药物,1例低钠血症,未停用研究药物, 对症处理后好转;NE组共发生1例指端缺血,未停止研究药物,对症处理后好转。
3 讨论本研究发现,TP用于治疗脓毒性休克时的休克纠正率、28 d生存率及不良反应发生率与NE相当;用药期间两组开放标签NE需要量差异无统计学意义。
鉴于系统性血管舒张为脓毒性休克的核心病理生理学机制,血管收缩剂用来改善血流动力学及逆转微循环衰竭[10-11]。不同于NE等儿茶酚胺的药理学机制,TP主要作用于血管平滑肌的V1受体引起血管收缩[12]。本研究显示,TP治疗脓毒性休克的疗效与NE相当。这与DOBUPRESS及TERLIVAP研究结果基本一致,其结果显示TP可以有效地逆转低血压[8, 13]。但上述研究是在共同应用NE基础上比较TP与NE的疗效,而本研究的优势在于直接对比单独应用TP与NE的疗效。然而,包括本研究在内,上述研究的样本量均较少,所得结果需多中心临床试验证实。故目前临床上仍以NE为治疗脓毒性休克的首选升压药物[1],但有研究表明,当NE的给药剂量≥0.7 μg/(kg·min)时脓毒症休克患者的ICU病死率明显增高[14]。国内外研究已证实,TP可以有效地治疗晚期儿茶酚胺无反应性休克,并在临床上得到应用[3-4]。
本研究显示,两组患者28 d生存率无明显差异。Tan等[15]对TP与NE治疗脓毒性休克的3个临床对照试验进行Meta分析,结果显示TP在降低病死率方面并不优于NE(RR=0.88, P=0.47),本研究结果与其相似。然而上述Meta分析仅纳入了89例患者,其结果需要进一步验证。另外,Tan等[15]对血管加压素与NE治疗脓毒性休克的9个临床对照试验进行Meta分析,共入选1 934例患者,结果显示血管加压素比NE显著地降低总病死率(RR=0.87,P=0.02)。TP作为人工合成的血管加压素类似物,具有较长的半衰期(4~6 h)及对V1受体的高度选择性,理论上TP比血管加压素有着更好的疗效[12]。但上述结果表明,血管加压素治疗脓毒性休克的疗效优于TP,其原因有待进一步探索。
Serpa等[16]的Meta分析提示,TP可以显著地降低NE需要量(标准均数差为-1.97,P < 0.01)。但本研究发现,用药期间两组开放标签NE需要量差异无统计学意义,与上述研究结果并不一致。可能与本研究纳入样本量较少及检验效能较低有关。同时TERLIVAP研究发现,持续低剂量输注TP 24 h后,NE需要量显著地减少[8]。本研究图 1和图 2结果与其相似。TP应用24 h才能显效的原因,可能与其药理学机制相关,TP自身并无活性,需要在体内缓慢转化为赖氨酸加压素才具有药理活性[12]。虽然脓毒性休克最新指南推荐,为将MAP提升至目标值或可减少NE的使用剂量,可在NE基础上联合应用TP [1]。但没有可靠证据表明,NE需要量减少可以改善生存结局[8, 16]。
本研究中TP组肢端缺血、低钠血症发生率与文献报道相似[17-18],两组均未发生心律失常、心肌梗死、支气管痉挛等先前研究出现的不良事件[8, 16, 19]。Efthymakis等[20]发现首例与TP相关的急性食管坏死事件,而本研究TP组发生1例可能与TP相关的胃肠出血,停用TP后症状消失,临床上应加以注意。
综上所述,TP治疗脓毒性休克的有效性及安全性与NE相当。由于本研究为单中心研究,样本量少,结果有待大规模多中心临床研究验证。
| [1] | 中华医学会重症医学分会. 中国严重脓毒症/脓毒性休克治疗指南(2014)[J]. 中华危重病急救医学, 2015, 27(6): 401-426. DOI:10.3760/j.issn.2095-4352.2015.06.001 |
| [2] | Zhou J, Qian C, Zhao M, et al. Epidemiology and outcome of severe sepsis and septic shock in intensive care units in mainland China[J]. PLoS One, 2014, 9(9): e107181. DOI:10.1371/journal.pone.0107181 |
| [3] | Svoboda P, Scheer P, Kantorová I, et al. Terlipressin in the treatment of late phase catecholamine-resistant septic shock[J]. Hepatogastroenterology, 2012, 59(116): 1043-1047. DOI:10.5754/hge10550 |
| [4] | Scarpati G, Piazza O. Vasopressin vs terlipressin in treatment of refractory shock[J]. Transl Med UniSa, 2013(5): 22-27. |
| [5] | Luckner G, Mayr VD, Jochberger S, et al. Comparison of two dose regimens of arginine vasopressin in advanced vasodilatory shock[J]. Crit Care Med, 2007, 35(10): 2280-2285. DOI:10.1097/01.CCM.0000281853.50661.23 |
| [6] | Shankar-Hari M, Phillips GS, Levy ML, et al. Developing a new definition and assessing new clinical criteria for septic shock: For the third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 775-787. DOI:10.1001/jama.2016.0289 |
| [7] | Russell JA, Walley KR, Singer J, et al. VASST Investigators. Vasopressin versus norepinephrine infusion in patients with septic shock[J]. N Engl J Med, 2008, 358(9): 877-887. DOI:10.1056/NEJMoa067373 |
| [8] | Morelli A, Ertmer C, Rehberg S, et al. Continuous terlipressin versus vasopressin infusion in septic shock (TERLIVAP): a randomized, controlled pilot study[J]. Crit Care, 2009, 13(4): R130. DOI:10.1186/cc7990 |
| [9] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [10] | Morelli A, Passariello M. Hemodynamic coherence in sepsis[J]. Best Pract Res Clin Anaesthesiol, 2016, 30(4): 453-463. DOI:10.1016/j.bpa.2016.10.009 |
| [11] | Miranda M, Balarini M, Caixeta D, et al. Microcirculatory dysfunction in sepsis: pathophysiology, clinical monitoring, and potential therapies[J]. Am J Physiol Heart Circ Physiol, 2016, 311(1): H24-35. DOI:10.1152/ajpheart.00034.2016 |
| [12] | Morelli A, Ertmer C, Pietropaoli P, et al. Terlipressin: a promising vasoactive agent in hemodynamic support of septic shock[J]. Expert Opin Pharmacother, 2009, 10(15): 2569-2675. DOI:10.1517/14656560903257808 |
| [13] | Morelli A, Ertmer C, Lange M, et al. Effects of short-term simultaneous infusion of dobutamine and terlipressin in patients with septic shock: the DOBUPRESS study[J]. Br J Anaesth, 2008, 100(4): 494-503. DOI:10.1093/bja/aen017 |
| [14] | Xing XZ, Wang HJ, Huang CL, et al. Prognosis of patients with shock receiving vasopressors[J]. World J Emerg Med, 2013, 4(1): 59-62. DOI:10.5847/wjem.j.1920-8642.2013.01.011 |
| [15] | Tan J, Chen H, Chen X, et al. Vasopressin and its analog terlipressin versus norepinephrine in the treatment of septic shock: A meta-analysis[J]. Int J Clin Exp Med, 2016, 9(7): 14183-14190. |
| [16] | Serpa NA, Nassar AP, Cardoso SO, et al. Vasopressin and terlipressin in adult vasodilatory shock: a systematic review and meta-analysis of nine randomized controlled trials[J]. Crit Care, 2012, 16(4): R154. DOI:10.1186/cc11469 |
| [17] | Ozel CBD, Karaman A, Gorkem H, et al. Terlipressin-induced ischemic skin necrosis: a rare association[J]. Am J Case Rep, 2014, 15: 476-479. DOI:10.12659/AJCR.891084 |
| [18] | Huang Y, Wang M, Wang J. Hyponatraemia induced by terlipressin: a case report and literature review[J]. J Clin Pharm Ther, 2015, 40(6): 626-628. DOI:10.1111/jcpt.12335 |
| [19] | Xiao X, Zhu Y, Zhen D, et al. Beneficial and side effects of arginine vasopressin and terlipressin for septic shock[J]. J Surg Res, 2015, 195(2): 568-579. DOI:10.1016/j.jss.2015.02.022 |
| [20] | Efthymakis K, Macaques C, Milano A, et al. Acute esophageal necrosis: possible association with terlipressin[J]. Endoscopy, 2014, 46(Suppl 1 UCTN): E279-280. DOI:10.1055/s-0034-1365789 |
 2018, Vol. 27
2018, Vol. 27




