心肌肥大是各种心脏疾病的重要表现之一,肾素-血管紧张素系统(renin-angiotensinsystem,RAS)中的血管紧张素Ⅱ(angeotensin Ⅱ,AngⅡ)通过不同的信号转导途径诱导心肌肥大。在肥大刺激信号作用下,心肌细胞钙流入增加可提高收缩力,同时也可导致持续小量的胞内游离钙含量增加及钙信号的动力学特征改变,从而破坏钙的动态平稳,可通过钙敏感的信号传导途径,引起心肌肥大。在钙依赖的信号通路中,心肌细胞内Ca2+水平升高,激活钙调神经磷酸酶(CaN)和钙调蛋白激酶Ⅱ(CaMK Ⅱ),促进心肌肥厚的发展[1]。在心肌肥大、心力衰竭中,肌浆网Ca2+-APT泵(SERCA2a)在mRNA水平及蛋白水平有表达的下调[2-3],导致胞浆钙的吸收与再摄取减慢,影响心肌收缩与舒张能力,并且激活钙相关通路,促进心肌肥大的发生。所以,心肌肥大时,细胞内钙及钙调控系统出现不同程度的异常,维持胞浆钙的稳态尤为重要,尤以SERCA2a在舒张期钙离子的再摄取、储存最为有效[4]。笔者前期研究通过甲基化芯片的检测发现,在心血管疾病发生时,发现钙调控相关基因SERCA2a、钠-钙交换体(sodium-calcium exchanger, NCX)、三磷酸肌醇受体(IP3R)、CaN和CaMKs钙敏感途径上存在着甲基化调控位点CpG岛[5]; 另有研究发现,肼苯哒嗪可抑制因心力衰竭所致SERCA2a启动子区甲基化异常,减低甲基化程度,从而使SERCA2a基因表达增加,可保持心肌细胞的钙动态平衡,抑制心力衰竭的发生[6]。甲基化抑制剂可能可抑制SERCA2a启动子甲基化,促进SERCA2a的表达,而5-氮杂胞苷(5-AZA-2’-dC)是已知较强的甲基化抑制剂,可能对SERCA2a有促进其表达的作用,抑制心肌肥大的发生。
本研究通过建立SD大鼠乳鼠原代心肌细胞肥大模型,采用不同时间加入5-氮杂胞苷进行干预,观察5-氮杂胞苷在血管紧张素Ⅱ诱导的心肌细胞肥大中的影响作用。
1 材料与方法 1.1 实验动物新生1~3 d SD大鼠乳鼠(购自广东省实验动物中心)。
1.2 试剂5-氮杂胞苷、血管紧张素Ⅱ(Sigma公司,美国),心肌肌钙蛋白I(cTnI)单克隆抗体(CST公司,美国)、Cy3标记羊抗兔IgG(Jackson公司,美国); Reverse Transcript PCR Master Mix、SYBR Green Real-time PCR Master Mix(TOYOBO公司,日本),BCA蛋白浓度测定试剂盒(Thermo Fisher公司,美国),一抗SERCA2a抗体(abcam公司,美国)、CaMKⅡ抗体、磷酸化CaMK Ⅱ(p-CaMKⅡ)抗体(CST公司,美国)、A型利钠肽(ANP)抗体(Bioworld,中国)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体,二抗兔抗鼠IgG(CST公司,美国); Fluo-3 AM钙离子探针(碧云天,中国),激光共聚焦专用培养皿(NEST公司,美国)。
1.3 实验方法心肌细胞培养:取1~3 d SD大鼠乳鼠心室肌,用0.25%胰蛋白酶、0.1% Ⅱ型胶原酶分次消化后,差速贴壁约1.5 h,使用含20%胎牛血清、青霉素、链霉素的DMEM培养液稀释、重悬心肌细胞,并加入5-溴脱氧尿嘧啶核苷0.1 mmol/L抑制非心肌细胞增殖,置于37 ℃、5%CO2培养箱中培养48 h,换用无血清培养基培养24 h。倒置相差显微镜镜下观察,24 h后90%的细胞都自发性搏动,频率一致,约120~200次/min,再培养24 h后,采用肌钙蛋白(cTnI)单克隆抗体及Cy3标记荧光二抗进行免疫荧光染色,90%以上的细胞呈阳性染色,则继续后续实验。
1.4 实验分组原代心肌细胞有血清培养稳定后换无血清培养液培养24 h; 5-氮杂胞苷及血管紧张素Ⅱ均配制后使用无菌过滤器,过滤除菌后按照不同分组处理加入心肌细胞再培养48 h。实验分组如下:对照组(N组):原代心肌细胞不加入任何干预因素; 血管紧张素Ⅱ组(A组):心肌细胞给予血管紧张素Ⅱ 1 μmol/L,刺激心肌细胞肥大; 5-氮杂胞苷组(D组):心肌细胞给予5-氮杂胞苷1 μmol/L; 血管紧张素Ⅱ+5-氮杂胞苷组(A + D组):心肌细胞给予血管紧张素Ⅱ 1 μmol/L,同时加入5-氮杂胞苷1 μmol/L; 5-氮杂胞苷预处理4 h组(D4h + A组):心肌细胞给予5-氮杂胞苷1 μmol/L预处理4 h后,再加入血管紧张素Ⅱ 1 μmol/L。
1.5 观测指标 1.5.1 心肌细胞肥大基因测定各组心肌细胞逆转录-聚合酶链反应(RT-PCR)测ANP的mRNA表达。加药处理48 h后终止细胞培养,洗涤后用Trizol提取总RNA。加入Oligo-(dT) 1 μL,逆转录条件为:37 ℃ 15 min,98 ℃ 5 min,4 ℃储存,逆转录合成cDNA。通过实时荧光定量PCR扩增目的基因。引物由上海生工设计合成GAPDH上游引物5’-TCCCTCAAGATTGTCAGCAA-3’,下游引物5’-AGATCCACAACGGATACAT-3’; ANP上游引物5’-GGGGGTAGGATTGACAGGAT-3’,下游引物5’-CTCCAGGAGGGTATTCACCA-3’。其PCR扩增条件为:95 ℃预变性30 s; 95 ℃15 s、60 ℃ 45 s延伸,40次循环,扩增曲线、融解曲线分析。
1.5.2 心肌细胞表面积测定加药处理48 h后,每组随机选择5个视野摄片,每个视野再任取20个细胞,用美国ImagePro Plus专业图像分析软件测定细胞表面积,取其平均数。
1.5.3 心肌细胞蛋白的提取和总蛋白含量的测定加药处理48 h后,加入RIPA细胞裂解液100 μL和苯甲基磺酰氟(PMSF)10 μL,冰上裂解。BCA法测定心肌细胞样品总蛋白含量并调整浓度。免疫印迹法测ANP、SERCA2a、CaMK Ⅱ、p-CaMK Ⅱ蛋白表达:SDS-PAGE电泳分离,转移到硝酸纤维素膜(PVDF膜)上,封闭后加入一抗(1:1 000)4 ℃孵育过夜,再与辣根过氧化物酶标记抗体(1:2 000)37℃孵育1 h。常规洗膜,ECL显色系统(Thermo Fisher,美国)检测后扫描,Image J图像分析系统定量各蛋白条带的总灰度值。
1.5.4 心肌细胞细胞内钙测定各组心肌细胞于激光共聚焦培养皿中培养并处理后,Fluo-3 AM以5 μmol/L浓度负载,37 ℃孵育30 min,37 ℃培养基洗涤后,加入培养基,使用激光共聚焦显微镜,以面扫描方式测定胞内钙变化情况,以t1/2α(上升至峰值一半时所需的时间)、t1/2β(下降至峰值一半时所需的时间)表示胞内钙变化情况。
1.6 统计学方法采用SPSS 16.0统计软件进行数据的分析处理。所有计量资料采用均数±标准差(x±s)表示,组间差异用单因素方差分析(one-way ANOVA),组间两两比较使用LSD-t法,以P < 0.05为差异有统计学意义。
2 结果 2.1 各组心肌肥大mRNA、蛋白表达各组细胞中ANP mRNA表达统计(图 1)示,与空白对照组相比,血管紧张素Ⅱ组ANP mRNA表达升高,为对照组的2.68倍(P < 0.05);5-氮杂胞苷组、5-氮杂胞苷+血管紧张素Ⅱ同时处理组、5-氮杂胞苷预处理4 h组与对照组相比,ANP表达无明显差异,而与血管紧张素Ⅱ组相比,ANP表达量减少(P < 0.05)。各组细胞中ANP蛋白表达量(图 3),血管紧张素Ⅱ组与对照组相比,ANP表达量增多(P < 0.01),而其他组别与血管紧张素Ⅱ组相比,ANP表达量相对减少(P < 0.01),差异有统计学意义。
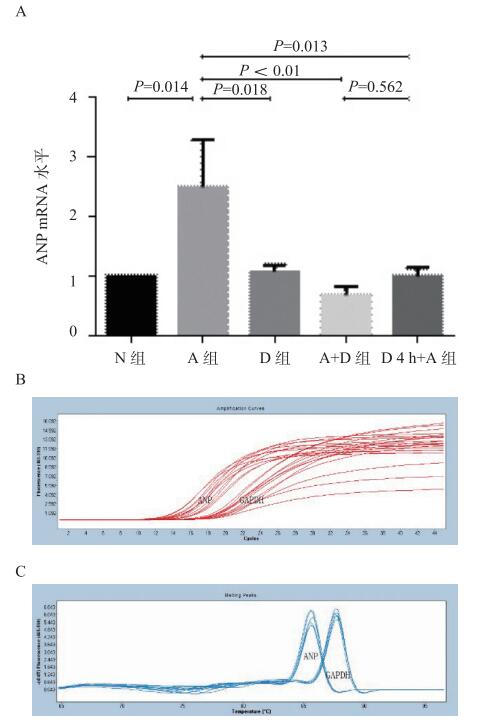
|
| N组为对照组; A组为血管紧张素Ⅱ组; D组为5-氮杂胞苷组; A+D组为血管紧张素Ⅱ+5-氮杂胞苷组; D4 h+A组为5-氮杂胞苷预处理4 h组; A:各组ANP mRNA表达情况; B:前者为ANP扩增曲线,后者为GAPDH扩增曲线; C:前者为ANP扩增产物溶解曲线,后者为GAPDH扩增产物溶解曲线,两者均呈单一溶解峰,扩增产物具有特异性 图 1 ANP mRNA荧光定量PCR结果 Figure 1 Real-time PCR quantitative detection of ANP mRNA |
|
|
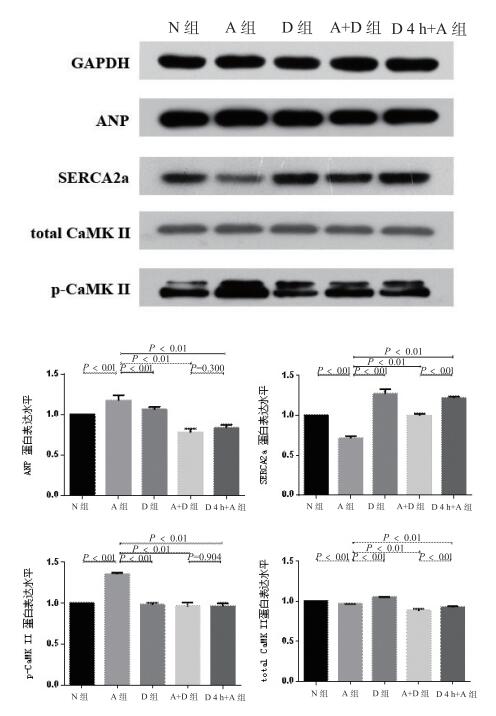
|
| N组为对照组; A组为血管紧张素Ⅱ组; D组为5-氮杂胞苷组; A+D组为血管紧张素Ⅱ+5-氮杂胞苷组; D4 h+A组为5-氮杂胞苷预处理4 h组 图 3 ANP、SERCA2a、total CaMK Ⅱ、p-CaMK Ⅱ蛋白表达情况及条带灰度分析 Figure 3 Western Blot quantification of ANP, SERCA2a, total CaMK Ⅱ, p-CaMK Ⅱ protein expression |
|
|
各组心肌细胞面积统计(图 2)示,与空白对照组相比,血管紧张素Ⅱ组细胞镜下面积增大(P < 0.01);5-氮杂胞苷组、血管紧张素Ⅱ+5-氮杂胞苷组同时处理组、5-氮杂胞苷预处理4 h组与对照组相比,细胞面积大小无明显差异,而与血管紧张素Ⅱ组相比,细胞面积相对较小(P < 0.01)。
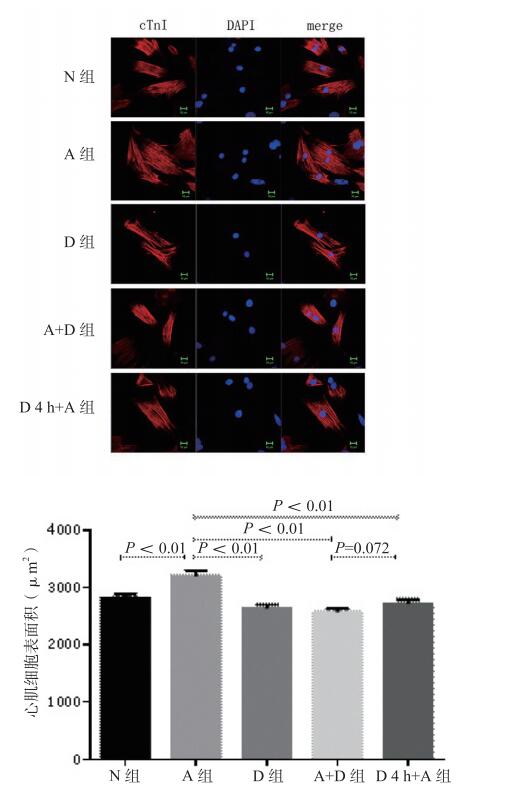
|
| N组为对照组; A组为血管紧张素Ⅱ组; D组为5-氮杂胞苷组; A+D组为血管紧张素Ⅱ+5-氮杂胞苷组; D4 h+A组为5-氮杂胞苷预处理4 h组 图 2 心肌细胞免疫荧光及表面积统计分析 Figure 2 Immunofluorescence of cardiomyocytes and surface area analysis |
|
|
各组心肌细胞中,GAPDH、SERCA2a、p-CaMK Ⅱ及total CaMK Ⅱ的表达情况。与对照组比较,SERCA2a在血管紧张素Ⅱ组中表达下降低(P < 0.05),与血管紧张素Ⅱ组比较,5-氮杂胞苷组、同时加药组及预处理4 h组SERCA2a表达相对增加(P < 0.05),而预处理4 h组SERCA2a较同时处理组增加较明显(P < 0.01)。与对照组相比,p-CaMK Ⅱ在血管紧张素Ⅱ组中,与其他组别相比表达增多较明显,5-氮杂胞苷组、同时加药组及预处理4 h组组间则差异无统计学意义。
2.4 胞内钙变化情况各组心肌细胞间荧光强度变化时间统计(图 4)示,血管紧张素Ⅱ组峰值t1/2α及t1/2β较其他组别延长(P < 0.05),加入5-氮杂胞苷干预的组别与血管及张素Ⅱ组比较,荧光强度上升及下降时间相对缩短(P < 0.05);而5-氮杂胞苷同时加药组与预处理4 h组之间差异无统计学意义。
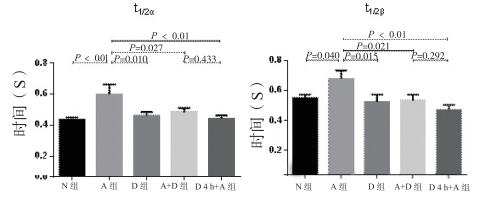
|
| N组为对照组; A组为血管紧张素Ⅱ组; D组为5-氮杂胞苷组; A+D组为血管紧张素Ⅱ+5-氮杂胞苷组; D4 h+A组为5-氮杂胞苷预处理4 h组; t1/2α为胞内钙离子浓度上升到一半峰值时所需要的时间,t1/2β为胞内钙离子浓度下降到一半峰值时所需要的时间 图 4 Fluo-3标记细胞内钙上升与下降时间变化情况 Figure 4 The rising and falling time of the calcium concentration labeling by Fluo-3 |
|
|
心肌肥大是心肌细胞在不同病理刺激下产生的适应性结构重塑,是多种心血管疾病共同的病理生理表现,其表现为:首先是肥大相关基因如早期基因表达; 继而心脏胚胎期基因心房利钠肽等的再表达; 最终表现为细胞体积增大。而心肌肥大病理生理中,钙稳态的失衡促进了这一过程的发生。钙离子浓度的增加则可以启动相关的钙敏感的信号途径参与心肌肥大,如丝裂原活化蛋白激酶(MAPK)家族、蛋白激酶C、钙调素(CaM)依赖的钙调神经磷酸酶-活化T细胞核因子3(CaN-NFAT3)途径和Ca2+ /CaM依赖的钙调蛋白激酶-肌细胞增强因子2(CaMKs-MEF2)等途径[1]。血管紧张素Ⅱ是对心肌细胞的一种促肥大因子。本研究结果中,血管紧张素Ⅱ处理后,可引起ANP、p-CaMK Ⅱ表达的增加,细胞表面积增大,与心肌肥大趋势相一致。
在心肌细胞舒张期,SERCA2a可逆浓度梯度将70%胞浆内钙转移入肌浆网内储存,以便下一次的释放[8],当SERCA2a表达下调时,可引起胞浆钙再摄取时间延长,持续小量的胞浆游离钙含量增加及钙信号的动力学特征改变,从而破坏钙的动态平稳; 在心肌肥大时,NCX、RyR、SERCA2a表达显著异常,导致钙超载,激活下游相关通路[9-10]。笔者前期研究发现SERCA2a在心脏疾病中存在甲基化调控位点[5]; 另有研究表明,肼苯哒嗪可抑制因心力衰竭所致SERCA2a启动子区甲基化异常,从而使SERCA2a基因表达增加; 在后负荷诱导或苯丙肾上腺素诱导的人工心脏组织心肌肥大模型中,通过去甲基化抑制剂干预基因启动子甲基化,发现后负荷诱导心肌肥大组细胞的SERCA2a启动子甲基化率明显较其他组别升高,加入甲基化抑制剂组SERCA2a启动子甲基化率较其他组别下降[6, 11]。本研究结果中,血管紧张素Ⅱ组SERCA2a表达减少,并且t1/2α、t1/2β相对延长,胞浆钙的释放和再摄取延缓,可能导致胞浆内钙浓度维持相对较高水平,导致钙超载,促进心肌肥大的发生; 而加入5-氮杂胞苷的预处理组与同时加药组,在SERCA2a表达、胞内钙变化情况,与下血管紧张素Ⅱ组比较差异有统计学意义,此两组中心肌细胞SERCA2a蛋白水平的表达上升,t1/2α、t1/2β与血管紧张素Ⅱ组比较则较为缩短,SERCA2a表达增加有利于胞浆钙的释放与再摄取,抑制血管紧张素Ⅱ促心肌肥大的作用。Luo等[12]的研究,同样得出相似结论,肥大刺激组SERCA2a表达下降明显,SERCA2a与胞内钙的释放、再摄取时间呈负性相关。因此,通过甲基化抑制剂5-氮杂胞苷可促进SERCA2a的表达,增强对胞内Ca2+的调节作用,有助于舒张期胞浆钙的再摄取,保持胞内钙的稳态,保证心肌收缩能力,抑制心肌肥大。结果中显示,在SERCA2a蛋白表达上,预处理组的SERCA2a表达量较同时加药组增多,可能由于预处理组5-氮杂胞苷在更充足的时间起效,促使SERCA2a表达更佳; 但在钙离子时间的变化上,两组无明显差异,SERCA2a的活性,还受磷酸受纳蛋白(PLB)等的调节,5-氮杂胞苷可能未进一步影响到SERCA2a活性调节的相关因子。
综上所述,本研究进一步证明SERCA2a表达的增加有利于胞内钙的再摄取和释放; 5-氮杂胞苷可抑制血管紧张素Ⅱ诱导的心肌细胞肥大,促进SERCA2a的表达,其机制可能通过直接抑制SERCA2a启动子甲基化。近年来,心血管疾病可通过表观遗靶向治疗而达到防治的目的[13],其中DNA去甲基化在多种疾病中已屡见报道,在心血管疾病当中也成为近年来的研究热点; 而SERCA2a更被认为是治疗心肌肥厚、心力衰竭的靶基因治疗位点之一[14-15],除了与钙相关通路有关之外,还与细胞增殖与凋亡通路相关[16-17]。对于SERCA2a甚至其他肥大相关蛋白、因子的启动子甲基化调控相关研究仍有较多未阐述之处,可行下一步的研究探索,了解5-氮杂胞苷是否有直接通过对SERCA2a启动子去甲基化的作用及相关信号通路机制,明确甲基化抑制剂抑制心肌肥大的具体机制。
| [1] | Fischer TH, Herting J, Tirilomis T, et al. Ca2+/calmodulin-dependent protein kinase Ⅱ and protein kinase a differentially regulate sarcoplasmic reticulum Ca2+ leak in human cardiac pathology[J]. Circulation, 2013, 128(9): 970-981. DOI:10.1161/circulationaha.113.001746 |
| [2] | Andersson KB, Birkeland JA, Finsen AV, et al. Moderate heart dysfunction in mice with inducible cardiomyocyte-specific excision of the Serca2 gene[J]. J Mol Cell Cardiol, 2009, 47(2): 180-187. DOI:10.1016/j.yjmcc.2009.03.013 |
| [3] | Kho C, Lee A, Jeong D, et al. SUMO1-dependent modulation of SERCA2a in heart failure[J]. Nature, 2011, 477(7366): 601-605. DOI:10.1038/nature10407 |
| [4] | Periasamy M, Huke S. SERCA pump level is a critical determinant of Ca2+homeostasis and cardiac contractility[J]. J Mol Cell Cardiol, 2001, 33(6): 1053-1063. DOI:10.1006/jmcc.2001.1366 |
| [5] | 林珮仪, 莫均荣, 茅海锋, 等. 急性ST段抬高型心肌梗死甲基化谱的研究[J]. 中华急诊医学杂志, 2015, 24(12): 1449-1454. DOI:10.3760/cma.j.issn.1671-0282.2015.12.027 |
| [6] | Kao YH, Cheng CC, Chen YC, et al. Hydralazine-induced promoter demethylation enhances sarcoplasmic reticulum Ca2+ -ATPase and calcium homeostasis in cardiac myocytes[J]. Lab Invest, 2011, 91(9): 1291-1297. DOI:10.1038/labinvest.2011.92 |
| [7] | Heineke J, Molkentin JD. Regulation of cardiac hypertrophy by intracellular signalling pathways[J]. Nat Rev Mol Cell Bio, 2006, 7(8): 589-600. DOI:10.1038/nrm1983 |
| [8] | Bassani JW, Bassani RA, Bers DM. Relaxation in rabbit and rat cardiac cells: species-dependent differences in cellular mechanisms[J]. J Physiol, 1994, 476(2): 279-293. DOI:10.1113/jphysiol.1994.sp020130 |
| [9] | Bers DM, Despa S. Cardiac myocytes Ca2+ and Na+ regulation in normal and failing gearts[J]. J Pharmacol Sci, 2006, 100(5): 315-322. DOI:10.1254/jphs.CPJ06001X |
| [10] | Priori SG, Napolitano C. Cardiac and skeletal muscle disorders caused by mutations in the intracellular Ca2+ release channels[J]. J Clin Invest, 2005, 115(8): 2033-2038. DOI:10.1172/JCI25664 |
| [11] | Nascimento AM, Lima EM, Brasil GA, et al. Serca2a and Na+/Ca2+ exchanger are involved in left ventricular function following cardiac remodelling of female rats treated with anabolic androgenic steroid[J]. Toxicol Appl Pharm, 2016, 301: 22-30. DOI:10.1016/j.taap.2016.04.001 |
| [12] | Luo J, Zhang WD, Du YM. Early administration of nifedipine protects against angiotensin Ⅱ-induced cardiomyocyte hypertrophy through regulating CaMK Ⅱ-SERCA2a pathway and apoptosis in rat cardiomyocytes[J]. Cell Biochem Funct, 2016, 34(3): 181-187. DOI:10.1002/cbf.3177 |
| [13] | Schiano C, Vietri MT, Grimaldi V, et al. Epigenetic-related therapeutic challenges in cardiovascular disease[J]. Trends Pharmacol Sci, 2015, 36(4): 226-235. DOI:10.1016/j.tips.2015.02.005 |
| [14] | Shareef MA, Anwer LA, Poizat C. Cardiac SERCA2A/B: therapeutic targets for heart failure[J]. Eur J Pharmacol, 2014, 724(1): 1-8. DOI:10.1016/j.ejphar.2013.12.018 |
| [15] | Sikkel MB, Hayward C, MacLeod KT, et al. SERCA2a gene therapy in heart failure: an anti-arrhythmic positive inotrope[J]. Brit J Pharmcol, 2014, 171(1): 38-54. DOI:10.1111/bph.12472 |
| [16] | Huang H, Joseph LC, Gurin MI, et al. Extracellular signal-regulated kinase activation during cardiac hypertrophy reduces sarcoplasmic/endoplasmic reticulum calcium ATPase 2 (SERCA2) transcription[J]. J Mol Cell Cardiol, 2014, 75(5): 58-63. DOI:10.1016/j.yjmcc.2014.06.018 |
| [17] | Kaikkonen L, Magga J, Ronkainen VP, et al. p38α regulates SERCA2a function[J]. J Mol Cell Cardiol, 2014, 67: 86-93. DOI:10.1016/j.yjmcc.2013.12.005 |
 2018, Vol. 27
2018, Vol. 27




