卒中是我国致死率最高的流行病,在人群中的发病率不断上升[1-3],其中缺血性脑卒中约占60%~80%,而大脑中动脉闭塞是缺血性脑卒中的常见病因,可引起细胞内钙超载、酸中毒、细胞凋亡、缺血-再灌注损伤(I/R)等病理生理反应。如何抑制或减轻脑缺血-再灌注后病理反应是目前研究热点。
MicroRNA (miRNA)是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,参与转录后基因表达调控。近年来,越来越多的证据表明,miRNAs在缺血-再灌注损伤中起着重要作用[4]。如大鼠心肌缺血-再灌注模型中,miRNA-320可以降低热休克蛋白20(HSP20)表达,调控心肌细胞损伤,miRNA还可以消除心肌缺血-再灌注诱导的心肌细胞蛋白表达,减少心肌细胞凋亡,但microRNA-320与脑缺血-再灌注损伤关系尚不清楚。本研究拟建立小鼠脑缺血-再灌注模型,通过调控脑皮层microRNA-320水平,探讨microRNA-320对缺血-再灌注脑损伤的作用,为脑缺血-再灌注损伤的治疗提供参考。
1 材料与方法 1.1 主要试剂Lipofectamine RNAiMAX(Invitrogen公司);2%的TTC溶液(Sigma公司);辣根过氧化物酶标记山羊抗兔IgG(H+L)(碧云天生物科技有限公司);辣根过氧化物酶标记山羊抗小鼠IgG(H+L) (碧云天生物科技有限公司);β-actin鼠单克隆抗体(杭州华安生物科技有限公司);IGF-1抗体(AFFINTY公司);TUNEL试剂盒(上海生物工程股份有限公司)。
1.2 动物选择及分组36只清洁级雄性C57BL小鼠,11~12周龄,体质量21~25 g,购自浙江中医药大学动物实验中心,许可证号:SYXK(浙)2013-0184。随机(随机数字法)分为4组:对照组(Sham, n=9),模型组(MCAO/R, n=9),microRNA-320拟似物组(n=9)和microRNA-320抑制剂组(n=9)。
1.3 模型制备及处理适应环境3~5 d后,采用线栓法制备大脑中动脉缺血-再灌注模型,术前禁食,自由饮水。3%戊巴比妥钠麻醉小鼠,颈部、头部备皮,消毒,插入肛温探头,保持体温在(37±0.5) ℃。
将microRNA-320拟似物、抑制剂和NC(9 μL,100 μmol/L)与2.5 μL的Lipofectamine RNAiMAX混合均匀,37 ℃下静置30 min后进行侧脑室注射。头部正中切口,小鼠脑立体定位仪定位(X=0.38 mm,Y=-1 mm,Z=2.5 mm),取7 μL注入小鼠左侧脑室,注射速度约为3 μL/min,留针时间5 min,10 min后行MCAO造模。
剪开颈部皮肤,分离出颈总动脉、颈内动脉和颈外动脉,在左侧颈总动脉上剪口,将一根头端处理过的0.18 mm线栓经颈总动脉插入颈内动脉,直至大脑中动脉,深度至颈内外动脉分叉处约(9±1) mm,稍有阻力感即停止进线,缺血后60 min拔掉线栓,整个过程监测维持小鼠的肛温在(37±0.5) ℃,于再灌注24 h后处死小鼠。
1.4 RNA分离和qPCR根据标准方案采用TRIzol试剂从小鼠脑组织样品中提取总RNA。使用PrimeScript RT Master Mix从总RNA中逆转录总cDNA,使用SYBR premix Ex Taq在ABI Biosystems上进行实时定量PCR,检测目标基因(包括IGF-1,GAPDH,miRNA-320-3p和U6)的表达水平。目标基因的相对表达水平通过2-ΔΔCt循环阈值法与内部对照(GAPDH)进行归一化。反应在95 ℃进行30 s,然后进行35个循环的95 ℃5 s和58 ℃30 s。引物序列如下所示:IGF-1:正向引物:CAGGCATTGTGGATGAGTGTT;反向引物:GCTTTTGTAGGCTTCAGTGGG;GAPDH:正向引物:AGGAGCGAGACCCCACTAACA;反向引物:AGGGGGGCTAAGCAGTTGGT;miRNA-320-3p:5’-GCTGGGTTGAGAGGGCGA-3’;U6引物:5’-CGCAAGGATGACACGCAAATTC-3’。
1.5 Western blot检测小鼠脑组织蛋白裂解液裂解,和所得的上清液离心测定蛋白浓度。蛋白质样品与凝胶上样缓冲液混合后在100 ℃沸水中变性5 min。50 μg蛋白上样到每个10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)孔中通电,进一步转移到PVDF,然后在含0.05%吐温20的Tris缓冲生理盐水(pH 7.4)(TBST)和5%的脱脂奶粉中冲洗5 min。一抗(稀释率:1:1 000,IGF-1;1:2 000,β-actin)在冰箱中放置在4 ℃过夜。洗3次×膜10 min后,用TBST孵育二抗室温1 h。胶片曝光测定蛋白浓度。蛋白质的相对表达的评价每个蛋白的灰度值的比值。
1.6 TUNEL细胞凋亡检测参照说明书进行TUNEL测定。将脑组织用4%多聚甲醛固定24 h,然后用梯度乙醇脱水,包埋,冷却,切片。连续放置在二甲苯中30 min,二甲苯Ⅱ 30 min,无水乙醇I 10 min,无水乙醇Ⅱ 5 min,95%乙醇5 min,90%乙醇5 min,80%乙醇5 min,70%乙醇5 min,蛋白质K加入15 min。向每个切片中,加入20μL TDT酶溶液,然后在37 ℃温育2 h后,加入50μL封闭溶液并在室温下孵育30 min。滴加100 μL生物素标记的抗体,并将样品在37 ℃下温育30 min。切片全部浸入并用PBS冲洗。然后加入50 μL FITC标记的二抗,将样品在黑暗中37 ℃孵育30 min后,用PBS洗涤切片并通过荧光显微镜观察。
1.7 TTC染色提取小鼠脑组织并冷却至-20 ℃达30 min。将组织切成1 mm厚的切片,分别由前囟前3片和前囟后3片组成。1%TTC中37 ℃的恒温下温育10 min,TTC染色后,正常组织呈红色,梗死组织呈白色。使用Image-Pro Plus 6.0软件测定脑梗死和脑水肿的体积。梗死体积(%)=(对侧半球体积-梗死面积的非梗死体积)/(对侧大脑半球体积×2)×100%;水肿体积(%)=(梗死侧大脑半球体积-对侧半球体积)/(对侧半球体积×2)×100%。
1.8 统计学方法所有数据采用SPSS 20.0统计软件进行数据分析处理,所得数据以均数±标准差(x±s)表示,多组之间均数比较采用单因素方差分析(ANOVA), 组间两组比较采用SNK-q检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 microRNA-320在小鼠脑缺血-再灌注后表达上调与对照组相比,模型组microRNA-320表达略有增加(P < 0.05);与模型组相比,microRNA-320拟似物组microRNA-320表达明显上调(P < 0.01),microRNA-320抑制剂组microRNA-320表达下调(P < 0.05)。见图 1。
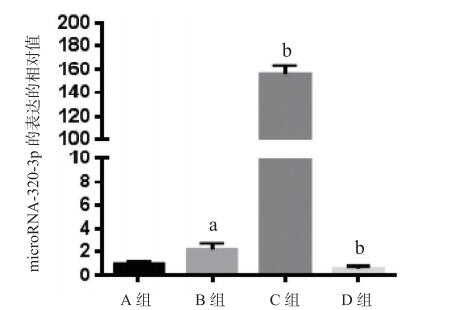
|
| A: Sham假手术组; B: MCAO/R大脑中动脉缺血-再灌注组; C: MCAO/R+miRNA-320拟似物组;D: MCAO/R+miRNA-320抑制剂组; 与A组比较,aP < 0.05;与B组比较,bP < 0.05 图 1 各处理组中microRNA-320-3p的表达情况 |
|
|
与假手术组比较,MCAO/R小鼠梗死区周边细胞凋亡明显增加,miRNA-320拟似物处理进一步加剧脑缺血小鼠皮层梗死周边区细胞凋亡水平,miRNA-320抑制剂处理降低脑缺血小鼠皮层梗死周边区细胞凋亡水平。见图 2。
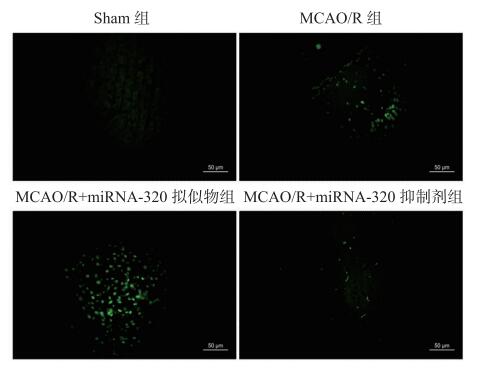
|
| Sham组:假手术组;MCAO/R组:大脑中动脉缺血-再灌注组 图 2 TUNEL荧光(×20)实验测定小鼠梗死周边区域细胞凋亡水平 |
|
|
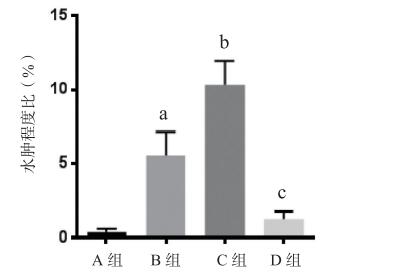
与对照组比较,MCAO/R组大鼠脑梗死体积和水肿程度明显增加(P < 0.01)。与MCAO/R组相比,miRNA-320拟似物组的脑梗死体积和水肿程度显著增加(P < 0.05)。此外,miRNA-320抑制剂组的脑梗死体积和水肿程度显著降低(P < 0.05,P < 0.01)。见图 3~5。
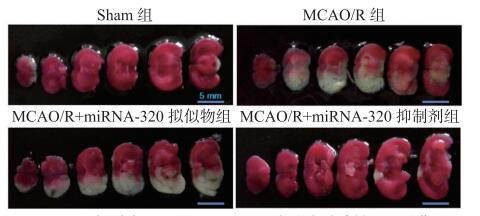
|
| Sham组:假手术组; MCAO/R组:大脑中动脉缺血-再灌注组 图 3 小鼠脑切片后TTC染色结果例图 |
|
|
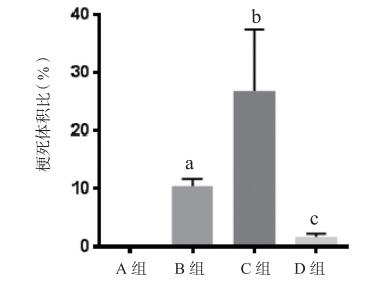
|
| A: Sham假手术组; B: MCAO/R大脑中动脉缺血-再灌注组; C: MCAO/R+miRNA-320拟似物组; D: MCAO/R+miRNA-320抑制剂组; 与A组比较,aP < 0.05;与B组比较,bP < 0.05,cP < 0.01 图 4 各组脑组织梗死体积比较 |
|
|
|
| A: Sham假手术组; B: MCAO/R大脑中动脉缺血-再灌注组; C: MCAO/R+miRNA-320拟似物组; D: MCAO/R+miRNA-320抑制剂组; 与A组比较,aP < 0.05;与B组比较,bP < 0.05 图 5 各组脑组织水肿程度比较 |
|
|
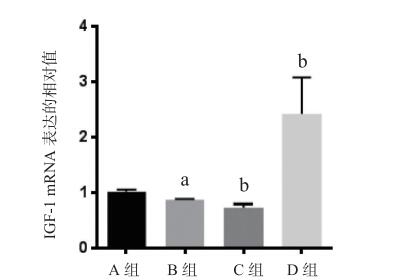
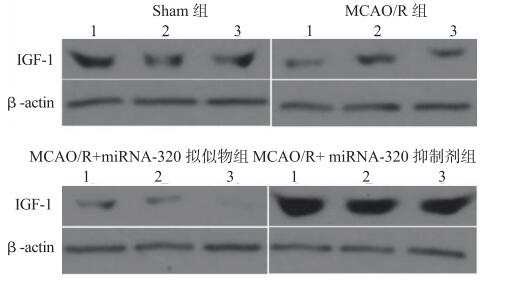
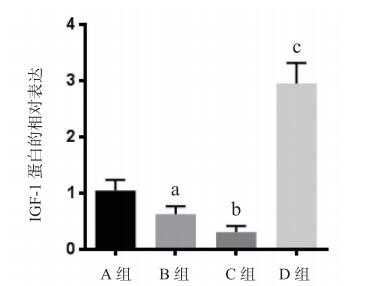
与对照组相比,MCAO / R组损伤侧皮层IGF-1的mRNA表达增加(P < 0.05);与MCAO / R组比较,miRNA-320拟似物组IGF-1 mRNA表达水平降低(P < 0.05),miRNA-320抑制剂组IGF-1 mRNA表达水平明显升高,(P < 0.05)见图 6。MCAO / R组损伤侧皮层IGF-1蛋白表达显著低于对照组(P < 0.05);与MCAO / R组比较,miRNA-320拟似物组IGF-1蛋白表达降低(P < 0.05),而miRNA-320抑制剂组IGF-1蛋白表达显著升高(P < 0.01),见图 7、图 8。
|
| Sham假手术组; B: MCAO/R大脑中动脉缺血-再灌注组; C: MCAO/R+miRNA-320拟似物组;D: MCAO/R+miRNA-320抑制剂组; 与A组比较,aP < 0.05;与B组比较,bP < 0.05,cP < 0.01 图 6 miRNA-320抑制MCAO / R小鼠损伤皮质侧IGF-1 mRNA水平 |
|
|
|
| Sham组:假手术组;MCAO/R组:大脑中动脉缺血-再灌注组 图 7 miRNA-320抑制MCAO / R小鼠损伤侧皮质IGF-1蛋白水平 |
|
|
|
| A: Sham假手术组; B: MCAO/R大脑中动脉缺血-再灌注组; C: MCAO/R+miRNA-320拟似物组;D: MCAO/R+miRNA-320抑制剂组; 与A组比较,aP < 0.05;与B组比较,bP < 0.05,cP < 0.01 图 8 小鼠损伤皮质侧IGF-1蛋白水平比较 |
|
|
目前,大脑中动脉阻塞模型是脑缺血病理学领域中建立局灶性脑缺血-再灌注的经典模型,用于对神经保护药物或治疗措施进行评估研究[5-7]。本研究采用大脑中动脉阻塞法,建立小鼠脑缺血-再灌注损伤模型。探索了miRNA-320在体内脑缺血-再灌注损伤中的作用,研究结果提示,miRNA-320参与了脑缺血-再灌注损伤的调控,可能通过抑制IGF-1的表达来促进脑组织损伤。
Luo等[8]进行的一项研究发现,脑缺血-再灌注损伤可能通过TLR4 / JNK / caspase-3信号通路诱导大鼠脑细胞凋亡。既往研究报道脑缺血-再灌注损伤可能通过IGF-1途径引起细胞凋亡并引发脑组织损伤发生。众多研究均证实,脑缺血-再灌注可引起神经元凋亡和水肿,从而导致脑组织死亡,细胞凋亡是脑缺血-再灌注损伤后神经细胞死亡的重要途径[9-10]。本研究采用TUNEL染色和TTC法检测缺血-再灌注后小鼠组织的变化。与对照组比较,缺血-再灌注组小鼠梗死灶大脑皮层周边区凋亡细胞明显增多,梗死灶脑梗死和水肿明显增加(P < 0.05)。本研究结果与既往研究类似,表明脑缺血-再灌注可引起血液动力学紊乱,血脑屏障损伤和细胞凋亡增多等变化,从而导致脑组织的损伤[11-13]。
近年来,miRNA在基础研究和临床实践中受到越来越多的关注[14],尤其是在其调节缺血-再灌注损伤的功能方面。miRNA是一类高度保守的内源性小RNA,主要调控转录后水平的基因表达。miRNAs可以调节组织血管生成,并诱导缺血情况下的一系列变化[15-16]。Guan等[17]报道,注射miRNA-1,miRNA-21和miRNA-24可减少非热休克诱导的心脏缺血-再灌注损伤小鼠的心肌梗死体积,此外,之前的miRNA芯片分析表明,在缺血-再灌注的大鼠模型中miRNA-320的表达显著增加[18]。本研究也证实miRNA在大鼠脑缺血-再灌注损伤中发挥了非常重要的作用。本研究中,miRNA-320拟似物和抑制剂实现了miRNA-320的过表达和抑制,miRNA-320抑制剂可显著降低细胞凋亡和脑损伤的发生率(P < 0.05),表明miRNA-320在脑缺血-再灌注损伤中起着关键作用。
胰岛素样生长因子-1(IGF-1)是调节神经生长的重要物质。IGF-1是由70个氨基酸组成的单链碱性多肽,相对分子质量为7 649 000,其在脑发育和中枢神经系统发育对促进神经元和神经胶质细胞的增殖,分化和营养以及神经功能的维持和调节是必要的[19],而且在脑缺血-再灌注等病理情况中对机体起着重要的保护作用[16]。既往研究表明,在IGF-1培养基中生长的小鼠神经细胞数量比正常培养基高8~40倍[20]。此外,Johnston等[21]报道,在低剂量范围内,脑室内注射重组IGF-1可以剂量依赖性的方式显著降低大脑中神经元凋亡的数量,包括皮质,海马和纹状体。为进一步探讨miRNA-320参与脑缺血-再灌注损伤脑组织实质损伤的具体机制,本研究分别从转录和翻译水平探讨了缺血-再灌注损伤模型小鼠中IGF-1的表达。结果发现小鼠模型组IGF-1 mRNA和蛋白的表达显著低于对照组,而miRNA-320抑制剂组IGF-1基因和蛋白的表达显著高于对照组及模型组。此外,miRNA-320抑制剂组的细胞凋亡率,脑组织水肿和梗死体积也相应降低(P < 0.05)。所有这些结果表明,miRNA-320可能通过抑制IGF-1的表达而在缺血-再灌注损伤中起作用。事实上,Song等[22]研究也证明,在心肌缺血-再灌注模型中,miRNA-320通过IGF-1途径引起心肌细胞凋亡和心肌梗死,并且抑制miRNA-320表达可以减少心肌损伤并保护心肌组织。
综上所述,在脑缺血-再灌注损伤过程中,micRNA-320可能通过调控靶基因IGF-1对脑组织损伤起作用,其可能是脑缺血-再灌注损伤的潜在机制,将对有关防治脑卒中的新药靶点提供一些依据。
| [1] | 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国重症脑血管病管理共识2015[J]. 中华神经科杂志, 2016, 49(3): 192-202. DOI:10.3760/cma.j.issn.1006-7876.2016.03.004 |
| [2] | 刘鸣, 刘峻峰, 吴波. 脑血管病分类分型进展与解读[J]. 中华神经科杂志, 2017, 50(3): 163-167. DOI:10.3760/cma.j.issn.1006-7876.2017.03.002 |
| [3] | Tang YH, Ma YY, Zhang ZJ, et al. Opportunities and challenges: stem cell-based therapy for the treatment of ischemic stroke[J]. CNS Neurosci Ther, 2015, 21(4): 337-347. DOI:10.1111/cns.12386 |
| [4] | van Rooij E, Olson EN. MicroRNAs: powerful new regulators of heart disease and provocative therapeutic targets[J]. J Clin Invest, 2007, 117(9): 2369-2376. DOI:10.1172/JCI33099 |
| [5] | 董真真, 魏巍, 董铁立, 等. 酮咯酸氨丁三醇对大鼠脑缺血-再灌注损伤的神经保护作用[J]. 中华实验外科杂志, 2016, 33(6): 1586-1588. DOI:10.3760/cma.j.issn.1001-9030.2016.06.046 |
| [6] | Baumann E, Preston E, Slinn J, et al. Post-ischemic hypothermia attenuates loss of the vascular basement membrane proteins, agrin and SPARC, and the blood-brain barrier disruption after global cerebral ischemia[J]. Brain Res, 2009, 1269(1269): 185-197. DOI:10.1016/j.brainres.2009.02.062 |
| [7] | 张美齐, 翟昌林, 涂建锋, 等. 丹参酮ⅡA对脑缺血-再灌注损伤大鼠高迁移率族蛋白1表达的影响[J]. 中华急诊医学杂志, 2012, 21(6): 626-630. DOI:10.3760/cma.j.issn.1671-0282.2012.06.016 |
| [8] | Luo SY, Li R, Le ZY, et al. Anfibatide protects against rat cerebral ischemia/reperfusion injury via TLR4/JNK/caspase-3 pathway[J]. Eur J Pharmacol, 2017, 807: 127-137. DOI:10.1016/j.ejphar.2017.04.002 |
| [9] | Kao TK, Ou YC, Liao SL, et al. Opioids modulate post-ischemic progression in a rat model of stroke[J]. Neurochem Int, 2008, 52(6): 1256-1265. DOI:10.1016/j.neuint.2008.01.007 |
| [10] | 曾潍贤, 陈大庆, 龚裕强, 等. 萝卜硫素对大鼠局灶性脑缺血-再灌注损伤的神经元保护机制[J]. 中华急诊医学杂志, 2013, 22(12): 1346-1351. DOI:10.3760/cma.j.issn.1671-0282.2013.12.010 |
| [11] | Alluri H, Stagg HW, Wilson RL, et al. Reactive oxygen species-caspase-3 relationship in mediating blood-brain barrier endothelial cell hyperpermeability following oxygen-glucose deprivation and reoxygenation[J]. Microcirculation, 2014, 21(2): 187-195. DOI:10.1111/micc.12110 |
| [12] | Saito K, Suyama K, Nishida K, et al. Early increases in TNF-alpha, IL-6 and IL-1 beta levels following transient cerebral ischemia in gerbil brain[J]. Neurosci Lett, 1996, 206(2/3): 149-152. DOI:10.1016/S0304-3940(96)12460-5 |
| [13] | Jafarinaveh HR, Allahtavakoli M, Rezazadeh H, et al. Proinflammatory cytokines in the embolic model of cerebral ischemia in rat[J]. Iran J Allergy Asthma Immunol, 2014, 13(2): 125-130. |
| [14] | 朱海娟, 何淑芳, 金世云, 等. 大鼠心力衰竭细胞microRNA表达谱及生物信息学分析[J]. 中华急诊医学杂志, 2016, 15(4): 439-443. DOI:10.3760/cma.j.issn.1671-0282.2016.04.009 |
| [15] | Bartel DP. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136(2): 215-233. DOI:10.1016/j.cell.2009.01.002 |
| [16] | Li L, Welser JV, Dore-Duffy P, et al. In the hypoxic central nervous system, endothelial cell proliferation is followed by astrocyte activation, proliferation, and increased expression of the alpha 6 beta 4 integrin and dystroglycan[J]. Glia, 2010, 58(10): 1157-1167. DOI:10.1002/glia.20995 |
| [17] | Guan J, Williams CE, Skinner SJ, et al. The effects of insulin-like growth factor (IGF)-1, IGF-2, and des-IGF-1 on neuronal loss after hypoxic-ischemic brain injury in adult rats: evidence for a role for IGF binding proteins[J]. Endocrinology, 1996, 137(3): 893-898. DOI:10.1210/en.137.3.893 |
| [18] | Jing Z, Han W, Sui X, et al. Interaction of autophagy with microRNAs and their potential therapeutic implications in human cancers[J]. Cancer Lett, 2015, 356(2 Pt B): 332-338. DOI:10.1016/j.canlet.2014.09.039 |
| [19] | 储照虎, 费世早, 吴家幂. 胰岛素样生长因子-1在脑出血后脑组织中的表达及作用[J]. 中华急诊医学杂志, 2006, 15(9): 805-808. DOI:10.3760/j.issn.1671-0282.2006.09.011 |
| [20] | Arsenijevic Y, Weiss S. Insulin-like growth factor-I is a differentiation factor for postmitotic CNS stem cell-derived neuronal precursors: distinct actions from those of brain-derived neurotrophic factor[J]. J Neurosci, 1998, 18(6): 2118-2128. |
| [21] | Johnston BM, Mallard EC, Williams CE, et al. Insulin-like growth factor-1 is a potent neuronal rescue agent after hypoxic-ischemic injury in fetal lambs[J]. J Clin Invest, 1996, 97(2): 300-308. DOI:10.1172/JCI118416 |
| [22] | Song CL, Liu B, Diao HY, et al. Down-regulation of miRNA-320 suppresses cardiomyocyte apoptosis and protects against myocardial ischemia and reperfusion injury by targeting IGF-1[J]. Oncotarget, 2016, 7(26): 39740-39757. DOI:10.18632/oncotarget.9240 |
 2018, Vol. 27
2018, Vol. 27




