急性肺损伤(acute lung injury,ALI)是以肺泡上皮细胞及微血管内皮细胞损伤、肺间质及肺泡弥漫性水肿,导致急性低氧性呼吸功能不全为主要特征的疾病,是常见于脓毒症等严重疾病的迟发型并发症,与患者病死率具有明显相关性。肺微血管内皮细胞,是维持血管腔隙和肺间质细胞间屏障功能的主要细胞,其屏障功能的完整性主要受到以下两种力的调控:内皮细胞自发的向心收缩力;细胞-细胞之间紧密连接(tight junctions,TJs)产生的黏附拉力[1, 2]。本综述将探讨高迁移率族蛋白B1(HMGB1)在脓毒症急性肺损伤过程中,对肺微血管内皮细胞,影响屏障功能的损伤机制。
1 HMGB1的结构与功能高迁移率族蛋白B1(high-mobility group box-1,HMGB1),是一种高度保守的,非组蛋白核蛋白,其生物学功能主要取决于其翻译后的修饰,当该蛋白未发生乙酰化时,其主要在细胞核内与核小体、转录因子及组蛋白相互作用,参与调节DNA转录。当HMGB1与DNA相结合后,可以导致DNA发生弯曲,对其他蛋白与DNA相互结合产生积极作用;而当其半胱氨酸残基发生高度乙酰化时,则导致该蛋白向细胞质移动。HMGB1在免疫应答过程中,可以由活化单核巨噬细胞,成熟树突状细胞,NK细胞和内皮细胞产生;除此之外,当发生细胞坏死时,由于其无法与DNA相结合,也可以导致HMGB1被动从细胞内泄露。细胞外HMGB1主要作为促炎因子,参与促进炎症反应,白细胞聚集和生血管等生理过程[3]。
高迁移率族蛋白1(HMGB1)是细胞核转录因子,因HMGB1的产生明显晚于其他介质,且持续时间较长,也被称作脓毒症的“晚期”介质[4],针对HMGB1的治疗时间窗较目前已知的其他细胞因子较长,也为临床治疗脓毒症引发的急性肺损伤提供相关依据。微血管内皮细胞是血液循环中炎症因子的首要攻击目标,而HMGB1对微血管内皮的损伤也是刺激系统性炎症反应的主要因素之一[5-6]。
急性肺损伤具有综合性和复杂性。HMGB1在脓毒症导致的急性肺损伤过程中,主要促进失控性炎症反应的发展。内毒素在诱导TNF-α、IL-1、IL-6及IFN-γ等炎症介质释放的同时,间接参与HMGB1的诱导,且体内实验也证实脓毒症情况下HMGB1 mRNA水平保持高表达状态[7]。当HMGB1产生后,将进一步促进肺组织中单核细胞合成分泌炎症因子,导致炎症反应恶性循环,不断放大,引发炎症反应失控。此外,HMGB1作为体内强效肝素结合蛋白,在损伤内皮细胞的同时,还可以诱导其产生纤溶蛋白酶原激活因子,降低纤溶系统对血管的保护作用,进一步导致组织水肿和炎症细胞的聚集[8]。
2 急性肺损伤与内皮细胞屏障功能肺微血管内皮细胞是脓毒症时最先受到冲击的细胞。当内皮细胞向心的收缩力及细胞-细胞间紧密连接黏附力失衡导致的[1]时,内皮细胞屏障功能受损,就产生ALI特征性的病理生理变化。肌动蛋白纤维也是调控内皮细胞屏障功能的主要因素:肌动蛋白纤维断裂则通透性增加,激动蛋白稳定则有助于屏障功能的恢复。肌动蛋白纤维与组成紧密链接的多种分子也可以相互作用,从而调控细胞间紧密连接的黏附力[9]。
紧密连接主要由occludin、claudin-5、ZO-1和ZO-2等蛋白组成。目前HMGB1作为紧密连接的损伤因素,被相关领域学者证实[10]。紧密连接(TJS)是维持内皮细胞屏障功能的主要成分之一,主要由跨膜蛋白claudins和occludin、连接黏附分子、外周膜蛋白等部分组成。细胞间隙和黏附链接使跨膜蛋白在细胞膜表面形成并与细胞细胞骨架紧密相连[9]。Occludin和Claudins是连接蛋白主要两类,在紧密连接中其负责细胞间的直接黏附并维持内皮细胞的渗透性[6, 10, 12]。紧密链接蛋白(zonula occludin proteins, ZO-1, -2, -3)在紧密链接形成过程中,使连接链接与细胞骨架形成紧密复合体,也成为完善内皮细胞屏障功能的重要组成部分[13]。
Wolfson等[7]研究发现用HMGB1处理肠上皮细胞和内皮细胞后,可引起单层细胞屏障功能丧失;重症急性胰腺炎时HMGB1表达延迟升高,也可以介导肠黏膜屏障通透性增加和肝、肺损伤;HMGB1还可通过改变肠黏膜上皮细胞occludin蛋白的分布和表达水平,增加肠黏膜屏障通透性[14-15]。用rhHMGB1处理内皮细胞后,内皮细胞对辣根过氧化物酶(horseradish peroxidase, HRP)通透性增加并且F-actin外周致密带逐渐断裂、解聚,也证实HMGB1可重构内皮细胞骨架,形成应力纤维。通过支气管镜活检发现,ALI患者内皮细胞周围组织间液中,HMGB1含量较血浆中含量高1 000倍以上,可达9.2 μg/mL[16]。可以说HMGB1释放增加与单层细胞通透性增加及内皮细胞损伤有着紧密的相关性,因此HMGB1对内皮细胞间紧密连接的损伤将对全身炎症反应起推动作用。
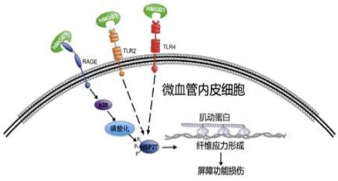
3 HMGB1损伤紧密连接的相关机制目前已知的HMGB1三种受体都可以在内皮细胞表面表达:糖基化终产物受体(RAGE),Toll样受体2和4(TLR2和TLR4)[17]。TLR2和TLR4也常被认为是HMGB1的特异性受体,但以上两种受体并不直接参与HMGB1对内皮细胞屏障功能的损伤机制,而是通过另外的途径激活非RAGE受体,并促进TNF-α等细胞因子释放。目前有学者通过基因敲出技术证明[18],HMGB1调控巨噬细胞释放TNF-α的过程中,TLR4是必不可少的受体之一,TLR2和TLR4受体,通过下游MyD88,TIRAP,IRAK-1和IRAK-2等分子,主要参与了HMGB1促进NF-κB激活的过程,从而进一步引起炎症因子的释放,间接地导致内皮细胞屏障功能的损伤[19-20]。
RAGE受体与配体HMGB1结合并激活两个主要途径:Rac/CDC42信号通路和丝裂原活化蛋白激酶(MAPK)通路[21]。MAPK活化会激活热休克蛋白(heat shock protein,Hsp27),其与肌动蛋白结合并调控其结构,对内皮细胞屏障功能产生影响。Hsp27在细胞受到损伤时,可以通过稳定肌动蛋白微丝,保护细胞,避免凋亡发生[11, 22-23]。在正常细胞内,Hsp27可以形成非磷酸化单体的大聚合体,在肌动蛋白丝两端形成帽状结构,调控微丝的组装;而磷酸化的Hsp27则由大聚合体分解为较小的聚合体,沿F-actin排列,防止微丝结构被相关蛋白酶水解。目前有研究发现,磷酸化的Hsp27可以使肌动蛋白末端延长,并与之结合稳定微丝结构[5, 24]。可以说,Hsp27磷酸化水平对激动蛋白组成细胞骨架,并调控内皮细胞功能具有至关重要的作用[25]。TNF-α,凝血酶和过氧化氢等分子,以Hsp27磷酸化为主要靶点,可以造成类似ALI肺水肿等症状;增加Hsp27磷酸化也将增加脓毒症动物模型肺损伤的程度[26]。肌动蛋白纤维是内皮细胞屏障的调控关键,而Hsp27磷酸化水平则有效影响细胞骨架纤维断裂,引起细胞屏障功能损伤,见图 1。
|
| 图 1 内皮细胞屏障功能受损示意图 |
|
|
总体而言,HMGB1作为促炎及“晚期”炎症介质,促进炎症细胞聚集在内皮细胞周围,并促进炎症因子的释放;还可以下调紧密连接相关蛋白的表达,减弱细胞间黏附作用力;此外,HMGB1通过RAGE-p38 MAKP通路,激活Hsp27磷酸化,破坏或重塑细胞骨架,增加细胞收缩应力,从而进一步扩大内皮细胞间隙,损伤屏障功能(图 1)。因此,明确HMGB1在脓毒症急性肺损伤过程中的病理生理学意义,才有利于在临床工作中,针对HMGB1损伤内皮细胞的生物学机制,作出及时而有效的治疗。
| [1] | Wolfson RK, Chiang ET, Garcia JG. HMGB1 induces human lung endothelial cell cytoskeletal rearrangement and barrier disruption[J]. Microvasc Res, 2011, 81(2): 189-197. DOI:10.1016/j.mvr.2010.11.010 |
| [2] | Yang R, Zou X, Tenhunen J, Tønnessen TI. HMGB1 and extracellular histones significantly contribute to systemic inflammation and multiple organ failure in acute liver failure[J]. Mediators Inflamm, 2017, 2017: 5928078. DOI:10.1155/2017/5928078 |
| [3] | Hasegawa A, Iwasaka H, Hagiwara S, et al. Relationship between HMGB1 and tissue protective effects of HSP72 in a LPS-induced systemic inflammation model[J]. J Surg Res, 2011, 169(1): 85-91. DOI:10.1016/j.jss.2009.10.015 |
| [4] | Ebina M. Pathognomonic remodeling of blood and lymphatic capillaries in idiopathic pulmonary fibrosis[J]. Respir Investig, 2017, Jan; 55(1): 2-9. DOI:10.1016/j |
| [5] | Belgrano FS, de Abreu da Silva IC, Bastos de Oliveira FM., et al. Role of the acidic tail of high mobility group protein B1 (HMGB1) in protein stability and DNA bending[J]. PLoS One, 2013, 8(11): e79572. DOI:10.1371/journal.pone.0079572 |
| [6] | Zhou W, Wang J, Li Z, et al. MicroRNA-2055b inhibits HMGB1 expression in LPS-induced sepsis[J]. Int J Mol Med, 2016, 38(1): 312-318. DOI:10.3892/ijmm.2016.2613 |
| [7] | Wolfson RK, Mapes B, Garcia JG. Excessive mechanical stress increases HMGB1 expression in human lung microvascular endothelial cells via STAT3[J]. Microvasc Res, 2014, 92(3): 50-55. DOI:10.1016/j.mvr.2013.12.005 |
| [8] | Doi K. Role of kidney injury in sepsis[J]. J Intensive Care, 2016, 23, 4: 17. DOI:10.1186/s40560-016-0146-3 |
| [9] | Huang LF, Yao YM, Sheng ZY. Novel insights for high mobility group box 1 protein-mediated cellular immune response in sepsis: A systemic review[J]. World J Emerg Med, 2012, 3(3): 165-171. DOI:10.5847/wjem.j.1920-8642.2012.03.001 |
| [10] | Qiu QM, Li ZW, Tang LM, et al. Expression of high mobility group protein B1 in the lungs of rats with sepsis[J]. World J Emerg Med, 2011, 2(4): 302-306. DOI:10.5847/wjem.j.1920-8642.2011.04.011 |
| [11] | Chen Y, Sun W, Gao R, et al. The role of high mobility group box chromosomal protein 1 in rheumatoid arthritis[J]. Rheumatology, 2013, 52(10): 1739-1747. DOI:10.1093/rheumatology/ket134 |
| [12] | Reiss LK, Uhlig U, Uhlig S. Models and mechanisms of acute lung injury caused by direct insults[J]. Eur J Cell Biol, 2012, 91(6-7): 590-601. DOI:10.1016/j.ejcb.2011.11.004 |
| [13] | Kojima T, Go M, Takano K, et al. Regulation of tight junctions in upper airway epithelium[J]. Biomed Res Int, 2013: 947072. DOI:10.1155/2013/947072 |
| [14] | Yang L, Xie M, Yang M, et al. PKM2 regulates the Warburg effect and promotes HMGB1 release in sepsis[J]. Nat Commun, 2014, 5: 4436. DOI:10.1038/ncomms5436 |
| [15] | Liu QY, Yao YM. Inflammatory response and immune regulation of high mobility group box-1 protein in treatment of sepsis[J]. World J Emerg Med, 2010, 1(2): 93-98. |
| [16] | Shen L. Tight junctions on the move: molecular mechanisms for epithelial barrier regulation[J]. Ann N Y Acad Sci, 2012, 1258: 9-18. DOI:10.1111/j.1749-6632.2012.06613.x |
| [17] | 巩博, 江伟伟, 魏东坡, 等. 生大黄灭菌溶液对脓毒症大鼠的治疗作用及对炎症因子的影响[J]. 中华急诊医学杂志, 2017, 26(5): 544-548. DOI:10.3760/cma.j.issn.1671-0282.2017.05.012 |
| [18] | Gando S. Microvascular thrombosis and multiple organ dysfunction syndrome[J]. Crit Care Med, 2010, 38(2 Suppl): S35-42. DOI:10.1097/CCM.0b013e3181c9e31d |
| [19] | Valdes-Ferrer SI, Papoin J, Dancho ME, et al. HMGB1 mediates anemia of inflammation in murine sepsis survivors[J]. Mol Med, 2015. [Epub ahead of print]. DOI: 10.2119/molmed.2015.00243. |
| [20] | Li K, Yang J, H an. Ketamine attenuates sepsis-induced acute lung injury via regulation of HMGB1-RAGE pathways[J]. Int Immunopharmacol, 2016, 34: 114-128. DOI:10.1016/j.intimp.2016.01.021 |
| [21] | 潘赟, 钱进先, 崔妍, 等. 丹参酮ⅡA磺酸钠对大鼠心肌缺血-再灌注损伤的影响[J]. 中华急诊医学杂志, 2016, 25(7): 864-870. DOI:10.3760/cma.j.issn.1671-0282.2016.07.005 |
| [22] | Chavan SS, Huerta PT, Robbiati S, et al. HMGB1 mediates cognitive impairment in sepsis survivors[J]. Mol Med, 2012, 18: 930-937. DOI:10.2119/molmed.2012.00195 |
| [23] | Diener KR., Al-Dasooqi N, Lousberg EL, et al. The multifunctional alarmin HMGB1 with roles in the pathophysiology of sepsis and cancer[J]. Immunol Cell Biol, 2013, 91(7): 443-450. DOI:10.1038/icb.2013.25 |
| [24] | Gentile LF, Moldawer LL. HMGB1 as a therapeutic target for sepsis: it' s all in the timing![J]. Expert Opin Ther Targets, 2014, 18(3): 243-245. DOI:10.1517/14728222.2014.883380 |
| [25] | 任超, 李秀花, 许碧磊, 等. 中枢拮抗高迁移率族蛋白B1对脓毒症脑损伤的影响[J]. 中华急诊医学杂志, 2016, 25(4): 433-438. DOI:10.3760/cma.j.issn.1671-0282.2016.04.008 |
| [26] | Huang W, Liu Y, Li L, et al. HMGB1 increases permeability of the endothelial cell monolayer via RAGE and Src family tyrosine kinase pathways[J]. Inflammation, 2012, 35(1): 350-362. DOI:10.1007/s10753-011-9325-5 |
 2018, Vol. 27
2018, Vol. 27




