创伤失血性休克(trumatic hemorrhagic shock, THS)是由于机体组织和脏器受到严重创伤后,机体大量出血,有效循环血量锐减,组织灌注不足,导致细胞缺氧、功能障碍等全身失代偿综合征[1-3]。创伤失血性休克具有高发生率、高病死率的特点,据统计每年约有2 960万人受伤,约有179 000死亡[4],是全球40岁以下死亡的主要原因[5],有报道指出伊拉克战争中87%的战场死亡是在到达医院前,其中有91%与失血性休克有关[6]。沙漠具有夏季气温高,昼夜温差大,干燥等气候特征,仅我国西北部地区就分布着大面积的戈壁沙漠,总面积约为130万平方公里,笔者前期进行的沙漠干热环境大鼠创伤失血性休克实验表明,沙漠干热环境创伤失血性休克的损伤发生早、且损伤严重[1, 7]。电解质的改变程度代表着低血容量性休克细胞功能障碍的程度[2]。钾离子具有多种生理功能(如心脏电生理及血管功能等),一直备受关注[8-9]。沙漠干热环境下创伤失血性休克的血清离子的变化特点目前在国内外尚未见文献报道,本研究拟通过建立沙漠干热环境创伤失血性休克大动物模型观察血清K+离子浓度、乳酸(Lac)、葡萄糖(Glu)变化特点,为沙漠干热环境创伤失血性休克的救治提供理论依据。
1 材料与方法 1.1 实验动物分组及环境本地雄性长白仔猪40头(25~35 kg,9周龄)。购自新疆天康畜牧生物技术股份有限公司,动物检疫合格证号:No.6500418762。随机(随机数字法)分为常温假手术组(normal temperature sham group, NS组,n=10),常温创伤失血性休克组(normal temperature traumatic hemorrhagic shock group, NTHS组,n=10),干热假手术组(dry-heat sham group, DS组,n=10),干热创伤失血性休克组(dry-heat traumatic hemorrhagic shock group, DTHS组,n=10)。模拟环境在西北特殊环境人工实验舱(新疆军区总医院研制)内进行,常温环境:温度(25±1)℃,湿度(35±5)%;沙漠干热环境:温度(40.5±0.5)℃,湿度(10±2) %。实验经新疆军区总医院伦理与福利委员会批准通过。
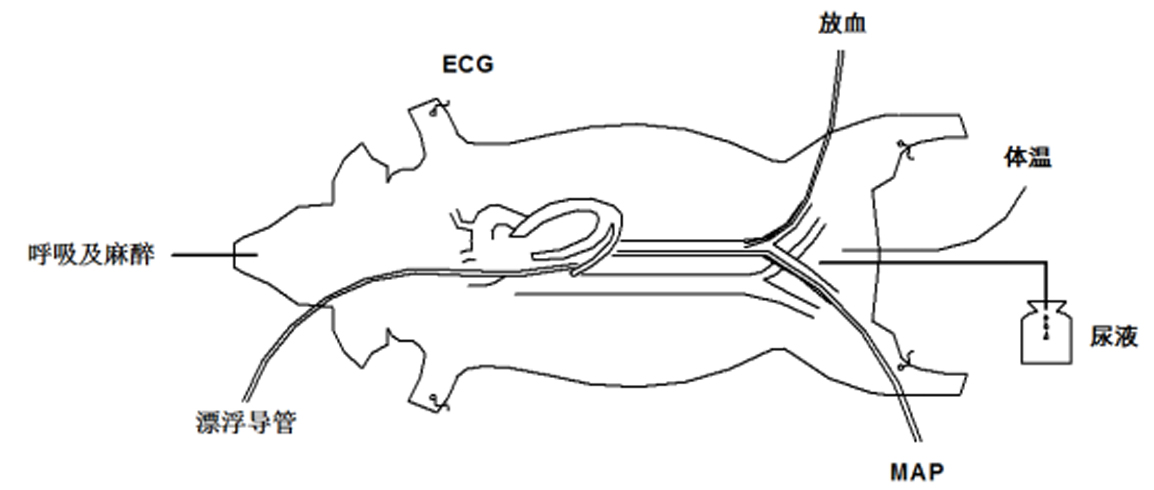
1.2 建立动物模型按以上分组将实验动物分别置于已提前设置相应环境的实验舱内分别暴露3 h。诱导麻醉使用氯胺酮(福建古田药业有限公司)20 mg/kg、阿托品(天津金耀药业有限公司)0.05 mg/kg肌肉注射;使用1.5%~3%的七氟烷(上海恒瑞医药有限公司)混入50%的氧气中维持麻醉,连接心电监护(深圳迈瑞生物医疗电子股份有限公司),BL-420(中国成都)体温监测,连续监测。完成麻醉,分离暴露右侧颈外静脉插入漂浮导管(Edwards Lifesciences LLC)以监测血流动力学及取混合静脉血液样本,右侧股动脉插管监测动脉血压,左侧股动脉用于放血及血液样本的采集。中线开腹、膀胱造瘘。NTHS组和DTHS组切除脾脏、称重,并输入3倍脾重的乳酸林格液(北京雷根生物科技有限公司)[10-11]。休克模型采用固定血压的中度创伤失血性休克模型[11],自髂外动脉快速放血致平均动脉压(MAP)(45±5) mmHg(1 mmHg=0.133 kPa),稳定20 min后记录休克0时,稳定期间可通过再放血或者静脉输入乳酸林格液,稳定目标血压。NS组和DS组按照上述方法完成动脉等监测后,行剖腹术及膀胱造瘘术后结束手术操作,未予创伤失血休克处理,故无切脾切肝及输入乳酸林格液等步骤。NS组在NTHS组存活最长时间基础上延长约30 min后处死,DS组在DTHS组存活最长时间的基础上延长约30 min后处死。模型建立示意图见图 1。
|
| 图 1 动物模型示意图 Figure 1 Schematic diagram of the model |
|
|
分别于暴露后、休克0时及休克后每30 min自左侧股动脉抽取动脉血,NTHS组和DTHS组直至动物自然死亡,NS组至暴露后11 h前,DS组至暴露后4 h前。动脉血液抽取后置于4℃保温盒内10 min内送至本院ICU血气分析仪(GEM Premier 3000,USA)检测动脉血清乳酸、葡萄糖及钾离子浓度。
1.4 统计学方法统计学处理采用SPSS 21.0软件,符合正态分布的计量资料以均数±标准差(x ± s)表示。采用Sigmaplot 12.5软件作图。方差齐时采用单因素方差分析,并以LSD进行多重比较,方差不齐时采用Kruskal Wallis检验,相关性分析采用Pearson相关性检验。以P < 0.05为差异有统计学意义。
2 结果在实验过程中,没有因为手术或麻醉等意外发生。沙漠干热环境创伤失血性休克的生存时间约为3.25 h左右,常温环境创伤失血性休克的休克后的生存时间长达10.5 h,故本研究中干热环境假手术组动物处死时间为暴露后4 h,常温假手术组的处死时间为11 h。
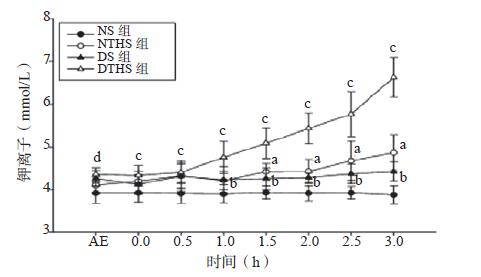
2.1 血清K+变化血清K+浓度环境暴露后干热环境组的血清K+浓度显著高于常温环境组(t=10.59,P < 0.01)。NTHS组自休克后缓慢上升,至休克后期(约5 h后)快速上升,与NS组至休克后1.5 h呈现显著差异(t=4.44,P < 0.01),并持续至动物死亡。DTHS组自休克后即快速上升,与NTHS组自暴露后即差异有统计学意义(t=3.68,P=0.01),见图 2。
|
| 与NS组比较,aP < 0.05;与DTHS组比较,bP < 0.05;与NTHS组比较,cP < 0.05;干热环境组与常温环境组暴露3 h比较,dP < 0.05 图 2 各组血清钾离子浓度变化趋势图 Figure 2 The trend chart of serumpotassium level in each group |
|
|
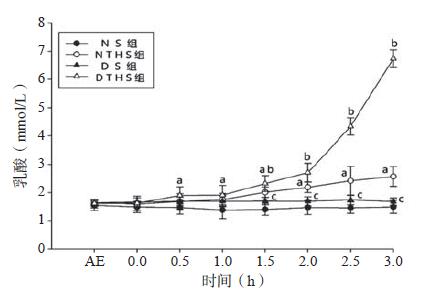
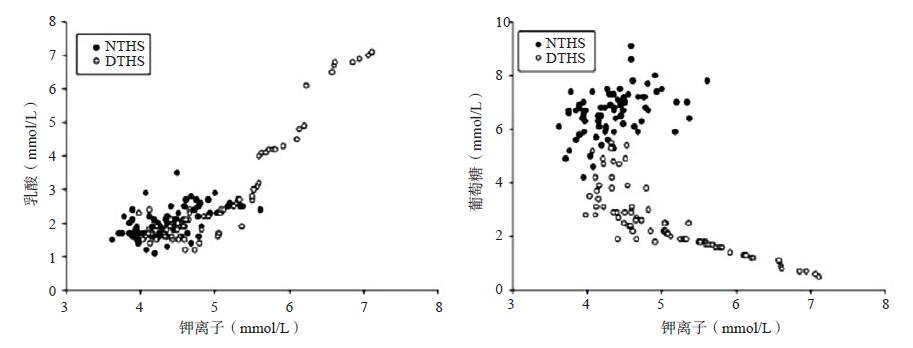
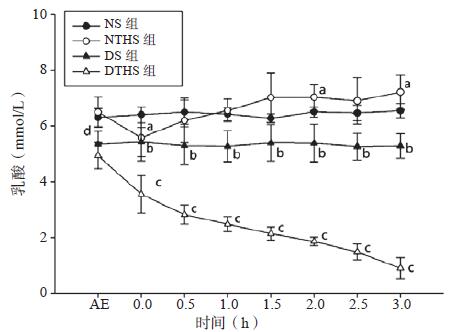
血清乳酸浓度暴露后血清乳酸(Lac)浓度各组间差异无统计学意义,休克后自0 h开始,NTHS组和DTHS组均呈上升趋势。NTHS组自创伤失血性休克后缓慢上升,自4 h后呈快速上升,0.5 h后即与NS组差异有统计学意义(t=2.5,P < 0.05)。DTHS组休克后即呈进行性快速上升趋势,2 h后尤显突出,与具有上升趋势的NTHS组和DS组和自创伤失血性休克1.5 h后,差异有统计学意义(t=6.30,P < 0.01)。休克3 h DTHS组血清Lac浓度达(6.74±0.32) mmol/L,而NTHS组和DS组分别是(2.57±0.35)mmol/L、(1.68±0.13) mmol/L(图 3)。至DTHS组动物死亡,血清K+与Lac浓度呈正相关,相关系数分别为rDHTS=0.927,rNTHS=0.539(P < 0.01),见图 4。
|
| 与NS组比较,aP < 0.05;与DTHS组比较,bP < 0.05;与NTHS组比较,cP < 0.05 图 3 各组血清乳酸浓度变化趋势图 Figure 3 The trend chart of serum lactate in each group |
|
|
|
| 图 4 钾离子与乳酸、葡萄糖相关的散点图 Figure 4 The scatter plot of serum K+ and lactic acid, and serum K+ and glucose |
|
|
血清葡萄糖浓度暴露后干热环境组血清葡萄糖(Glu)浓度显著低于常温组(F=27.275,P < 0.01)。NTHS组自创伤失血性休克后在NS组上下波动,自4 h后呈快速进行性下降,3h内仅0 h、2 h和3 h与NS组差异有统计学意义(P < 0.05)。DTHS组自开始建立模型开始即呈进行性快速下降,与DS组自休克0 h开始差异有统计学意义(t=6.23,P < 0.05),与NTHS组自休克后即差异有统计学意义,持续至DTHS组动物死亡(图 5)。血清K+浓度与DTHS组血清Glu浓度呈负相关,与NTHS组呈正相关,相关系数分别是rDHTS=-0.804,rNTHS= 0.420(P < 0.01),见图 4。
|
| 与NS组比较,aP < 0.05;与DTHS组比较,bP < 0.05;与NTHS组比较,cP < 0.05;干热环境组与常温环境组暴露3 h比较,dP < 0.05 图 5 各组血清葡萄糖浓度变化 Figure 5 The changes of serum glucose in each group |
|
|
本研究首次成功建立沙漠干热环境创伤失血性休克猪的动物模型,与笔者前期建立的沙漠干热环境创伤失血性休克大鼠相比[1],猪的属性更接近于人类,病理生理反应与人类有较多相似之处,因此研究结果与人类有更好的拟合效应。本实验未进行心电图分析,但是进行尸检时发现,部分常温创伤失血性休克组和干热创伤失血性休克组死亡动物的心脏处于舒张期,证明其死亡与高钾血症有关,因此本实验主要观察血清钾离子浓度的变化特点,研究其与机体乳酸酸中毒及血清葡萄糖浓度的关系,探讨可能参与高钾血症的因素。
钾离子广泛分布于全身组织器官,对维持机体神经细胞、心肌细胞和平滑肌细胞正常生理功能发挥重要作用[8],血清钾离子浓度过高或过低都会严重威胁人们健康和生命安全(心脏骤停)。本研究发现干热环境中猪的血清K+暴露后即与常温组差异有统计学意义(P < 0.05),干热环境中的创伤失血性休克组(DTHS组)自模型建立后即呈快速上升趋势,与NTHS组始终保持较大差异(P < 0.05),与DS组在约1.5 h即差异有统计学意义,至DTHS组动物死亡时(约3 h),其血清K+浓度达(6.62±0.46)mmol/L,与NTHS组和DS组均差异有统计学意义(P < 0.05),这可能是部分动物死亡时心脏处于舒张期的主要原因。
正常机体钾离子98%储存于细胞内,细胞内外钾离子浓度比为30:1[13],内源性或外源性多种因素影响体内钾离子分布,酸中毒是较为常见的原因之一[14],创伤失血性休克后,血液大量丢失,循环不足,组织缺氧导致体内大量乳酸堆积,血清中H+增加,细胞H+-K+交换活跃,细胞内K+外流,血钾升高;血液中H+增加,细胞膜电压门控通道活化,钾离子外流,血钾升高。本实验中DTHS组自0.5 h血清Lac即处于快速进行性升高趋势,至3 h,NTHS组血清Lac浓度达(6.74±0.32)mmol/L,是相同时间点NTHS组(2.57±0.35)mmol/L和DS组(1.68±0.132)mmol/L的数倍。经Pearson相关性分析显示,DTHS组和NTHS组血清K+与Lac浓度呈正相关,相关系数分别为rDHTS=0.927,rNTHS=0.539(P < 0.01),因此认为沙漠干热环境创伤失血性休克猪由于受到干热环境和创伤失血性休克的“双重打击”,使组织缺血缺氧发生较早且严重,乳酸升高早且快,最终导致血清K+升高早且快。
在哺乳动物细胞膜上广泛分布着钠泵(Na+-K+-ATP酶)。钠泵每分解1分子ATP可将3个钠离子移出胞外,同时将两个钾离子移进胞内[15],因此ATP是钠泵保持功能的必要前提,糖作为体内能量代谢的主要物质之一,是体内ATP直接来源主要途径[16],创伤失血性休克引起机体高代谢导致体内能量物质快速消耗及缺氧导致的体内葡萄糖不能快速彻底水解等,导致ATP合成不足,消耗过快,最终导致体内ATP储存不足,钠泵活性受到抑制,使细胞外钾离子不能泵入细胞内,是血钾持续升高的重要原因;除钠泵外,细胞膜上还存在一种ATP敏感钾通道(KATP)通道,组织缺血缺氧时,ATP合成减少,从而激活KATP[17],使细胞内K+外流,是另一个血钾升高的重要原因。热环境引起心率、呼吸增快等机体高代谢[7]。本研究发现沙漠干热环境暴露后,血清葡萄糖浓度显著低于常温环境(P < 0.01),可能是导致干热环境暴露后血清K+显著高于常温环境组的重要原因;DTHS组休克后血清葡萄糖呈进行性快速下降,未呈现NTHS组休克后的代偿性升高和DS组麻醉后基本平稳的趋势,至3 h,DTHS组血清葡萄糖降至(0.9±0.38)mmol/L,低于同时间点其他各组的数倍,经Pearson相关性分析显示,DTHS组和NTHS组血清K+与Glu浓度呈正相关,关系数分别是rDHTS=-0.804,rNTHS=-0.420(P < 0.01),因此笔者推测本实验中沙漠干热环境的创伤失血性休克猪在创伤失血性休克的“雪”上加干热环境“霜”的双重打击,加快了体内能量物质的消耗,使DTHS组呈进行性快速下降,导致ATP快速减少,从而导致胞外K+浓度持续性升高。
创伤失血性休克后,机体由于受到创伤直接损伤、THS后炎症或氧自由基等对机体组织或器官细胞膜的直接、间接损伤,导致细胞膜上Na+-K+泵功能紊乱,活性降低[17],Na+内流,K+外流是造成高钾血症的另一个原因。而热应激会导致全身组织器官损伤,甚至凋亡[18-19]。本实验中DTHS组由于热应激和创伤失血性休克的双重打击必然导致组织器官的细胞膜损伤更严重,从而导致暴露后及休克后的高钾血症比NTHS组和DS组更严重。
热环境中的机体主要通过皮肤血管扩张,蒸发带走多余的热量[20],导致体液丢失,血液浓缩,也是血钾升高的原因;肾脏是排钾的重要器官,约85%由肾脏排泄,干热环境和创伤失血性休克都有血液重新分布,肾血流量减少的特点,使DTHS组较早期即出现少尿、无尿,也是导致机体排钾减少也是机体高钾血症的重要原因。
因此,笔者认为干热环境创伤失血性休克猪的高钾血症是由创伤失血性休克和干热环境共同导致的,但这种作用并不是两种因素的简单加和。自休克1 h后,干热环境DS组的血钾水平始终低于常温NTHS组的血钾水平,因此笔者推测对干热环境创伤失血性休克猪的钾离子变化,创伤失血性休克的影响可能较干热环境影响更大,其机制尚待进一步研究。
综上所述,由于热应激和创伤失血性休克的双重打击,沙漠干热环境创伤失血休克组的高钾血症比常温失血性休克组和干热假手术组的高钾血症发生早,且严重,虽具体机制尚不完全清楚,但与机体酸中毒及高代谢密切相关,提示及时有效地控制高钾血症、酸中毒及补给足够能量,对提高沙漠干热环境创伤失血性休克的救治成功率可能起重要作用。
| [1] | 刘江伟, 钱建辉, 李瑞, 等. 沙漠干热环境下创伤失血性休克大鼠模型的建立[J]. 中国比较医学杂志, 2015, 25(2): 30-33. DOI:10.3969/j.issn.1671-7856.2015.02.009 |
| [2] | Lee MY, Yang DK, Kim SJ. Alterations of Mg2+ after hemorrhagic shock[J]. Biol Trace Elem Res, 2017, 180(1): 120-126. DOI:10.1007/s12011-017-0994-2 |
| [3] | 宋轶, 路晓光, 陈龙翊, 等. AQP5和CC16蛋白在大鼠失血性休克复苏后肺损伤中的表达及意义[J]. 中华急诊医学杂志, 2017, 26(12): 1397-1401. DOI:10.3760/cma.j.issn.1671-0282.2017.12.013 |
| [4] | Hylands M, Toma A, Beaudoin N, et al. Vasopressor use following traumatic injury: protocol for a systematic review[J]. BMJ Open, 2017, 7(2): e14166. DOI:10.1136/bmjopen-2016-014166 |
| [5] | 刘明华, 赵晓东, 于学忠. 创伤失血性休克诊治中国急诊专家共识[J]. 中华急诊医学杂志, 2017, 26(12): 1358-1365. DOI:10.3760/cma.j.issn.1671-0282.2017.12.004 |
| [6] | Eastridge BJ, Mabry RL, Seguin P, et al. Death on the battlefield (2001-2011): implications for the future of combat casualty care[J]. J Trauma Acute Care Surg, 2012, 73(6 Suppl 5): S431-437. DOI:10.1097/TA.0b013e3182755dcc |
| [7] | 沈才福, 刘江伟, 钱若筠, 等. 沙漠干热环境不同温度对创伤失血性休克猪生存时间的影响[J]. 实验动物科学, 2016, 33(4): 48-51. DOI:10.3969/j.issn.1006-6179.2016.04.009 |
| [8] | Nassoiy SP, Byron KL, Majetschak M. Kv7 voltage-activated potassium channel inhibitors reduce fluid resuscitation requirements after hemorrhagic shock in rats[J]. J Biomed Sci, 2017, 24(1): 8. DOI:10.1186/s12929-017-0316-1 |
| [9] | Kaczorowski GJ, Garcia ML. Developing molecular pharmacology of BK channels for therapeutic benefit[J]. Int Rev Neurobiol, 2016, 128: 439-475. DOI:10.1016/bs.irn.2016.02.013 |
| [10] | Borovniklesjak V, Whitehouse K, Baetiong A, et al. Effects of intraosseous erythropoietin during hemorrhagic shock in swine[J]. Plos One, 2014, 9(11): e110908. DOI:10.1371/journal.pone.0110908 |
| [11] | Larentzakis A, Toutouzas KG, Papalois A, et al. Porcine model of hemorrhagic shock with microdialysis monitoring[J]. J Surg Res, 2013, 179(1): e177-182. DOI:10.1016/j.jss.2012.01.040 |
| [12] | Fulop A, Turoczi Z, Garbaisz D, et al. Experimental models of hemorrhagic shock: a review[J]. Eur Surg Res, 2013, 50(2): 57-70. DOI:10.1159/000348808 |
| [13] | 贾绍杰, 周华忠. 钾离子代谢与临床[J]. 中国社区医师(医学专业半月刊), 2009, 11(20): 140. DOI:10.3969/j.issn.1007-614x.2009.20.171 |
| [14] | 杜鹏飞, 朱海彬, 赵会民. 不同补液强度对重度失血性休克早期血清乳酸及钾的影响[J]. 中国急救医学, 2013, 33(5): 462-464. DOI:10.3969/j.issn.1002-1949.2013.5.021 |
| [15] | 吴博威. 细胞的基本功能[M]//朱大年. 生理学. 7版. 北京: 人民卫生出版社, 2008: 9-16. |
| [16] | Lusczek ER. Metabolic alterations associated with hemorrhagic shock and traumatic injury as measured in the urine[D]. University of Minnesota: 2011. http://journals.lww.com/shockjournal/Pages/articleviewer.aspx?year=2014&issue=01000&article=00012&type=Fulltext |
| [17] | 张海霞, 王晓良. 氧敏感钾离子通道的功能、亚型及氧敏感的可能机制[J]. 中国药理学通报, 2004, 20(8): 841-844. DOI:10.3321/j.issn.1001-1978.2004.08.001 |
| [18] | 王俊义, 高志清, 张贞乾, 等. 出血性休克细胞膜损伤机制的实验研究[C]//第三次全国急诊医学学术会议, 杭州, 1990. |
| [19] | Mei C, He SS, Yin P, et al. Magnolol pretreatment attenuates heat stress-induced IEC-6 cell injury[J]. J Zhejiang Univ Sci B, 2016, 17(6): 413-424. DOI:10.1631/jzus.B1500261 |
| [20] | Crandall CG, Wilson TE. Human cardiovascular responses to passive heat stress[J]. Compr Physiol, 2015, 5(1): 17-43. DOI:10.1002/cphy.c140015 |
 2018, Vol. 27
2018, Vol. 27




