心脏骤停(cardiac arrest, CA)是临床上最为严重的急症,全球每年数百万人发生CA[1],通过救治,其中25%~50%的患者可以恢复自主循环(restoration of spontaneous circulation, ROSC),但只有2%~10%的患者可以存活出院并具有较好的神经功能[2-3]。准确评估ROSC患者的脑损伤程度及预后具有十分重要的意义。
目前多通过临床体征、脑电图和影像学等方法评估CA患者脑损伤,有研究发现高达30%的评估结果是不可靠的[4]。电子发射型计算机断层显像(positron emission tomography, PET)是一种核医学影像技术,在器官发生解剖学改变之前即可以检测其代谢变化[5],而能量代谢特别是糖代谢的变化可能是判断脑缺血缺氧损伤预后的指标[6]。本研究拟采用18F-FDG PET对CA大鼠心肺复苏后(cardiopulmonary resuscitation, CPR)脑损伤程度与脑葡萄糖代谢变化之间的关系进行研究。
1 材料与方法 1.1 动物准备本实验获中山大学动物伦理委员会批准,42只健康成年雄性Wistar大鼠,体质量量280~320 g,由南方医科大学实验动物中心提供。动物购进后在SPF级动物房饲养一周,实验前晚禁食不禁水。动物麻醉:戊巴比妥钠(sigma公司,美国)30 mg/kg腹腔内注入,酌情给予1/3的首剂量维持。
1.2 手术操作麻醉成功后,以14 G鞘管经口气管插管,接小动物呼吸机(Harvard Apparatus, 美国),通气频率70次/min,潮气量12 mL/kg。连续Ⅱ导联心电监护,解剖分离股动静脉,24 G留置针穿刺,动脉管监测动脉血压,静脉管用以给药。四通道生理信号采集分析系统(SantaBarbara, 美国)记录血压、心电信息。调整电热毯温度使肛温维持在(36.5±0.5)℃。
1.3 模型制备采用窒息法建立大鼠CA模型,静脉注射维库溴铵2 mg/kg消除大鼠自主呼吸,于呼气末关闭呼吸机、封堵气管导管。当收缩压至20 mmHg(1 mmHg=0.133 kPa)以下开始CA计时,各组大鼠CA时间达到实验分组要求后开放气道、纯氧机械通气,通气频率70次/min,同时进行胸外按压,按压频率约200次/min,按压深度为胸廓前后径1/3,每3 min予0.02 mg/kg肾上腺素静推直至ROSC。ROSC定义为平均动脉压(mean arterial pressure,MAP)>50 mmHg并持续10 min以上,复苏10 min无效者放弃复苏。ROSC后持续机械通气2 h。
1.4 实验分组大鼠随机(随机数字法)分为实验组和假手术组。实验组分为CA4组、CA6组和CA8组,每组12只动物,分别于CA后4、6、8 min给予CPR。假手术组(sham)6只大鼠,仅行麻醉置管。
1.5 PET扫描各实验组大鼠于ROSC 24 h、72 h,假手术组于术后72 h行PET扫描。扫描时以戊巴比妥进行麻醉,经股静脉置管注入18F-FDG(4.25 MBq/kg)。注射后40 min开始扫描。PET图像以三维有序子集最大期望值法重建。以IRW4.1软件对大鼠大脑外耳道层面进行感兴趣区域(region of interest, ROI)勾画,勾画直径为3 mm圆形区域。脑摄取FDG值取外耳道层面皮质区5个区域的最大标准化摄取值(maximum standardized uptake value,SUVmax)平均数。SUV=(peak kBq/mL in ROI)/(injected activity/gram body weight)。以SUVmax值反映葡萄糖代谢水平[7]。
1.6 神经功能缺损评分(neurological deficit score, NDS)各实验组大鼠ROSC 24 h、72 h进行NDS评分[8],sham组大鼠术后72 h测评。从整体行为、肌张力评分、脑干功能、运动评分、感觉评分、行为学评分、癫痫发作7个方面评估脑损伤程度,总分80分为正常,0分为脑死亡。
1.7 脑组织病理损伤及凋亡细胞检测各组大鼠于实验72 h麻醉后脱颈处死取脑制备石蜡切片。按说明书步骤,Nissl法(尼氏染色液,碧云天)检测损伤神经元、TUNEL法(TUNEL细胞凋亡检测试剂盒,Rosche)检测细胞凋亡。400倍镜下两侧颞叶皮质各随机选取5个不重叠视野,计数损伤神经元数、凋亡细胞数和细胞总数,计算损伤神经元比例及凋亡指数,以5个视野的均数作为该标本的结果。
1.8 己糖激酶(Hexokinase,HXK)1蛋白检测按照试剂盒说明提取全蛋白(蛋白提取试剂盒,北京百泰克),BCA法测定蛋白浓度(蛋白浓度测定试剂盒,碧云天),30 μg蛋白上样进行聚丙烯酰胺凝胶电泳,湿转法转移蛋白到PVDF膜(0.4 μm),5%的脱脂奶粉封闭1 h,滴加一抗(1:1 000)4℃过夜,TBST洗膜10 min×3次,滴加二抗(1:5 000)室温下孵育1 h,TBST洗膜10 min×3次,发光液浸泡1 min,凝胶成像仪曝光成像(Image Quant LAS4000mini)。一抗︰HXK I(SC6517,Santa Cruz),GAPDH(AP50048,ABGENT); 二抗(LP1001A,ABGENT)。
1.9 统计学方法采用SPSS 13.0软件包进行统计分析,计量资料以均数±标准差(x ± s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;采用Kaplan-Meier法绘制生存曲线,生存情况比较采用Log-rank检验;数据相关性检验采用Pearson相关分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 复苏及生存情况CPR开始前所有大鼠表现为无脉性电活动或心电静止,无室颤发生。复苏及生存情况见图 1,3组大鼠生存时间比较差异有统计学意义(P < 0.05)。
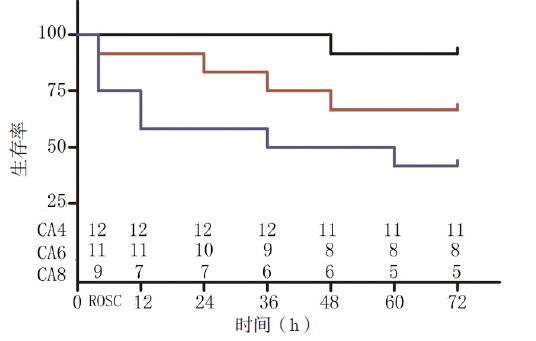
|
| 图 1 各组大鼠生存曲线 Figure 1 Survival curves of rats in each group |
|
|
在ROSC 24 h及72 h,CA6组SUVmax低于CA4组(P < 0.05,图 2和表 1),CA8组低于CA4组及CA6组(P < 0.05);在ROSC 72 h三组大鼠SUVmax较ROSC 24 h有不同程度恢复,CA6组仍低于CA4组(P < 0.05),CA8组低于CA4组及CA6组(P < 0.05)。
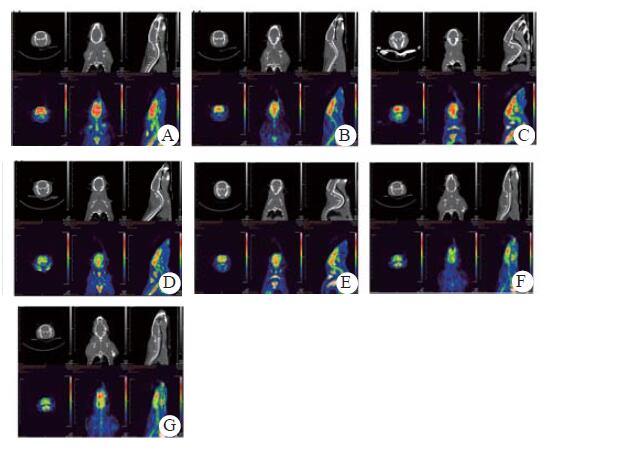
|
| A:sham组;B:CA4组ROSC 24 h;C:CA4组ROSC 72 h;D:CA6组ROSC 24 h;E:CA6组ROSC 72 h;F:CA8组ROSC 24 h;G:CA8组ROSC 72 h 图 2 各组大鼠PET扫描图像 Figure 2 PET scanning images of rats in each group |
|
|
| 组别 | SUVmax | NDS评分 | 神经元损伤(%) | 凋亡指数(%) |
| Sham(n=6) | 2.51±0.21 | 80 | 0.72±0.14 | 0.58±0.09 |
| CA4组 | ||||
| 24 h(n=12) | 1.93±0.18 | 67.08±5.40 | ||
| 72 h(n=11) | 2.01±0.15 | 71.63±4.69 | 11.36±4.71 | 9.36±3.88 |
| CA6组 | ||||
| 24 h(n=10) | 1.75±0.17a | 60.80±6.25a | ||
| 72 h(n=8) | 1.80±0.17a | 65.25±5.18a | 20.53±6.56a | 17.12±7.51a |
| CA8组 | ||||
| 24 h(n=7) | 1.38±0.18ab | 54.71±9.03a | ||
| 72 h(n=5) | 1.58±0.19ab | 61.08±6.13a | 32.27±8.45ab | 28.36±8.71ab |
| 注:与CA4组同一时间点比较,aP < 0.05;与CA6组同一时间点比较,bP < 0.05 | ||||
ROSC 24 h时CA6组和CA8组NDS评分均低于CA4组(P < 0.05,表 1);在ROSC 72 h各组动物NDS评分对比ROSC 24 h时有不同程度恢复,CA6组和CA8组仍均低于CA4组(P < 0.05)。
2.4 组织病理损伤及细胞凋亡ROSC后大脑神经元损伤的表现为:胞质深染,尼氏小体消失,胞核固缩。损伤神经元的比例与CA时间长短有关,CA8组高于CA6及CA4组(P < 0.05,图 3A~D和表 1),CA6组高于CA4组(P < 0.05);TUNEL检测的凋亡阳性细胞呈红色荧光, 凋亡指数与CA时间长短有关,CA8组高于CA6及CA4组(P < 0.05,图 3E~H和表 1),CA6组高于CA4组(P < 0.05)。
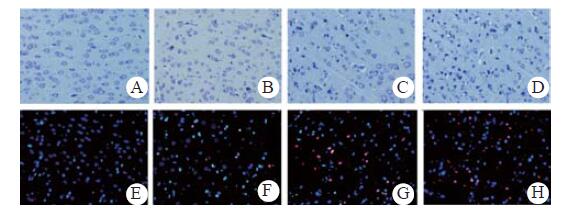
|
| A~D:sham、CA4、CA6和CA8组Nissl染色图片;E~F:sham、CA4、CA6和CA8组TUNEL免疫荧光图片 图 3 各组大鼠皮质Nissl染色及TUNEL免疫荧光图片(×400) Figure 3 The images of cortical Nissl staining and TUNEL immunofluorescence of rats in each group (×400) |
|
|
ROSC 24 h和72 h脑SUVmax与NDS均呈显著正相关(r=0.771和r=0.653,P < 0.05);ROSC 72 h脑SUVmax与损伤神经元比例和凋亡指数均呈显著负相关(r=-0.775和r=-0.787, P < 0.05),见图 4。
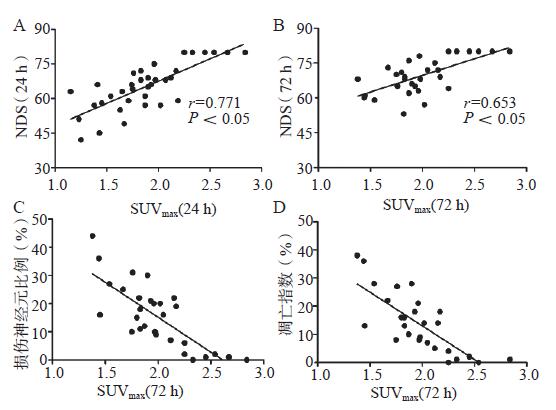
|
| A:SUVmax (ROSC 24 h)与NDS(ROSC 24 h)相关分析,n=35;B: SUVmax (ROSC 72 h)与NDS(ROSC 72 h)相关分析, n=30;C: SUVmax (ROSC 72 h)与损伤神经元相关分析, n=30;D: SUVmax (ROSC 72 h)与凋亡指数相关分析, n=30 图 4 相关性分析 Figure 4 Pearson correlation analysis |
|
|
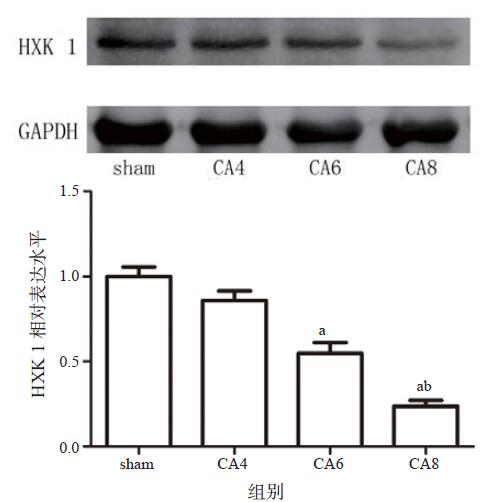
ROSC后HXK I蛋白表达减少,CA8组低于CA6及CA4组(P < 0.05),CA6组低于CA4组(P < 0.05), 见图 5。
|
| 与CA4组比较,aP < 0.05;与CA6组比较,bP < 0.05;n=5 图 5 各组HXK I蛋白的表达 Figure 5 The expression of HXK I of each group |
|
|
CA后多达50%的患者在ROSC后出现严重的意识障碍[9],准确评估这部分患者的脑损伤程度及神经功能预后有利于临床医生做出更好地治疗并更加合理地分配医疗资源[10]。现有的评估方法主要包括神经功能体格检查、脑电图、体表诱发电位、血清标志物和影像学检查,这些方法均有各自的局限性(如无法量化评估或假阳性率高等),新的可量化评估的检查手段仍在探索之中[11]。
代谢活动是细胞存活的可靠标志,凋亡细胞葡萄糖代谢明显下降,PET显像的优势在于可以从分子水平显示活体器官的代谢活动并量化检测[7, 12]。18F-FDG是PET显像中常用的显像剂,其作为葡萄糖的类似物,与葡萄糖竞争细胞膜上的葡萄糖转运蛋白进入细胞内,然后在HXK作用下生成6-磷酸-18F-FDG,由于6-磷酸-18F-FDG不能进入糖酵解过程而潴留于细胞内, 因此18F-FDG可反映组织摄取葡萄糖的能力以及代谢活性[13]。
在一项颅脑外伤的研究中,Hattori等[14]发现昏迷患者脑葡萄糖代谢水平明显低于非昏迷患者,进而推测患者意识状态与脑葡萄糖代谢水平与有关。在另一项研究中,Schaafsma等[15]对ROSC后昏迷的患者进行头颅CT及MRI检查未见明显异常表现,但行PET扫描发现患者脑葡萄糖代谢水平降至正常值的50%~70%。Li等[16]在一项CA动物实验研究中发现,ROSC后犬脑葡萄糖代谢水平明显下降并推测PET可被用于预测CA患者的预后。本研究发现,复苏后大鼠大脑皮质细胞凋亡坏死,神经功能受损,SUVmax下降,并且随着CA时间延长,CA8组细胞凋亡坏死最多、SUVmax下降也最为明显(CA6组居中),进而通过Pearson相关检验发现SUVmax与神经功能缺损评分、损伤神经元及凋亡细胞数目密切相关,这说明CA后脑葡萄糖代谢水平与损伤的严重程度相关。
HXK磷酸化葡萄糖为6-磷酸葡萄糖从而进行后续的代谢反应,是葡萄糖代谢的限速酶[17],其中HXK I主要表达于脑,遭受缺血-再灌注损伤后其表达会显著下降[16]。本研究发现,复苏后大鼠脑HXK I蛋白表达下降,并且随着CA时间延长,CA8组HXK I蛋白表达最少,这与SUVmax的变化趋势一致。这一现象也间接提示脑葡萄糖代谢水平与损伤的严重程度相关。
综上所述,CA后脑葡萄糖代谢水平下降,神经细胞发生凋亡坏死,HXK I蛋白表达减少,葡萄糖代谢水平与脑损伤的严重程度密切相关。但PET检查费用较昂贵、试剂具有放射性,其在评估CA患者脑损伤中的价值仍有待进一步探索。
| [1] | Berdowski J, Berg R, Tijssen J, et al. Global incidences of out-of-hospital cardiac arrest and survival rates: Systematic review of 67 prospective studies[J]. Resuscitation, 2010, 81(11): 1479-1487. DOI:10.1016/j.resuscitation.2010.08.006 |
| [2] | Nolan J, Laver S, Welch C, et al. Outcome following admission to UK intensive care units after cardiac arrest: a secondary analysis of the ICNARC Case Mix Programme Database[J]. Anaesthesia, 2007, 62(12): 1207-1216. DOI:10.1111/j.1365-2044.2007.05232.x |
| [3] | Shao F, Li C, Liang L, et al. Incidence and outcome of adult in-hospital cardiac arrest in Beijing, China[J]. Resuscitation, 2016, 102: 51-56. DOI:10.1016/j.resuscitation.2016.02.002 |
| [4] | Friberg H, Cronberg T, Dünser M, et al. Survey on current practices for neurological prognostication after cardiac arrest[J]. Resuscitation, 2015, 90: 158-162. DOI:10.1016/j.resuscitation.2015.01.018 |
| [5] | Eom K, Lim C, Gu S, et al. Positron emission tomography features of canine necrotizing meningoencephalitis[J]. Vet Radiol Ultrasound, 2008, 49(6): 595-599. DOI:10.1111/j.1740-8261.2008.00437.x |
| [6] | Kannan S, Chugani H. Applications of positron emission tomography in the newborn nursery[J]. Semin Perinatol, 2010, 34(1): 39-45. DOI:10.1053/j.semperi.2009.10.004 |
| [7] | 吴彩军, 李春盛, 杨军, 等. 窒息心脏骤停动物模型中碳酸氢钠对复苏的影响[J]. 中华急诊医学杂志, 2015, 24(4): 403-407. DOI:10.3760/cma.j.issn.1671-0282.2015.04.015 |
| [8] | 马宇洁, 杨兴易, 林兆奋, 等. 心搏骤停后脑复苏研究的动物模型[J]. 中华急诊医学杂志, 2007, 16(9): 957-960. DOI:10.3760/j.issn.1671-0282.2007.09.017 |
| [9] | Wachelder E, Moulaert V, Heugten C, et al. Life after survival: long-term daily functioning and quality of life after an out-of-hospital cardiac arrest[J]. Resuscitation, 2009, 80(5): 517-522. DOI:10.1016/j.resuscitation.2009.01.020 |
| [10] | Hahn D, Geocadin R, Greer D. Quality of evidence in studies evaluating neuroimaging for neurologic prognostication in adult patients resuscitated from cardiac arrest[J]. Resuscitation, 2014, 85(2): 165-172. DOI:10.1016/j.resuscitation.2013.10.031 |
| [11] | Rossetti A, Rabinstein A, Oddo M. Neurological prognostication of outcome in patients in coma after cardiac arrest[J]. Lancet Neurol, 2016, 15(6): 597-609. DOI:10.1016/S1474-4422(16)00015-6 |
| [12] | Muellerleil K, Barmeyer A, Groth M, et al. Assessment of myocardial viability in ischemic heart disease by cardiac magnetic resonance imaging[J]. Minerva Cardioangiol, 2008, 56(2): 237-249. |
| [13] | 王凌雁, 齐铁伟, 黄正松, 等. 大鼠脑慢性低灌注模型18F-FDG PET/CT显像及SUVmax值变化[J]. 中山大学学报(医学科学版), 2014, 35(4): 589-593. |
| [14] | Hattori N, Huang S, Wu H, et al. Correlation of regional metabolic rates of glucose with glasgow coma scale after traumatic brain injury[J]. J Nucl Med, 2003, 44(11): 1709-1716. |
| [15] | Schaafsma A, Jong B, Jl B, et al. Cerebral perfusion and metabolism in resuscitated patients with severe post-hypoxic encephalopathy[J]. J Neurol Sci, 2003, 210(1/2): 23-30. DOI:10.1016/S0022-510X(03)00063-7 |
| [16] | Li Y, Liao X, Lu J, et al. Assessing the early changes of cerebral glucose metabolism via dynamic 18FDG-PET/CT during cardiac arrest[J]. Metabolic Brain Disease, 2015, 30(4): 969-977. DOI:10.1007/s11011-015-9658-0 |
| [17] | Lee K, Park J, Won R, et al. Inhibition of hexokinase leads to neuroprotection against excitotoxicity in organotypic hippocampal slice culture[J]. J Neurosci Res, 2011, 89(1): 96-107. DOI:10.1002/jnr.22525 |
 2018, Vol. 27
2018, Vol. 27




