多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)是重症医学科最常见的临床综合征,其病理生理机制比较复杂,涉及炎症失控、细菌毒素、免疫抑制及缺血-再灌注等,其中炎症因子的释放在MODS的演变过程中发挥着重要作用[1-2]。临床治疗策略有限,大量研究表明,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)具有抗炎、免疫调节、抗凋亡及组织修复等功能[3-4],但其治疗MODS炎症调节机制尚不清楚。本实验通过内毒素脂多糖(lipopolysaccaride,LPS)建立大鼠MODS模型,探讨BMSC移植对MODS炎症因子调控作用,为MODS的治疗及生物标志物探索提供实验及理论依据。
1 材料与方法 1.1 实验材料磷酸盐缓冲液(PBS)购自美国Hyclone公司(SH3025601B)、脂多糖(LPS)购自美国Sigma-Aldrich公司;DMEM/F12培养基购自美国Invitrogen公司;10%特级胎牛血清购自美国Hyclone公司;流式细胞仪购自美国B.D Calibur公司;anti-CD34购自美国Abcam公司,anti-CD44、anti-CD45、anti-CD90均购自美国Ebioscience公司,水合氯醛购自中国Solarbio公司,细胞因子抗体芯片工具、白细胞介素(IL-4)及晚期糖基化终产物受体(RAGE)的酶联免疫吸附试验(ELISA)试剂盒均购自美国RayBiotech公司。
1.2 动物分组与MODS模型制备Sprague-Dawley(SD)大鼠60只(雌雄不限,体质量180~220 g),由成都军区昆明总医院医学动物实验中心提供,动物合格证号:SYXK(滇),2014-2015。饲养条件:室温20~25℃,湿度50%~70%,光照/黑暗各12 h循环,自由摄食饮水。按照随机数字表法将动物分成3组,每组20只,MODS组经大隐静脉注射LPS(1 mg/kg);Sham组经大隐静脉注射PBS(剂量与MODS组相同);BMSC组在LPS注射后2 h内经尾静脉输注BMSC(106/只,0.5 mL)。本实验动物处置方法符合昆明医科大学动物实验伦理审查委员会的相关要求。整个动物实验过程在解放军昆明总医院动物实验中心完成。
1.3 BMSC的提取、培养及鉴定4周龄左右SD大鼠,引颈处死,75%乙醇浸泡5 min,解剖分离出股骨、胫骨,浸在含双抗的DEME培养基中,用5 mL注射器抽取含10%特级胎牛血清的低糖DMEM培养液从股骨、胫骨两端反复冲洗骨髓腔,获得细胞悬液4 mL,离心5 min后接种于T175细胞培养瓶中补充DEME培养基,置于37 ℃、5%CO2的培养箱中进行原代培养,48 h后首次换液,去除未贴壁细胞,当原代细胞融合到80%~90%后用胰蛋白酶消化传代培养。经免疫化学分析,体外培养的BMSC细胞表面抗原如CD34-,CD45-,CD90+,CD44+,采用相应抗体免疫荧光染色,流式细胞仪鉴定BMSC。取第四代BMSC用于实验,在LPS注射后2 h内经尾静脉缓慢注射(106/只,0.5 mL)。
1.4 观察大鼠存活率、血气、生化指标及苏木精-伊红染色检测观察各组大鼠72 h的存活率,绘制生存曲线;术后72 h采用4%水合氯醛(400 mg/kg,腹腔注射)麻醉动物,取腹主动脉血进行血气分析和生化检测(肝功能,心肌酶学);然后留取肺脏,肝脏、心脏组织用4%多聚甲醛固定、常规石蜡包埋、切片(厚4 μm),苏木精-伊红(HE)染色后,光镜下观察组织病理学变化。
1.5 细胞因子蛋白芯片检测采用细胞因子芯片技术检测术后72 h各组血清中相关34种炎症因子的表达。根据美国Ray-Biotech公司AAR-CYT-G2蛋白芯片试剂盒的说明书,将34种目标因子排布于芯片上;采用膜成像系统检测相关信号,并将信号强度量化,不同膜的阳性对照作为标准。
1.6 ELISA细胞因子的量化采用ELISA技术验证有明显差异的细胞因子。按试剂盒说明进行操作,使用各种稀释浓度制作标准。根据标准曲线计算这些细胞因子的表达水平。所有样品和标准重复测量2次。
1.7 统计学方法采用SPSS 17.0统计学软件对数据进行分析和处理。多组定量资料采用单因素方差分析,组间两两比较采用LSD-t检验,生存曲线差异的比较采用Log-rank检验,数据用均数±标准差(x±s)表示,以P < 0.05为差异有统计学意义。采用Ray Bio AAR-CYT-G2软件分析细胞因子芯片的数据,其结果用信号比值来表示,根据厂家说明书及实验需要,信号比值> 2或者 < 0.5认为有明显差异。
2 结果 2.1 BMSC的培养及鉴定流式细胞仪鉴定显示,细胞91.85%属于一个细胞群体(图 1A),其表面抗原检测:CD90+(95.5%),CD44+(85.44%)(图 1 B~C),CD90+CD34-的细胞群占86.31%(图 1D),CD44+CD45-的细胞群占78.23%(图 1E),结果显示培养的细胞为BMSC。
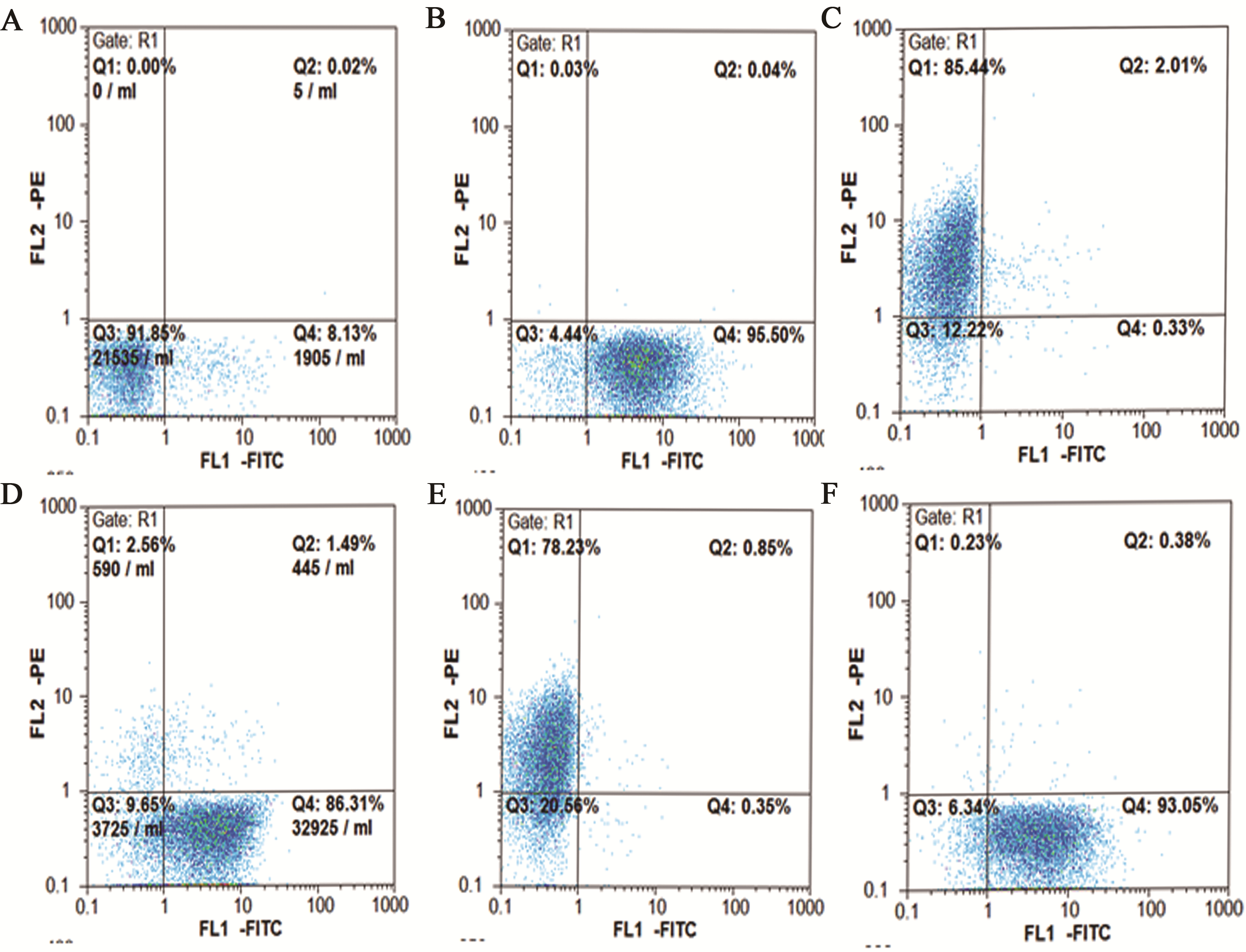
|
| A:空白对照组;B:单标抗体CD90+;C:单标抗体CD44+;D:双标抗体CD90+CD34-;E:双标抗体CD44+CD45-;F:绿色荧光蛋白(GFP)标记的BMSC;FITC为异硫氰酸荧光素,PE为藻红蛋白 图 1 BMSC的流式细胞仪鉴定 Figure 1 Identification of BMSC by flow cytometry |
|
|
Sham组,MODS组以及BMSC组中大鼠术后72 h的生存率分别为100%、60%、80%。三组生存率进行log-rank法检验显示(图 2):Sham组的生存率明显大于MODS组及BMSC组(Sham vs. MODS χ2=9.798,P=0.001 7;Sham vs. BMSC χ2=4.333,P=0.037 4),差异有统计学意义;BMSC组的生存率大于MODS组(BMSC vs. MODS χ2=2.408,P=0.120 7),但差异无统计学意义。
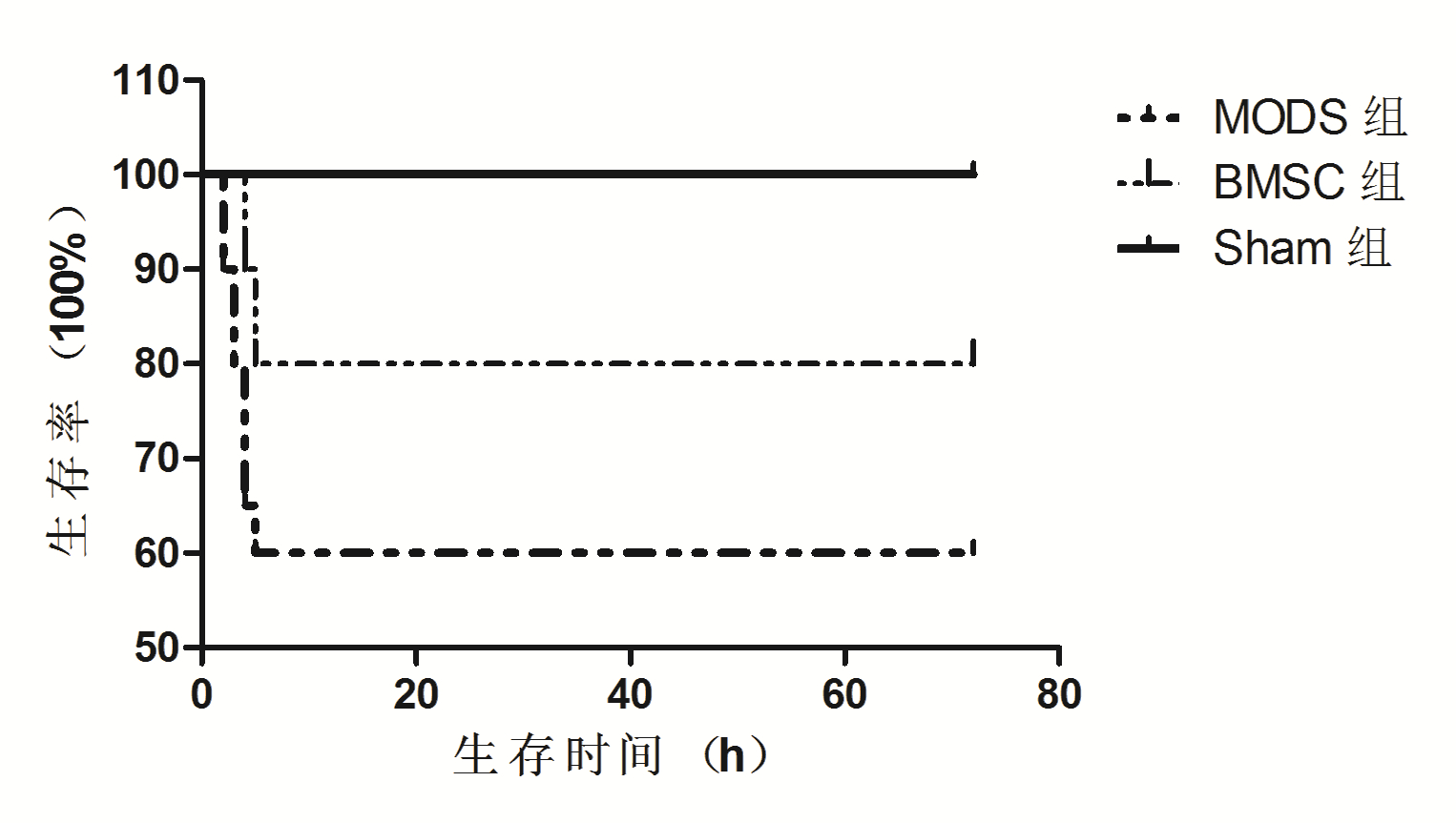
|
| 图 2 三组大鼠的生存率比较(log-rank法检测) Figure 2 Survival analysis of rats in the three groups (log-rank test) |
|
|
HE染色结果显示,与Sham组比较,MODS组的各受损器官肺脏、肝脏、心脏组织细胞充血水肿,细胞间隔增宽,炎症细胞浸润;BMSC组受损器官组织仍有不同程度的充血水肿,炎症细胞浸润,但较MODS组组织水肿及炎症细胞浸润有所减轻,见图 3。

|
| 图 3 病理组织HE染色(×400) Figure 3 Hematoxylin and eosin staining of tissue (original magnification ×400) |
|
|
动脉血气分析结果显示,与Sham组比较,MODS组中pH值显著降低(F=14.101,P < 0.01),动脉二氧化碳分压PaCO2(F=1.821,P=0.009)、血乳酸Lac(F=85.333,P < 0.01)显著升高,而动脉氧分压PO2虽有变化,但差异无统计学意义(P=0.065);与MODS组比较,BMSC组pH显著升高(F=14.101,P=0.001),PaCO2、Lac显著降低(F=1.821,P=0.032;F=85.333,P < 0.01),而PaO2的差异无统计学意义(P=0.124)。BMSC组与Sham组比较,pH,PO2,PaCO2,Lac差异均无统计学意义(P=0.098、P=0.657、P=0.589、P=0.053),见表 1。
| 组别 | pH | PaO2(mmHg) | PaCO2(mmHg) | Lac(mmol/L) |
| Sham组 | 7.337±0.062 | 91.752±11.352 | 46.665±3.783 | 1.351±0.241 |
| MODS组 | 7.219±0.064a | 64.671±28.911 | 65.667±17.612a | 6.172±0.632a |
| BMSC组 | 7.299±0.054b | 86.333±6.431 | 50.333±13.312b | 2.432±0.353b |
| 注:与Sham组比较,aP<0.05;与MODS组比较,bP<0.05;PaO2,动脉血氧分压;PaCO2,动脉血二氧化碳分压;Lac,乳酸 | ||||
生化指标结果显示,与Sham组比较,MODS组中总胆红素TB、肌酸激酶CK明显升高(F=19.000,P=0.003;F=12.582,P=0.002);白蛋白ALB水平明显降低(F=8.697,P=0.006);BMSC组TB及CK的水平显著降低(F=19.000,P=0.002;F=12.582,P=0.007),白蛋白水平明显升高(F=8.697,P=0.039)。BMSC组与Sham组比较,TB,ALB,CK差异均无统计学意义(P=0.679、P=0.187、P=0.075);三组组间比较肌钙蛋白Ⅰ的水平差异无统计学意义(F=1.851,P=0.199),见表 2。
| 组别 | TB(U/L) | ALB(U/L) | cTnI(ng/mL) | CK(U/L) |
| Sham组 | 0.801±0.501 | 35.471±4.015 | 0.026±0.134 | 315.670±41.402 |
| MODS组 | 2.533±0.382a | 23.202±4.872a | 0.114±0.129 | 708.250±219.201a |
| BMSC组 | 0.934±0.211b | 31.031±0.401b | 0.106±0.047 | 471.502±153.363b |
| 注:与Sham组比较,aP<0.05;与MODS组比较,bP<0.05;TB,总胆红素;ALB,白蛋白;cTnI,肌钙蛋白Ⅰ;CK,肌酸激酶 | ||||
34种目标因子在蛋白芯片上清晰可见,蛋白芯片(图 4)及分析结果(表 3)显示,与Sham组比较,MODS组IFN-γ和MCP-1的表达水平升高(信号比值分别为5.763,3.474)。BMSC移植治疗后,IFN-γ和MCP-1的表达水平明显降低(信号比值分别0.104,0.185);各因子排布情况见图 5。
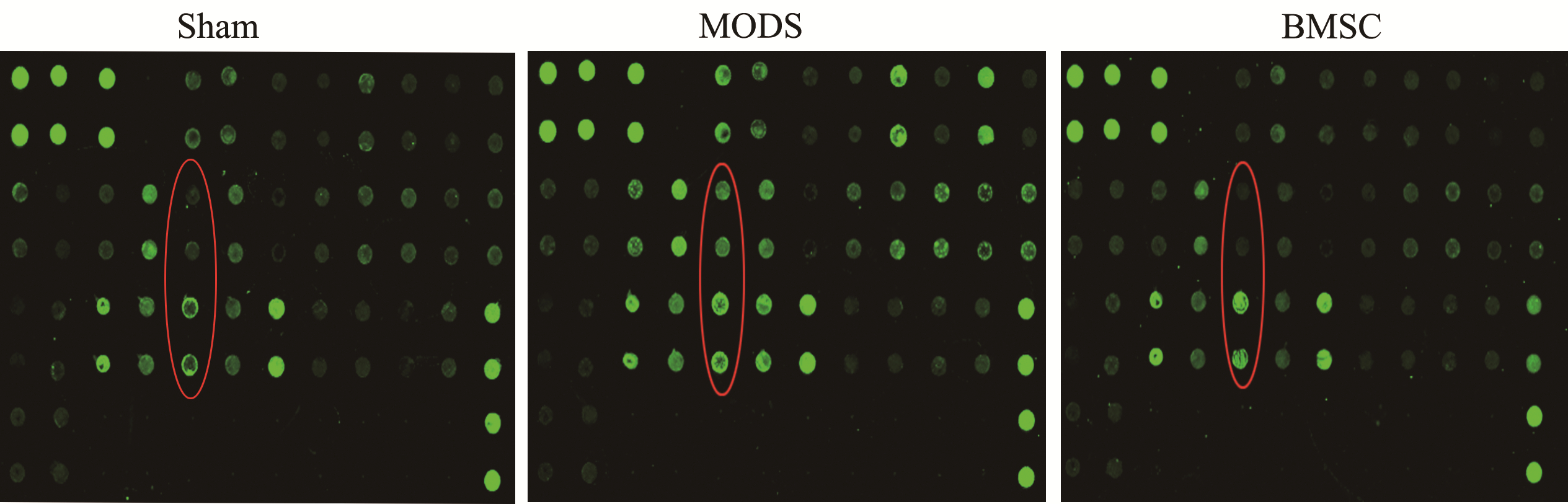
|
| 红框表示有差异的细胞因子(自上而下分别是IFN-γ与MCP-1,每个因子重复两次)荧光强度越强表示蛋白质越多 图 4 细胞因子芯片中各因子的表达情况 Figure 4 Expressions of cytokines in the chips |
|
|
| 目标因子 | Sham组 | MODS组 | BMSC组 | MODS组/Sham组 | BMSC组/MODS组 | BMSC组/Sham组 |
| IFN-γ | 3 271 | 18 851 | 1 955 | 5.763 | 0.104 | 0.598 |
| MCP-1 | 8 749 | 30 395 | 5 628 | 3.474 | 0.185 | 0.643 |
| 注:细胞因子信号值>400,信号比值>2或<0.5,表示该因子为差异性表达因子。IFN-γ,干扰素-γ;MCP-1,单核细胞趋化因子-1 | ||||||
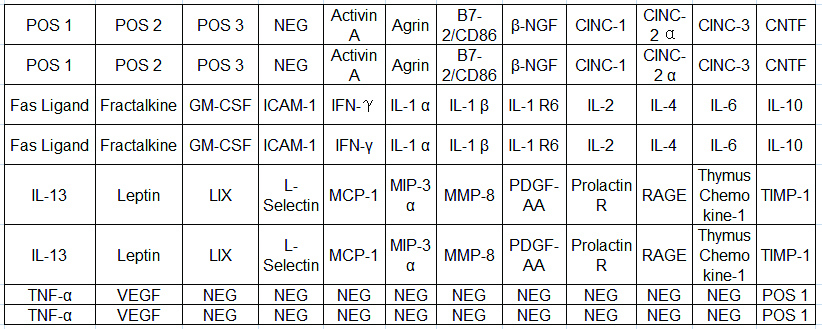
|
| POS,阳性对照;NEG,阴性对照;CINC,中性粒细胞趋化因子;Fractalkine,一种趋化因子;CNTF,睫状神经营养因子;GM-CSF,粒细胞-巨噬细胞集落刺激因子;ICAM-1,细胞间黏附分子-1;IFN-γ,干扰素-γ;IL,白介素;LIX,一种趋化因子;MCP,单核细胞趋化因子;MIP,巨噬细胞炎性蛋白质;MMP-8,基质金属蛋白酶-8;PDGF-AA,血小板源生长因子-AA;PRLR,催乳素受体;RAGE,晚期糖化终产物受体;ThymusChemokine1,胸腺趋化因子;TIMP-1,金属蛋白组织抑制剂1;TNF-α,肿瘤坏死因子-α。每个抗体每组重复2次,阳性与阴性对照用于确定数组之间的信号变化 图 5 AAR-CYT-G2检测的34种细胞因子在芯片上的排布 Figure 5 Maps of 34 cytokines detected by AAR-CYT-G2 |
|
|
酶联免疫吸附实验(ELISA)对蛋白芯片显示的差异蛋白进行量化验证,其检测结果与芯蛋白芯片结果一致(表 4):与Sham组比较,MODS组IFN-γ和MCP-1的表达水平显著上调(F=61.511,P < 0.01;F=193.295,P < 0.01);与MODS组比较,BMSC组IFN-γ和MCP-1的表达水平显著下调(F=61.511,P=0.001;F=193.295,P < 0.01);BMSC组与Sham组比较,差异无统计学意义(P=0.051,P=0.834)。
| 组别 | IFN-γ(pg/mL) | MCP-1(pg/mL) |
| Sham组 | 7 540.523±1 052.901 | 104.601±6.523 |
| MODS组 | 21 383.053±1 823.453a | 1 384.217±160.075a |
| BMSC组 | 13 563.526±1 617.063b | 87.997±8.985b |
| 注:与Sham组比较,aP<0.01;与MODS组比较,bP<0.01;IFN-γ,干扰素-γ;MCP-1,单核细胞趋化因子-1 | ||
本实验运用LPS成功制作了MODS大鼠模型,血清中细胞因子IFN-γ与MCP-1表达明显上调,受损器官(肺、肝、心)出现组织形态学的改变及器官功能的下降,动物存活率的明显降低,而给予BMSC移植干预后,血清中细胞因子IFN-γ与MCP-1表达明显下调,受损组织修复及器官功能改善,动物存活率提高。实验结果表明BMSC能够促进MODS大鼠器官修复及功能改善,可能与抑制MODS的炎症细胞因子释放有关,特别是IFN-γ与MCP-1密切相关。
BMSC作为组织工程及再生医学中常用的干细胞,具有广泛的生物学作用, 可抑制炎症,改善凝血功能,调节先天性和获得性免疫反应,促进缺血组织和血管再生,促进受损器官的修复等[4-8],但具体机制不清。本实验探讨了BMSC调控LPS所致MODS炎症反应的潜在机制,其结果表明BMSC可抑制炎症细胞因子IFN-γ与MCP-1的表达与释放,进而调节机体的促炎与抗炎反应的平衡,促进受损器官组织的修复。
在脓毒血症中,炎症因子的过度分泌诱发瀑布级联反应,导致MODS的发生发展。IFN-γ是重要的炎症细胞因子,可调控机体的免疫炎症反应;同时作为主要的巨噬细胞活化因子,又可提高巨噬细胞对LPS反应的敏感性,并促进其他炎症细胞因子(如TNF-α、IL-1、IL-6)的过度表达,从而加重炎症风暴的发生,导致组织的损伤[9]。IFN-γ与其他炎症因子相互作用,一方面可增强机体杀灭微生物的能力,然而其IFN-γ的过度分泌又会引起机体的促炎与抗炎反应的失衡,导致疾病的进一步发展,最终导致MODS的发生发展。本研究中BMSC的治疗可明显抑制IFN-γ的过度表达,从而减轻炎症级联反应,促进组织修复。已有研究证明BMSC可以减弱巨噬细胞分泌大量炎症因子[10],减弱1型成熟树突状细胞对TNF-α释放[11],减轻炎症反应。亦有研究表明,当脓毒症患儿病情逐渐好转时,IFN-γ、TNF-α、IL-8逐渐降低,提示IFN-γ的降低可作为反映治疗细菌感染有效的指标[12]。
在MODS的发展过程中,除促炎因子参与外,趋化因子在调控中性粒细胞活化和游走过程中亦起到关键作用。MCP-1是最重要的单核细胞趋化因子,参与了脓毒症组织损伤过程,其可调节单核/巨噬细胞的迁移和浸润,加重血管内皮及其周围组织的损害。Bozza等[13]研究发现细胞因子浓度与器官功能紊乱的程度及进展相关,在脓毒性休克患者中MCP-1的浓度比在严重脓毒症患者中明显升高,且与疾病预后差正相关,其高表达水平可作为预测脓毒症患者病死率的指标之一。有研究表明,MCP-1不仅趋化单核细胞到达损伤及感染部位,而且可促进抗炎因子IL-10的合成,MCP-1可能是脓毒症由促炎阶段向免疫抑制阶段演变的一个关键要素[14]。MCP-1有望作为判断炎症反应阶段的一个新的生物标记物[15]。
促炎和抗炎因子的相互平衡对机体内环境保持稳定具有重要意义。脓毒症时促炎因子和抗炎因子同时升高提示预后不佳,导致失控性炎症介质释放,可能与免疫反应的极度紊乱有关[13]。因此,减少失控性炎症介质释放,调节促炎和抗炎因子的平衡是治疗脓毒症所致MODS的重点。本研究运用LPS建立大鼠MODS模型,诱发了严重的炎症反应,发现肺脏、肝脏以及心脏组织充血水肿明显,大量炎症介质浸润,内皮细胞损伤与破坏,血气分析及生化检测也发现受损器官功能出现障碍,动物的存活率大大降低。这可能与脓毒症导致的炎症介质、补体和凝血系统的大量激活,内皮和上皮细胞屏障的破坏,炎症及免疫系统的紊乱密切相关[16],最终导致机体器官衰竭。
综上所述,本实验探讨了BMSC对LPS诱导的MODS大鼠中炎症因子表达的调控作用,结果显示BMSC可抑制IFN-γ和MCP-1的表达来调控MODS大鼠的炎症反应,从而促进损伤组织的修复,改善器官功能,提高大鼠的存活率。本研究结果有助于为临床上脓毒症及MODS的治疗提供新的方法及实验理论依据。
| [1] | Shukla P, Rao GM, Pandey G, et al. Therapeutic interventions in sepsis: current and anticipated pharmacological agents[J]. Br J Pharmacol, 2014, 171(22): 5011-5031. DOI:10.1111/bph.12829 |
| [2] | Rosenthal MD, Moore FA. Persistent inflammation, immunosuppression, and catabolism: evolution of multiple organ dysfunction[J]. Surg Infect (Larchmt), 2016, 17(2): 167-172. DOI:10.1089/sur.2015.184 |
| [3] | Zhou J, Jiang LY, Long X, et al. Bone-marrow-derived mesenchymal stem cells inhibit gastric aspiration lung injury and inflammation in rats[J]. J Cell Mol Med, 2016, 20(9): 1706-1717. DOI:10.1111/jcmm.12866 |
| [4] | Xie XL, Liu HH, Wu JH, et al. Rat BMSC infusion was unable to ameliorate inflammatory injuries in tissues of mice with LPS-induced endotoxemia[J]. Biomed Mater Eng, 2017, 28(s1): S129-138. DOI:10.3233/BME-171634 |
| [5] | Xu SY, Zhou Z, Li H, et al. BMSCs ameliorate septic coagulopathy by suppressing inflammation in cecal ligation and puncture-induced sepsis[J]. J Cell Sci, 2018, 131(3): pii: jcs211151. DOI:10.1242/jcs.211151 |
| [6] | Monsel A, Zhu YG, Gennai S, et al. Cell-based therapy for acute organ injury: preclinical evidence and ongoing clinical trials using mesenchymal stem cells[J]. Anesthesiology, 2014, 121(5): 1099-1121. DOI:10.1097/ALN.0000000000000446 |
| [7] | Miao CM, Jiang XW, He K, et al. Bone marrow stromal cells attenuate LPS-induced mouse acute liver injury via the prostaglandin E 2-dependent repression of the NLRP3 inflammasome in Kupffer cells[J]. Immunol Lett, 2016, 179: 102-113. DOI:10.1016/j.imlet.2016.09.009 |
| [8] | Eirin A, Lerman LO. Mesenchymal stem cell treatment for chronic renal failure[J]. Stem Cell Res Ther, 2014, 5(4): 83. DOI:10.1186/scrt472 |
| [9] | 田园, 丁壮, 岳玉环. 干扰素γ生物学功能及其应用的研究进展[J]. 中国生物制品学杂志, 2010, 23(10): 1147-1150. DOI:10.13200/j.cjb.2010.10.118.tiany.016 |
| [10] | 李香琴, 朱俊宇, 马娓, 等. 咪唑克生对内毒素攻击小鼠体内及体外活化巨噬细胞炎症介质释放的抗炎效应[J]. 中华危重病急救医学, 2016, 28(5): 445-449. DOI:10.3760/cma.j.issn.2095-4352.2016.05.013 |
| [11] | Krasnodembskaya A, Samarani G, Song YL, et al. Human mesenchymal stem cells reduce mortality and bacteremia in gram-negative sepsis in mice in part by enhancing the phagocytic activity of blood monocytes[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 302(10): L1003-1013. DOI:10.1152/ajplung.00180.2011 |
| [12] | 林丹梅. 脓毒症患儿血清TNF-α、IL-8、IFN-γ的动态变化[J]. 中国医药科学, 2014, 4(24): 180-182. |
| [13] | Bozza FA, Salluh JI, Japiassu AM, et al. Cytokine profiles as markers of disease severity in sepsis: a multiplex analysis[J]. Crit Care, 2007, 11(2): R49. DOI:10.1186/cC5783 |
| [14] | Faix JD. Biomarkers of sepsis[J]. Crit Rev Clin Lab Sci, 2013, 50(1): 23-36. DOI:10.3109/10408363.2013.764490 |
| [15] | Wang YC, Liu QX, Liu T, et al. Early plasma monocyte chemoattractant protein 1 predicts the development of sepsis in trauma patients: A prospective observational study[J]. Medicine (Baltimore), 2018, 97(14): e0356. DOI:10.1097/MD.0000000000010356 |
| [16] | Papadopoulou A, Krance RA, Allen CE, et al. Systemic inflammatory response syndrome after administration of unmodified T lymphocytes[J]. Mol Ther, 2014, 22(6): 1134-1138. DOI:10.1038/mt.2014.48 |
 2018, Vol. 27
2018, Vol. 27




