冠状动脉微栓塞(coronary microembolization,CME)是指由冠状动脉粥样斑块自发破裂或冠心病介入治疗(percutaneous coronary intervention,PCI)过程中微小栓子堵塞冠状动脉远端小血管,引起微小血管堵塞[1]。CME后心肌供血受影响,引起恶性心律失常,心功能下降,导致心血管不良事件的发生[2]。笔者前期研究发现,CME引起的局部心肌炎症反应是导致进行性心功能障碍的重要原因,而PDCD4/NF-κB/TNF-α信号通路在CME引起的心肌炎症反应中起着关键的作用,若能抑制该通路则可以有效地改善CME后的心肌损伤[3-4]。
尼可地尔是具有扩张血管和开放钾通道双重活性的烟酰胺硝酸盐,能够激活细胞内鸟苷酸环化酶,使血管扩张,也能直接或者间接激活机体一氧化氮-蛋白激酶G通路,使细胞内流出的钾离子明显增加,引起细胞膜超极化,抑制钙离子向细胞内迁移,舒张冠状动脉,导致冠脉血流增加[5-6]。近年来越来越多的研究发现,急性冠脉综合征的患者PCI术前给予尼可地尔治疗,可以减少围手术期的心肌损伤,心功能得到明显改善,推测该效应可能与尼可地尔的抗炎作用有关[7-8]。由于CME是PCI围手术期的心肌损伤的重要原因之一,因此,笔者考虑尼可地尔很有可能通过抑制CME所致的心肌炎症反应,起到心肌保护的作用。因此,本研究通过观察尼可地尔预处理治疗对猪CME后心功能的影响,以及对PDCD4/NF-κB/TNF-α信号通路的作用,以探讨尼可地尔防治CME致心肌损伤的作用机制。
1 材料与方法 1.1 材料42 μm微栓塞球(Biosphere Medical Inc.,美国); 尼可地尔(北京四环科宝制药有限公司,中国); TRNzol-A+总RNA提取试剂(南京凯基生物科技发展有限公司,中国); TNF-α mRNA、PDCD4 mRNA、β-actin mRNA引物(广州赛哲生物科技股份有限公司,中国),羊抗猪PDCD4多克隆抗体(LifeSpan BioSciences,美国); 兔抗猪TNF-α多克隆抗体(Abcam,美国); 兔抗GAPDH多克隆IgG抗体(Proteintech Group,美国); EMSA试剂盒(Pierce,美国)。
实验动物:健康巴马系小型猪15头,雌雄不拘,体质量25~30 kg,由广西大学动物科学技术学院提供。本实验遵照广西医科大学伦理委员会动物试验管理规范执行并获批准。
1.2 CME模型的建立与实验分组参照前期实验方法[9],先肌内注射盐酸氯胺酮注射液(5~10 mg/kg)为基础麻醉,待3~5 min后实验猪出现站立不稳,倒地后冲洗干净,常规消毒、铺巾,5½号头皮针穿刺猪耳缘静脉成功后留置并静注地西泮作为维持麻醉,用量为0.5 mg/(kg·h)。分离穿刺一侧股动脉,植入6 F动脉鞘,经鞘注入肝素200 U/kg达肝素化,后以100 U/(kg·h)维持。行冠状动脉造影,并经指引导管送入微导管至左前降支分出第一对角支后的远端,经微导管注入微栓塞球建立猪冠状动脉微栓塞模型,注入微栓塞球10万个(将微球悬浮在1.5 mL生理盐水中)。同样操作,以注射生理盐水1.5 mL为Sham组。巴马系小型猪15头,随机(随机数字法)分为Sham组、CME组、CME+尼可地尔组,每组5头。CME+尼可地尔组术前30 min通过耳缘静脉注射尼可地尔(150 μg/kg)。
1.3 小猪心功能的检测在笔者前期研究中发现CME后9 h心功能最低,因此本研究选取CME后9 h为观察点,检测左心室射血分数(LVEF)、左心室舒张期末径(LVEDd)、左心室短轴缩短率(FS)和心排血量(CO)。探头频率为12 MHz。所有测量值均取3个心动周期的平均值[10]。所有超声心动图检查均由一位经验丰富的专科医生完成。
1.4 组织取材及样品处理检测心功能后,在麻醉状态下,经耳缘静脉注入10 %氯化钾处死实验动物,开胸,取出心脏,平行于房室沟将心室切成6层(层厚5~8 mm),取左心室前壁心肌固定于4 %中性甲醛,制备病理切片后行苏木精-伊红(HE)染色和苏木精碱性复红苦味酸(HBFP)染色检测心肌微梗死面积。
1.5 心肌微梗死面积测量HBFP染色是诊断早期心肌缺血的一种重要染色方法,缺血心肌、红细胞呈红染,正常心肌胞浆黄染、胞核蓝染。DMR+Q550病理图像分析仪检查,每张HBFP染色切片随机选取5个视野(×100),使用Leica Qwin分析软件平面法测量梗死区域,并表示为总分析切片的面积百分比,取平均值[11]。
1.6 血清cTnI水平检测CME后9 h采取动脉血10 mL,全血静置30 min后,1800 r/min离心15 min,分离血清至-80 ℃冰箱保存。按照说明书ELISA法检测猪血清cTnI水平。
1.7 荧光定量PCR检测PDCD4与TNF-α mRNA表达量按照Trizol(Invitrogen,美国)操作说明提取左心室心肌的总RNA。RNA浓度采用NanoDrop (Thermo Fisher Scientific,美国)定量,采用cDNA逆转录试剂盒(TAKARA,日本)逆转录。采用SYBR GreenΙ荧光标记法检测PCR产物,PDCD4引物:正向:5'-GCTACGGTGCTCCTGAGTAT-3',反向:5'-GGCAATGTTCAGCTTCCGAT-3';TNF-α引物:正向:5'-GGCCCAAGGACTCAGATCAT-3',反向:5'-GCATACCCACTCTGCCATTG-3';β-actin引物:正向:5'-CACCTTCTACAACGAGCTGC-3',反向:5'-TCATCTTCTCACGGTTGGCT-3',按试剂盒说明设置反应体系及参数,每个样本均做复孔检测,同时每次反应均设置阴性孔。PCR产物经过测序检测。结果采用2-ΔΔCT法比较。
1.8 Western blot检测心肌组织中PDCD4与TNF-α蛋白表达用组织裂解液提取心肌组织蛋白,采用Lowry法测定蛋白浓度,取50 μg蛋白样品,10 %SDS-PAGE电泳,100 mA×2 h湿转将蛋白条带转至PVDF膜上。封闭液室温封闭1 h,TBST洗脱后,加入羊抗猪PDCD4多克隆抗体或兔抗猪TNF-α多克隆抗体室温孵育2 h,以兔抗GAPDH多克隆IgG抗体作内参照,洗膜后各以相应的二抗孵育1 h。抗原-抗体复合物用增强化学发光法显示,暗室X光胶片曝光,数码相机拍照,采用Bio-Rad公司的Gel Doc2000凝胶图像中专用软件分析目标条带的积分吸光度值(intergrated absorbance,IA=平均吸光度×面积),经GAPDH校正后,分别以PDCD4、TNF-α IA值/GAPDH IA值反映PDCD4、TNF-α相对蛋白表达量。
1.9 EMSA评价NF-κB活性根据核蛋白抽提试剂盒说明提取心肌细胞核蛋白; 制备生物素标记探针,以5'端生物素标记的含有NF-κB结合位点的寡核苷酸DNA5'-AGTTGAGGGGACTTTCCCAGGC-3',3'-TCAACTCCCCTGAAAGGGTCCG-5'作为探针(上海生工生物技术有限公司,中国)。核蛋白与探针室温下孵育20 min后在6.5 %聚丙烯酰胺凝胶电泳。凝胶图像分析系统分析吸光度值(A值),反映NF-κB的活化程度。
1.10 统计学方法数据分析采用SPSS 23.0统计软件(IBM Corporation, Chicago,美国),计量资料以均数±标准差(x±s)表示,两组间比较采用成组t检验,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 小猪心功能指标的变化情况(1) 与Sham组比较,CME组心功能明显下降,表现为心肌收缩功能障碍和左室扩张即LVEF、FS、CO下降(t值分别为9.53、3.90、2.23,P值分别为 < 0.01、0.004 5、0.046)和LVEDd增加(t=5.13,P=0.000 9);(2)与CME组比较,CME+尼可地尔组可以减少CME引起的心功能损伤,表现为LVEF、FS、CO升高(t值分别为8.004、3.435、2.344,P值分别为 < 0.01、0.008 9、0.047 1)和LVEDd减少(t=4.465 3,P=0.002 1)。见表 1。
| 组别 | LVEF (%) | LVFS (%) | CO (L/min) | LVEDd (mm) |
| Sham组 | 70.12±2.87 | 43.16±5.94 | 4.03±0.77 | 3.41±0.37 |
| CME组 | 50.75±3.52a | 25.69±8.04a | 2.84±0.91a | 4.99±0.58a |
| CME+尼可地尔组 | 67.03±2.88b | 40.84±5.71b | 4.05±0.71b | 3.56±0.42b |
| 注:LVEF,左室射血分数; CO,心排血量; LVEDd,左室舒张期末径; LVFS,左室短轴缩短率; 与Sham组相比,aP < 0.05;与CME组相比,bP < 0.05 | ||||
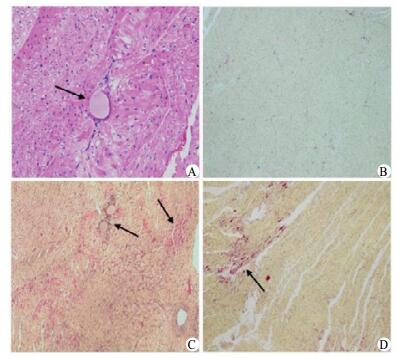
Sham组未见明显的梗死灶。CME组、CME+尼可地尔组可以见多发微梗死灶,多为楔形,呈局灶性分布。HE染色示微梗死灶内心肌细胞核溶解或消失,胞浆红染,可见红细胞渗出,微动脉内见到微栓塞球。CME组、CME+尼可地尔组梗死面积分别为(8.97±3.26)%、(8.04±3.38)%,两组间差异无统计学意义(t=0.442 8, P=0.669 6)。见图 1。
|
| A:为CME组局部心肌微梗死灶HE染色,箭头示微球,×400;B~D:分别为Sham组,CME组,CME+尼可地尔组HBFP染色,缺血心肌红染,箭头示微梗死灶,HBFP染色,×200 图 1 HE和HBFP染色 Figure 1 HE and HBFP staining |
|
|
(1) 与Sham组比较,CME组术后9 h血清cTnI明显升高[(0.186±0.016)ng/mL vs. (0.035±0.006) ng/mL,t=19.759 3, P < 0.001)]; (2)与CME组比较,CME+尼可地尔组血清cTnI的浓度明显降低[(0.057±0.013)ng/mL vs. (0.186±0.016)ng/mL, t=13.992 0, P < 0.01]。
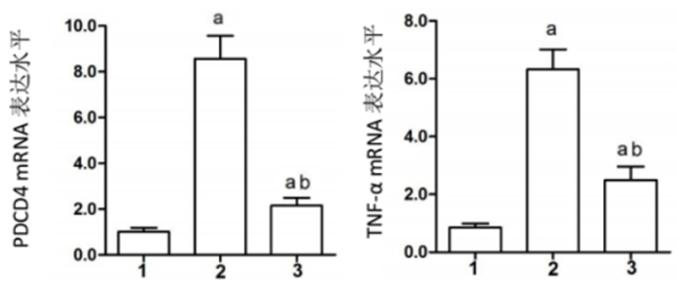
2.4 各组PDCD4与TNF-α mRNA表达量的比较(1) 与Sham组比较,CME组PDCD4和TNF-α mRNA的表达量明显增加(P < 0.05);(2)与CME组比较,CME+尼可地尔组PDCD4和TNF-α mRNA的表达量较低(P < 0.05),见图 2。
|
| 1:Sham组,2:CME组,3:CME+尼可地尔组; 与Sham组相比较,aP < 0.05;与CME组相比较,bP < 0.05 图 2 荧光定量PCR检测PDCD4和TNF-α mRNA表达量 Figure 2 PDCD4 and TNF-α mRNA transcription in myocardial tissues as detected by fluorescence quantitative PCR |
|
|
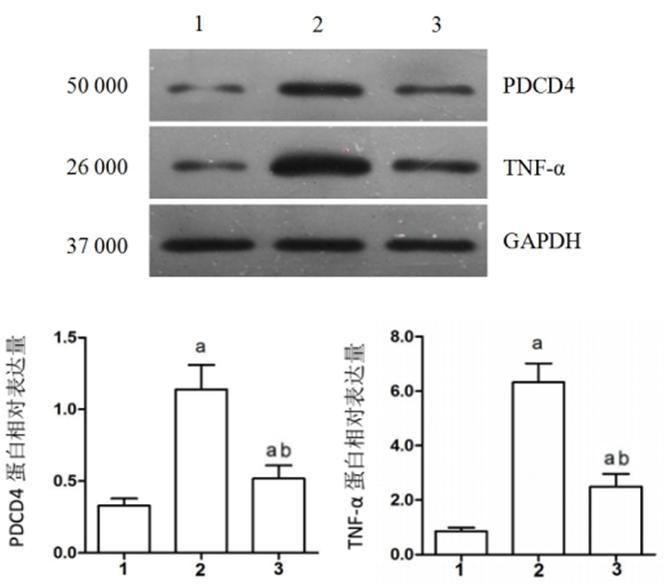
(1) 与Sham组比较,CME组PDCD4和TNF-α相对蛋白表达量明显升高(P < 0.05);(2)与CME组比较,CME+尼可地尔组显著降低PDCD4与TNF-α的相对蛋白表达量(P < 0.05)。见图 3。
|
| 1:sham组,2:CME组,3:CME+尼可地尔组; 与Sham组相比较,aP < 0.05;与CME组相比较,bP < 0.05 图 3 Western blot检测PDCD4和TNF-α蛋白相对表达量 Figure 3 PDCD4 and TNF-α protein expression in the myocardium |
|
|
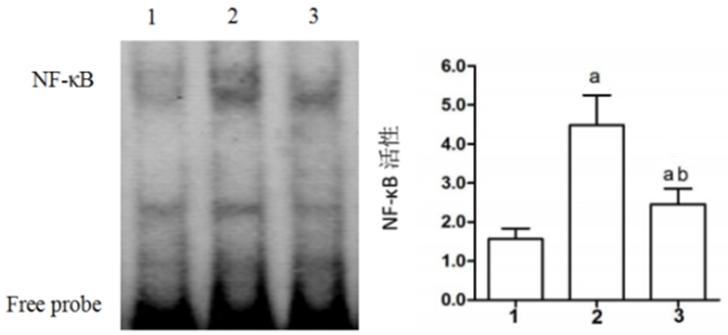
(1) 与Sham组比较,CME组NF-κB活性明显增加(P < 0.05);(2)与CME组比较,CME+尼可地尔组NF-κB活性较低(P < 0.05),见图 4。
|
| 1:sham组,2:CME组,3:CME+尼可地尔组; 与Sham组相比较,aP < 0.05;与CME组相比较,bP < 0.05 图 4 EMSA检测NF-κB活性 Figure 4 EMSA detecting NF-κB activity |
|
|
CME常发生于急性冠脉综合征不稳定斑块破裂和PCI治疗过程中,不同于心外膜近端血管阻塞,CME引起左室功能的降低与灌注缺损的心肌范围并非密切相关[12],局部心肌血流灌注量的缺乏或者微小的梗死灶无法完全解释该现象。Thielmann等[13]研究发现,CME后急性期局部心肌出现微梗死灶,微梗死灶周围发现大量炎性细胞浸润,同时伴随着心功能的进行性下降。在前期研究中发现,CME后9 h,程序性细胞死亡因子4(programmed cell death 4,PDCD4)表达明显升高,在心肌局部炎症反应中发挥重要的作用。其活化后会诱使NF-κB的广泛激活及由此导致的TNF-α等炎性介质的大量释放,在CME所致进行性心功能不全的发生发展中起重要作用,而TNF-α水平表达升高是CME所致心肌损伤的中心环节[14-16]。
尼可地尔是首个在临床上应用的ATP敏感的钾离子通道开放剂,具有类硝酸酯和作用及钾通道开放作用的双重机制。它适用于包括劳力型心绞痛和痉挛性心绞痛在内的各类型心绞痛,能显著降低心血管不良事件的发生率[17-18]。近年来研究证实,尼可地尔可以用于防治PCI围手术期的心肌损伤,减少无复流和慢血流的发生率,起到心肌保护的作用,推测其效应可能与减轻心肌局部炎症反应相关[19-20]。陈美姬等[21]在体外高糖引起的心肌细胞损伤模型中发现,给予尼可地尔预处理可以对抗高糖诱导的心肌细胞毒性,升高心肌细胞存活率,其机制与抑制NF-κB/COX-2通路对抗高糖引起的心肌细胞损伤和炎症有关。
在本研究发现在CME前给予尼可地尔预处理是可以明显改善小猪心功能,降低血清cTnI水平,减少CME后的心肌损伤,但微梗死面积未见明显减少; 与Sham组相比,虽然尼可地尔组的心功能差异无统计学意义,但肌钙蛋白依旧偏高,提示尼可地尔可以改善CME所致心功能下降,但不能完全逆转其导致的心肌损伤。通过进一步检测PDCD4/NF-κB/TNF-α信号通路,本研究发现:与CME组相比,该通路是受到显著的抑制,表现为心肌PDCD4水平下调,NF-κB活化受到抑制,TNF-α表达显著下降,说明尼可地尔对于CME后心肌损伤的保护作用与抑制PDCD4所介导的炎症反应有关,这可能是尼可地尔改善CME所致心肌损伤的重要机制之一。
本研究的局限性:在CME造模时使用的塑料微球,与临床实际不稳定斑块破裂脱落形成的富有血小板、红细胞等具有生物活性的栓塞物质不同,与动脉粥样斑块破裂后引起的CME的实际病理生理改变有一定的差距,今后研究中可以考虑用自体血栓制成微栓塞剂进一步改善CME模型。此外,本研究为小样本动物实验,其研究结论需要更大规模的随机对照试验进一步证实。
综上所述,尼可地尔预处理可以有效改善CME所致的心肌损伤,该效应可能是通过阻断心肌细胞PDCD4/NF-κB/TNF-α信号通路,减少心肌炎症反应实现。该机制可能是PCI术前预防性应用尼可地尔改善患者预后的重要机制之一。
| [1] | Heusch G, Kleinbongard P, Böse D, et al. Coronary microembolization from bedside to bench and back to bedside[J]. Circulation, 2009, 120(18): 1822-1836. DOI:10.1161/CIRCULATIONAHA.109.888784 |
| [2] | Heusch G. The Coronary circulation as a target of cardioprotection[J]. Circ Res, 2016, 118(10): 1643-1658. DOI:10.1161/CIRCRESAHA.116.308640 |
| [3] | Su Q, Li L, Wang J, et al. Mechanism of programmed cell death factor 4/nuclear factor-κB signaling pathway in porcine coronary micro-embolization-induced cardiac dysfunction[J]. Exp Biol Med, 2015, 240(11): 1426-1433. DOI:10.1177/1535370215573400 |
| [4] | Su Q, Li L, Liu Y, et al. Ultrasound-targeted microbubble destruction-mediated microRNA-21 transfection regulated PDCD4/NF-κB/TNF-α pathway to prevent coronary microembolization-induced cardiac dysfunction[J]. Gene Ther, 2015, 22(12): 1000-1006. DOI:10.1038/gt.2015.59 |
| [5] | Afzal MZ, Reiter M, Gastonguay C, et al. Nicorandil, a nitric oxide donor and ATP-sensitive potassium channel opener, protects against dystrophin-deficient cardiomyopathy[J]. J Cardiovasc Pharmacol Ther, 2016, 21(6): 549-562. DOI:10.1177/1074248416636477 |
| [6] | Tarkin JM, Kaski JC. Vasodilator therapy: nitrates and nicorandil[J]. J Cardiovasc Pharmacol Ther, 2016, 30(4): 367-378. DOI:10.1007/s10557-016-6668-z |
| [7] | Yang J, Zhang J, Cui W, et al. Cardioprotective effects of single oral dose of nicorandil before selective percutaneous coronary intervention[J]. Anat J Cardiol, 2015, 15(2): 125-131. DOI:10.5152/akd.2014.5207 |
| [8] | 裴玮娜, 谢瑞芹, 崔炜, 等. 曲美他嗪与尼可地尔对经皮冠状动脉介入治疗相关心肌损伤干预作用的比较[J]. 中国循环杂志, 2014, 29(4): 256-260. DOI:10.3969/j.issn.1000-3614.2014.04.005 |
| [9] | Su Q, Li L, Liu T, et al. Effects of atorvastatin on PDCD4/NF-κB/TNF-α signaling pathway during coronary microembolization of miniature pigs[J]. Exper Mol Path, 2015, 99(3): 564-569. DOI:10.1016/j.yexmp.2015.08.022 |
| [10] | 苏强, 李浪, 刘阳春, 等. 超声微泡靶向转染MicroRNA-21对猪冠状动脉微栓塞后心肌细胞凋亡的影响[J]. 中华急诊医学杂志, 2015, 24(7): 712-718. DOI:10.3760/cma.j.issn.1671-0282.2015.07.005 |
| [11] | 王现涛, 李浪, 陆元喜, 等. TAK-242调控TLR4/NF-κB对大鼠冠状动脉微栓塞后心肌细胞凋亡的影响[J]. 中华急诊医学杂志, 2017, 26(7): 745-750. DOI:10.3760/cma.j.issn.1671-0282.2017.07.006 |
| [12] | Skyschally A, Gres P, Hoffmann S, et al. Bidirectional role of tumor necrosis factor-α in coronary microembolization progressive contractile dysfunction versus delayed protection against infarction[J]. Circ Res, 2007, 100(1): 140-146. DOI:10.1161/01.RES.0000255031.15793.86 |
| [13] | Thielmann M, Dörge H, Martin C, et al. Myocardial dysfunction with coronary microembolization signal transduction through a sequence of nitric oxide, tumor necrosis factor-α, and sphingosine[J]. Circ Res, 2002, 90(7): 807-813. DOI:10.1161/01.RES.0000014451.75415.36 |
| [14] | Su Q, Li L, Zhao J, et al. Effects of trimetazidine on PDCD4/NF-κB/TNF-α pathway in coronary microembolization[J]. Cell Phy Bioch, 2017, 42(2): 753-760. DOI:10.1159/000478067 |
| [15] | Li S, Zhong S, Zeng K, et al. Blockade of NF-κB by pyrrolidine dithiocarbamate attenuates myocardial inflammatory response and ventricular dysfunction following coronary microembolization induced by homologous microthrombi in rats[J]. Basic Res Cardiol, 2010, 105(1): 139-150. DOI:10.1007/s00395-009-0067-6 |
| [16] | Ge Y, Huang M, Ma Y. The effects of microRNA-34a regulating Notch-1/NF-κB signaling pathway on lipopolysaccharide-induced human umbilical vein endothelial cells[J]. World J Emerg Med, 2017, 8(4): 292. DOI:10.5847/wjem.j.1920-8642.2017.04.008 |
| [17] | Ye Z, Su Q, Li L. The clinical effect of nicorandil on perioperative myocardial protection in patients undergoing elective PCI: A Systematic Review and Meta-Analysis[J]. Sci Rep, 2017, 7: 45117. DOI:10.1038/srep45117 |
| [18] | Ito N, Nanto S, Doi Y, et al. Beneficial effects of intracoronary nicorandil on microvascular dysfunction after primary percutaneous coronary intervention: demonstration of its superiority to nitroglycerin in a cross-over study[J]. Cardiovasc Drugs Ther, 2013, 27(4): 279-287. DOI:10.1007/s10557-013-6456-y |
| [19] | Hwang J, Lee HC, Kim BW, et al. The effect on periprocedural myocardial infarction of intra-coronary nicorandil prior to percutaneous coronary intervention in stable and unstable angina[J]. J Cardiol, 2013, 62(2): 77-81. DOI:10.1016/j.jjcc.2013.03.017 |
| [20] | Zhang F, Xuan Y, Cui J, et al. Nicorandil modulated macrophages activation and polarization via NF-κb signaling pathway[J]. Mol Immun, 2017, 88: 69-78. DOI:10.1016/j.molimm.2017.06.019 |
| [21] | 陈美姬, 梁伟杰, 李健豪, 等. 尼可地尔对抗高糖引起的H9c2心肌细胞损伤和炎症反应[J]. 中国药理学通报, 2016, 32(12): 1657-1665. DOI:10.3969/j.issn.1001-1978.2016.12.006 |
 2018, Vol. 27
2018, Vol. 27




