心力衰竭猝死机制的研究一直为该领域的学者所关注,超过50%的心源性猝死是由于恶性心律失常所致[1]。钙调蛋白依赖的蛋白激酶Ⅱ(Ca2+/calmodulin dependent protein kinaseⅡ, CaMKⅡ)可以通过影响细胞内兰尼碱受体、钙泵和受磷蛋白等钙转运蛋白,引发钙稳态失调[2-5]。研究发现,炎症反应、RAAS系统和交感神经系统等神经内分泌系统可以激活CaMKⅡ通路,导致钙稳态失调,引起潜在恶性心律失常的发生[6-8]。然而,CaMKⅡ通路在心衰时心律失常的发生发展过程中的作用尚未完全明确。本文利用CaMKⅡ抑制剂KN93,观察其对兔心衰模型迟后除极(delayed afterdepolarization, DAD)和触发活动(trigger activity, TA)的作用及可能的分子机制进行研究,以探索CaMKⅡ在心衰时心律失常发生发展中的作用。
1 材料与方法 1.1 溶液与试剂HEPES、胶原酶Ⅱ、胰蛋白酶、FBS胎牛血清、L-谷氨酸、K-aspartame acid、GTP、CdCl2、TTX和CsCl购自美国Sigma公司; EGTA购自美国Fluka Biochemika公司; DMEM细胞培养基购自美国Thermo公司产品; Lipofectamine转染试剂为美国Invitrogen公司产品。
细胞分离液成份(mmol/L):NaCl 11.0,KCl 5,CaCl2 1.5,MgCl2 1.2,HEPES 10,葡萄糖10,pH值用NaOH调至7.4;无钙分离液为分离液中不加CaCl2但增加EGTA 10 mmol/L。
细胞外液:同细胞分离液。于细胞外液加入4-AP 5 mmol/L阻断Ito,TTX 100 μmol/L阻断INa。细胞内液(mmol/L):CsCl 100、TEA-Cl 20、EGTA 10、Na2ATP 5、HEPES 10,pH调至7.2。
1.2 兔慢性心力衰竭模型的制备及分组取雄性新西兰大白兔(解放军总医院动物实验中心),体质量2.5~3.5 kg。采用20%乌拉坦(1.00 mg/kg)麻醉,分离腹主动脉近心端,在右肾动脉开口以上,用丝线将其缩窄60%~70%。2周后钝性分离右侧颈总动脉,4 F动脉鞘管通过右颈总动脉刺破主动脉瓣造成返流,脉压增加50%以上视为手术成功。青霉素肌注连续3 d,预防感染。术后8周评估心功能,心脏射血分数小于50%以下兔允许进入下列实验[9]。将实验兔随机(随机数字法)分为3组:假手术组(sham组)、心衰组(HF组)、心衰+KN93组(HF+KN93组),每组10只。其中HF组、HF+KN93组采用腹主动脉缩窄联合主动脉瓣反流术建立兔心力衰竭模型,sham组只游离腹主动脉不缩窄、只结扎右颈总动脉不破坏主动脉瓣。
1.3 兔心室肌细胞的分离按文献[10]采用酶解法制备心室肌单细胞并进行了改进。取上述实验兔首先肝素化(腹腔注射100 U/mL),再用20%乌拉坦(1.00 mg/kg)麻醉,迅速取心脏,在37℃和通氧条件下行Langendorff灌流。用无Ca2+ Tyrode's液灌流3~5 min,用含Ⅱ型胶原酶70 mg、胰蛋白酶12 mg的无Ca2+ Tyrode's液灌流(50 mL) 25~30 min。沿房室间沟取心室肌,剪碎入KB液中并吹打使细胞脱落,并于-4℃保存,1 h后进行实验。取保存液加入1 mL灌流槽中,待细胞贴壁后,于倒置显微镜下选择边缘整齐、表面无颗粒、横纹清晰、无收缩的细胞,37℃下进行实验。Sham组和HF组心肌细胞灌流正常台氏液; HF+KN93组为含有KN93的台氏液灌流心衰心肌细胞,每组取10~15个心肌细胞。
1.4 全细胞膜片钳记录采用全细胞膜片钳记录方法,在电压钳制下记录电流。将Axon-700B膜片钳放大器(Molecular Devices, Sunnyvale, CA, USA)同计算机连接。刺激信号及电压输入信号的采集应用Digidata 1440A数模转换器(Molecular Devices, Sunnyvale, CA, USA),均由软件(pCLAMP10.2)控制。GG-17玻璃毛坯经pp-83微电极拉制仪(Narishige Co. Japan)拉制成电阻为2.0~5.5MΩ的电极。调节三维操纵器进行封接,使封接电阻达1GΩ以上,吸破细胞膜形成全细胞记录模式。测定电容时,施以0.4 V/s的斜坡刺激,测电流并按方程Cm=I/(dv/dt)计算(Cm为膜电容,I为电流值,dV/dt即电压斜率)。为消除细胞间的误差,I值以电流密度(pA/pF)表示。信号经截止频率为1 kHz的四阶贝塞尔低通滤波器滤波,采样率为5 kHz。串联电阻补偿90%~95%以消除电压偏差,液接电位补偿校正至小于2 mV,慢电容补偿约为85%~90 %,以消除膜电容的充放电影响。
1.5 膜片钳记录参数设置动作电位(action potetial,AP)的记录:电流钳模式下,钳制电位为0 mV,1500 pA持续10 ms的20个串刺激,频率为4.0 Hz,记录AP。参照文献[9] DAD被定义为:在4期紧接着正常动作电位后出现的去极化幅值大于5 ms持续时间大于10ms的自动去极化波形。TA被定义为:在DAD的基础上出现的一个自发性动作电位,其特征是0相有明显的自发性除极。
Iti电流记录:参照文献[11]在电压钳方式下,首先给予20个方波预刺激,从-80 ~ +50 mV,150 ms,每组刺激间隔100 ms,之后给予2 000 ms,-100 ~ +30 mV的测试刺激,引出Iti。Iti被定义为:波峰与电流基线之间的差值,按第一个出现的波形进行分析。
1.6 钙瞬变的检测采用IonOptix离子浓度测定系统检测细胞内钙瞬变。将心肌细胞置于倒置显微镜载物台上的细胞灌流小室内,并给予电场刺激(0.5 Hz,5 ms),细胞收缩影像通过40×物镜呈现在监视器上,心肌细胞内与游离Ca2+结合的荧光物质被激发,并通过双激发荧光光电倍增系统检测荧光信号。单个心肌细胞电刺激钙瞬变测量,刺激状态稳定,0.5 Hz。
1.7 Western blot测定钙调控蛋白表达取100 mg冻存心肌组织,加入1 mL含蛋白酶抑制剂的RIPA蛋白裂解液中。剪碎,高速匀浆; 冰上静置1.0 min; 12 000 r/min,4℃离心1.0 min,取上清液于离心管中,-20℃冻存备用。采用美国Pierce公司生产的蛋白浓度试剂盒,BCA方法测定蛋白浓度。以上样蛋白量20 μg为1次上样量,根据测定的蛋白浓度计算蛋白上样量。采用Bolt 4%~12% Bis-Tris Plus和NuPAGE 3%~8% Tris-Acetate凝胶,电泳分离NCX1.1、CaMKⅡ、RyR2、PLN,采用Blot Gel Transfer System转移电泳胶将电泳后蛋白从凝胶转移NC膜上。5%脱脂奶粉封闭1 h,4℃加anti-NCX1.1、anti-CAMKⅡ、anti-RyR2、anti-PLN、anti-pPLN一抗过夜(目的蛋白抗体稀释比例1:200;GAPDH:1:1 000)。次日TBST洗3次,每次10 min。然后用二抗:CaM(1:2 000);GAPDH (1:5 000)室温孵育摇床1 h,用TBST洗3次,每次10 min。ECL发光显影。用ImageLab软件读取条带的积分灰度值。
1.8 统计学方法所有数据以均数±标准差(x±s)表示,数据采用pCLAMP10.2处理,采用spss17.0软件进行统计学分析,多组间数据比较用ANOVA方差分析,组间两两比较用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 KN93对心衰兔心室肌细胞DAD和TA的作用在心衰兔的心室肌细胞上约有73.3% (11/15)出现DAD,进一步约28.6%(4/15)的细胞形成TA与Sham组比差异有统计学意义(P < 0.01);而Sham组仅20%(3/15)细胞出现DAD,未出现TA。应用1.0μmol/L的KN93后,心衰心室肌细胞约46.7%(7/15)出现DAD,其中13.3%(2/15)出现TA,与HF组比差异有统计学意义(P < 0.01)。提示KN93对心衰兔的心室肌细胞DAD和TA均有抑制效应,见图 1。
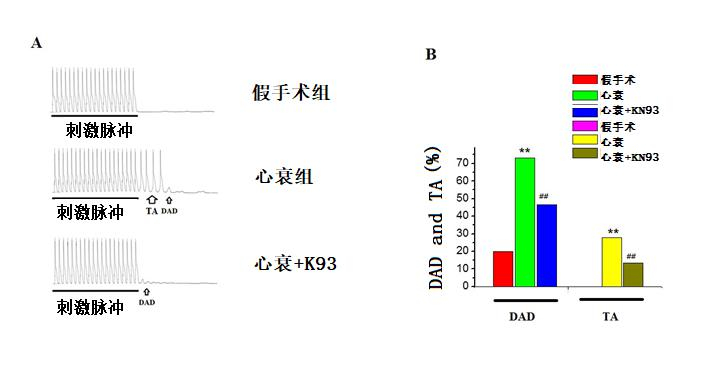
|
| A.三组细胞DADs及TA的原始记录图; B.三组细胞DADs及TA的发生百分比。与假手术组比较,aP < 0.01,与心衰组比较,bP < 0.01 图 1 KN93对心衰兔心室肌细胞DADs和DAD诱导TA的作用 Figure 1 Effect of KN93 on DADs, DAD-induced TA of ventricular myocytes in rabbit with heart failure |
|
|
Iti电流密度在心衰后增加,-50 mV时,峰电流密度从Sham组细胞的-0.12±0.02 pA/pF增加至-0.95±0.06 pA/pF(n=10,P < 0.01)。暴露于1.0 μmol/L KN93后,电流密度降低为-0.44±0.04 pA/pF(n=10,P < 0.01)。I-V显示Iti电流在-50 mV去极化时最大,而在更负或更正的刺激电位时,电流幅值均减少。心衰时,电流密度增加,尤其以-90 ~ +10 mV的电流为甚,且在+20 mV以上电位时出现外向电流。上述现象在应用1.0 μmol/L KN93后得以阻滞,见图 2。
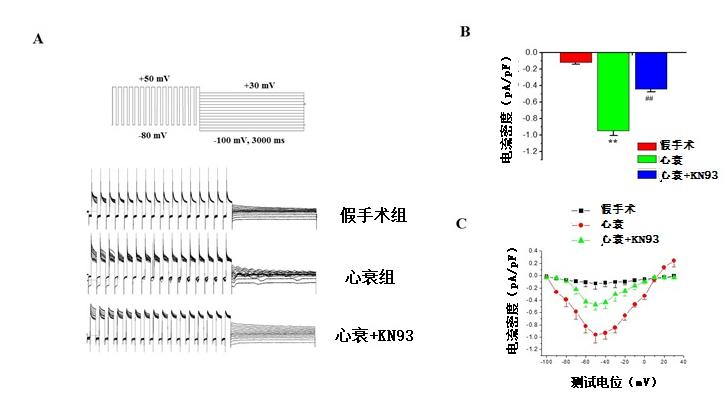
|
| A.给予从-100 mV到+ 30 mV,2000 ms的条件刺激,之后跟着一个从-80到+50 mV,150 ms的测试刺激记录Iti电流; B.心衰后增加的Iti密度可以被KN93抑制; C.显示三组I-V曲线。与假手术组比较,aP < 0.01,与心衰组比较,bP < 0.01 图 2 KN93对心衰兔心室肌细胞Iti的作用 Figure 2 Effect of KN93 on Iti of ventricular myocytes in rabbit with Heart failure |
|
|
心衰时,静息态钙浓度、钙瞬变幅度和胞内钙最高50%时间等参数显著升高,与Sham组比差异具有统计学意义(n=15, P < 0.01)。应用1.0 μmol/L KN93后,上述参数的增加幅度均降低(n=15, P < 0.05或P < 0.01)。心衰后兔心室肌细胞内钙瞬变衰减率下降,应用KN93后,得到部分恢复(n=15, P < 0.05)见表 1、图 3。
| 指标 | Sham组 | HF组 | HF+KN93组 |
| 静息态钙浓度(F340/380) | 0.92±0.04 | 1.24±0.03b | 1.05±0.02d |
| 钙瞬变幅度(%) | 10.3±0.8 | 22.5±1.2b | 13.2±1.0d |
| 胞内钙最高50%时间(Tpeak, 50, s) | 0.035±0.002 | 0.056±0.003b | 0.039±0.002c |
| 胞内钙瞬变衰减率(t90, s) | 0.65±0.03 | 0.46±0.02a | 0.58±0.02c |
| 注:与Sham组比较,aP < 0.05,bP < 0.01;与HF组比较,cP < 0.05,dP < 0.01 | |||
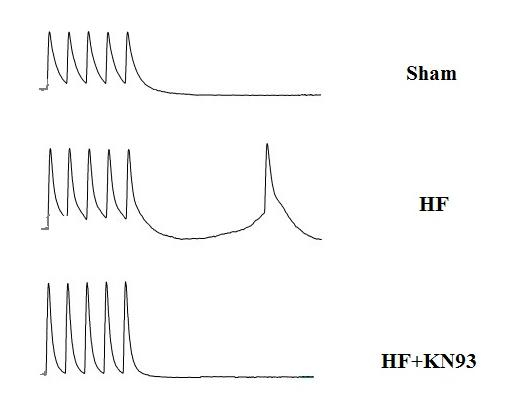
|
| 心衰细胞的钙瞬变幅值显著增加,但可以被KN93抑制 图 3 KN93对心衰兔心室肌细胞内钙瞬变的作用 Figure 3 Effect of KN93 on intracellular calcium transients in the ventricular myocytes of heart failure |
|
|
图 4为Sham组、HF组和HF+KN93组主要钙运载蛋白的表达。结果显示,NCX1.1和CaMKⅡ在心衰时表达上调,SERCA2a和pPLN则下调,RyR2和PLN表达基本不变,提示心衰时主要是钙离子摄取障碍,导致细胞内钙离子浓度增加; 提示由于NCX上调,使得Iti幅值和电流密度增加明显。KN93可以上调pPLN,使其对SERCA2a的抑制降低,同时上调SERCA2a,最终增加钙离子摄取,缓解心衰时钙循环的病理改变。
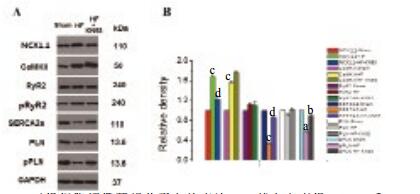
|
| A.三组细胞钙循环相关蛋白的表达; B.其中心衰组NCX1.1和CaMKⅡ上调,而SERCA2a和pPLN下调,此变化可以被KN93抑制。与假手术组比较aP < 0.05, bP < 0.01;与心衰组比较cP < 0.05, dP < 0.01 图 4 KN93对心衰兔心室肌钙转运蛋白的作用 Figure 4 Effect of KN93 on the cardiac calcium transporter in the ventricular myocytes of heart failure |
|
|
心衰时,长期的病理学因素、神经内分泌的过度激活、机械电反馈作用等引起心肌电活动出现多种形式的适应性改变,这些改变在一定程度上能代偿和缓解心功能损害,但同时这种适应性改变将成为新的致心律失常因素,是心衰致心律失常发生的重要原因[12-13]。研究表明,器质性心脏病中存在着CaMKⅡ的表达和功能上调,CaMKⅡδB和CaMKⅡδC过度表达的转基因小鼠均可导致心肌肥厚和心力衰竭,更易于诱发心律失常[14]。Liu等[15]研究发现,将CPVT的RyR R4496C转基因小鼠与CaMKⅡδC过度表达的转基因小鼠杂交,发现其后代CaMKⅡδC/RyRR4496C小鼠在9~10周时产生自发性的恶性室性心律失常,并导致猝死。本文的结果提示,KN93可以降低心衰时心室肌细胞DAD,减少TA,说明CaMKⅡ在心衰时细胞内钙处置以及心律失常发生方面起着重要的作用,同时,也提示KN93具有潜在的抗心律失常效应,具有一定的研发前景。
心衰时Ca循环发生复杂的重构,既有代偿性的改变,又有发生在舒张期的DAD出现。DAD发生的离子基础与Na /Ca交换体(NCX)的反向转运有关,后者可使细胞内Ca2+浓度增高,从而诱发瞬时内向电流(Iti),使震荡电位的幅度升高,当达到阈电位时将引发一次除极,即触发活动,在一次TA后,DAD幅度可更大,从而导致一连串TA,表现为室性心动过速,包括多形性室速和尖端扭转型室速,严重危及患者的生命[16-17]。本研究显示,KN93可降低心衰时心室肌细胞内静息态钙浓度,减少Iti,这可能是其减少DAD和TA的主要原因。同时也反映了CaMKⅡ抑制虽然没有改变NCX1.1的表达,但可能改变NCX交换体的功能,进而减少Iti电流。
KN93可以上调肌浆网Ca2+-ATP酶(Sarcoplasmic reticulum Ca2+-ATPase,SERCA2a)和pPLN的表达,提示其可以增加细胞内Ca2+的摄取。生理状态时,去磷酸化的PLB(Phospholamban,PLN)通过降低SERCA与Ca2+亲和力,抑制SERCA功能,故PLB磷酸化可能解除抑制。心衰时PLN的活性降低,即磷酸化状态下调,使SERCA2a与Ca2+的亲和力下降,肌浆网再摄取胞浆中Ca2+能力降低,舒张期胞浆中Ca2+增高和心脏舒张功能下降[18-19]。本文结果显示,KN93虽然不能改变PLN,但可以上调pPLN,增加SERCA2a与Ca2+的亲和力,促进胞内钙摄取, 进而达到降低DAD和TA的目的。这可能是CaMKII抑制能够减少心衰时DAD发生的又一原因。本研究并未发现抑制CaMKII对RyR2表达的影响,但心衰时RyR2-Ser2815位点的磷酸化水平显著增加,舒张期出现钙离子渗漏。而应用KN93后,可降低过度磷酸化RyR2,减少舒张期细胞内Ca2+,降低触发性心律失常的发生。
| [1] | Patton KK, Hellkamp AS, Lee KL, et al. Unexpected deviation in circadian variation of ventricular arrhythmias: the SCD-HeFT (Sudden Cardiac Death in Heart Failure Trial)[J]. J Am Coll Cardiol, 2014, 63(24): 2702-2708. DOI:10.1016/j.jacc.2013.11.072 |
| [2] | Sobie EA, Guatimosim S, Gómez-Viquez L, et al. The Ca2+ leak paradox and rogue ryanodine receptors: SR Ca2+ efflux theory and practice[J]. Prog Biophys Mol Biol, 2006, 90(13): 172-185. DOI:10.1016/j.pbiomolbio.2005.06.010 |
| [3] | Bers DM1, Morotti S1. Ca(2+) current facilitation is CaMKⅡ-dependent and has arrhythmogenic consequences[J]. Front Pharmacol, 2014, 17(5): 144. DOI:10.3389/fphar.2014.00144 |
| [4] | Kohlhaas M, Zhang T, Seidler T, et al. Increased sarcoplasmic reticulum calcium leak but unaltered contractility by acute CaMKⅡ overexpression in isolated rabbit cardiac myocytes[J]. Circ Res, 2006, 98(2): 235-244. DOI:10.1161/01.RES.0000200739.90811.9f |
| [5] | Netticadan T, Temsah RM, Kawabata K, et al. Ca2+-overload inhibits the cardiac SR Ca2+-calmodulin protein kinase activity[J]. Biochem Biophys Res Commun, 2002, 293(2): 727-732. DOI:10.1016/S0006-291X(02)00287-5 |
| [6] | Racioppi L, Means AR. Calcium/calmodulin-dependent protein kinase kinase 2: roles in signaling and pathophysiology[J]. J Biol Chem, 2012, 287(38): 31658-31665. DOI:10.1074/jbc.R112.356485 |
| [7] | Marcelo KL, Means AR, York B. The Ca(2+)/Calmodulin/CaMKK2 axis: nature's metabolic caMshaft[J]. Trends Endocrinol Metab, 2016, 27(10): 706-718. DOI:10.1016/j.tem.2016.06.001 |
| [8] | Fuller SJ, Osborne SA, Leonard SJ, et al. Cardiac protein kinases: the cardiomyocyte kinome and differential kinase expression in human failing hearts[J]. Cardiovasc Res, 2015, 108(1): 87-98. DOI:10.1093/cvr/cvv210 |
| [9] | 柯俊, 李泱, 陈锋, 等. 大蒜素对心力衰竭兔心室肌细胞的作用[J]. 中华急诊医学杂志, 2018, 27(7): 729-734. DOI:10.3760/cma.j.issn.1671-0282.2018.07.005 |
| [10] | Chen YJ, Chen YC, Yeh HI, et al. Electrophysiology and arrhythmogenic activity of single cardiomyocytes from canine superior vena cava[J]. Circulation, 2002, 105(22): 2679-8265. DOI:10.1161/01.CIR.0000016822.96362.26 |
| [11] | Verkerk AO, Veldkamp MW, Bouman LN, et al. Calcium-activated Cl(-) current contributes to delayed afterdepolarizations in single Purkinje and ventricular myocytes[J]. Circulation, 2000, 101(22): 2639-2644. DOI:10.1161/01.CIR.101.22.2639 |
| [12] | Mondésert B, Dubin AM, Khairy P. Diagnostic tools for arrhythmia detection in adults with congenital heart disease and heart failure[J]. Heart Fail Clin, 2014, 10(1): 57-67. DOI:10.1016/j.hfc.2013.09.009 |
| [13] | Motonaga KS1, Khairy P, Dubin AM. Electrophysiologic therapeutics in heart failure in adult congenital heart disease[J]. Heart Fail Clin, 2014, 10(1): 69-89. DOI:10.1016/j.hfc.2013.09.011 |
| [14] | Charles B, Gray B, Brown JH. CaMKⅡ delta subtypes: localization and function[J]. Front Pharmacol, 2014, 5: 15. DOI:10.3389/fphar.2014.00015 |
| [15] | Liu N, Ruan Y, Denegri M, et al. Calmodulin kinaseⅡ inhibition prevents arrhythmias in RyR2 (R4496C+/-) mice with catecholaminergic polymorphic ventricular tachycardia[J]. J Mol Cell Cardiol, 2011, 50(1): 214-222. DOI:10.1016/j.yjmcc.2010.10.001 |
| [16] | Liu MB, de Lange E, Garfinkel A, et al. Delayed afterdepolarizations generate both triggers and a vulnerable substrate promoting reentry in cardiac tissue[J]. Heart Rhythm, 2015, 12(10): 2115-2124. DOI:10.1016/j.hrthm.2015.06.019 |
| [17] | Ko CY, Liu MB, Song Z, et al. Multiscale determinants of delayed afterdepolarization amplitude in cardiac tissue[J]. Biophys J, 2017, 112(9): 1949-1961. DOI:10.1016/j.bpj.2017.03.006 |
| [18] | Dhondup Y, Sjaastad I, Sandanger Ø, et al. Toll-Like receptor 9 promotes survival in SERCA2a KO heart failure mice[J]. Mediators Inflamm, 2017, 2017(4): 9450439. DOI:10.1155/2017/9450439 |
| [19] | Cutler MJ, Wan X, Plummer BN, et al. Targeted sarcoplasmic reticulum Ca2+ ATPase 2a gene delivery to restore electrical stability in the failing heart[J]. Circulation, 2012, 126(17): 2095-2104. DOI:10.1161/CIRCULATIONAHA.111.071480 |
 2018, Vol. 27
2018, Vol. 27




