2 215500 江苏省常熟,常熟市第一人民医院消化科
2. Department of Gastroenterology Changshu NO.1 Hospital, Jiangsu 215500, China
目前肠内营养已成为危重症患者首选的营养途径,但由于病情的危重与复杂多变,肠内营养不耐受的发生几率明显增高。调查显示,因颅脑损伤入住重症监护病房(intensive care unit, ICU)的患者在使用胃管进行喂养时易发生呕吐反流等情况,影响了肠内营养的实施[1-2]。
由于创伤早期很多患者无法耐受足量的肠内喂养,故有学者提出了“滋养性喂养”及“允许性低热卡”的理念[3-4],然而减少营养物质的摄取极易造成营养不良等后果的产生。本研究旨在探讨对于重型颅脑损伤的患者通过经皮内窥镜下胃空肠造瘘(percutaneous endoscopic gastrostomy-percutaneous endoscopic jejunostomy, PEG-J)管实施肠内营养能否可以增加早期营养的摄入,改善患者的临床结局。
1 资料与方法 1.1 一般资料选取常熟市第一人民医院重症医学科2013年1月至2016年12月期间收治的重型颅脑损伤并行机械通气的患者为研究对象,研究方案通过医院伦理委员会批准并获得患者家属知情同意。入选患者均符合重型颅脑损伤的标准诊断:①广泛颅骨骨折、脑挫裂伤,脑干损伤或颅内血肿,GCS评分3~8分;②深昏迷12 h以上,意识障碍逐渐加重或出现再昏迷;③有明显的阳性体征;④体温、呼吸、脉搏、血压有显著改变。入选患者发病时间 < 24 h。排除标准:①年龄小于18岁;②入院后24 h内死亡或排除药物因素影响后持续24 h无自主呼吸的患者;③基础有严重心肺及其他慢性疾病患者;④既往有胃肠道大手术史,严重胃肠道损伤,严重凝血障碍,严重腹腔高压,全身水肿明显患者。
1.2 方法患者根据随机数字表法分为对照组及治疗组。对照组经口腔或鼻腔留置胃管进行肠内营养饲入。治疗组于入院后5 d内在床边行PEG-J术,通过J管进行肠内营养支持,在PEG-J管道未建立前先经胃管进行营养支持。PEG-J置入步骤:选择左上腹肋缘下中线外3~5 cm处,经口腔置入胃镜,通过触碰法、透光法确定穿刺部位;内镜监控下将穿刺套管针经穿刺点穿入胃内,退出针芯,沿套管送入导线,内镜下将导线拉至口腔外后与造瘘管头端的线圈牢固连接;再通过牵拉腹壁外的导线,将造瘘管拉入胃腔内直至胃内固定盘片紧贴胃壁,后剪断造瘘管尾端,外接连接头;将PEJ导管通过PEG放入胃腔,在胃镜辅助下用异物钳将PEJ管送至十二指肠降部。完成后通过摄片确认导管位置。
两组患者均选用标准能量密度的能全力[纽迪希亚公司,500 mL/瓶,1 000 kcal/L(1kcal=4.18kj)]作为肠内营养制剂,最终目标能量为30 kcal/(kg·d)。对照组根据胃残余量调节肠内营养速度。实施肠内营养时每6 h回抽一次胃残余量,若胃残余量 < 250 mL,则将输注速度增加10 mL/h,直至到达目标量。若胃残余量≥250 mL,则先回输胃内容物并维持原速度,6 h后继续回抽,若胃残余量仍≥250 mL,则回输250 mL胃内容物后将输注速度减慢10 mL/h。治疗组根据有无反流呕吐症状调节输注速度,具体调整方法同对照组。若肠内营养实施一周后仍未达到目标量,则辅以补充肠外营养制剂。
两组患者均接受重型颅脑损伤的常规治疗,血糖水平控制在6~10 mmol/L,在血糖到达目标范围前每1~2 h监测一次末梢血糖,对于血糖偏高患者由护士根据血糖控制方案予以普通胰岛素微量泵持续泵注控制血糖。选用丙泊酚注射液(AstraZeneca UK Limited,500 mg/50 mL)为镇静药物,镇静目标为RASS评分-1~0分,选用枸橼酸芬太尼注射液(宜昌人福药业,0.1 mg/2 mL)为镇痛药物,镇痛目标为CPOT评分 < 2分,镇静镇痛药物均予以微量泵持续泵注。若机械通气 > 14 d则行气管切开术。血清白蛋白低于28 g/L的患者予以外源性人血白蛋白输注至白蛋白水平 > 28 g/L。
1.3 观察指标患者前7 d摄入肠内营养靶热量达标率情况(实际摄入能量占目标能量的比例);(2)治疗第1天及第7天采集肘静脉血,进行淋巴细胞亚群分析,检测促甲状腺激素水平(TSH)、游离T3(F-T3)、游离T4(F-T4)及皮质醇水平,治疗28 d时血清白蛋白水平、前白蛋白水平;(3)治疗前7 d使用镇静及镇痛药物剂量;(4)预后指标:28 d病死率、28 d日常生活活动能力量表(Barthel指数)评分、ICU时间、机械通气时间,入ICU48 h后新出现的器官功能不全(SOFA评分中某一单项评分≥3分)的发生情况,并发感染情况、以及非感染并发症(呕吐、反流、出血等)的发生率。观察的时间以入ICU为起点,以转出ICU(最长随访时间28 d)或死亡为终点。
1.4 统计学方法运用SPSS17.0软件包对上述所有数据进行统计学处理,正态分布数据用(x±s),偏态分布数据使用中位数(四分位间距)表示,正态分布数据组间比较使用t检验,偏态分布数据组件比较使用非参数检验的Mann-Whitney U秩和检验,率的比较用χ2检验,配对数据使用配对t检验,生存曲线采用Kaplan-Meier方法绘制,以P < 0.05为差异具有统计学意义。
2 结果 2.1 基线资料共有93例患者入选研究,6例患者予以剔除,其中1例为入院后24 h内死亡,3例在排除其他干扰因素后持续24 h无自主呼吸,2例合并有严重的腹部损伤,最终共87例患者纳入研究。根据随机数字表法分为对照组(45例)及治疗组(42例),两组患者在性别、年龄、体质量、体质量指数(BMI,Body Mass Index)及入院时APACHEⅡ评分等指标上均差异无统计学意义(P > 0.05)。治疗组开始置管的时间稍晚于对照组[第(1.18±0.39)天vs.第(3.86±0.65)天,P < 0.01]。这是由于PEG-J术为一项微创手术,操作不如留置胃管简便,需更多的时间完善相关术前准备,治疗组在未建立PEG-J导管前先通过胃管进行营养支持,见表 1。
| 指标 | 对照组(n=5) | 治疗组(n=42) | t/χ2值 | P值 |
| 年龄(岁) | 54.5±12.3 | 55.9±9.34 | -0.623 | 0.535 |
| 性别(男/女) | 23/22 | 24/18 | 0.318 | 0.573 |
| 开始置管时间(天) | 1.18±0.39 | 3.85±0.65 | -23.253 | 0.000 |
| 体质量(kg) | 63.2±6.29 | 62.5±7.57 | 0.470 | 0.639 |
| BMI(kg/m2) | 21.9±1.34 | 22.3±1.48 | -1.182 | 0.241 |
| APACHEⅡ评分 | 16.1±3.8 | 15.9±4.3 | 0.265 | 0.792 |
两组患者按照肠内营养饲入流程进行营养支持,及时调整管饲的速度,两组患者肠内营养的摄入量随时间的延长均呈逐渐增加的趋势,治疗组自第4天开始靶热量达标情况明显优于对照组(P=0.001, < 0.01, 0.024),见表 2。但在第7天时仍有17例对照组患者,7例治疗组患者实际摄入能量未达到靶目标,这些患者自第8天起辅以添加肠外营养,见表 2。
| 组别 | 第1天 | 第2天 | 第3天 | 第4天 | 第5天 | 第6天 | 第7天 |
| 对照组 | 0(0, 0) | 0(20) | 20(33) | 33(25) | 66(33) | 66(34) | 100(34) |
| 治疗组 | 0(0, 0) | 0(20) | 33(33) | 33(33) | 100(24) | 100(0) | 100(0) |
| P值 | 1.000 | 0.939 | 0.058 | 0.001 | < 0.01 | < 0.01 | 0.024 |
| Z值 | 0.000 | -0.077 | -1.898 | -3.237 | -3.764 | -4.229 | -2.251 |
两组患者第1天CD4+、CD8+及CD4+/CD8+比值,甲状腺激素与皮质醇水平相似(P > 0.05),与同期对照组相比,第7天治疗组CD4+水平、CD4+/CD8+比值较高(P=0.03, 0.001),TSH、F-T3、F-T4水平高于对照组(P=0.036, 0.013, 0.025),皮质醇浓度低于对照组(P=0.004)。两组患者28 d白蛋白水平,前白蛋白水平基本相同,两组使用外源性人血白蛋白总剂量及胰岛素总剂量方面差异无统计学意义,见表 3、表 4。
| 指标 | 对照组(n=45) | 治疗组(n=42) | t/z值 | P值 |
| 第1天 | ||||
| CD4+(%) | 35.23±7.02 | 36.42±6.08 | -0.844 | 0.401 |
| CD8+(%) | 23.07±3.93 | 24.83±4.75 | -1.894 | 0.062 |
| CD4+/CD8+ | 1.55±0.31 | 1.49±0.25 | 0.902 | 0.370 |
| TSH(Uiu/mL) | 0.85±0.43 | 0.89±0.46 | -0.537 | 0.592 |
| F-T3(pg/mL) | 3.47±0.57 | 3.55±0.53 | -0.209 | 0.835 |
| F-T4(ng/mL) | 10.52±1.06 | 10.60±1.03 | -0.095 | 0.924 |
| 皮质醇(nmol/L) | 22.63±6.92 | 22.19±5.87 | 0.314 | 0.754 |
| 白蛋白水平(g/L) | 26.2±2.37 | 26.3±2.24 | -0.213 | 0.832 |
| 前白蛋白水平(g/L) | 208.9±17.8 | 210.9±16.6 | -0.537 | 0.592 |
| 指标 | 对照组(n=45) | 治疗组(n=42) | t/z值 | P值 |
| 治疗第7天 | ||||
| CD4+(%) | 22.57±3.40 | 26.0±4.26 | 2.213 | 0.030 |
| CD8+(%) | 20.2±3.30 | 21.62±4.55 | -0.976 | 0.332 |
| CD4+/CD8+ | 1.14±0.21 | 1.23±0.22 | -3.385 | 0.001 |
| TSH(U/mL) | 0.68±0.33 | 0.78±0.36 | 2.129 | 0.036 |
| F-T3(pg/mL) | 2.59±0.56 | 2.91±0.49 | 2.526 | 0.013 |
| F-T4(ng/mL) | 8.80±0.89 | 9.37±1.00 | 2.283 | 0.025 |
| 皮质醇(nmol/L) | 26.43±7.35 | 24.94±6.20 | 2.947 | 0.004 |
| 治疗第28天 | ||||
| 白蛋白水平(g/L) | 32.11±2.57 | 32.35±2.41 | -0.209 | 0.835 |
| 前白蛋白水平(g/L) | 241.8±16.56 | 244.29±20.54 | -0.095 | 0.924 |
| 使用人血白蛋白总量(g) | 50(10) | 50(25) | -0.933 | 0.351 |
| 胰岛素总剂量(U) | 50(177) | 76(250) | -0.930 | 0.352 |
治疗组前7 d内使用的丙泊酚及芬太尼的日均剂量略低于对照组,但两组间差异无统计学意义。(P=0.064, 0.05),见表 5。
| 药物 | 对照组(n=45) | 治疗组(n=42) | t/z值 | P值 |
| 丙泊酚(mg) | 939.33±281.58 | 842.14±195.75 | 1.879 | 0.064 |
| 芬太尼(mg) | 0.76±0.18 | 0.69±0.13 | 1.995 | 0.05 |
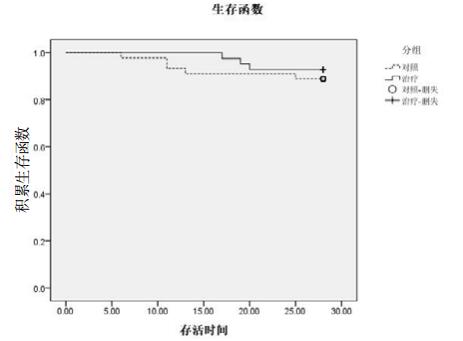
两组患者28 d病死率差异无统计学意义,治疗组28 d Barthel评分略高于对照组(P=0.049),ICU时间及机械通气时间较对照组更短(P=0.048, 0.044)。入院后新发器官功能不全发生例数、总感染例数以及治疗后SOFA评分下降水平方面差异无统计学意义,治疗组VAP发生率明显降低(P=0.037),呕吐、反流误吸(气道或口腔内吸出胃内容物或食物)发生率明显下降(P=0.013),见表 6。根据两组患者28 d生存情况描绘生存曲线,病死率差异无统计学意义,Log Rank χ2=0.45,P=0.502,见图 1。
| 对照组(n=45) | 治疗组(n=42) | t/z值 | P值 | |
| 28 d病死率 | 5(11.1%) | 3(7.1%) | 0.415 | 0.522 |
| 28 dBarthel评分 | 0(10) | 10(15) | -1.968 | 0.049 |
| ICU时间(d) | 17(8) | 14(6) | -1.978 | 0.048 |
| 机械通气时间(d) | 13(8) | 8(5) | -2.016 | 0.044 |
| 新发器官功能不全 | 12(26.7%) | 10(30.1%) | 0.094 | 0.759 |
| 28 dSOFA评分变化值(治疗前-治疗后) | 3(2) | 3(3) | -0.624 | 0.533 |
| 感染相关的并发症 | 31(68.9%) | 22(52.4%) | 2.487 | 0.115 |
| VAP | 25(55.6%) | 14(33.3%) | 4.338 | 0.037 |
| 导管相关血流感染 | 3(6.7%) | 3(7.1%) | 0.008 | 0.93 |
| 尿路感染 | 2(4.4%) | 3(7.1%) | 0.293 | 0.588 |
| 其他部位感染 | 1(2.2%) | 2(4.8%) | 0.427 | 0.514 |
| 脓毒症 | 12(26.7%) | 11(26.2%) | 0.003 | 0.96 |
| 非感染相关的并发症 | ||||
| 呕吐反流误吸 | 14(31.1%) | 4(9.5%) | 6.170 | 0.013 |
| 消化道出血 | 4(8.8%) | 3(7.1%) | 2.749 | 0.097 |
| 血糖 < 2.2mmol/l | 2(4.4%) | 1(2.4%) | 0.284 | 0.594 |
| 血糖 > 15mmol/l | 28(62.2%) | 26(61.9%) | 0.001 | 0.976 |
|
| 图 1 两组患者28 d生存曲线 Figure 1 Kaplan-Meier survival curves at Day 28 |
|
|
世界卫生组织估计至2020年,颅脑损伤将成为全球最普遍的死亡和致残原因之一[5],因此提高颅脑损伤的救治水平至关重要[6]。目前营养干预已被认可是影响预后的干预措施之一,并被颅脑创伤基金会列为优先研究领域[7]。
颅脑损伤患者在创伤早期机体处于高分解、高代谢阶段,迅速出现负氮平衡,造成创伤后早期肌肉与内脏蛋白的丢失,不利于骨骼肌肌肉功能的恢复,此外还伴有神经-内分泌-免疫功能紊乱,出现免疫功能下降,甲状腺激素分泌减少,皮质醇分泌增多,T4可以激活脑原性神经营养因子,影响受伤神经元的存活,皮质醇的上升水平与颅脑损伤程度成正比[8]。肠道除了营养吸收功能外,肠系统还富含淋巴系统,具有免疫调节,减轻炎症反应的功能。有研究表明,从围手术期开始实施肠内营养较术后开始实施的胃癌患者CD4+/CD8+比例下降幅度明显减少,早期实施肠内营养的急性胰腺炎患者免疫抑制状态明显减轻,并发症发生率降低[9-10]。Michael等[10]研究显示早期肠内营养的颅脑损伤患者在治疗第6天及第12天甲状腺激素水平要高于延迟肠内营养的颅脑损伤患者,皮质醇水平低于延迟肠内营养患者,有着更好的预后。2016年SCCM/ASPEN发表的重症患者营养指南中也推荐对于颅脑创伤的患者,一旦血流动力学稳定,在创伤后(24~48 h内)立即开始肠内营养[3]。然而重型颅脑损伤患者实施肠内营养的过程并非顺利,应激状态下代谢紊乱,激素的异常分泌,镇静镇痛药物的使用,颅内高压,机械通气等均会引起胃肠动力障碍[10-11]。在本研究中观察到有31.1%的经胃管喂养患者出现了呕吐反流等肠内营养不耐受的情况。
本研究中通过PEG-J管喂养的患者从第4天起能量摄入量明显高于经胃管喂养组,呕吐反流的发生率低于经胃管喂养组,这是由于PEG-J导管尖端位于幽门后[12],故可以有效地解决因胃排空延迟所导致的无法有效进行肠内营养的问题,利于促进肠动力的恢复和提高肠内营养的耐受性。在研究中观察到经胃喂养组前7 d日均使用丙泊酚量为(939.33±281.58)mg,芬太尼量为(0.76±0.18)mg,与其他研究的机械通气患者[13]相比镇痛镇静药物剂量偏大,这考虑与不同原发病相关。由于PEG-J管较胃管而言舒适度更好[14],故而治疗组在镇静镇痛药物剂量上略有减少,减轻了药物对肠道功能的抑制作用,这也可能是其肠内耐受性更好的原因之一。
本研究显示PEG-J管喂养组与同期经胃管喂养组相比,第7天时CD4+水平、CD4+/CD8+比值较高,TSH、F-T3、F-T4水平升高,皮质醇浓度下降,提示经PEG-J管喂养能促进颅脑损伤后免疫及内分泌功能的更早恢复。两组患者在28 d血清白蛋白及前白蛋白水平相似,差异无统计学意义,可能与后期肠外营养的添加及外源性人血白蛋白补充等因素有关。PEG-J管喂养组远期神经功能恢复程度更好,机械通气时间及ICU时间更短,这与早期高效的营养支持,避免了过多的肌肉蛋白丢失,改善骨骼肌及呼吸功能有关。由于免疫功能的恢复,感染风险降低,呕吐反流的发生率下降,故PEG-J管喂养组VAP发生率更低。就目前的诊断技术而言尚无法明确VAP是由于误吸直接引起还是由于免疫抑制、继发感染、呼吸机管路污染等原因造成,故本研究未有进一步对其中的误吸性肺炎进行分层分析。两组的病死率、器官衰竭发生率方面差异无统计学意义,这可能由于患者的预后由多方面影响,除了营养干预之外,年龄,GCS评分,出血类型等均是影响重型颅脑损伤患者预后的影响因素[15-16]。在冯玉峰课题组[17-19]的其他研究中也可以观察了相似的结果。既往也有学者采用鼻肠管喂养来提高肠内营养的耐受性[20],与鼻肠管相比,PEG-J在导管误入、鼻出血、鼻窦炎、意外拔管、管道堵塞等发生率方面明显降低[21]。对于重型颅脑这类患者而言,PEG-J可能是更为合适的一项肠内营养途径。
目前对于摄入能量的评估更提倡个体化的精准测量,间接热量测定是现推荐的确定能量消耗的“金标准”[22],研究显示使用预测公式评估的患者中有12%高估了能量需求,10%~41%低估了能量需求[23],而本研究采用理想体质量来估算目标能量所造成的误差是该研究的不足之处,另外本研究为单中心研究,样本量偏少,因此仍需进一步的试验验证结果。
综上所述,通过经皮胃空肠造瘘术对重型颅脑损伤患者进行肠内营养支持,可以提高早期肠内营养支持效率,改善早期免疫及内分泌功能,有益于患者的恢复。
| [1] | 呼邦传, 孙仁华, 吴爱萍, 等. ICU内喂养不耐受与重症患者临床预后的相关研究:一项多中心、前瞻性、观察性研究[J]. 中华急诊医学杂志, 2017, 26(4): 434-440. DOI:10.3760/cma.j.issn.1671-0282.2017.04.016 |
| [2] | Bistrian BR. The who, what, where, when, why, and how of early enteral feeding[J]. Am J Clin Nutr, 2012, 95: 1303-1304. DOI:10.3945/ajcn.112.039826 |
| [3] | 乔世刚, 方立超, 安堃, 等. 早期肠内滋养对重症创伤患者肠黏膜屏障的改善作用研究[J]. 中华急诊医学杂志, 2017, 26(9): 1050-1053. DOI:10.3760/cma.j.issn.1671-0282.2017.09.014 |
| [4] | McClave SA, Taylor BE, Martindale RG, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.)[J]. JPEN J Parenter Enteral Nutr, 2016, 40(2): 159-211. DOI:10.1177/0418607115621863 |
| [5] | Hyder AA, Wunderlich CA, Puvanachandra P, et al. The impact of traumatic brain injuries: a global perspective[J]. Neuro Rehabilitation, 2007, 22: 341-353. |
| [6] | Menon DK, Schwab K, Wright DW, et al. Position statement: definition of traumatic brain injury[J]. Arch Phys Med Rehabil, 2010, 91(11): 1637-1640. DOI:10.1016/j.apmr.2010.05.017 |
| [7] | Brain Trauma Foundation. Guidelines for the management of severe traumatic brain injury[J]. J Neurotrauma, 2007, 24(Suppl. 1): S77-82. DOI:10.1089/neu.2006.9984 |
| [8] | Santarsieri M, Kumar RG, Kochanek PM, et al. Variable neuroendocrine-immune dysfunction in individuals with unfavorable outcome after severe traumatic brain injury[J]. Brain Behav Immun, 2015, 5: 15-27. DOI:10.1016/j.bbi.2014.09.003 |
| [9] | Wang F, Hou MX, Wu XL, et al. Impact of enteral nutrition on postoperative immune function and nutritional status[J]. Genet Mol Res, 2015, 14(2): 6065-6072. DOI:10.4238/2015.June.8.4 |
| [10] | Jia K, Sun XW, Mu WQ, et al. Effect of early enteral nutrition on immune function of severe acute pancreatitis patients[J]. World J Gastroenterol, 2013, 19(6): 917-922. DOI:10.3748/wjg.v19.i6.917 |
| [11] | Chourdakis M, Kraus MK, Tzellos T, et al. Effect of early compared with delayed enteral nutrition on endocrine function in patients with traumatic brain injury: an open-labeled randomized trial[J]. JPEN J Parenter Enteral Nutr, 2012, 36: 108-116. DOI:10.1177/0148607110397878 |
| [12] | Gauderer M, Ponsky J, Izant R, et al. Gastrostomy without laparotomy: a percutaneous endoscopic technique[J]. Pediatr Surg, 1980, 15: 872-875. DOI:10.1016/S0022-3468(80)80296-X |
| [13] | 蔡燕, 李勇, 吉木森, 等. 轻度持续镇静对重症机械通气患者预后和炎症水平的影响[J]. 中华结核和呼吸杂志, 2014, 37(11): 820-823. DOI:10.3760/cma.j.issn.1001-0939.2014.11.007 |
| [14] | 章靓, 徐邦英, 郭文霞, 等. 空肠造瘘管与鼻肠管在胸腹腔镜联合食管癌手术患者肠内营养应用的效果比较[J]. 中华现代护理杂志, 2017, 23(11): 1482-1485. DOI:10.3760/cma.j.issn.1674-2907.2017.11.007 |
| [15] | Leijdesdorff HA, van Dijck JT, Krijnen P, et al. Injury pattern, hospital triage, and mortality of 1250 patients with severe traumatic brain injurycaused by road traffic accidents[J]. J Neurotrauma, 2014, 31(5): 459-465. DOI:10.1089/neu.2013.3111 |
| [16] | Gwj H, Ullman JS, Totten AM, et al. In Reply: Guidelines for the Management of Severe Traumatic Brain Injury, Fourth Edition[J]. Neurosurgery, 2017, 81(1): 6-15. DOI:10.1227/NEU.0000000000001432 |
| [17] | 冯玉峰, 叶宏伟, 许春阳, 等. PEG-J在重型颅脑损伤患者中呼吸机相关性肺炎发生率的应用研究[J]. 南京医科大学学报,, 2014, 34(12): 1719-1720. DOI:10.7655/NYDXBNS20141228 |
| [18] | 冯玉峰, 钱建清, 温顺, 等. 置管术行营养支持在重度AECOPD患者中的临床应用[J]. 肠外与肠内营养, 2015, 22(5): 288-290. DOI:10.16151/j.1007-810x.2015.05.010 |
| [19] | 冯玉峰, 钱建清, 俞隼, 等. 经皮内镜下胃空肠造瘘对重症患者呼吸机相关肺炎发生率的影响[J]. 中华临床营养杂志, 2017, 25(2): 90-93. DOI:10.3760/cma.j.issn.1674-635X.2017.02.005 |
| [20] | 陈飞翔, 徐超, 张存海. 重型颅脑损伤机械通气患者留置鼻肠管进行肠内营养的效果分析[J]. 中华危重病急救医学, 2018, 30(1): 57-60. DOI:10.3760/cma.j.issn.2095-4352.2018.01.011 |
| [21] | Baskin WN. Acute complications associated with bedside placement of feeding tubes[J]. Nutr Clin Pract, 2006, 21(1): 40-55. DOI:10.1177/011542650602100140 |
| [22] | Segadilha NL, Rocha EE, Tanaka LM, et al. Energy expenditure in critically ill elderly patients: indirect calorimetry vs predictive equations[J]. JPEN J Parenter Enteral Nutr, 2017, 41(5): 776-784. DOI:10.1177/0148607115625609 |
| [23] | Oshima T, Berger MM, De Waele E, et al. Indirect calorimetry in nutritional therapy: a position paper by the ICALIC study group[J]. Clin Nutr, 2017, 36(3): 651-662. DOI:10.1016/j.clnu.2016.06.010 |
 2018, Vol. 27
2018, Vol. 27




