2 200092 上海,上海交通大学医学院附属新华医院肾内科
2. Department of Nephrology, Shanghai 200092, China
脓毒症是因感染引起宿主反应失调而导致危及生命的器官功能障碍[1]。尽管脓毒症发病机制仍不明确,但越来越多的证据表明氧化系统与抗氧化系统失衡导致的氧化应激是脓毒症发生的重要诱发因素。临床上,脓毒症患者易出现应激性高血糖,这可能是由于胰岛β细胞内抗氧化酶水平较低,易受氧化应激损伤所致[2]。
脂多糖(lipopolysaccharide,LPS)是革兰阴性菌细胞壁的组成成分,是内毒素发挥作用和脓毒症发病的主要因素[3]。Toll样受体4(Toll like receptor 4,TLR4)作为一种模式识别受体(pattern recognition receptor,PRR),参与LPS信号传导到胞内,介导炎症发生[4]。沉默信息调节因子(silent mating type information regulation 2 homolog 1, SIRT1)是一种依赖酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的组蛋白/非组蛋白去乙酰化酶,通过抑制TLR4/NF-κB信号通路减少促炎因子产生[5],或通过去乙酰化其下游靶因子参与DNA损伤修复,抑制细胞凋亡,促进线粒体的生成[6]。其中叉头框蛋白1(fork head transcription factor1,FoxO1)是SIRT1下游的重要靶蛋白,其乙酰化水平的改变参与改善胰岛素抵抗,影响线粒体功能[7]。研究指出线粒体损伤可能与抗氧化物酶活性降低,活性氧生成过多,线粒体功能蛋白活性改变有关[8-9]。本实验通过使用SIRT1激动剂RSV和SIRT1抑制剂EX527干预SIRT1的活性,探究SIRT1对LPS诱导的胰岛素瘤细胞-1(insulinoma cell lines-1, INS-1)线粒体损伤的作用,为临床治疗脓毒症及其并发症,尤其是应激性糖尿病,提供新的治疗思路。
1 材料与方法 1.1 细胞培养INS-1细胞培养于含10%胎牛血清(Gibco公司,美国)、1 mmol/L丙酮酸钠(Gibco公司,美国)、10 mmol/L HEPES(Gibco公司,美国)、50 μmol/L β-巯基乙醇(Gibco公司,美国)、100 U/mL青霉素(Gibco公司,美国),100 μg/mL链霉素(Gibco公司,美国),10 mmol/L谷氨酰胺(Sigma公司,美国)的RPMI 1640培养基(Gibco公司,美国)中,将培养皿置于37 ℃饱和湿度、5% CO2培养箱中。
1.2 CCK8检测INS-1细胞活力取对数生长的细胞,按1×104个/孔的密度接种于96孔板,细胞密度达80%左右,分别设置调零组(不含细胞)、对照组、LPS组、LPS+RSV组、LPS+EX527组和EX527+RSV+LPS组,每组3个复孔,按不同处理组加入10 mL CCK8检测试剂,药物处理1.5 h后,在酶标仪于450 nm波长测定吸光度值,计算细胞存活率=(加药组平均A值-调零组平均A值)/(对照组平均A值-调零组平均A值)×100%。
1.3 ATP水平检测根据以上分组处理,加入适量裂解液裂解细胞。4 ℃,12 000 g,离心5 min,取上清液。配置一定浓度梯度的ATP标准溶液。测定ATP浓度,加100 μL ATP检测工作液到检测孔或检测管内,室温放置4 min,再加入20 μL样品或标准品,立即上机检测。
1.4 细胞质蛋白和线粒体蛋白分离胰酶消化INS-1细胞,室温离心,200 g,10 min收集细胞, 加入线粒体裂解液。用预冷的PBS轻轻重悬细胞沉淀,弃上清液。加入1.5 mL含有PMSF的线粒体分离试剂,轻轻悬浮细胞,冰浴放置15 min,把细胞悬液转移到玻璃匀浆器中,细胞匀浆在600 g、4 ℃离心10 min。小心把上清液转移到另一离心管中,在11 000 g、4 ℃离心10 min。收集上清液,即为胞质蛋白,沉淀即为分离得到的细胞线粒体蛋白。
1.5 Western Blot法检测蛋白表达取对数生长期细胞,将细胞按1×106个/皿的密度提前一天接种到6 cm2的培养皿中,根据上述分组进行处理,加入适量裂解液,冰上裂解10 min,4 ℃,12 000 r/min,离心10 min,取上清液,加入蛋白上样缓冲液,收集蛋白。恒压电泳,300 mA恒流转膜,封闭液室温封闭,孵育一抗SIRT1(1:1 000)(CST公司,美国,#9475),TLR4(1:200)(Santa Cruz公司,美国,sc-293072),乙酰化FoxO1(1:100)(CST公司,美国,sc-374427),CytC(1:200)(碧云天公司,中国,AC909),COXⅣ(1:1 000)(碧云天公司,中国,AC610),Mfn1(1:500)(Norus公司,美国,NBP1-51841SS),Mfn2(1:1 000)(CST公司,美国,9482S),Fis1(1:500)(Norus公司,美国,NBP100-56646)过夜。TBST轻洗3次,10 min/次,室温孵育辣根过氧化物酶标记山羊抗鼠/兔抗体(碧云天公司,中国)1 h, TBST洗3次,10 min/次,滴加ECL超敏发光液,于成像仪下显影。
1.6 Real-time PCR取对数生长期的INS-1细胞,按1×106个/皿的密度将细胞接种到六孔板中,根据上述分组进行处理。提取RNA,用分光光度仪检测RNA浓度,A260/A280=1.8~2.2,计算反转录上样体积=1 000 ng/C。向PCR管中加入反应物,20 μL体系,37 ℃,15 min,85 ℃,5 s。向八联管中加入反应物,20 μL体系,设置扩增条件。引物序列见表 1。
| 基因 | 正向引物(5'→3') | 反向引物(5'→3') |
| GAPDH | TCTCTGCTCCTCCCTGTTC | ACACCGACCTTCACCATCT |
| SIRT1 | TACCAGAACAGTTTCATAGAGCCAT | CAAAATGTAGATGAGGCAGAGGTT |
| FoxO1 | CCGGAGTTTAACCAGTCCAA | TGCTCATAAAGTCGGTGCTG |
| MFN1 | AGATAATGCAGCCCAGGAAGAG | GCACGAGTAGTCCAAGTCAGT |
| MFN2 | CGTCAAGAAGGATAAGCGACAC | CAACCCGCAGGAAGCAAT |
| Fis1 | ATCCGTAGAGGCATCGTG | GGGAGGAGGAAGAGCAGA |
实验数据用SPSS 23软件进行统计学分析,计量资料以均数±标准差(x±s)表示。多组间比较采用单因素方差分析,用LSD-t法进行组间两两比较,以P < 0.05为差异有统计学意义。
2 结果 2.1 CCK8法检测INS-1细胞活性如图 1,与对照组比较,1 mg/L LPS刺激INS-1细胞24 h后细胞活力明显下降,吸光度值约为对照组的0.56±0.13(P < 0.01),EX527+LPS组和EX527+RSV+LPS组细胞活力下降,吸光度值约分别是对照组的0.49±0.08、0.48±0.07(P < 0.01);与LPS组比较,RSV预处理可以增强INS-1细胞的活力,吸光度值约为LPS组的1.41倍(P < 0.01),但是EX527预处理后与LPS组比较,差异无统计学意义(P > 0.05),且RSV不能增强EX527诱导的细胞活性的降低(P > 0.05)。
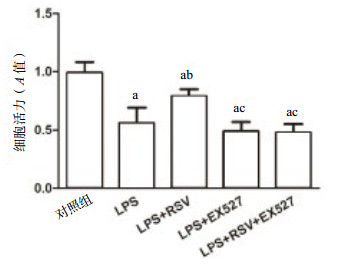
|
| 与对照组比较,aP < 0.01;与LPS组比较,bP < 0.01;与RSV+LPS组比较,cP < 0.01 图 1 CCK8法检测各组INS-1细胞活性 Figure 1 The activity of INS-1 cells in each group detected by CCK8 method |
|
|
通常细胞在凋亡、坏死或处于一些毒性状态下,ATP水平会下降,表明线粒体的功能受损或下降。如图 2示,与对照组ATP(187.82±38.96)nmol/μg比较,LPS组、EX527+LPS组和EX527+RSV+LPS组ATP生成减少[(119.21±14.13)nmol/μg、(90.43±14.38)nmol/μg、(89.09±20.44)nmol/μg,P < 0.05]。与LPS组比较,RSV预处理后能改善LPS诱导的ATP生成减少(250.47±17.42),(P < 0.01),EX527组和EX527+RSV+LPS组ATP生成较对照组减少,但这两组间差异无统计学意义(P > 0.05)。
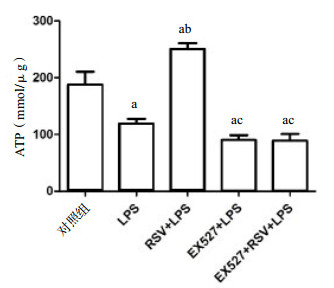
|
| 与对照组比较,aP < 0.05;与LPS组比较,bP < 0.01;与RSV+LPS组比较,cP < 0.01 图 2 不同处理组ATP产生比较 Figure 2 Comparison of ATP production in different treatment groups |
|
|
10 μmol/L RSV、20 μmol/L EX527分别预处理1 h后,加入1 mg/L LPS培养INS-1细胞24 h,检测相关蛋白表达。图 3所示,与对照组比较,LPS诱导INS-1细胞SIRT1表达降低,TLR4和FoxO1乙酰化水平增加(P < 0.01),EX527组和EX527+RSV+LPS组也出现SIRT1表达降低,TLR4和乙酰化FoxO1表达增加(P < 0.01)。RSV预处理可以逆转LPS诱导的SIRT1、TLR4、乙酰化FoxO1蛋白表达的改变(P < 0.01),但并不能逆转EX527预处理后LPS诱导的蛋白改变(P > 0.05)。
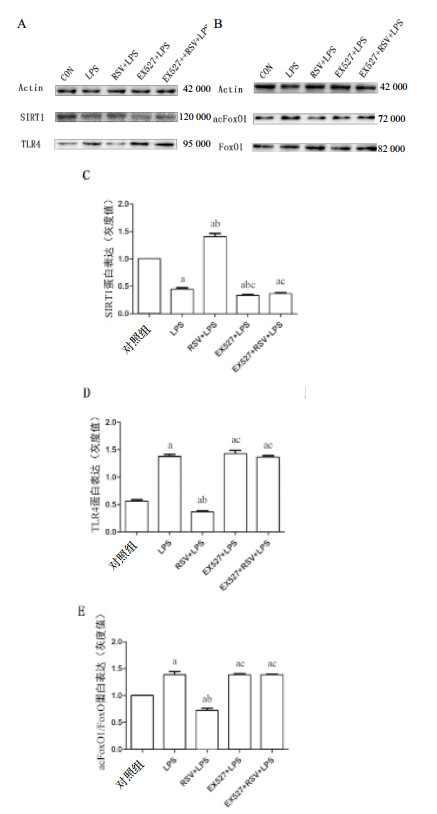
|
| 与对照组比较,aP < 0.05;与LPS组比较,bP < 0.01;与RSV+LPS组比较,cP < 0.01 图 3 蛋白印迹法检测SIRT1、TLR4、acFoxO1蛋白表达 Figure 3 The protein expression of SIRT1, TLR4 and acFoxO1 was detected by Western-blot |
|
|
10 μmol/L RSV、20 μmol/L EX527分别预处理1 h后,加入1 mg/L LPS培养INS-1细胞24 h,检测相关蛋白表达。图 4所示,与对照组比较,LPS组、EX527组、EX527+RSV+LPS组有大量CytC释放入细胞质(P < 0.01),而RSV预处理后CytC在细胞质的表达减少。与LPS组比较,RSV可以减少LPS诱导CytC释放入细胞质(P < 0.01)。EX527预处理后也诱导CytC大量释放入细胞质(P < 0.01),但是RSV却能逆转EX527预处理后LPS诱导的CytC在细胞质的释放,EX527+LPS组和EX527+RSV+LPS组差异有统计学意义(P < 0.01)。
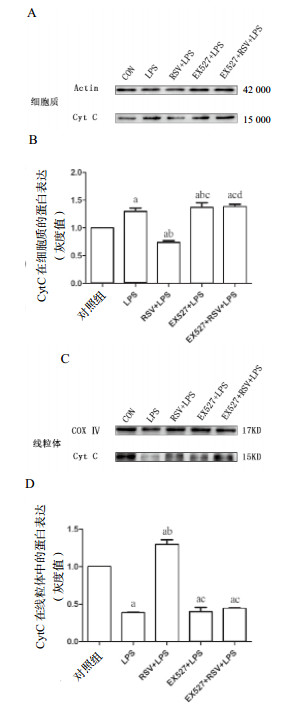
|
| 与对照组比较,aP < 0.01;与LPS组比较,bP < 0.01;与RSV+LPS组比较,cP < 0.01;与EX527+LPS组比较,dP < 0.01 图 4 蛋白印迹法检测细胞色素C在细胞质和线粒体内表达 Figure 4 Analysis of Cytochrome C protein expression in cytoplasmand mitochondria |
|
|
10 μmol/L RSV、20 μmol/L EX527分别预处理1 h后,加入1 mg/L LPS培养INS-1细胞24 h,检测相关蛋白表达。图 5所示,与对照组比较,LPS组、EX527+LPS组、EX527+RSV+LPS组Mfn1、Mfn2表达减少,Fis1增加,RSV预处理可以增加Mfn1、Mfn2表达,减少Fis1表达(P < 0.01)。RSV预处理后可以逆转LPS诱导的Mfn1、Mfn2表达的降低和Fis1的增加(P < 0.01)。EX527+LPS组和EX527+RSV+LPS组除了Mfn2表达降低(P < 0.01)外,Mfn1和Fis1的蛋白表达与LPS组比较,差异无统计学意义(P > 0.05),说明Mfn2可能参与LPS介导INS-1细胞线粒体的炎症信号传导。
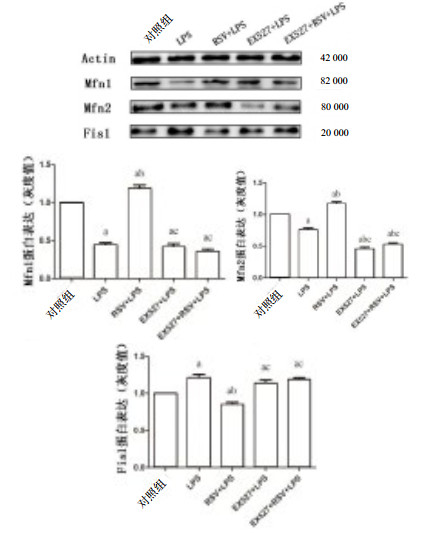
|
| 与对照组比较,aP < 0.01;与LPS组比较,bP < 0.01;与RSV+LPS组比较,cP < 0.01 图 5 蛋白印迹法检测线粒体功能蛋白表达 Figure 5 Mitochondrial functional protein expression detected by Western-blot |
|
|
10 μmol/L RSV、20 μmol/L EX527分别预处理1 h后,加入1 mg/L LPS培养INS-1细胞24 h检测相关基因表达。如图 6所示,与对照组比较,LPS组、EX527组、EX527+RSV+LPS组LPS作用后SIRT1、Mfn1、Mfn2基因水平下调,FoxO1、Fis1基因水平上调(P < 0.01),RSV预处理后能上调SIRT1、Mfn1基因水平(P < 0.01)。与LPS组比较,RSV组SIRT1、Mfn1、Mfn2基因水平上调,FoxO1、Fis1基因水平下调(P < 0.01),EX527+RSV+LPS组的Mfn2基因水平下调(P < 0.05),Fis1在EX527+LPS组和EX527+RSV+LPS组间差异有统计学意义(P < 0.01)。
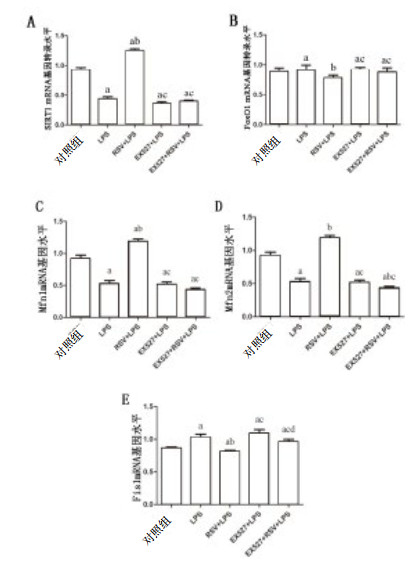
|
| 与对照组比较,aP < 0.01;与LPS组比较,bP < 0.05;与RSV+LPS组比较,cP < 0.01;与EX527+LPS组比较,dP < 0.01 图 6 Real-time PCR检测SIRT1, FoxO1及线粒体功能相关基因 Figure 6 Real-time PCR for detection of SIRT1, FoxO1 and mitochondrial function-related genes |
|
|
多种原因所致的氧化应激损伤是脓毒症发生的关键环节,最终导致器官功能障碍,其中应激性高血糖是临床上脓毒症最常见的并发症之一。经研究证明,LPS促使大量ROS生成,诱导氧化应激产生[10]。胰岛β细胞是LPS作用的靶细胞,当LPS作用于胰岛β细胞时,细胞易受氧化应激的影响,释放过多促炎介质,影响细胞炎症、免疫、能量代谢等生理过程。线粒体作为活性氧类、能量代谢的主要场所,其功能改变与脓毒症所致的器官功能障碍密切相关[11]。研究LPS诱导的氧化应激对INS-1细胞线粒体功能的影响对脓毒症及其并发症应激性高血糖的预防与治疗具有重要意义。
SIRT1是NAD+依赖的组蛋白去乙酰化酶,通过去乙酰化作用于组蛋白及多种细胞转录调控因子,参与细胞凋亡、代谢、线粒体生物合成等过程。目前对SIRT1的研究多集中于其部分参与各种信号通路,对机体的氧化损伤发挥一定的保护作用。如Sin等[7]的研究发现SIRT1可能通过去乙酰化作用抑制FoxO1,增加细胞对胰岛素的敏感性,保护线粒体功能。也有研究指出Sirtuins其他家族成员如SIRT2也能够减轻线粒体损伤,改善胰岛素敏感性[12]。SIRT3能够保护多巴胺能神经元免受线粒体氧化应激损伤[13]。因而Sirtuins家族可能在氧化应激过程中存在协同作用,更好地保护细胞功能。本课题组先前的研究[14]发现抑制Toll样受体4能够保护大鼠胰岛细胞免受LPS诱导的功能障碍。本实验发现,与对照组相比,LPS诱导INS-1细胞活力降低,细胞内TLR4的表达增加,EX527预处理后,细胞活力降低,TLR4的表达有增加,可能与SIRT1活性被抑制有关。RSV预处理后逆转了LPS诱导的TLR4表达的升高,可能是由于SIRT1激活,抑制了炎症信号的传导。但EX527预处理后,RSV不能激活活性已被抑制的SIRT1,炎症信号被激活,介导LPS对INS-1细胞的损伤作用。这与Wang等[15]的研究RSV通过抑制TLR4/NF-κB p65/MAPKs信号级联反应减轻LPS诱导的急性炎症的结果一致。本研究中还发现,LPS诱导FoxOl发生乙酰化,EX527预处理后也出现了FoxOl乙酰化,但RSV并不能降低EX527预处理后FoxOl的乙酰化水平,可能是由于EX527预处理后抑制SIRT1的活性,RSV不能发挥对FoxOl的去乙酰化作用,导致炎症反应发生。由此推测SIRT1活性的改变可能参与LPS作用下FoxOl乙酰化水平的改变,进而影响细胞对炎症的应激反应。Zhang等[16]的研究也证明抑制SIRT1活性后,促进FoxOl乙酰化结果。但也有研究显示RSV通过激活SIRT1去磷酸化FoxO1改善小鼠的肾损伤,这说明SIRT1还可能通过对FoxO1不同化学修饰的调控保护机体[17]。
线粒体是调节能量产生、细胞凋亡和钙稳态的重要多功能细胞器,许多疾病和病症的发病机制都涉及有线粒体功能障碍。线粒体的不断更新对维持线粒体功能稳态至关重要,通过去除损伤的线粒体, 线粒体生成和形态学改变,如分裂和融合,以维持细胞中线粒体质量。研究表明, 一旦线粒体融合与分裂的功能出现缺陷或其平衡受到干扰, 会导致诸多疾病, 如糖尿病、神经退行性疾病等[18-19]。有实验证实抑制线粒体分离或促进线粒体融合对鱼藤酮诱导的神经毒性具有保护作用,也促进线粒体生成[20]。本研究中探讨了在LPS诱导的氧化应激作用下,INS-1细胞线粒体的功能改变与SIRT1活性之间的联系。本实验中与对照组相比,LPS组,EX527+LPS组和EX527+RSV+LPS组的ATP生成减少,可能与LPS激活炎症通路,EX527预处理后抑制SIRT1活性,细胞能量代谢发生异常有关。RSV预处理后可能通过激活SIRT1逆转LPS诱导的ATP降低,却不能逆转EX527诱导的ATP生成的减少,可见SIRT1活性的抑制阻碍了RSV发挥抵御炎症损伤,保护细胞的作用。这与Li等[21]的研究敲除SIRT1后降低细胞ATP产生的结果一致。紧接着本实验通过Western-blot和Real-time PCR检测线粒体融合和分离相关蛋白表达和基因水平探究SIRT1在LPS诱导INS-1细胞线粒体动态维持中的作用。与对照组相比,LPS诱导线粒体融合蛋白Mfn1、Mfn2表达减少,线粒体分离蛋白Fis1表达增加。EX527预处理后,也出现融合蛋白Mfn1、Mfn2的减少,线粒体分离蛋白Fis1表达增加。RSV预处理后逆转了LPS诱导的Mfn1、Mfn2的表达降低和Fis1的表达增加。这说明RSV激活SIRT1后,可能通过增加线粒体融合,减少线粒体分裂,而维持线粒体分离与融合的动态平衡,保护线粒体功能,然而RSV却不能改善EX527预处理后LPS诱导的INS-1细胞融合和分离的失衡,这说明EX527的预处理预先抑制了SIRT1的活性,RSV不能通过激活SIRT1抵抗LPS诱导的线粒体功能障碍。基因水平上,与对照组比较,LPS诱导线粒体融合基因Mfn1、Mfn2下调,上调线粒体分离基因Fis1水平。RSV预处理后逆转了LPS诱导的线粒体功能相关基因水平的改变,却不能逆转EX527预处理后诱导的Mfn1、Mfn2基因水平下调,而线粒体分离基因Fis1水平却有下调。因而推测RSV通过激活SIRT1,调控促进线粒体融合基因Mfn1、Mfn2上调,抑制线粒体分离基因Fis1的上调,以维持线粒体融合和分离的动态平衡,抵御LPS导致的线粒体功能障碍。这与Peng等[22]的研究RSV可以通过调控线粒体生物发生和裂变/融合的动态平衡以减弱鱼藤酮诱导的神经毒性相一致。但是,有关参与氧化应激过程线粒体分离和融合的蛋白还有很多[23],且线粒体融合蛋白Mfn2还参与内质网应激过程[24],因而选择有效的靶点干预线粒体功能,可能为逆转脓毒症进程,提供更为有效的治疗手段。
综上所述,本研究发现RSV预处理后可能通过激活SIRT1,使FoxO1去乙酰化,降低TLR4表达,参与维持线粒体融合和分离的动态平衡,保护INS-1细胞免受LPS诱导的线粒体损伤。因此研究SIRT1对LPS诱导的INS-1细胞线粒体损伤中的作用可能为今后脓毒症及其并发症尤其是应激性糖尿病提供更夯实的理论基础。
| [1] | Shankar-Hari M, Phillips GS, Levy ML, et al. Developing a new definition and assessing new clinical criteria for septic shock: for the third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 775-787. DOI:10.1001/jama.2016.0289 |
| [2] | Lenzen S, Drinkgern J, Tiedge M. Low antioxidant enzyme gene expression in pancreatic islets compared with various other mouse tissues[J]. Free Radic Biol Med, 1996, 20(3): 463-466. DOI:10.1016/0891-5849(96)02051-5 |
| [3] | Wang Y, Wang Y, Yang D, et al. β1-adrenoceptor stimulation promotes LPS-induced cardiomyocyte apoptosis through activating PKA and enhancing CaMKII and IκBα phosphorylation[J]. Crit Care, 2015, 19(1). DOI:10.1186/s13054-015-0820-1 |
| [4] | Zhang Z, Amorosa LF, Coyle SM, et al. Insulin-dependent regulation of mTORC2-Akt-FoxO suppresses TLR4 signaling in human leukocytes: relevance to type 2 diabetes[J]. Diabetes, 2016, 65(8): 2224-2234. DOI:10.2337/db16-0027 |
| [5] | Lin QQ, Geng YW, Jiang ZW, et al. SIRT1 regulates lipopolysaccharide-induced CD40 expression in renal medullary collecting duct cells by suppressing the TLR4-NF-kappaB signaling pathway[J]. Life Sci, 2016, 170: 100-107. DOI:10.1016/j.lfs.2016.11.026 |
| [6] | Tang BL. Sirt1 and the Mitochondria[J]. Mol Cells, 2016, 39(2): 87-95. DOI:10.14348/molcells.2016.2318 |
| [7] | Sin TK, Yung BY, Siu PM. Modulation of SIRT1-Foxo1 signaling axis by resveratrol: implications in skeletal muscle aging and insulin resistance[J]. Cell Physiol Biochem, 2015, 35(2): 541-552. DOI:10.1159/000369718 |
| [8] | 李莉, 严静, 陈昌勤, 等. 线粒体损伤在脓毒症大鼠心肌细胞凋亡中的作用[J]. 中华急诊医学杂志, 2012, 21(11): 1221-1225. DOI:10.3760/cma.j.issn.1671-0282.2012.11.009 |
| [9] | 康元元, 史佳, 余剑波, 等. CORM-2通过p38MAPK信号通路对脂多糖刺激大鼠肺巨噬细胞中线粒体分裂蛋白Fis1的影响[J]. 中华急诊医学杂志, 2017, 26(4): 401-404. DOI:10.3760/cma.j.issn.1671-0282.2017.04.009 |
| [10] | Kim YS, Kim EK, Jeon NJ, et al. Antioxidant effect of taurine-rich paroctopus dofleini extracts through inhibiting ros production against lps-induced oxidative stress in vitro and in vivo model[J]. Adv Exp Med Biol, 2017, 975: 1165-1177. DOI:10.1007/978-94-024-1079-2_93 |
| [11] | 张卉, 李春盛, 姚咏明. 脓毒症线粒体功能障碍及其干预对策[J]. 中华急诊医学杂志, 2018, 27(2): 117-119. DOI:10.3760/cma.j.issn.1671-0282.2018.02.001 |
| [12] | Lemos V, de Oliveira RM, Naia L, et al. The NAD+-dependent deacetylase SIRT2 attenuates oxidative stress and mitochondrial dysfunction and improves insulin sensitivity in hepatocytes[J]. Hum Mol Genet, 2017, 26(21): 4105-4117. DOI:10.1093/hmg/ddx298 |
| [13] | Shi H, Deng HX, Gius D, et al. Sirt3 protects dopaminergic neurons from mitochondrial oxidative stress[J]. Hum Mol Genet, 2017, 26(10): 1915-1926. DOI:10.1093/hmg/ddx100 |
| [14] | Wang X, Ge QM, Bian F, et al. Inhibition of TLR4 protects rat islets against lipopolysaccharide-induced dysfunction[J]. Mol Med Rep, 2017, 15(2): 805-812. DOI:10.3892/mmr.2016.6097 |
| [15] | Wang G, Hu Z, Fu Q, et al. Resveratrol mitigates lipopolysaccharide-mediated acute inflammation in rats by inhibiting the TLR4/NF-kappaBp65/MAPKs signaling cascade[J]. Sci Rep, 2017, 7: 45006. DOI:10.1038/srep45006 |
| [16] | Zhang M, Zhang Q, Hu Y, et al. miR-181a increases FoxO1 acetylation and promotes granulosa cell apoptosis via SIRT1 downregulation[J]. Cell Death Dis, 2017, 8(10): e3088. DOI:10.1038/cddis.2017.467 |
| [17] | Macek P, Lebez D. Isolation and characterization of three lethal and hemolytic toxins from the sea anemone Actinia equina L[J]. Toxicon, 1988, 26(5): 441-451. DOI:10.1016/0041-0101(88)90183-3 |
| [18] | Abramov AY, Berezhnov AV, Fedotova EI, et al. Interaction of misfolded proteins and mitochondria in neurodegenerative disorders[J]. Biochem Soc Trans, 2017, 45(4): 1025-1033. DOI:10.1042/bst20170024 |
| [19] | Kim MK, Shin HM, Jung H, et al. Comparison of pancreatic beta cells and alpha cells under hyperglycemia: Inverse coupling in pAkt-FoxO1[J]. Diabetes Res Clin Pract, 2017, 131: 1-11. DOI:10.1016/j.diabres.2017.05.017 |
| [20] | Peng K, Yang L, Wang J, et al. The interaction of mitochondrial biogenesis and fission/fusion mediated by pgc-1alpha regulates rotenone-induced dopaminergic neurotoxicity[J]. Mol Neurobiol, 2017, 54(5): 3783-3797. DOI:10.1007/s12035-016-9944-9 |
| [21] | Li P, Liu Y, Burns N, et al. SIRT1 is required for mitochondrial biogenesis reprogramming in hypoxic human pulmonary arteriolar smooth muscle cells[J]. Int J Mol Med, 2017, 39(5): 1127-1136. DOI:10.3892/ijmm.2017.2932 |
| [22] | Peng K, Tao Y, Zhang J, et al. Resveratrol regulates mitochondrial biogenesis and fission/fusion to attenuate rotenone-induced neurotoxicity[J]. Oxid Med Cell Longev, 2016, 2016: 6705621. DOI:10.1155/2016/6705621 |
| [23] | Zhao G, Cao K, Xu C, et al. Crosstalk between mitochondrial fission and oxidative stress in paraquat-induced apoptosis in mouse alveolar type II cells[J]. Int J Biol Sci, 2017, 13(7): 888-900. DOI:10.7150/ijbs.18468 |
| [24] | Ngoh GA, Papanicolaou KN, Walsh K. Loss of mitofusin 2 promotes endoplasmic reticulum stress[J]. J Biol Chem, 2012, 287(24): 20321-20332. DOI:10.1074/jbc.M112.359174 |
 2018, Vol. 27
2018, Vol. 27




