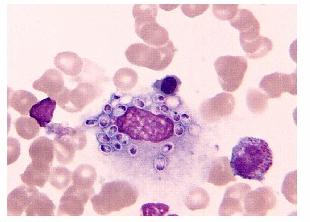
患者中年男性,主因“间断发热伴黄疸3个半月”于2016年9月1日转入北京大学人民医院ICU。患者3个半月前无明显诱因出现发热伴皮肤、巩膜黄染,最高体温39.8 ℃,伴纳差、恶心、呕吐、上腹疼痛,有排便排气,院外实验室检查示肝功能损伤、胆红素代谢异常、血CMV-IgM阳性,肝穿刺示“肝细胞核内有巨细胞病毒包涵体”,诊断为“巨细胞病毒性肝炎”,给予抗病毒及对症支持治疗,肝功能改善、黄疸减轻,但仍间断发热。病程中逐渐出现急性肾损伤、贫血、血小板减少症,行骨髓穿刺示“吞噬细胞内可见形似杜氏利什曼原虫物质”,临床考虑为“黑热病”转入北京大学人民医院ICU。既往史:2型糖尿病15年,长期胰岛素控制血糖,血糖控制不良。否认药敏史。入科查体:T 38.6 ℃,P 94次/min,R 24次/min,BP 134/76 mmHg(1 mmHg=0.133 kPa)。神志清,贫血貌。巩膜轻微黄染。双肺呼吸音清。心率94次/min,律齐,心音可。腹软,上腹压痛,无反跳痛、肌紧张,肝脾未触及,移动性浊音阳性。双下肢中度可凹性水肿。入院后完善相关检查:血常规:白细胞6.71×109/L、中性粒细胞比例91.9%、血红蛋白63 g/L、血小板12×109/L、网织红细胞比例1.92%;生化:丙氨酸氨基转移酶21 U/L、天门冬氨酸氨基转移酶16 U/L、总胆红素29.5 μmol/L、直接胆红素22.6 μmol/L、血清总蛋白39.9 g/L、血清白蛋白23.6 g/L、总胆固醇3.25 mmol/L、尿素氮55.04 mmol/L、肌酐463 μmol/L;糖化血红蛋白8.5%;铁蛋白6 450 ng/mL;降钙素原10.55 ng/mL;脑钠肽223.5 pg/mL;DIC未见异常;胸片示双肺纹理增重、双侧少量胸腔积液可能;腹部超声示大量腹水;心脏超声示主动脉瓣轻度反流。为明确诊断将患者骨髓片送至北京市热带病研究所阅片后除外黑热病,遂于我科再次行骨穿,骨髓象示“骨髓增生活跃,可见大量荚膜组织胞浆菌,可见噬血细胞”(图 1),临床诊断为播散型组织胞浆菌病,噬血细胞综合征?。予伊曲康唑注射液静脉滴注200 mg,2次/d抗真菌,同时予输血、营养支持、纠正低蛋白血症、液体管理、控制血糖等综合治疗。2 d后患者出现急性左心衰,检测脑钠肽1 065 pg/mL,不能排除与使用伊曲康唑有关;遂停用伊曲康唑注射液改用注射用两性霉素B脂质体静脉滴注100 mg/d,患者心衰症状逐步缓解。据美国胸科学会发布的治疗指南[1],2周后将两性霉素B更换为伊曲康唑注射液静脉滴注200 mg,2次/d,患者接受伊曲康唑1 d后再次出现急性左心衰,检测脑钠肽804 pg/mL。
|
| 图 1 油镜下患者骨髓象见大量荚膜组织胞浆菌(瑞氏染色,×100) |
|
|
最终该患者经综合治疗病情平稳后于2016年10月13日出院,出院前复查血常规:白细胞7.7×109/L、血红蛋白91 g/L、血小板196×109/L;生化:血清总蛋白53.1 g、血清白蛋白28.2 g/L、尿素氮12.88 mmol/L、肌酐191 μmol/L;降钙素原0.89 ng/mL;骨髓象示“骨髓增生活跃,可见少量荚膜组织胞浆菌,可见噬血细胞”。
2 讨论组织胞浆菌病是指荚膜组织胞浆菌所引起的系统性真菌感染性疾病,该菌自然栖息地为富含鸟粪和蝙蝠粪便的土壤。该病临床表现与黑热病极为相似,诊断主要根据痰液、血液、骨髓、淋巴结穿刺及其他活检等标本中找到细胞内的酵母型菌,治疗主要选用两性霉素B或伊曲康唑[1]。
伊曲康唑是一种合成的唑类抗真菌药,在美国被批准用于治疗甲真菌病和严重的系统性真菌感染,如慢性肺曲霉菌病、球孢子菌病等[2-3]。新近的一些研究推荐其为免疫抑制疾病或状态的预防用药[4-5],其药物代谢动力学也已被详细阐述[6]。
伊曲康唑可导致剂量依赖性的不良反应,常见的为恶心、呕吐;当剂量 > 400 mg/d时可导致低钾血症、ALT及AST升高、胃肠道功能紊乱、皮疹等一系列不良反应[7-8]。一项纳入了645例使用伊曲康唑治疗皮肤孢子丝菌病的研究发现,伊曲康唑100 mg/d组临床不良事件发生率为18.1%,而200~400 mg/d组临床不良事件发生率增高至21.9%;两组最常见的不良反应均为恶心和上腹疼痛,心血管系统不良事件发生率极低[9]。
然而在临床使用过程中,相继有一些报道认为伊曲康唑可带来诸多心血管系统的不良事件,如充血性心衰[10]、高血压[8]、室早[11],甚至室颤[12]。但是,这些不良事件在临床中并不常见。以美国为例,自1992年9月到2001年4月FDA不良事件报告系统仅仅接收到59例可能与使用伊曲康唑相关的充血性心衰的病例报告。为确保用药安全,FDA建议临床医师对于合并左心室功能受损的患者禁用伊曲康唑;对于无禁忌证者在临床使用过程中要监测心衰的症状和体征[13]。事实上伊曲康唑及心衰之间的关系仍有争议[14],主要原因是临床上在使用伊曲康唑前排除无症状的器质性心脏病或潜在的心血管疾病是有困难的。
随着对伊曲康唑的认识逐步深入,一些动物实验及临床药理研究认为其存在负性肌力作用[10]。Qu等[15]研究认为伊曲康唑可降低心肌收缩力、减慢心率、减少冠脉血流、延长PR间期及QRS波群,提示伊曲康唑可能损害了心肌细胞或干扰了心肌细胞正常的电活动。在近期一份针对抗真菌药物不良反应的统计报告中,伊曲康唑被证实是唯一一个与充血性心衰存在依赖关系的药物[16]。本例患者入住ICU后积极控制感染,严格管理液体,两次心衰均在使用伊曲康唑后发生,检测症状发作时的BNP明显升高,更换抗真菌药物后心衰症状逐渐缓解,以上提示伊曲康唑为患者心衰发作的致病因素。
除心衰之外,Denolle等[17]认为伊曲康唑还可导致高血压,其机制可能与血清肾素水平升高有关。Fung等[18]报道了一例慢性坏死性肺曲霉病患者在使用伊曲康唑过程中猝死的病例,高度怀疑为恶性心律失常,并认为如果患者合并糖尿病或高血压等潜在危险因素,在使用伊曲康唑过程中更易出现心血管不良事件。因此,所有准备接受伊曲康唑治疗者,在治疗前均应该进行心脏功能评估。
目前,伊曲康唑导致心血管不良事件的发病机制并不清楚,由其导致的心肌损伤是否可逆也不清楚[19],尚需要更多的基础研究及临床研究提供证据支持。
| [1] | Limper AH, Knox KS, Sarosi GA, et al. An official American Thoracic Society statement: Treatment of fungal infections in adult pulmonary and critical care patients[J]. Am J Respir Crit Care Med, 2011, 183(1): 96-128. DOI:10.1164/rccm.2008-740ST |
| [2] | Denning DW, Cadranel J, Beigelman-Aubry C, et al. Chronic pulmonary aspergillosis: rationale and clinical guidelines for diagnosis and management[J]. Eur Respir J, 2016, 47(1): 45-68. DOI:10.1183/13993003.00583-2015 |
| [3] | Galgiani JN, Ampel NM, Blair JE, et al. 2016 Infectious Diseases Society of America (IDSA) clinical practice guideline for the treatment of coccidioidomycosis[J]. Clin Infect Dis, 2016, 63(6): e112-146. DOI:10.1093/cid/ciw360 |
| [4] | Pantziarka P, Sukhatme V, Bouche G, et al. Repurposing drugs in oncology (ReDO)-itraconazole as an anti-cancer agent[J]. Ecancermed icalscience, 2015, 9: 521. DOI:10.3332/ecancer.2015.521 |
| [5] | Lockhart NR, Waddell JA, Schrock NE. Itraconazole therapy in a pancreatic adenocarcinoma patient: a case report[J]. J Oncol Pharm Pract, 2016, 22(3): 528-532. DOI:10.1177/1078155215572931 |
| [6] | Bellmann R, Smuszkiewicz P. Pharmacokinetics of antifungal drugs: practical implications for optimized treatment of patients[J]. Infection, 2017, 45(6): 737-779. DOI:10.1007/s15010-017-1042-z |
| [7] | Tucker RM, Haq Y, Denning DW, et al. Adverse events associated with itraconazole in 189 patients on chronic therapy[J]. J Antimicrob Chemother, 1990, 26(4): 561-566. DOI:10.1093/jac/26.4.561 |
| [8] | Sharkey PK, Rinaldi MG, Dunn JF, et al. High-dose itraconazole in the treatment of severe mycoses[J]. Antimicrob Agents Chemother, 1991, 35(4): 707-713. DOI:10.1128/AAC.35.4.707 |
| [9] | de Lima Barros MB, Schubach AO, de Vasconcellos Carvalhaes de Oliveira R, et al. Treatment of cutaneous sporotrichosis with itraconazole--study of 645 patients[J]. Clin Infect Dis, 2011, 52(12): e200-206. DOI:10.1093/cid/cir245 |
| [10] | Ahmad SR, Singer SJ, Leissa BG. Congestive heart failure associated with itraconazole[J]. Lancet, 2001, 357(9270): 1766-1767. DOI:10.1016/S0140-6736(00)04891-1 |
| [11] | Okamoto J, Fukunami M, Kioka H. Frequent premature ventricular contractions induced by itraconazole[J]. Circ J, 2007, 71(8): 1323-1325. DOI:10.1253/circj.71.1323 |
| [12] | Nelson MR, Smith D, Erskine D, et al. Ventricular fibrillation secondary to itraconazole induced hypokalaemia[J]. J Infect, 1993, 26(3): 348. |
| [13] | Advisory for fungal drugs[J]. FDA Consum, 2001, 35(4): 4. |
| [14] | Slørdal L, Spigset O. Heart failure induced by non-cardiac drugs[J]. Drug Saf, 2006, 29(7): 567-586. DOI:10.2165/00002018-200629070-00003 |
| [15] | Qu Y, Fang M, Gao B, et al. Itraconazole decreases left ventricular contractility in isolated rabbit heart: mechanism of action[J]. Toxicol Appl Pharmacol, 2013, 268(2): 113-122. DOI:10.1016/j.taap.2013.01.029 |
| [16] | Hauben M, Hung EY. A quantitative analysis of the spontaneous reporting of congestive heart failure-related adverse events with systemic anti-fungal drugs[J]. J Clin Pharmacol, 2013, 53(7): 762-772. DOI:10.1002/jcph.84 |
| [17] | Denolle T, Azizi M, Massart C, et al. Itraconazole: a new drug-related cause of hypertension[J]. Ann Cardiol Angeiol(Paris), 2014, 63(3): 213-215. DOI:10.1016/j.ancard.2014.05.007 |
| [18] | Fung SL, Chau CH, Yew WW. Cardiovascular adverse effects during itraconazole therapy[J]. Eur Respir J, 2008, 32(1): 240. DOI:10.1183/09031936.00021208 |
| [19] | Okuyan H, Altın C. Heart failure induced by itraconazole[J]. Indian J Pharmacol, 2013, 45(5): 524-525. DOI:10.4103/0253-7613.117751 |
 2018, Vol. 27
2018, Vol. 27




