急性坏死性脑病(acute necrotizing encephalopathy,ANE)是一种罕见的儿童重症疾病,以急性发热为特征,常表现为进行性症状迅速发作,包括惊厥、呕吐、意识恶化、肝功能障碍,最终导致昏迷。1995年在日本首次报道,随后在全球范围内得到认可[1]。常发生在病毒感染后,多发生于流感季节,甲型流感(H1N1)是ANE最常见的相关病毒[2]。神经病理学上,病毒感染引起血脑屏障中的局灶性破坏,进展快,病死率高达30%[3]。每年11月到次年3月流感在全国范围内流行,存在ANE高发风险。目前国内尚未有流感高发季节的病例分析报告,现将10例ANE患儿的临床资料及预后报道如下。
1 资料与方法 1.1 一般资料纳入流感高发季节(2017年12月至2018年2月)陆续收治于浙江大学医学院附属儿童医院重症监护室的10例急性坏死性脑病患儿,入选标准:符合以下ANE诊断标准[1, 4]:①病毒感染后引起发热、意识障碍或惊厥,快速恶化的急性脑病; ②脑脊液白细胞计数正常,蛋白质增加; ③涉及双侧丘脑、脑干、脑室周围白质、内囊、壳核和小脑的多个对称脑病灶的神经影像学结果; ④不同程度的血清转氨酶升高,但无高氨血症和低血糖; ⑤排除类似的疾病(感染性、代谢性、中毒性、自身免疫性疾病) 。
1.2 观察指标分析10例急性坏死性脑病患儿的病史特点,观测入院24 h内的肝肾功能、心肌酶谱、血常规、超敏C反应蛋白、降钙素原、血培养、细胞因子、免疫球蛋白、补体、CD系列、脑脊液常规、脑脊液生化、脑脊液培养、血糖、血氨等相关实验室指标,完善流感A型、流感B型、流感A(H1、H3、H7、H9、H10)亚型病毒荧光定量RT-PCR检测以及呼吸道合胞病毒、副流感病毒(含1、2、3、4型)、腺病毒、肠道病毒、鼻病毒、冠状病毒(含OC43、229E、NL63、HKU1、SARS-CoV、MERS-CoV)、人卡博病毒、人偏肺病毒、多瘤病毒等常见呼吸道病毒荧光定量PCR/RT-PCR,并完善影像学资料包括头颅CT、头颅磁共振,分析动态脑电图及预后情况。
1.3 治疗方法患儿入院后常规给予危重症患儿监护,对于格拉斯评分3分或体温大于40 ℃的患儿给予变温毯进行亚低温脑保护,使肛温保持在34~35 ℃,既往研究报道认为糖皮质醇类可以改善脑干未受损患儿的预后[5],本组患儿均给予甲泼尼龙(10~20 mg/kg)及丙种球蛋白(1 g/d, 2 d)抑制炎症反应,以及甘露醇、3%氯化钠降颅压,咪唑安定止痉,奥司他韦抗病毒,脑苷肌肽营养神经,复方甘草酸苷注射液、注射用复合辅酶、注射用磷酸肌酸钠等辅助支持治疗。经治疗48 h后给予完善动态脑电图监测。
1.4 预后判定出院后1个月进行随访,按日常生活能力量表(Activity of daily living scale, ADL)评分功能进行预后判定。Ⅰ级(完全独立,完全恢复日常生活),Ⅱ级(轻度依赖,大部分恢复或可独立生活),Ⅲ级(中度依赖,需人帮助),Ⅳ级(重度依赖,卧床但保留意识),Ⅴ级(完全依赖,植物生存状态)。
2 结果 2.1 临床特点10例患儿,男5例,女5例,年龄6~80个月,(32.1±23.3)个月,均表现为发热、抽搐、昏迷,病初平均热峰在40.2 ℃,昏迷发生在平均病程的1.3 d内,入院昏迷评分平均为3.5分(表 1)。入院时5例患儿存在高热,3例患儿表现为低体温,体温正常2例。10例患儿均病情进展快,7例气管插管带入,2例入院后立即给予气管插管,1例患儿GCS评分6分,给予面罩吸氧未行气管插管。5例入院时存在休克表现,有高血钠、多尿表现,需使用肾上腺素维持血压,2例考虑预后差家属放弃治疗死亡,3例诊断脑死亡。2例入院24 h内死亡。3例存活。
| 序号 | 性别 | 年龄(月) | 发热 | 抽搐 | 昏迷 | GCS | 病原体 | 住院时间(d) | 愈后 |
| #1 | 男 | 63 | + | + | + | 3 | N | 89 | 脑死亡 |
| #2 | 女 | 81 | + | + | + | 6 | A/H1 | 12 | 存活 |
| #3 | 男 | 6 | + | + | + | 3 | Ev | 5 | 死亡 |
| #4 | 女 | 16 | + | + | + | 3 | A/H1 | 3 | 死亡 |
| #5 | 女 | 38 | + | + | + | 4 | A/H1 | 15 | 存活 |
| #6 | 女 | 27 | + | + | + | 3 | A/H1 | 38 | 脑死亡 |
| #7 | 男 | 33 | + | + | + | 3 | B | 1 | 死亡 |
| #8 | 女 | 22 | + | + | + | 4 | A/H1 | 15 | 存活 |
| #9 | 男 | 15 | + | + | + | 3 | N | 62 | 脑死亡 |
| #10 | 男 | 20 | + | + | + | 3 | A/H3 | 1 | 死亡 |
10例患儿入院前或入院时均积极完善头颅CT,头颅CT可见丘脑、基底节、脑干对称性低信号影(表 2)。4例患儿在入院后2~5 d完善头颅MRI,4例患儿头颅MRI提示病灶呈长T1长T2信号,FLAIR可见同心圆环状混杂信号(图 1)。通过完善呼吸道合胞病毒、肠道病毒、禽流感病毒核酸检测、支原体、衣原体、痰培养、血培养、脑脊液培养、尿培养病原学分析发现6例流感A阳性,5例核酸检测提示H1N1,1例核酸检测提示H1N3,1例流感B阳性,1例肠道病毒通用型阳性,2例相关病原学检测均阴性(表 1)。
| 序号 | CT | MRI | 脑电图 | |||||
| t1 | 水肿 | 灰白质 | 低密度影 | t2 | 结果 | |||
| #1 | 2 | 轻度 | 模糊 | 丘脑、脑干 | 5 | 图 1A | 1 | |
| #2 | 0 | 弥漫 | 尚清 | 丘脑 | 3 | 图 1B | 3 | |
| #3 | 0 | 弥漫 | 不清 | 丘脑、基底节 | 1 | |||
| #4 | 0 | 轻度 | 模糊 | 基底节、丘脑、脑干 | 1 | |||
| #5 | 1 | 弥漫 | 模糊 | 小脑 | 3 | 图 1C | 3 | |
| #6 | 1 | 弥漫 | 模糊 | 脑干 | 2 | |||
| #7 | 2 | 弥漫 | 模糊 | 丘脑、基底节 | 1 | |||
| #8 | 0 | 轻度 | 不清 | 丘脑、基底节 | 3 | 图 1D | 3 | |
| #9 | 0 | 轻度 | 模糊 | 基底节、小脑 | 1 | |||
| #10 | 0 | 弥漫 | 模糊 | 丘脑、脑干、基底节、小脑 | 1 | |||
| 注:t1为入院完成头颅CT的时间;t2为入院完成头颅MRI的时间;脑电图结果中1为动态脑电图监测提示电静息,2为动态脑电图提示持续性低电压,3为动态脑电图提示持续性慢波 | ||||||||
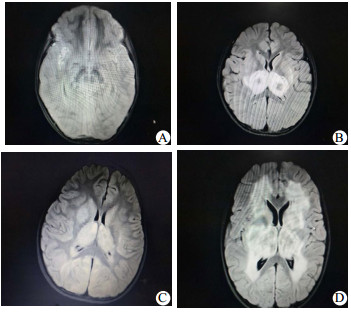
|
| A:病例1,患儿入院第3天诊断脑死亡,家属要求继续要求治疗,住院89天后家属自行联系康复科医院康复治疗;B:病例2,住院12天出院,没有遗留神经系统异常表现,出院时ADL评分Ⅰ级;C:病例5住院第3天拔出气管插管,住院15天出院,出院时神志转清,但不会讲话,有傻笑,需鼻饲喂养,康复中,ADL评分Ⅳ级;D:病例8,患儿住院第5天拔出气管插管,住院15天出院,出院仍处于昏迷中,昏迷评分7分,康复中,ADL评分Ⅳ级 图 1 四例患儿头颅磁共振结果 |
|
|
10例患儿实验室检查发现白细胞、超敏C反应蛋白升高不明显,尤其流感病毒阳性的患儿,且血小板计数偏低,10例患儿降钙素原均明显偏高,细胞因子检测发现IL-6、IL-10、INF-γ有升高,肿瘤坏死因子(TNF)均在正常范围内。IL-6值的中位数为1 120.4 pg/mL,IL-10值中位数为512.6 pg/mL,INF-γ值中位数为12.7 pg/mL。10例患儿均发现不同程度的肝肾功能、乳酸脱氢酶、肌酸激酶同工酶升高;免疫球蛋白、补体检测均在正常范围内,CD系列发现NK细胞降低;3例脑疝的患儿存在腰椎穿刺禁忌证未完善脑脊液检查,7例患儿完善脑脊液检查结果示脑脊液白细胞计数均正常,脑脊液蛋白明显增高(中位数为2 538 g/L)。
2.4 治疗及预后患儿入院后常规给予危重症患儿监护,亚低温脑保护,甲泼尼龙及丙种球蛋白抗炎治疗,降颅压、止惊、抗病毒、对症营养等支持治疗。入院常规亚低温治疗48 h后给予完善动态脑电图监测,3例存活的患儿脑电图提示持续性慢波,7例死亡的动态脑电图提示电静息或持续性低电压。该病死亡率高,10例患儿7例死亡,存活的3例患儿病原学均提示H1N1阳性,1例患儿未行气管插管,治疗10 d出院时无神经系统异常表现,预后断定ADL Ⅰ级。另外2例存活的患儿有严重的神经系统后遗症,目前在康复治疗,预后判定均为ADL Ⅳ级。
3 讨论急性坏死性脑病是一种急性、暴发性重症脑病,临床以高热、惊厥、意识障碍及对称性多灶性脑损害为特征,病死率高。ANE是一种罕见的疾病,其发病率在日本估计为每年约20人(人口约1.28亿)[6]。世界范围内已报道ANE,但主要报道这种疾病主要发生在东亚的婴幼儿[4, 7-9]。
儿童急性坏死性脑病(ANEC)是1995年由日本Mizughuchi等[1]报道的一种特定类型的脑病。发生在病毒感染后,可以通过丘脑、脑干、脑室周围白质和小脑的双侧对称损伤来诊断,最常见于脑干和丘脑[10],在头颅MRI中可以看到丘脑、脑干、脑室周围白质、核壳和小脑的双侧对称性病灶。神经病理学上,病毒感染引起血脑屏障中的局灶性破坏,临床表现为病毒感染后癫痫发作和意识改变,脑脊液细胞数目正常伴有蛋白水平升高是ANEC的临床特征。此外,ANEC可引起肝脏非特异性改变,肝血清转氨酶水平轻度升高,血氨水平正常,可作为实验室检查依据。
本组的10例患儿临床症状表现为感染后发热的1~3 d内出现神经功能迅速恶化,精神状态改变,迅速出现癫痫发作,从而进入昏迷状态,7例院外气管插管入科,2例入院后即刻需要呼吸机辅助呼吸。生化资料提示均存在不同程度的谷丙转氨酶、谷草转氨酶、肌酸激酶同工酶的升高。头颅影像学揭示了双侧丘脑的多灶性病变,此外,脑干、脑室、脑室周围白质和其他区域的变化可以存在。本组10例患儿均完善头颅CT,头颅CT都发现不同程度丘脑、基底节、脑干、小脑对称性低信号影;4例患儿完善头颅MRI,病灶呈长T1长T2信号,FLAIR可见同心圆环状混杂信号(图 1)。目前国内仅有个例报告,王华等[11]总结4例急性坏死性脑病,头颅MRI发现除了双侧丘脑对称性长T1、长T2信号外,大脑、小脑及脑干也有受累。
ANEC的病因目前仍不清楚,多见于5岁以下儿童,可能是环境因素与宿主因素共同参与。环境因素主要是病毒感染,最常见的是甲型、乙型流感病毒和人类疱疹病毒6型[4]。在副流感病毒,单纯疱疹病毒,肠道病毒、支原体和麻疹感染中也有报道[6, 12-17]。近期也有报道寨卡病毒导致ANEC[18]。本研究通过病原学检测分析发现6例流感A阳性,1例流感B阳性,1例肠道病毒阳性,2例相关病原学检测均阴性。本研究首次报道了国内急性坏死性脑病与流感病毒的相关性。国外已有报道急性坏死脑病常发生在病毒感染后,多发生于流感季节,甲型流感(H1N1)是ANE最常见的相关病毒[2]。
急性坏死性脑病是一种独特的疾病过程,导致患者受到类似的损伤,但这种疾病背后的病因仍然是一个谜。有研究认为,细胞因子的不受控制的产生“细胞因子风暴”,在ANE的发病机制中至关重要[9, 19]。细胞因子风暴引起血管内皮损伤和全身血管壁渗透性改变。这与ANE患者常有系统症状包括休克、急性肾功能衰竭或弥散性血管内凝血相一致。已有报道表明在与流感病毒感染相关的ANE急性期白细胞介素-6和肿瘤坏死因子(TNF)-α明显增加[20]。此外,已经证实TNF-α在各种神经炎症事件如脓毒症或细菌性脑膜炎中参与BBB通透性的改变[21]。本研究通过10例患儿细胞因子监测发现,IL-6、IL-10、INF-γ高出正常水平,TNF-α未见明显升高,PCT也明显增高。具体的发病机制仍需要进一步探讨。
ANEC进展快,病死率高,目前仍无特效治疗方法,主要包括免疫与抗细胞因子治疗,其他治疗包括重症监护、辅助支持治疗及抗病毒治疗。该病可能由感染后免疫介导的细胞因子风暴引起,因此免疫治疗,特别是抗细胞因子治疗有助于改善其预后,主要包括糖皮质激素、免疫球蛋白、血浆置换。Okumura等[22]考虑了高细胞因子血症在发病机制中的作用,并建议早期激素冲击治疗可能可有效治疗ANEC,并提出IVIG治疗无脑干病变的ANEC也有效。其他研究已经表明低温和早期抗细胞因子治疗在某些ANEC患者中的疗效[23]。Kumakura等[24]报道了一例8岁的女孩,伴有H1N1流感相关的急性坏死性脑病,颅脑MRI在惊厥20 h后发现丘脑、脑干、内囊和脑白质的病变。尽管如此,早期干预甲泼尼龙冲击疗法和高剂量丙种球蛋白治疗后,女孩几乎完全康复。Kawashima等[25]还报道一例在激素和血浆置换后迅速恢复的患者。本研究发现,急性期脑MRI的异常信号可能与致命的后果有关,但这些病例表明早期干预可能有助于改善结果。本组病例均早期给予甲泼尼龙(10~20 mg/kg)及丙种球蛋白(1 g/d, 2 d)抑制炎症反应,一例6岁9个月的女孩,双侧丘脑病灶严重,经过甲泼尼龙冲击治疗,免疫球蛋白、亚低温治疗,降颅压等支持治疗后,治疗12 d,患儿出院时无明显异常神经系统改变。另外2例虽然存活,但存在严重的神经系统后遗症,因此本病疾病恢复期还需予以康复治疗。
综上所述,本病进展快,需早期识别,应提高广大医生对流感相关性脑病的认识和重视,一旦确诊可考虑激素冲击治疗及丙种球蛋白应用。
| [1] | Mizuguchi M, Abe J, Mikkaichi K, et al. Acute necrotizing encephalopathy of childhood: a new syndrome presenting with multifocal, symmetric brain lesions[J]. J Neurol Neurosurg Psychiatry, 1995, 58(5): 555-561. DOI:10.1136/jnnp.59.6.661 |
| [2] | Surana P, Tang S, McDougall M, et al. Neurological complications of pandemic influenza A H1N1 2009 infection: European case series and review[J]. Eur J Pediatr, 2011, 170(8): 1007-1015. DOI:10.1007/s00431-010-1392-3 |
| [3] | Togashi T, Matsuzono Y, Narita M, et al. Influenza-associated acute encephalopathy in Japanese children in 1994-2002[J]. Virus Res, 2004, 103(1): 75-78. DOI:10.1016/j.virusres.2004.02.016 |
| [4] | Mizuguchi M. Acute necrotizing encephalopathy of childhood: a novel form of acute encephalopathy prevalent in Japan and Taiwan[J]. Brain Dev, 1997, 19(2): 81-92. DOI:10.1016/s0387-7604(96)00063-0 |
| [5] | Mizuguchi M, Hoshino A, Saitoh M. Chapter 12-Acute necrotizing encephalopathy[M]// Acute encephalopathy and encephalitis in infancy and its related disorders. Elsevier, 2018, 87-92, DOI: 10.1016/b978-0-323-53088-0.00012-9. |
| [6] | Hoshino A, Saitoh M, Oka A, et al. Epidemiology of acute encephalopathy in Japan, with emphasis on the association of viruses and syndromes[J]. Brain Dev, 2012, 34(5): 337-343. DOI:10.1016/j.braindev.2011.07.012 |
| [7] | Kim JH, Kim IO, Lim MK, et al. Acute necrotizing encephalopathy in Korean infants and children: imaging findings and diverse clinical outcome[J]. Korean J Radiol, 2004, 5(3): 171-177. DOI:10.3348/kjr.2004.5.3.171 |
| [8] | Lee CG, Kim JH, Lee M, et al. Clinical outcome of acute necrotizing encephalopathy in related to involving the brain stem of single institution in Korea[J]. Korean J Pediatr, 2014, 57(6): 264-270. DOI:10.3345/kjp.2014.57.6.264 |
| [9] | Wong AM, Simon EM, Zimmerman RA, et al. Acute necrotizing encephalopathy of childhood: correlation of MR findings and clinical outcome[J]. AJNR Am J Neuroradiol, 2006, 27(9): 1919-1923. |
| [10] | Mizuguchi M, Yamanouchi H, Ichiyama T, et al. Acute encephalopathy associated with influenza and other viral infections[J]. Acta Neurol Scand, 2007, 115(s186): 45-56. DOI:10.1111/j.1600-0404.2007.00809.x |
| [11] | 王华, 张晓纲, 周晓薇, 等. 急性坏死性脑病的诊断与鉴别诊断[J]. 中国小儿急救医学, 2006, 13(5): 443-445. DOI:10.3760/cma.j.issn.1673-4912.2006.05.017 |
| [12] | Lyon JB, Remigio C, Milligan T, et al. Acute necrotizing encephalopathy in a child with H1N1 influenza infection[J]. Pediatr Radio, 2010, 40(2): 200-205. DOI:10.15844/pedneurbriefs-24-8-3 |
| [13] | Sujay M, Kansagra MD, William B, et al. Cytokine storm of acute necrotizing encephalopathy[J]. Pediatr Neurol, 2011, 45(6): 400-402. DOI:10.1016/j.pediatrneurol.2011.09.007 |
| [14] | Gika AD, Rich P, Gupta S, et al. Recurrent acute necrotizing encephalopathy following Influenza A in a genetically predisposed family[J]. Dev Med Child Neurol, 2010, 52(1): 99-102. DOI:10.1111/j.1469-8749.2009.03405.x |
| [15] | Neilson DE, Adams MD, Orr CM, et al. Infection-triggered familial or recurrent cases of acute necrotizing encephalopathy caused by mutations in a component of the nuclear pore, RANBP2[J]. Am J Hum Genet, 2009, 84(1): 44-51. DOI:10.1016/s1090-3798(09)70307-1 |
| [16] | Weng WC, Peng SS, Lee WT. Acute necrotizing encephalopathy of childhood with spinal cord involvement: a case report[J]. J Child Neurol, 2010, 25(12): 1539-1541. DOI:10.1177/0883073810374877 |
| [17] | Tabarki B, Thabet F, Shafi SA, et al. Acute necrotizing encephalopathy associated with enterovirus infection[J]. Brain Dev, 2013, 35(5): 454-457. DOI:10.1016/j.braindev.2012.07.001 |
| [18] | Ergul AB, Altug U, Aydin K, et al. Acute necrotizing encephalopathy causing human bocavirus[J]. Neuroradiol J, 2017, 30(2): 164-167. DOI:10.1177/1971400916687586 |
| [19] | Ichiyama T, Isumi H, Ozawa H, et al. Cerebrospinal fluid and serum levels of cytokines and soluble tumor necrosis factor receptor in influenza virus- associated encephalopathy[J]. Scand J Infect Dis, 2003, 35(1): 59-61. DOI:10.1080/0036554021000026986 |
| [20] | Aiba H, Mochizuki M, Kimura M, et al. Predictive value of serum interleukin-6 level in influenza virus-associated encephalopathy[J]. Neurology, 2001, 57(2): 295-299. DOI:10.1212/wnl.57.2.295 |
| [21] | Tsao N, Hsu HP, Wu CM, et al. Tumour necrosis factor-alpha causes an increase in blood–brain barrier permeability during sepsis[J]. J Med Microbiol, 2001, 50(9): 812-821. DOI:10.1099/0022-1317-50-9-812 |
| [22] | Okumura A, Mizuguchi M, Kidokoro H, et al. Outcome of acute necrotizing encephalopathy in relation to treatment with corticosteroids and gammaglobulin[J]. Brain Dev, 2009, 31: 221-227. DOI:10.1016/j.braindev.2008.03.005 |
| [23] | Munakata M, Kato R, Yokoyama H, et al. Combined therapy with hypothermia and anticytokine agents in influenza A encephalopathy[J]. Brain Dev, 2000, 22: 373-377. DOI:10.1016/s0387-7604(00)00169-8 |
| [24] | Kumakura A, Iida C, Saito M, et al. Pandemic influenza A-associated acute necrotizing encephalopathy without neurologic sequelae[J]. Pediatr Neurol, 2011, 45(5): 344-346. DOI:10.1016/j.pediatrneurol.2011.08.004 |
| [25] | Kawashima H, Togashi T, Yamanaka G, et al. Efficacy of plasma exchange and methylprednisolone pulse therapy on influenza associated encephalopathy[J]. J Infect, 2005, 51(2): E53-56. DOI:10.1016/j.jinf.2004.08.017 |
 2018, Vol. 27
2018, Vol. 27




