Ca2+是细胞内重要的第二信使,调控多种细胞功能。心肌组织中,Ca2+经L型钙通道进入细胞,在维持动作电位时程、触发心肌收缩过程中起着重要作用。心肌L型钙通道主要由α亚基(Cav1.2)组成,Cav1.2通道受多种因子如辅助亚基、蛋白激酶、磷酸酶、细胞骨架蛋白等调节[1-3]。Thomsen等[4]发现在KChIP2敲除的转基因鼠中,Cav1.2蛋白表达增加,但L型钙电流显著降低。Liu等[5]发现KCNE2可以通过改变心肌细胞L型钙通道亚基Cav1.2通道的门控和动力学特征,降低L型钙电流幅值。KCNE1作为KCNE家族的重要钾通道蛋白,对许多通道蛋白均有调控效应[6-7]。然而,其是否对Cav1.2通道具有调控作用,尚不清楚。本研究采用异源性表达系统结合细胞电生理技术研究KCNE1对Cav1.2电流及通道门控特征的影响。
1 材料与方法 1.1 主要试剂及仪器HEPES、L-谷氨酸(L-GlutamIc acid)为美国Sigma公司产品;EGTA购自美国Fluka Biochemika公司;CdCl2购自美国Sigma公司。DMEM细胞培养基购自Thermo公司, FBS胎牛血清、LipofectamIne转染试剂、GFP均为美国Invitrogen公司产品。
AXON-700B膜片钳系统、Digidata 1440A数模转换器、pCLAMP10.4数据处理软件,美国MDC(AXON)公司;pp-83微电极拉制仪,日本NarishIge公司;MP-285三维纤维操纵仪,美国Sutter公司;SF-77B快速灌流给药系统、TC-334B双自动温控仪,美国Water公司。
1.2 溶液的配制细胞内液(mmol/L):KCl 120、NaCl 10、CaCl2 1、MgATP 5、EGTA 11及HEPES 10,用KOH调pH值至7.3。
细胞外液(mmol/L):氯化胆碱126、CsC1 5.4、MgC12 1.0、Hepes 10、葡萄糖10.0及CaC12 2.0,pH用CsOH调至7.4。
1.3 HEK293细胞培养与pcDNA3.1-HERG质粒转染取HEK293细胞系培养,镜下观察培养良好的HEK293,参考Qiagen转染试剂盒中的说明书,应用Lipofectamine-2000转染试剂进行转染,根据质粒的浓度加入所需转染的相应质粒体积目的质粒pcDNA3.1-CACNA1C 0.5 μg或pcDNA3.1-CACNA1C 0.5 μg+ pcDNA3.1-KCNE1 0.5 μg。以0.2 μg绿色荧光蛋白(GFP)表达质粒与含有目的基因的质粒共转染,作为阳性转染细胞的指示剂,选取转染后48~72 h的HEK293细胞,在荧光显微镜下观察转染效率为50%~80%;用PBS缓冲液洗一次后,胰酶消化约1 min后,培养基终止。吹打后以1:10传至35 mm平皿,并放置于孵箱中5 h,荧光显微镜下观察转染阳性的细胞用于膜片钳记录。实验分两组:Cav1.2组和Cav1.2+KCNE1组,每组取15个转染阳性的HEK293细胞。
1.4 全细胞膜片钳的电流记录在倒置荧光显微镜下,选择边缘清楚、表面光滑、大小适中、呈球形或多边形、不与其他细胞连结且带有绿色荧光的细胞进行实验。将Axon-700B膜片钳放大器同计算机连接。刺激信号及电压输入信号的采集应用Digidata 1440A数模转换器,均由软件(pCLAMP10.4)控制。GG-17玻璃毛坯经pp-83微电极拉制仪拉制成尖端直径2~4 μm,入液电阻为2.0~5.5 MΩ的电极。电极入液后进行液接电位补偿校正,使其至小于±2 mV,调节三维操纵器使电极尖端移向细胞表面进行封接,使电阻达1 GΩ以上形成高阻封接,进行快电容补偿以消除仪器引入的电容误差。采用脉冲式方式负压吸破细胞膜形成全细胞记录模式。测定电容时,施以0.4 V/s的斜坡刺激,测电流并按方程Cm=I/(dv/dt)计算(Cm为膜电容,I为电流值,dv/dt即电压斜率)。采用全细胞膜片钳记录方法,在电压钳制下记录电流。为消除细胞间的误差,I值以电流密度(pA/pF)表示。信号经截止频率为1 kHz的四阶贝塞尔低通滤波器滤波,采样率为5 kHz。串联电阻补偿90%~95%以消除电压偏差;应用仪器自动进行慢电容补偿约为85%~90%,以消除细胞膜电容导致的充放电影响。为了避免通道电流的衰减现象(rundown)对实验结果产生影响,控制实验在细胞破膜后20 min内完成。采样后的数据贮存在硬盘内,以便将来测量和分析通道的电生理特性。整个实验在室温下(22~24 ℃)进行。
1.5 ICa, L电流记录程序及数据分析ICa, L峰值电流记录:保持电位-40 mV,施予150 ms,阶跃0 mV极化脉冲,记录ICa, L电流。
ICa, L电流-电压(I-V)曲线:保持电位-40 mV,施予-40 mV ~ +50 mV,150 ms的去极化脉冲,阶跃为10 mV,记录ICa, L,计算电流密度。以各电压下的刺激脉冲为横轴,以电流密度为纵轴作图,即得电流-电压(I-V)依赖性曲线。
ICa, L的稳态激活(SSA)曲线:保持电位-90 mV,施予-50 mV ~ +60 mV,500 ms的去极化脉冲,记录ICa, L。将尾电流标准化,以各电压下的刺激脉冲为横轴,以标准化尾电流为纵轴作图。并用Boltzmann方程(I/Imax=1/{1+exp[(V1/2-Vm)/k]})进行曲线拟合求出半激活电压(V1/2)和激活曲线斜率(k)。
ICa, L的稳态失活(SSI)曲线:保持电位-90 mV,施予1 000 ms,阶跃为10 mV,-70 mV ~ +40 mV的系列去极化脉冲,在每一条件脉冲后紧跟一固定去极化至0 mV,150 ms的测试脉冲,记录ICa, L。用Boltzmann方程(I/Imax=1/{1+exp[(Vm-V1/2)/k]})进行曲线拟合求出半失活电压(V1/2)和曲线斜率(k)。
ICa, L失活后恢复曲线:钳制电位-40 mV,给予0 mV,150 ms的去极化脉冲,分别间隔20、40、80、160、320、640、1 280及2 560 ms后,再施予第2次0 mV,150 ms的方波刺激,将第2次方波脉冲引出的电流与条件刺激电流相比,求出恢复曲线的τ值。
1.6 统计学方法所有数据以均数±标准差(x±s)表示,数据处理采用pCLAMP10.4处理,采用SPSS 19.0软件进行统计学处理,两组间数据比较用t检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 KCNE1对Cav1.2电流幅值的影响在0 mV刺激电压时,Cav1.2组峰电流密度为(-14.8±2.5) pA/pF,而Cav1.2+KCNE1组峰值电流密度降为(-7.5±1.6) pA/pF。提示KCNE1可以使Cav1.2电流密度峰值显著下降(n=15,P < 0.01),见图 1。

|
| 图 1 KCNE1对Cav1.2电流密度峰值的影响 Figure 1 Effects of KCNE1 on peak current density of Cav1.2 |
|
|
Cav1.2+KCNE1组和Cav1.2组电流的I-V曲线形状基本相似,在-40 mV到0 mV。随着刺激电压增加各组电流幅值和电流密度逐渐增加,在0 mV时均达到峰值,在+20 mV至+50 mV之间;随着刺激电压增加,电流密度逐渐降低。当激活电压位于-20 mV ~ +20 mV范围时,Cav1.2+KCNE1组电流密度明显低于Cav1.2组(P < 0.05或P < 0.01,n=15,图 2)。
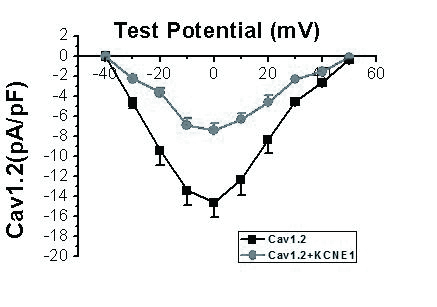
|
| 图 2 KCNE1对Cav1.2电流I-V曲线的影响 Figure 2 Effects of KCNE1 on I-V curve of Cav1.2 current |
|
|
与Cav1.2组相比,Cav1.2+KCNE1组电流的稳态激活曲线没有明显改变。Cav1.2组半激活电压为(-11.5±0.5) mV,Cav1.2+KCNE1组半激活电压为(-10.8±0.7) mV,两组激活曲线斜率分别为(10.9±0.4) mV和(11.8±0.8) mV,两组间差异无统计学意义(图 3)。
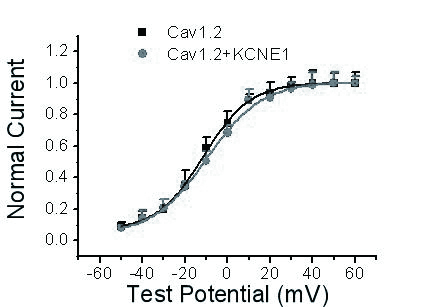
|
| 图 3 KCNE1对Cav1.2电流稳态激活曲线的影响 Figure 3 Effects of KCNE1 on steady-state activated curve of Cav1.2 current |
|
|
与Cav1.2组比,Cav1.2+KCNE1组稳态失活曲线明显左移。Cav1.2组半失活电压为(-12.7±1.2)mV,Cav1.2+KCNE1组为(-23.2±2.8) mV (P < 0.01,n=15),两组失活曲线斜率为(11.5± 0.5) mV和(9.6 ±0.9) mV,差异无统计学意义(图 4)。
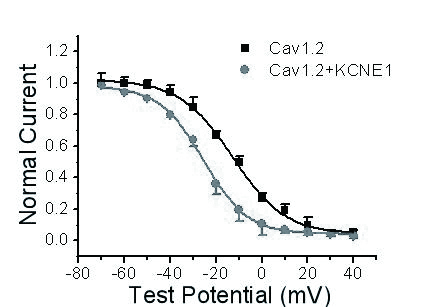
|
| 图 4 KCNE1对Cav1.2电流稳态失活曲线的影响 Figure 4 Effects of KCNE1 on steady-state inactivated curve of Cav1.2 current |
|
|
Cav1.2+KCNE1组失活后恢复曲线右移。恢复时间常数明显延长,Cav1.2组失活后恢复时间常数为(123.7±20.9)ms,而Cav1.2+KCNE1组失活后恢复时间常数为(214.2±16.6) ms(P < 0.05,n=15),见图 5。这说明KCNE1可能影响通道的恢复过程。
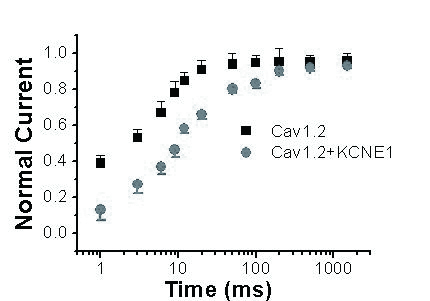
|
| 图 5 KCNE1对Cav1.2电流失活后恢复曲线的影响 Figure 5 Effects of KCNE1 on recovery curve from inactivation of Cav1.2 current |
|
|
本研究发现调控钙电流的钾通道辅助亚基KCNE1对Cav1.2通道有调控效应。Cav1.2蛋白是电压门控L型钙通道α亚基,在心肌细胞去极化时激活,介导Ca2+进入细胞。Ca2+作为重要的细胞内第二信使,参与多种心脏生理过程,如心肌收缩、动作电位形成以及基因表达调控[8]。Cav1.2通道功能受多种因素调控,如辅助亚基、蛋白激酶(PKA、PKG和钙调蛋白激酶)、磷酸酶、细胞骨架及小分子RNA等[9-11]。最近研究表明钾通道蛋白辅助亚基参与调控L型钙电流。Thomsen等[4]发现在KChIP2敲除转基因鼠中,L型钙电流显著降低。体外研究表明,KChIP2显著增加L型钙电流幅值,而不改变通道门控和动力学特征。Liu等[5]发现KCNE2调控心脏L型钙通道亚基Cav1.2,降低L型钙电流幅值。本研究证实KCNE1同样具备调控Cav1.2的效应,这不仅为研究二类通道的相互作用提供了进一步的证据,也为临床L型钙通道的干预提供了新的靶点。
为了分析KCNE1抑制钙电流的机制,本研究记录了钙电流主要门控特征如稳态激活、稳态失活、失活后恢复。结果表明KCNE1并不改变Cav1.2通道激活过程,而主要影响Cav1.2通道稳态失活和失活后恢复过程,使通道的失活加速,失活后恢复减慢,从而降低了Cav1.2电流密度[12-13]。这与KCNE2不同,后者在异源性系统中KCNE2不改变Cav1.2通道的门控和动力学特征,但减少Cav1.2在细胞膜表达,使得电流密度降低[5]。
本研究局限性在于没有进一步对Cav1.2通道的表达进行探讨,所以KCNE1是否影响Cav1.2通道蛋白还需下一步探究。另外,HEK293细胞系是常用的哺乳细胞异源性表达系统,与心肌细胞不同,HEK293细胞没有复杂的调控通路,不能替代心肌细胞,所以本研究结论有一定的局限性。
本研究首次报道了KCNE1可以通过改变Cav1.2通道的失活和失活后恢复过程,影响通道的开放,从而降低Cav1.2通道的电流密度,不仅为离子流之间的相互作用的研究提供依据,也为临床上心脏钙通道的干预提供新的靶点。
| [1] | Hill BJF, Dalton RJ, Joseph BK, et al. 17β-estradiol reduces Cav1.2channelabundance and attenuates Ca2+-dependent contractions in coronary arteries[J]. Pharmacol Res Perspect, 2017, 5(5): e00358. DOI:10.1002/prp2.358 |
| [2] | BourdIn B, BrIot J, Tétreault MP, et al. Negatively charged residues In the first extracellular loop of theL-type CaV1.2channelanchor the InteractIon wIth the CaVα2δ1 auxillarysubunit[J]. J Biol Chem, 2017, 292(42): 17236-17249. DOI:10.1074/jbc.M117.806893 |
| [3] | ChoI YK, Park JH, Baek YY, et al. Carbon monoxide stimulates astrocytic mitochondrial biogenesis viaL-type Ca2+channel-mediated PGC-1α/ERRα activatIon[J]. Biochem Biophys Res Commun, 2016, 14(2): 297-304. DOI:10.1016/j.bbrc.2016.09.063 |
| [4] | Thomsen MB, Wang C, Ozgen N, et al. AccessorysubunitKchIP2modulates the cardiacL-typecalciumcurrent[J]. Circ Res, 2009, 104(12): 1382-1389. DOI:10.1161/CIRCRESAHA.109.196972 |
| [5] | LIu W, Deng J, Wang G, et al. KCNE2modulatescardiacL-typeCa (2+)channel[J]. J Mol Cell CardIol, 2014, 72(7): 208-218. DOI:10.1016/j.yjmcc.2014.03.013 |
| [6] | Larsson JE, Larsson HP, Liin SI. KCNE1tunes the sensitivity of KV7.1 to polyunsaturated fatty acids by moving turret residues close to the binding site[J]. Elife, 2018, 7: e37257. DOI:10.7554/eLIfe.37257 |
| [7] | Barro-Soria R, Ramentol R, Liin SI, et al. KCNE1and KCNE3 modulate KCNQ1 channels by affecting different gating transitions[J]. Proc Natl Acad Sci U S A, 2017, 114(35): E7367-E7376. DOI:10.1073/pnas.1710335114 |
| [8] | Gerbino A, Colella M. The different facets of extracellular calcium sensors: old and new concepts in calcium-sensing receptor signalling and pharmacology[J]. Int J Mol Sci, 2018, 19(4): E999. DOI:10.3390/Ijms19040999 |
| [9] | Lu JM, Wang CY, Hu C, et al. GDF-15 enhances intracellular Ca2+ by increasIng Cav1.3 expression in rat cerebellar granule neurons[J]. Biochem J, 2016, 473(13): 1895-1904. DOI:10.1042/BCJ20160362 |
| [10] | Ouyang QF, Han Y, Lin ZH, et al. Fluvastatin upregulates the α 1CsubunItof CaV1.2channelexpression in vascular smooth muscle cells via RhoA and ERK/p38 MAPK pathways[J]. Dis Markers, 2014: 237067. DOI:10.1155/2014/237067 |
| [11] | Mortensen OV. MKP3 eliminates depolarization-dependent neurotransmitter release through downregulation ofl-typecalcium channelCav1.2 expression[J]. CellCalcium, 2013, 53(3): 224-230. DOI:10.1016/j.ceca.2012.12.004 |
| [12] | TreInys R, JurevIcIus J. L-type Ca2+ channels in theheart: structure and regulatIon[J]. Medicina (Kaunas), 2008, 44(7): 491-499. DOI:10.3390/medicina44070064 |
| [13] | Brette F, Leroy J, Le Guennec JY, et al. Ca2+ currents in cardiac myocytes: old story, new insights[J]. Prog Biophys Mol Biol, 2006, 91(1/2): 1-82. DOI:10.1016/j.pbIomolbio.2005.01.001 |
 2018, Vol. 27
2018, Vol. 27




