癫痫持续状态是最严重的癫痫发作形式,是神经科常见的急重症之一。持续的痫性发作不仅可引起细胞代谢紊乱、供能障碍导致脑神经元死亡,还可由于继发感染、内环境平衡紊乱、呼吸循环衰竭等导致患者死亡,幸存者也可能遗留严重的神经功能障碍,或出现耐药性癫痫[1]。早期发现患者癫痫持续状态的潜在影响因素并及时进行干预,有助于减少并发症的发生率。目前各中心预测开颅手术患者癫痫持续状态多基于经验性判断,缺乏量化的识别模型。因此,本研究在观察一系列可能引发患者癫痫持续状态的量化指标的基础上,拟建立早期预警模型,旨在实现精准化早期预测,为医护人员预防和处理癫痫持续状态提供客观性依据。
1 资料与方法 1.1 一般资料回顾性分析2017年1月至2017年12月浙江大学医学院附属第二医院神经外科823例住院开颅手术患者资料。入选标准:①符合颅脑肿瘤诊断标准,且进行开颅手术治疗的患者;②能配合评分且知情同意的患者;③年龄14~80岁。排除临床资料不齐全的患者。
1.2 调查工具参考国内外相关文献资料,并结合病例资料形成调查表,经预调查和运用德尔菲法修订形成完整的调查表,用于本研究临床资料的收集,其主要内容包括患者个体资料、既往病史、临床症状体征、术前、术中及术后情况。既往病史:术后是否按医嘱服用抗癫痫药、病变复发情况、手术次数(单次、2次及以上)等。临床症状体征:有无头痛、呕吐(提示有无颅高压),是否以癫痫为首发症状:有无语言障碍(包括运动性失语、感觉性失语、混合性失语),有无肢体活动障碍(包括单、双侧肢体活动障碍)。术前情况:疾病性质、有无术前癫痫、病变部位(通过CT、MRI确定)。术中情况:手术入路、手术时间、有无皮质牵拉(手术时间超过5 h或脑深部的病变且手术时间>4 h)、有无术中动静脉损伤(包括供应功能部位的动脉、侧裂静脉或功能部位的回流静脉等的切断、烧闭等损伤)、切除程度(全切除、不全切除)。术后情况:有无早期血肿、有无术后水电解质酸碱紊乱、有无术后脑水肿、有无颅内感染。
1.3 调查方法本研究通过医院人体研究伦理委员会审批。资料的收集由科室硕士研究生和中级职称以上的医生共同完成,前期已进行相关培训。观察患者是否发生癫痫持续状态的起点为手术后返回病房,终点为手术后7 d。调查者按照调查表的条目准确记录患者的临床资料。调查表在录入之前先进行整理和核查,对数据进行双人双录入,以便发现错误并及时核对纠正。对资料缺失等问卷视为无效,本次共调查830例患者,其中资料完整的有效问卷共823份,有效回收率99.2%。
1.4 统计学方法采用SPSS 22.0统计学软件对数据进行处理。患者的一般资料采用频数、频率进行描述性分析。计量资料用独立样本t检验,计数资料用χ2检验,非正态分布的计量资料用秩和检验,对所有可能有影响的指标进行单因素分析,有意义的指标进一步行Logistic回归分析,得出开颅患者术后早期识别模型的相关危险因素,建立模型,并应用ROC曲线来评价该模型的预测效能。
2 结果 2.1 一般资料本次调查共收集823例患者,男性331例,女性492例,年龄(49.69±12.72)岁,术后出现癫痫持续状态的患者有64例,发生率为7.8%。
2.2 术后患者出现癫痫持续状态的单因素分析通过单因素分析发现影响术后早期癫痫持续状态发作的因素有:自行停药史、呕吐、额颞部手术入路、动静脉损伤、指片状水肿(P < 0.05),见表 1。
| 指标 | 例数 | 癫痫持续状态(例,%) | F值 | P值 |
| 自行停药史 | ||||
| 是 | 688 | 43(5.22) | 13.822 | < 0.01 |
| 否 | 135 | 21(2.55) | ||
| 呕吐 | ||||
| 是 | 255 | 27(3.28) | 4.084 | 0.044 |
| 否 | 568 | 37(4.50) | ||
| 额颞部手术 | ||||
| 是 | 31 | 20(2.43) | 26.842 | < 0.01 |
| 否 | 791 | 44(5.35) | ||
| 动静脉损伤 | ||||
| 是 | 71 | 10(1.22) | 4.324 | 0.038 |
| 否 | 752 | 54(6.56) | ||
| 指片状水肿 | ||||
| 是 | 41 | 13(1.58) | 35.875 | < 0.01 |
| 否 | 782 | 51(6.20) |
以患者手术后是否出现癫痫持续状态为因变量,自行停药史、呕吐、额颞部手术入路、动静脉损伤、指片状水肿作为自变量,进行Logistic回归分析。结果显示对患者是否存在癫痫持续状态的影响因素有自行停药史、额颞部手术入路、术区或周围脑组织存在指套状或片状水肿,采用四舍五入的方法对OR值进行赋分,拟合预警模型公式Z=0.1+2.8×自行停药史+4.7×额颞部手术+5.2×指片状水肿,见表 2~3。
| 自变量 | 赋值方式 |
| 自行停药史 | 无=0,有=1 |
| 手术次数≥2次 | 否=0,是=1 |
| 呕吐 | 无=0,有=1 |
| 额颞部手术 | 否=0,是=1 |
| 动静脉损伤 | 无=0,有=1 |
| 指片状水肿 | 无=0,有=1 |
| 变量 | B | SE | Wald | P值 | OR | 95%CI | 积分 |
| 自行停药史 | 1.020 | 0.298 | 11.715 | 0.001 | 2.774 | 1.547~4.977 | 2.8 |
| 额颞部手术 | 1.550 | 0.453 | 11.692 | 0.001 | 4.709 | 1.937~11.447 | 4.7 |
| 指片状水肿 | 1.657 | 0.396 | 17.491 | < 0.01 | 5.247 | 2.413~11.405 | 5.2 |
| 常数 | -2.992 | 0.179 | 280.343 | < 0.01 | 0.050 | 0.1 |
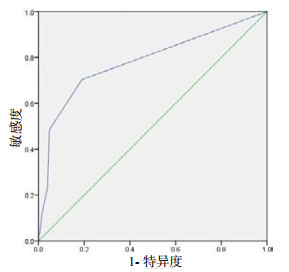
绘制ROC曲线(图 1),得出曲线下面积为0.783 (95%CI:0.713~0.852),Youden指数为0.513时为最佳截断点,由此计算出该模型的评价指标,模型的敏感度为70.3%,特异度为81.0%,阳性似然比是3.700,阴性似然比是0.367。
|
| 图 1 所建模型的ROC曲线 |
|
|
神经外科患者存在较多安全隐患,术后癫痫持续状态的发生便是其中之一,易导致患者病情出现变化,对脑神经造成不可逆的损伤,甚至引起窒息及死亡,需要紧急有效处理。如何早期识别患者病情变化,进而有效干预具有重要意义[2]。
本研究基于国内外研究,结合临床病例资料和专家意见,制定了开颅手术后癫痫持续状态危险因素的调查表,全面分析了开颅手术患者各种临床表现和癫痫持续状态的关系,得出了其独立危险因素为:癫痫史、额部手术入路、术区或周围脑组织存在指片状水肿。Ozdilek等[3]研究表明,既往癫痫者自行停用或更换抗癫痫药物出现率最高,与年龄、性别等均无关。也有研究表明肿瘤和脑组织创伤是癫痫持续状态的危险因素,幕上开颅术后癫痫的发生率更高[4-5]。因此,本研究纳入的3个独立危险因素具有较高的可信度,在临床工作中应引起高度重视。
本研究参考国内外相关文献,采用单因素分析和Logistic回归分析对患者开颅手术患者癫痫持续状态的独立危险因素进行统计学分析,建立早期识别模型:Z=0.1+2.8×自行停药史+4.7×额颞部手术+5.2×指片状水肿。ROC曲线分析表明,曲线下面积为78.3% (95%CI:0.713~0.852),表明该模型准确性较高,可用于识别癫痫持续状态高风险患者。
该模型的最佳截点Youden指数为0.513,与其相对应的灵敏度为70.3%,特异度为81.0%,说明该早期识别模型对开颅手术患者癫痫持续状态的预测效果良好,提示开颅手术患者癫痫持续状态事件有70.3%可以被筛选出来,未发生癫痫持续状态的患者有81.0%以上可以通过该识别模型排除在高危风险人群外。该模型灵敏度一般,但特异度较高,可能是因为癫痫持续状态的影响因素较多,本研究纳入的对象相对集中在开颅手术患者,一些癫痫持续状态高危人群如脑炎患者并未纳入研究当中,产生了一定的偏倚。随着多中心研究的开展,样本量增多,所得到的识别模型将更有代表性。
本模型阳性似然比为3.700,说明应用本模型筛选出癫痫持续状患者的机会是未应用本模型时的3.700倍;阴性似然比为0.367,说明发生癫痫持续状态的患者不符合本模型的可能仅为未发生癫痫持续状态患者的0.367倍。可见,本模型的检出能力较强,能较好地识别开颅手术患者癫痫持续状态的风险。
综上所述,本研究应用Logistic回归筛选出开颅手术患者癫痫持续状态的危险因素,建立早期识别模型,并运用ROC曲线进行效能的评价。因颅内疾病的特殊性,临床表现存在较大的个体差异,开颅手术患者癫痫持续状态的影响因素较多,如不及时处理将影响患者预后,严重者可危及患者生命。因此,建立早期识别模型的理念和方法,将有效科学地评估癫痫持续状态的发生风险,精准化识别高危患者,做好安全防护措施,进一步减少患者癫痫持续状态不良事件的发生率,节约医疗费用,提高患者的远期生存质量。
| [1] | 王学峰, 肖波, 洪震, 等. 癫痫持续状态的诊断和治疗[M]. 北京: 人民卫生出版社, 2010: 6. |
| [2] | 曲丹, 刘洋, 孟一, 等. 冠心病稳定期再发心血管事件预警模型的建立与效能评估[J]. 中西医结合心脑血管病杂志, 2014, 12(7): 777-779. DOI:10.3969/j.issn.16721349.2014.07.001 |
| [3] | Ozdilek B, Midi I, Agan K, et al. Episodes of status epilepticus in young adults: etiologic factors, subtypes, and outcomes[J]. Epilepsy Behav, 2013, 27(2): 351-354. DOI:10.1016/j.yebeh.2013.02.023 |
| [4] | Betjemann JP, Lowenstein DH. Status epilepticus in adults[J]. Lancet Neuml, 2015, 14(2): 615-624. DOI:10.1016/S1474-4422(15)00042-3 |
| [5] | Kombogiorgas D, Jatavallabhula NS, Sgouros S, et al. Risk factors for developing epilepsy after craniotomy in children[J]. Childs Nerv Syst, 2006, 22(11): 1441-1445. DOI:10.1007/s00381-006-0117-4 |
 2019, Vol. 28
2019, Vol. 28


