脓毒症是机体对感染的反应失调而导致危及生命的器官功能障碍[1]。肺脏是脓毒症时最易受损的器官。脓毒症可引起肺组织氧自由基大量产生,其所致的氧化/抗氧化失衡及氧化应激反应是引起肺损伤的重要原因。
核因子E2相关因子2转录因子(nuclear factor E2-related factor-2, Nrf2)属于Cap ' n' Collar家族,是调节细胞内众多抗氧化物表达的关键性因子[2]。研究发现在急性肺损伤过程中,Nrf2具有保护作用并且是通过调节机体氧化应激反应实现的[3]。组蛋白去乙酰化酶(histone deacetylase, HDAC)属于组蛋白去乙酰化酶超家族, 共有Ⅰ~Ⅳ四型,其中Ⅰ型中HDAC2具有很强的组蛋白去乙酰化活性,其对Nrf2乙酰化水平的影响和相关疾病的关系日益受到重视[4-5]。本研究通过体外实验初步探讨HDAC2介导Nrf2乙酰化/去乙酰化在脓毒症急性肺损伤中的作用,为脓毒症急性肺损伤治疗提供新的理论策略。
1 材料与方法 1.1 实验动物与试剂健康雄性清洁级BALB/c小鼠,体质量20~25 g,由上海斯莱克实验动物有限责任公司提供,许可证号:SCXK(沪)2012-0002。小鼠饲养及动物实验在温州医科大学实验动物中心进行,使用许可证号:SYXK(浙)2010.0150。实验遵循国际通行的动物福利和伦理准则。兔抗HDAC2多克隆抗体、兔抗Nrf2多克隆抗体、protein A/G-beads、抗乙酰化赖氨酸抗体(均购于Santa Cruz Biotechnology公司,加利福尼亚,美国),BCA蛋白浓度测定试剂盒(温壳生物科技有限公司,浙江,中国),羊抗兔二抗(温壳生物科技有限公司,浙江,中国),脂多糖(Sigma-Aldrich公司,圣路易斯,美国),CCK-8试剂盒(Cell Counting Kit-8)(日本同仁),超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒(西唐生物科技有限公司,上海,中国)。
1.2 分离培养小鼠Ⅱ型肺泡上皮细胞将BALB/c小鼠颈部脱位处死,快速取出双肺,置于75%乙醇中浸泡5 min,取出后至超净台中操作,快速完整地取下肺组织,尽可能清除干净残留的气管组织和结缔组织后置于预冷的PBS液中,清洗2~3次。磷酸盐缓冲液洗涤肺组织两次。将肺组织剪为碎块,用胰酶溶液清洗1次,然后用胰酶溶液于37 ℃搅动消化15 min。用等量含10%胎牛血清(FBS)的M199完全培养基终止胰酶消化,200目筛网过滤后,1 500 r/min低温离心5 min,弃去上清液,收集沉淀。将分离的细胞加入含10% FBS的M199培养基制成悬液接种入培养瓶中,置于37 ℃,5% CO2培养箱内培养。
1.3 实验分组与处理常规分离培养小鼠Ⅱ型肺泡上皮细胞,用不同浓度的LPS(10、100、1 000 ng/mL)刺激3 d,CCK-8检测细胞活性,与对照组相比,存活率有差异的浓度作为实验浓度。然后用此浓度LPS分别在0、6、12、24及48 h时用CCK-8检测细胞活性,选择存活率出现差异的时间点作为本实验的时间点。
常规培养Ⅱ型肺泡上皮细胞,随机分为对照组、LPS组、HDAC2慢病毒干扰组(siRNA-HDAC2组)、HDAC2慢病毒过表达组(LV-HDAC2组)。siRNA-HDAC2组和LV-HDAC2组经过慢病毒转染后予LPS刺激,LPS浓度和刺激的时间点依据第一部分实验结果。
1.4 CCK-8法检测细胞存活率细胞以8×104个/mL密度接种于96孔板中,每孔100 μL,细胞培养24 h后,每孔加入100 μL不同浓度的受测试样品,培养不同时间后,每孔加入100 μL完全培养基,继续培养2 h。选择450 nm波长,在酶联免疫监测仪上测定各孔吸光度(A)值,计算细胞相对存活率。存活率=[(A实验组-A空白孔)/(A对照孔-A空白孔)]× 100%。
1.5 慢病毒构建与转染HDAC2过表达及沉默慢病毒的构建交于上海锐赛生物技术有限公司进行。小鼠LV-HDAC2的序列是5' -AAGCTTTTTATACAACAGATC-3' ,小鼠siRNA-HDAC2的序列为5' -GACTGTCGACTCGACCCTCCT-3' 。将细胞接种在6孔板中,然后将感染复数(multiplicity of infection, MOI)等于80的病毒颗粒与RPMI-1640培养基预混合,并添加到6孔板中。12 h后,用新鲜培养基代替培养基。48 h后,在荧光显微镜下观察细胞。
1.6 Western blot法检测HDAC2、Nrf2蛋白表达常规提取细胞胞浆及胞核蛋白,BCA检测核蛋白浓度。制备上样缓冲液,蛋白上样量为30 μg;配制10%的分离胶和5%的浓缩胶(聚丙烯酰胺凝胶);电泳在浓缩胶中80 V,20 min,分离胶中120 V,60 min;半干式电泳仪转膜100 mA,70 min;5%脱脂牛奶室温下封闭过夜;加入一抗,4 ℃孵育过夜用PBST洗膜,加入二抗,37 ℃孵育2 h,再用TBST洗膜,ECL显影,用图像分析系统分析蛋白条带灰度值。
1.7 免疫共沉淀法检测Nrf2乙酰化水平收获细胞,加入适量IP裂解液,冰上裂解30 min,12 000 g离心30 min取上清液。取200 μg的蛋白上清液用缓冲液稀释至100 μL,加入1 μg抗Nrf2抗体,4 ℃缓慢摇晃孵育过夜,并加入50 μL protein A琼脂糖珠,4 ℃振荡过夜。免疫沉淀反应后,在4 ℃以3 000 r/min速度离心3 min,将琼脂糖珠离心至管底,Western blot分析Nrf2乙酰化水平,一抗选用乙酰化赖氨酸抗体。
1.8 Nrf2蛋白稳定性检测处理后的细胞以0.5 μg/mL的放线菌酮(cycloheximide)抑制细胞蛋白质合成,应用Western blot法检测放线菌酮作用后各时间点(0、5、20、40、80 min)Nrf2蛋白量的变化。
1.9 SOD、MDA检测经过不同处理后,收集细胞上清液,化学比色法测定上清液SOD、MDA水平,具体操作严格按照试剂盒说明书进行。
1.10 统计学方法计量资料若服从正态分布则以均数±标准差(Mean±SD)表示,应用SPSS 23.0统计软件进行数据处理,多组均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
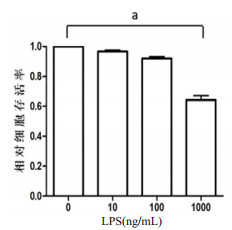
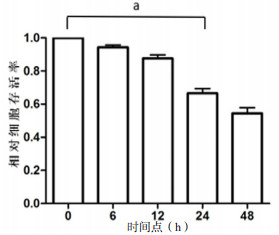
2 结果 2.1 LPS刺激对小鼠Ⅱ型肺泡上皮细胞的存活率的影响如图 1所示,分别用10、100、1 000 ng/mL的LPS刺激小鼠Ⅱ型肺泡上皮细胞3 d,发现10 ng/mL及100 ng/mL的LPS刺激后小鼠Ⅱ型肺泡上皮细胞存活率未见明显下降(P > 0.05),而1 000 ng/mL的LPS刺激后,小鼠Ⅱ型肺泡上皮细胞存活率为(60.13±0.03)%,存活率明显下降(P < 0.05)。如图 2所示,用1 000 ng/mL的LPS刺激刺激小鼠Ⅱ型肺泡上皮细胞,分别在0、6、12、24及48 h时用CCK-8检测细胞活性。结果发现,随着刺激时间延长,小鼠Ⅱ型肺泡上皮细胞存活率逐渐下降。LPS刺激24 h时,小鼠Ⅱ型肺泡上皮细胞存活率为(66.54±0.02)%,存活率明显下降(P < 0.05)。因此,在后面的实验中采用1 000 ng/mL的LPS刺激24 h。
|
| aP < 0.05 图 1 不同浓度LPS对小鼠Ⅱ型肺泡上皮细胞存活率的影响 Fig 1 Effect of different concentrations of LPS on survival of mouse typeⅡalveolar epithelial cells |
|
|
|
| aP < 0.05 图 2 不同时间点LPS对小鼠Ⅱ型肺泡上皮细胞存活率的影响 Fig 2 Effect of LPS on survival of mouse typeⅡalveolar epithelial cells at different time points |
|
|
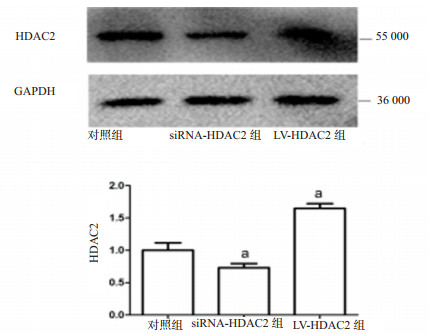
将慢病毒载体转染小鼠Ⅱ型肺泡上皮细胞,培养72 h后,Western Blot检测HDAC2蛋白的表达。与对照组相比,siRNA-HDAC2组小鼠Ⅱ型肺泡上皮细胞内HDAC2蛋白表达量减少,差异有统计学意义(t=5.196,P=0.035),而LV-HDAC2组小鼠Ⅱ型肺泡上皮细胞内HDAC2蛋白表达量增加,差异有统计学意义(t=5.877,P=0.027),见图 3。
|
| 与对照组比较,aP < 0.05 图 3 慢病毒载体转染小鼠Ⅱ型肺泡上皮细胞后HDAC2蛋白表达 Fig 3 Expression of HDAC2 protein after transfection of lentiviral vector into mouse type Ⅱ alveolar epithelial cells |
|
|
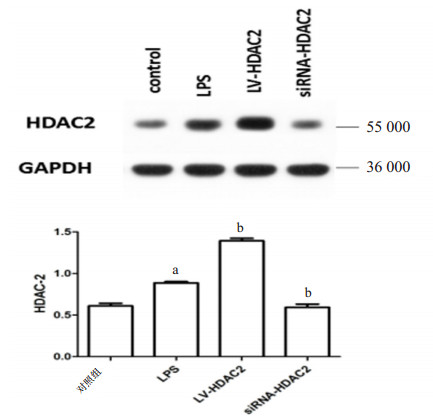
小鼠Ⅱ型肺泡上皮细胞经过不同处理后HDAC2的蛋白表达如图 4所示,与对照组相比,LPS刺激后HDAC2的蛋白表达水平升高(t=5.974,P=0.027)。与LPS组相比,LV-HDAC2组HDAC2的蛋白表达水平明显升高(t=11.69,P=0.007 2)。与LPS组相比,siRNA-HDAC2组HDAC2的蛋白表达水平下降(t=6.102,P=0.025 8)。
|
| 与对照组比较,aP < 0.05;与LPS组比较,bP < 0.05 图 4 各组Ⅱ型肺泡上皮细胞HDAC2的蛋白表达 Fig 4 Protein expression of HDAC2 in typeⅡalveolar epithelial cells of each group |
|
|
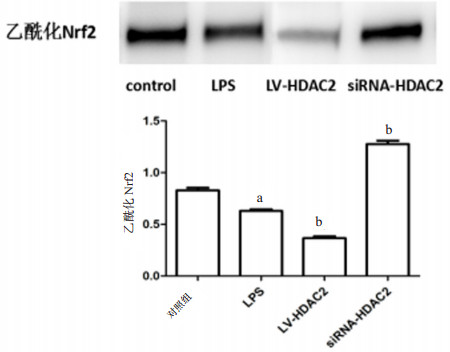
免疫共沉淀法检测各组小鼠Ⅱ型肺泡上皮细胞Nrf2乙酰化水平,如图 5所示,与对照组相比,LPS刺激后Nrf2乙酰化水平降低(t=7.223,P=0.002),过表达HDAC2后,Nrf2乙酰化水平降低更明显(t=11.29,P=0.000 4)。而干扰HDAC2的表达后,Nrf2乙酰化水平升高(t=17.86,P < 0.01)。
|
| 与对照组比较,aP < 0.05;与LPS组比较,bP < 0.05 图 5 各组Ⅱ型肺泡上皮细胞Nrf2乙酰化水平 Fig 5 Acetylation level of Nrf2 in typeⅡalveolar epithelial cells of each group |
|
|
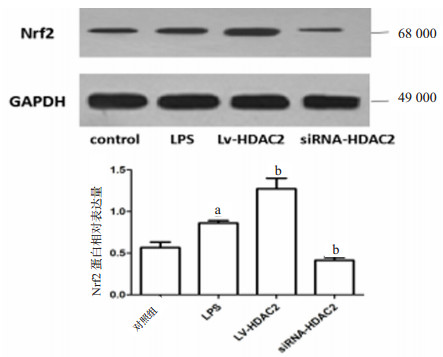
蛋白免疫印迹法检测各组小鼠Ⅱ型肺泡上皮细胞Nrf2蛋白表达水平,如图 6所示,与对照组相比,LPS刺激后Nrf2蛋白水平升高(t=2.929,P=0.043)。与LPS组相比,过表达HDAC2后,Nrf2蛋白表达水平升高明显(t=3.194,P=0.033)。而干扰HDAC2的表达后,Nrf2蛋白水平降低(t=9.359,P=0.000 7)。
|
| 与对照组比较,aP < 0.05;与LPS组比较,bP < 0.05 图 6 各组Ⅱ型肺泡上皮细胞Nrf2的蛋白表达 Fig 6 Protein expression of Nrf2 in typeⅡalveolar epithelial cells of each group |
|
|
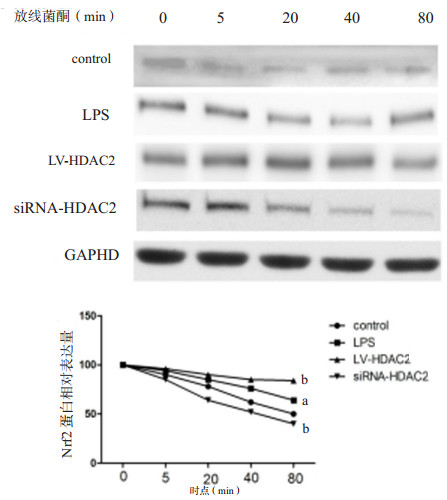
如图 7所示,对照组Nrf2蛋白的表达随着时间的增长逐渐下降,5、20、40及80 min时Nrf2的蛋白相对表达量分别是(90.23±3.78)%、(78.23±5.45)%、(62.76±5.65)%、(50.21±4.98)%,LPS刺激后Nrf2的蛋白稳定性升高。与LPS组相比,上调HDAC2后蛋白稳定性升高,而下调HDAC2后蛋白稳定性下降。
|
| 与对照组比较,aP < 0.05;与LPS组比较,bP < 0.05 图 7 各组Ⅱ型肺泡上皮细胞Nrf2的蛋白稳定性 Fig 7 Protein stability of Nrf2 in type Ⅱ alveolar epithelial cells |
|
|
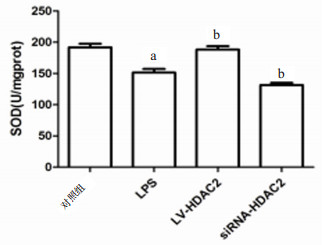
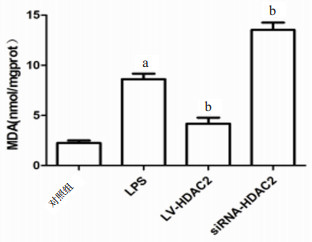
为了阐明调控HDAC2表达对LPS诱导小鼠Ⅱ型肺泡上皮细胞氧化应激的影响,本研究检测了SOD、MDA的水平,如图 8所示,对照组SOD活性为(191.7±6.009)U/mgprot,而LPS刺激后SOD活性下降(t=121,P < 0.01)。与LPS组相比,LV-HDAC2组SOD活性升高(t=4.678,P=0.009),而siRNA-HDAC2组SOD活性降低(t=2.87,P=0.045)。如图 9所示,对照组MDA含量为(2.25±0.258)nmol/mgprot,而LPS刺激后MDA含量升高(t=10.45,P=0.000 5)。与LPS组相比,LV-HDAC2组MDA含量下降(t=5.417,P=0.005 6),而siRNA-HDAC2组MDH含量升高(t=5.291,P=0.006)。
|
| 与对照组比较,aP < 0.05;与LPS组比较,bP < 0.05 图 8 各组Ⅱ型肺泡上皮细胞SOD的水平 Fig 8 The level of SOD in typeⅡ alveolar epithelial cells of each group |
|
|
|
| 与对照组比较,aP < 0.05;与LPS组比较,bP < 0.05 图 9 各组Ⅱ型肺泡上皮细胞MDA的水平 Fig 9 The level of MDH in typeⅡalveolar epithelial cells of each group |
|
|
生理状态下,肺内产生少量自由基,这些自由基参与解毒、吞噬等生理功能,且肺内存在超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽转移酶等抗氧化酶或自由基清除剂,能及时清除多余的活性自由基。因此健康肺脏内存在着氧化/抗氧化的动态平衡。
在脓毒症状态下,肺组织内大量中性粒细胞和巨噬细胞被激活,促使循环和肺局部的氧自由基增多,增加的活性自由基又可使巨噬细胞和中性粒细胞在肺组织聚集、激活,进一步释放自由基和溶酶体酶等,形成氧化应激。氧化应激产生的过量活性自由基超过肺内抗氧化系统的清除能力,打破了肺内氧化和抗氧化的动态平衡并形成恶性循环,最终导致肺损伤的发生。本研究通过LPS刺激Ⅱ型肺泡上皮细胞制作脓毒症模型,通过体外实验发现LPS刺激后Ⅱ型肺泡上皮细胞中SOD活性下降,MDA水平升高,氧化应激损伤加重。
Nrf2是调节细胞内众多抗氧化物表达的关键性因子,在生理状态下,Nrf2蛋白与肌动蛋白结合蛋白结合,锚定于细胞质中,处于失活状态[6];在应激状态下,Nrf2与肌动蛋白结合蛋白解离,并进入细胞核,与细胞核内抗氧化应答元件结合,然后激活下游解毒酶和抗氧化物酶基因的表达,如SOD和HO-1等,从而发挥其抗氧化作用[7-9]。已有文献证实在急性肺损伤中Nrf2具有保护作用,并且是通过调节机体氧化应激反应实现的[3, 10-11]。本研究发现LPS刺激后Nrf2表达升高,原因可能是LPS刺激后导致氧化应激加重,Nrf2应激性升高应对氧化应激损伤。
核心组蛋白的乙酰化和去乙酰化与基因调控相关。有研究发现,去乙酰化酶抑制剂能够显著抑制氧化应激后Nrf2蛋白表达和活性,下游抗氧化分子的表达降低,认为去乙酰化在维持Nrf2蛋白的稳定性和活性中起着重要的作用[3]。也有研究报道组蛋白乙酰转移酶能增加Nrf2的核转移,并上调下游抗氧化分子的表达[4]。因此机体的乙酰化状态可能影响Nrf2表达从而影响机体氧化应激。本研究发现LPS刺激后HDAC2的蛋白表达升高,Nrf2乙酰化水平降低,Nrf2的稳定性增强,Nrf2的蛋白表达升高,应对氧化应激损伤。笔者推测脓毒症或应激状态下HDAC2可降低Nrf2的乙酰化水平,提高Nrf2表达和稳定性。本实验通过慢病毒下调和过表达HDAC2,进一步验证HDAC2可调节Nrf2乙酰化水平进一步调节Nrf2的表达。Mercado等[12]研究发现下调HDAC2可导致Nrf2蛋白稳定性下降,表达降低,抗氧化基因表达减少,对氧化应激敏感性增加,致使炎症加重,这与本研究结果一致。也有研究发现HDAC2是吸入毒物介导的肺部炎症的一个关键因素,敲除Nrf2小鼠的肺组织HDAC2水平降低,炎症反应增加[13]。而相关研究在脓毒症中也有报道,有研究发现组蛋白去乙酰化酶抑制剂曲古霉素A对脓毒症小鼠急性肺损伤具有保护作用,可能与通过降低炎症反应及减少凋亡有关[14]。在脓毒症模型中,Takebe等[15]发现抑制组蛋白去乙酰化酶可以减轻脓毒症小鼠肺脏和脾脏凋亡,但其具体机制尚不清楚。有研究发现HDAC2可通过调节c-Jun/PAI-1通路抑制LPS诱导的巨噬细胞炎症反应[16]。Nrf2在脓毒症中的表达也有报道,有研究发现在脓毒症大鼠模型中,肝组织Nrf2水平在6 h时上升,12 h后下降[17]。在金黄色葡萄球菌腹膜炎小鼠模型中,Nrf2水平在6、24及48 h都升高,在6 h升高明显[18],这可能与模型不同,疾病严重程度不同有关。
SOD、MDA是氧化应激的重要指标。SOD是生物体内重要的抗氧化酶,是生物体内清除自由基的首要物质。它可对抗与阻断因氧自由基对细胞造成的损害,并及时修复受损细胞,复原因自由基造成的细胞损伤。MDA是脂质发生过氧化反应的产物。SOD、MDA对评估脓毒症氧化应激及预后都有重要的价值[19-20]。本研究发现LPS刺激后Ⅱ型肺泡上皮细胞中SOD活性下降,MDA升高。抑制HDAC2后,Nrf2表达降低,氧化应激加重;而上调HDAC2后,Nrf2表达升高,Nrf2可能与肌动蛋白结合蛋白解离并进入细胞核,与细胞核内抗氧化应答元件结合,然后激活下游解毒酶和抗氧化物酶基因的表达,SOD升高,从而使氧化应激减轻。
综上所述,LPS可诱导Ⅱ型肺泡上皮细胞氧化损伤,而HDAC2可使Nrf2去乙酰化,上调Nrf2的表达,减轻氧化应激。本研究只是体外研究,不能准确模拟脓毒症致病过程,因此,下一步将进行体内实验进一步探究其机制,为脓毒症急性肺损伤治疗提供新的理论依据。
| [1] | Freund Y, Lemachatti N, Krastinova E, et al. Prognostic accuracy of sepsis-3 criteria for in-hospital mortality among patients with suspected infection presenting to the emergency department[J]. JAMA, 2017, 317(3): 301-308. DOI:10.1001/jama.2016.20329 |
| [2] | Tkachev VO, Menshchikova EB, Zenkov NK. Mechanism of the Nrf2/Keap1/ARE signaling system[J]. Biochemistry Moscow, 2011, 76(4): 407-422. DOI:10.1134/s0006297911040031 |
| [3] | Reddy NM, Potteti HR, Mariani TJ, et al. Conditional deletion ofnrf2in airway epithelium exacerbates acute lung injury and impairs the resolution of inflammation[J]. Am J Respir Cell Mol Biol, 2011, 45(6): 1161-1168. DOI:10.1165/rcmb.2011-0144oc |
| [4] | Mercado N, Thimmulappa R, Thomas CMR, et al. Decreased histone deacetylase 2 impairs Nrf2 activation by oxidative stress[J]. Biochem Biophys Res Commun, 2011, 406(2): 292-298. DOI:10.1016/j.bbrc.2011.02.035 |
| [5] | Chen ZW, Ye XY, Tang NW, et al. The histone acetylranseferase hMOF acetylates Nrf2 and regulates anti-drug responses in human non-small cell lung cancer[J]. Br J Pharmacol, 2014, 171(13): 3196-3211. DOI:10.1111/bph.12661 |
| [6] | Zhao J, Moore AN, Redell JB, et al. Enhancing expression of nrf2-driven genes protects the blood brain barrier after brain injury[J]. J Neurosci, 2007, 27(38): 10240-10248. DOI:10.1523/jneurosci.1683-07.2007 |
| [7] | Dinkova-Kostova AT. The role of sulfhydryl reactivity of small molecules for the activation of the KEAP1/NRF2 pathway and the heat shock response[J]. Scientifica, 2012, 2012: 606104. DOI:10.6064/2012/606104 |
| [8] | Giudice A, Arra C, Turco MC. Review of molecular mechanisms involved in the activation of the NRF2-ARE signaling pathway by chemopreventive agents[J]. Methods Mol Biol, 2010, 647: 37-74. DOI:10.1007/978-1-60761-738-9_3 |
| [9] | Motohashi H, Yamamoto M. Nrf2-Keap1 defines a physiologically important stress response mechanism[J]. Trends Mol Med, 2004, 10(11): 549-557. DOI:10.1016/j.molmed.2004.09.003 |
| [10] | Lv H, Liu QM, Wen ZM, et al. Xanthohumol ameliorates lipopolysaccharide (LPS)-induced acute lung injury via induction of AMPK/GSK3β-Nrf2 signal axis[J]. Redox Biology, 2017, 12: 311-324. DOI:10.1016/j.redox.2017.03.001 |
| [11] | Ding YW, Zhao GJ, Li XL, et al. SIRT1 exerts protective effects against paraquat-induced injury in mouse type Ⅱ alveolar epithelial cells by deacetylating NRF2 in vitro[J]. Int J Mol Med, 2016, 37(4): 1049-1058. DOI:10.3892/ijmm.2016.2503 |
| [12] | Mercado N, Thimmulappa R, Thomas CMR, et al. Decreased histone deacetylase 2 impairs Nrf2 activation by oxidative stress[J]. Biochem Biophys Res Commun, 2011, 406(2): 292-298. DOI:10.1016/j.bbrc.2011.02.035 |
| [13] | Adenuga D, Caito S, Yao HW, et al. Nrf2 deficiency influences susceptibility to steroid resistance via HDAC2 reduction[J]. Biochem Biophys Res Commun, 2010, 403(3/4): 452-456. DOI:10.1016/j.bbrc.2010.11.054 |
| [14] | 陈隆望, 罗欢, 郑来赞, 等. 组蛋白去乙酰化酶抑制剂曲古霉素A对脓毒症小鼠急性肺损伤的保护作用[J]. 中华急诊医学杂志, 2018, 27(3): 275-282. DOI:10.3760/cma.j.issn.1671-0282.2018.03.010 |
| [15] | Takebe M, Oishi H, Taguchi K, et al. Inhibition of histone deacetylases protects septic mice from lung and splenic apoptosis[J]. J Surg Res, 2014, 187(2): 559-570. DOI:10.1016/j.jss.2013.10.050 |
| [16] | Fang WF, Chen YM, Lin CY, et al. Histone deacetylase 2 (HDAC2) attenuates lipopolysaccharide (LPS)-induced inflammation by regulating PAI-1 expression[J]. J Inflamm, 2018, 15: 3. DOI:10.1186/s12950-018-0179-6 |
| [17] | 李晶菁, 张霞, 陈瑜, 等. Nrf2在脓毒症大鼠肝组织中的表达及姜黄素的干预作用[J]. 重庆医学, 2013, 42(24): 2873-2876. DOI:10.3969/j.issn.1671-8348.2013.24.021 |
| [18] | MacGarvey NC, Suliman HB, Bartz RR, et al. Activation of mitochondrial biogenesis by heme oxygenase-1-mediated NF-e2-related factor-2 induction rescues mice from lethal staphylococcus aureus sepsis[J]. Am J Respir Crit Care Med, 2012, 185(8): 851-861. DOI:10.1164/rccm.201106-1152oc |
| [19] | 许俞露, 方强, 方雪玲. 丙二醛和超氧化物歧化酶浓度评估脓毒症患者预后的研究进展[J]. 中华急诊医学杂志, 2017, 26(2): 247-249. DOI:10.3760/cma.j.issn.1671-0282.2017.02.036 |
| [20] | Cheng ZQ. Edaravone attenuates paraquat-induced lung injury by inhibiting oxidative stress in human type Ⅱ alveolar epithelial cells[J]. World J Emerg Med, 2012, 3(1): 55. DOI:10.5847/wjem.j.issn.1920-8642.2012.01.010 |
 2019, Vol. 28
2019, Vol. 28




