严重感染是一种常见的急危重症,严重威胁着患者的生命安全。美国的流行病学研究提示,美国重症感染人群的发病率为300例/10万,其中50%为ICU住院患者,院内病死率高达25%,感染性休克的病死率高达50%以上[1]。血流感染(blood stream infection, BSI)是感染性疾病的最严重表现之一。近年来,患者BSI发生率显著增加,全球每年约发生200万例血流感染,病死率为20%~50%,美国每年发生BSI约25万例,因其导致的死亡居总死因的第13位[2],ICU成为BSI的高发科室,且BSI已成为ICU患者全身感染性疾病死亡的主要原因之一[3-4]。
本研究拟通过监测B型尿钠肽(brain natriuretic peptide,BNP)和可溶性尿激酶型纤溶酶原激活物受体(soluble urokinase plasminogen activator receptor,suPAR),观察上述血清标志物在BSI中的诊断和预后评估价值,寻找BSI的最佳生物标志物,为BSI的早期诊断提供参考,从而使患者获得及时合理的针对性治疗,改善临床预后,减少病死率,降低医药费用。
1 资料与方法 1.1 一般资料选择2016年1月至2017年12月苏州大学附属第二医院ICU收治的165例疑似血流感染患者为研究对象。根据BSI诊断标准[5],将患者分为血流感染组(n=65)和非血流感染组(n=100)。以28 d为观察期,根据患者的预后又将血流感染组分成生存组(n=39)和死亡组(n=26)。
1.1.1 入选标准年龄18~80岁临床疑似血流感染患者。
1.1.2 排除标准① 年龄 < 18岁或﹥80岁;②妊娠;③存在慢性心脏功能不全;④合并慢性肾功能不全;⑤入院后24 h内死亡。
1.1.3 伦理学本研究符合医院伦理学标准,并经医院伦理委员会批准,所有检查和治疗均获得过患者家属的知情同意。
1.2 观察指标记录患者的一般资料,入ICU时血清suPAR,采用酶联免疫吸附试验(ELISA)检测,试剂盒购自英国Abcam公司;BNP、PCT、CRP、PCT(送我院检验科检测);入ICU当日急性生理学与慢性健康状况评分系统Ⅱ(APACHE Ⅱ)评分及28 d预后。
1.3 统计学方法使用SPSS 24.0软件处理数据,计量资料先行正态检验,符合正态分布者以均数±标准差(Mean±SD)表示,两组间比较采用成组t检验;非正态计量资料用中位数(四分位数)[M(P25, P75)]不是,采用Mann-Whitney U检验;使用Spearman相关性分析考察指标间的相关性。使用GraphPad Prism 7绘制受试者工作特征曲线(receiver operating characteristic curve,ROC),评估血清BNP、suPAR、CRP、PCT、APACHE Ⅱ对血流感染早期诊断及预测预后的能力。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况共收集65例符合诊断标准的血流感染患者,其中男性38例,女27例;年龄28~80岁;感染部位:肺部28例、腹部19例、泌尿道8例、无明确感染部位10例。感染细菌:鲍曼不动杆菌6例;白色假丝酵母菌4例;光滑假丝酵母菌3例;大肠埃希菌6例;肺炎克雷伯菌11例;铜绿假单胞菌5例;洋葱伯克霍尔德菌2例;葡萄球菌17例;其他11例。非血流感染组100例患者根据临床症状及相关炎症指标显示存在感染,但不符合血流感染相关诊断。
2.2 非血流感染组与血流感染组患者血清各指标及评分的比较血流感染组和非血流感染组比较血清suPAR、BNP、CRP、PCT、APACHE Ⅱ评分的差异,血流感染组患者的血清suPAR、BNP、CRP、PCT、APACHE Ⅱ评分均高于非血流感染组(均P < 0.05),见表 1。
| 指标 | 非血流感染组(n=100) | 血流感染组(n=65) | 统计值 | P值 |
| suPAR (ng/mL, Mean±SD) |
4.56±3.91 | 12.39±3.62 | 0.345 | 0.006 |
| BNP [pg/mL, M(P25, P75)] |
98 (45, 342) | 321(110, 679) | 6.127 | 0.026 |
| CRP[mg/L, M(P25, P75)] | 89 (46, 123) | 132(96, 178) | 4.596 | 0.032 |
| PCT (ng/mL, Mean±SD) |
22.1±18.1 | 67.2±32.9 | 7.406 | < 0.01 |
| APACHE Ⅱ评分 (Mean±SD) |
11.91±5.86 | 19.91±7.89 | 5.645 | < 0.01 |
根据患者不同预后比较血清suPAR、BNP、CRP、PCT、APACHE Ⅱ评分水平表达的差异,死亡组患者的血清suPAR、BNP、CRP、PCT、APACHE Ⅱ评分高于存活组(均P < 0.05),见表 2。
| 指标 | 生存组(n=39) | 死亡组(n=26) | 统计值 | P值 |
| suPAR (ng/mL, Mean±SD) |
8.17±2.76 | 17.84±4.91 | 2.345 | 0.003 |
| BNP [pg/mL, M(P25, P75)] |
106(62.7, 372) | 678(570, 839) | 6.201 | 0.016 |
| CRP[mg/L, M(P25, P75)] | 106(84, 148) | 144(100, 192) | 4.124 | 0.012 |
| PCT (ng/mL, Mean±SD) |
31.23±6.46 | 55.34±9.78 | 4.172 | 0.003 |
| APACHE Ⅱ评分 (Mean±SD) |
14.91±6.64 | 28.13±7.56 | 9.689 | < 0.01 |
血清suPAR、BNP、CRP、PCT、APACHE Ⅱ评分不符合正态分布,数据经对数转化后近似正态分布,将对数转化后的数据进行Pearson线性相关分析。suPAR、BNP、PCT与APACHE Ⅱ评分之间呈正相关,相关系数(r)分别为0.503、0.548、0.781,P值分别为0.012、0.024、0.001。CRP与APACHE Ⅱ评分之间无显著相关(RS=0.264,P=0.261)。
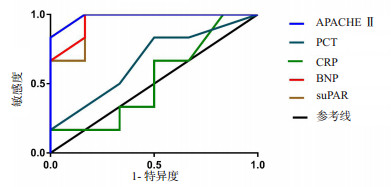
2.5 血清suPAR、BNP、CRP、PCT、APACHE Ⅱ评分对预后的预测作用血清suPAR、BNP、CRP、PCT水平和APACHE Ⅱ评分对预后的预测能力ROC曲线结果见表 3和图 1。
| 指标 | AUC | 95%CI | S.E. | P值 |
| suPAR | 0.944 4 | 0.813~1.075 | 0.067 | 0.010 |
| BNP | 0.958 3 | 0.851~1.065 | 0.054 | 0.082 |
| CRP | 0.527 8 | 0.181~0.874 | 0.177 | 0.087 |
| PCT | 0.667 0 | 0.348~0.985 | 0.053 | 0.002 |
| APACHE Ⅱ评分 | 0.986 1 | 0.932~1.040 | 0.027 | 0.005 |
|
| 图 1 血清suPAR、BNP、CRP、PCT、APACHE Ⅱ评分水平对血流感染患者预后预测的ROC曲线 Fig 1 ROC curve analysis of serum suPAR, BNP, CRP, PCT and APACHE Ⅱ score in predicting the prognosis of patients with blood stream infection |
|
|
对于BSI的早期诊断及评估患者的预后是临床医生需注意的关键所在。血培养作为诊断血流感染的“金标准”, 目前已成为诊断和病情监测的常规而重要的手段之一;但由于获取“金标准”诊断耗时长,且ICU患者中多达70%已接受过抗感染治疗,影响了病原菌的阳性检出率,而且即使血培养病原菌检出阳性时患者可能已处于严重感染阶段,从而延误病情,并可增加患者的病死率[6]。而生物标志物是协助诊断的有力工具。理想的生物标志物能帮助早期诊断、危险分层、治疗监测和预后判断。目前可用于诊断感染的标志物多达一百多种,各有局限性,理想的标志物仍需探索[7-8]。
尿激酶型纤溶酶原激活物受体(receptorurokinase-type plasminogen activator receptor, uPAR),是一种在白细胞表达的表面信号受体,可在血液和体液中检测。其血清浓度能反映免疫系统的激活。有研究证实,uPAR在评估严重感染患者病死率的价值优于对严重感染的诊断价值[9-10]。PCT是近年来用来评估感染的血清标志物[11],指南推荐用于细菌性感染的辅助性诊断标志物。研究显示PCT鉴别细菌性感染明显优于CRP[12]。但是PCT在手术、急性移植物宿主病、心源性休克以及免疫治疗等情况下也可增高,同时PCT的高低可能与血流感染患者的严重程度及预后并无明显相关性[13-15]。因此,PCT的解读需结合患者具体临床情况。
血流感染患者血浆suPAR升高,升高的机制可能是由于在感染的情况下,uPAR在白细胞表面的表达增高,它可以结合β-整联蛋白,从而调节白细胞的粘附、游走和分化。在机体的免疫防御中发挥枢纽作用。已有基础研究证明uPAR的这一作用。在铜绿假单胞菌肺炎动物模型中,uPAR基因敲除小鼠与野生小鼠相比,中性粒细胞的募集能力明显下降[16];细胞膜表面的uPAR可调节抗原致敏引起的淋巴细胞向肺部的募集[17]。以上证据表明uPAR在炎症反应的起始阶段(即炎症细胞的趋化和渗出)起重要作用,从而有利于感染的清除。升高的uPAR水平与升高的suPAR水平相关[18]。白细胞膜表面大量表达的uPAR在GPI锚处断裂后释放至血循环中,形成suPAR。suPAR比细胞膜表面的uPAR更容易监测,即可在早期发现感染的存在。本研究中血流感染患者suPAR明显高于非感染患者,提示suPAR在预测血流感染有一定价值,但是与传统感染相关指标PCT、CRP比较并不具有优势,并且稳定较差;但是死亡患者的suPAR明显高于生存者,提示suPAR对于预测血流感染患者预后存在一定价值,本实验ROC曲线也提示suPAR对于预后的预测作用优于PCT、CRP等传统炎症指标。
BNP或N末端脑钠肽前体(N-terminal pro-B-type natriuretic peptide, NT-proBNP)是心力衰竭的重要标志物[19],研究发现BNP或NT-proBNP是感染的诊断和死亡的重要预测指标之一[20-21],但BNP的诊断严重感染的价值仍有争议[22]。上述标志物在BSI的诊断和评估预后中的价值,仍需进一步研究。
本研究认为,血流感染患者易发生心肌灌注不足从而导致部分患者可发生心脏损伤,出现心脏损伤后可使患者的预后更加不良。血流感染患者出现休克时心脏损伤的发生率更高,病死率也更高。监测BNP在一定程度上反映心脏损伤的程度及预后,本研究也证实血流死亡患者BNP水平明显高于生存患者。血流感染患者BNP增高的原因与炎症介质的大量释放造成的心肌损害,BNP的转录增加,大量、快速的扩容补液有关[23]。有研究表明因心血管系统受损而死亡的脓毒症患者占脓毒症死亡患者的50%以上,其机制主要是发生脓毒症时,包括心脏在内的多个组织器官局部血流动力学发生异常,导致微循环障碍,继而心脏局部缺血,心肌细胞的线粒体结构随之发生改变,出现代谢功能障碍而死亡[24-25]。本研究发现和suPAR类似,BNP与传统感染相关指标PCT、CRP比较也不具有优势;但通过ROC曲线也提示BNP对于患者死亡预后的预测作用优于PCT、CRP等传统炎症指标。
本研究认为单独使用某一种标志物在临床诊断及预后方面效果有限,而用多种标志物联合诊断血流感染患者,诊断及预测的能力会有所提高。总之,尚需大型、前瞻性研究来验证各指标的动态变化对血流感染患者预后的预测价值。
| [1] | Angus DC, Linde-Zwirble WT, Lidicker J, et al. Epidemiology of severe sepsis in the United States:Analysis of incidence, outcome, and associated costs of care[J]. Crit Care Med, 2001, 29(7): 1303-1310. DOI:10.1097/00003246-200107000-00002 |
| [2] | 孙伏喜, 冯旰珠, 高天明, 等. 综合重症监护病房肠杆菌科细菌致血流感染发生的危险因素[J]. 中华医学杂志, 2014, 94(9): 684-687. DOI:10.3760/cma.j.issn.0376-2491.2014.09.012 |
| [3] | Marra AR, Camargo LFA, Pignatari ACC, et al. Nosocomial bloodstream infections in brazilian hospitals:analysis of 2, 563 cases from a prospective nationwide surveillance study[J]. J Clin Microbiol, 2011, 49(5): 1866-1871. DOI:10.1128/jcm.00376-11 |
| [4] | Dick A, Liu HS, Zwanziger J, et al. Long-term survival and healthcare utilization outcomes attributable to sepsis and pneumonia[J]. BMC Health Serv Res, 2012, 12: 432. DOI:10.1186/1472-6963-12-432 |
| [5] | CDC. Bloodstream infection event. 2016. Available at: http://www.cdc.gov/nhsn/PDFs/pscManual/4PSC_CLABScurrent.pdf |
| [6] | 陈炜, 赵磊, 牛素平, 等. 不同炎症因子对细菌性血流感染所致脓毒症患者的早期诊断价值[J]. 中华危重病急救医学, 2014, 26(3): 165-170. DOI:10.3760/cma.j.issn.2095-4352.2014.03.008 |
| [7] | Cho SY, Choi JH. Biomarkers of sepsis[J]. Infect Chemother, 2014, 46(1): 1. DOI:10.3947/ic.2014.46.1.1 |
| [8] | Pierrakos C, Vincent JL. Sepsis biomarkers:a review[J]. Crit Care, 2010, 14(1): R15. DOI:10.1186/cc8872 |
| [9] | Koch A, Voigt S, Kruschinski C, et al. Circulating soluble urokinase plasminogen activator receptor is stably elevated during the first week of treatment in the intensive care unit and predicts mortality in critically ill patients[J]. Crit Care, 2011, 15(1): R63. DOI:10.1186/cc10037 |
| [10] | Wu XL, Long D, Yu L, et al. Urokinase-type plasminogen activator receptor as a predictor of poor outcome in patients with systemic inflammatory response syndrome[J]. World J Emerg Med, 2013, 4(3): 190-195. DOI:10.5847/wjem.j.issn.1920-8642.2013.03.006 |
| [11] | Tang BM, Eslick GD, Craig JC, et al. Accuracy of procalcitonin for sepsis diagnosis in critically ill patients:systematic review and meta-analysis[J]. Lancet Infect Dis, 2007, 7(3): 210-217. DOI:10.1016/s1473-3099(07)70052-x |
| [12] | Dellinger RP, Levy MM, Carlet JM, et al. Surviving Sepsis Campaign:international guidelines formanagement of severe sepsis and septic shock:2008[J]. Crit Care Med, 2008, 36(1): 296-327. DOI:10.1007/s00134-007-0934-2 |
| [13] | Schuetz P, Mueller B, Trampuz A. Serum procalcitonin for discrimination of blood contamination from bloodstream infection due to coagulase-negative staphylococci[J]. Infection, 2007, 35(5): 352-355. DOI:10.1007/s15010-007-7065-0 |
| [14] | Theodorou VP, Papaioannou VE, Tripsianis GA, et al. Procalcitonin and procalcitonin kinetics for diagnosis and prognosis of intravascular catheter-related bloodstream infections in selected critically ill patients:a prospective observational study[J]. BMC Infect Dis, 2012, 12: 247. DOI:10.1186/1471-2334-12-247 |
| [15] | 降钙素原急诊临床应用专家共识组. 降钙素原(PCT)急诊临床应用的专家共识[J]. 中华急诊医学杂志, 2012, 21(9): 944-951. DOI:10.3760/cma.j.issn.1671-0282.2012.09.005 |
| [16] | Gyetko MR, Sud S, Kendall T, et al. Urokinase receptor-deficient mice have impaired neutrophil recruitment in response to pulmonary pseudomonas aeruginosa infection[J]. J Immunol, 2000, 165(3): 1513-1519. DOI:10.4049/jimmunol.165.3.1513 |
| [17] | Gyetko MR, Sud S, Sonstein J, et al. Cutting edge:antigen-driven lymphocyte recruitment to the lung is diminished in the absence of urokinase-type plasminogen activator (uPA) receptor, but is independent of uPA[J]. J Immunol, 2001, 167(10): 5539-5542. DOI:10.4049/jimmunol.167.10.5539 |
| [18] | Mustjoki S, Sidenius N, Sier CF, et al. Soluble urokinase receptor levels correlate with number of circulating tumor cells in acute myeloid leukemia and decrease rapidly during chemotherapy[J]. Cancer Res, 2000, 60(24): 7126. |
| [19] | de Lemos JA, McGuire DK, Drazner MH. B-type natriuretic peptide in cardiovascular disease[J]. Lancet, 2003, 362(9380): 316-322. DOI:10.1016/s0140-6736(03)13976-1 |
| [20] | Papanikolaou J, Makris D, Mpaka M, et al. New insights into the mechanisms involved in B-type natriuretic peptide elevation and its prognostic value in septic patients[J]. Crit Care, 2014, 18(3): R94. DOI:10.1186/cc13864 |
| [21] | McLean AS, Huang SJ. Brain not processing:is finding a role for BNP in sepsis like fitting a square peg into a round hole?[J]. Crit Care, 2014, 18(4): 161. DOI:10.1186/cc13960 |
| [22] | Paratz JD, Lipman J, Boots RJ, et al. A new marker of sepsis post burn injury?[J]. Crit Care Med, 2014, 42(9): 2029-2036. DOI:10.1097/ccm.0000000000000400 |
| [23] | 冀晓俊, 段美丽, 李昂. BNP检测对脓毒症心肌损伤的诊断价值[J]. 中国分子心脏病学杂志, 2010, 10(4): 207-209. DOI:10.16563/j.cnki.1671-6272.2010.04.017 |
| [24] | Pulido JN, Afessa B, Masaki M, et al. Clinical spectrum, frequency, and significance of myocardial dysfunction in severe sepsis and septic shock[J]. Mayo Clin Proc, 2012, 87(7): 620-628. DOI:10.1016/j.mayocp.2012.01.018 |
| [25] | Werdan K, Schmidt H, Ebelt H, et al. Impaired regulation of cardiac function in sepsis, SIRS, and MODS[J]. Can J Physiol Pharmacol, 2009, 87(4): 266-274. DOI:10.1139/Y09-012 |
 2019, Vol. 28
2019, Vol. 28




