2 北京市顺义区医院急诊科 101300;
3 首都医科大学附属北京朝阳医院急诊科 100020
脓毒症和脓毒症休克第三次国际会议共识重新定义脓毒症是宿主对感染反应失调引起的危及生命的器官功能障碍。器官功能障碍定义为序贯器官衰竭评分(SOFA)≥2分。脓毒症休克患者临床上常表现为在循环血容量充足的情况下需要应用血管活性药物维持平均动脉压≥65 mmHg(1 mmHg=0.133 kPa)或是血清乳酸 > 2 mmol/L。脓毒症患者病死率可高达40%[1]。脓毒症患者应尽早诊断,包括确定感染的存在以及病情的评估[2]。早期检测炎症指标有助于脓毒症的早期诊断,对于判断脓毒症的严重程度和预后有着重要的临床意义。本研究意旨通过患者血清中正五聚蛋白-3(pentraxin-3,PTX-3)增高的浓度及中性粒细胞与淋巴细胞比值(NLR)及SOFA评分与急性生理学与慢性健康状况评分系统(APACHE)Ⅱ评分对脓毒症患者病情严重程度及预后做出客观的评估。
1 资料与方法 1.1 一般资料选取2017年3月至2017年8月首都医科大学附属北京朝阳医院急诊科符合脓毒症诊断的患者。记录患者的血压、体质量、身高。同时完善该患者的临床生化指标包括:血常规,血气及APACHE Ⅱ评分,SOFA评分等。按7 d患者预后分为存活组和死亡组。
排除条件:年龄 < 18岁;妊娠;糖尿病;恶性肿瘤晚期患者;自身免疫性疾病及移植术后患者或长期服用免疫抑制剂及激素患者;严重肝、肾功能不全;心功能4级;常见的血栓栓塞性疾病(包括急性心肌梗死、急性脑梗死、主动脉夹层、肺栓塞、下肢动脉血栓、肠系膜动脉栓塞等)。
本研究通过首都医科大学附属北京朝阳医院伦理委员会审查。
1.2 研究方法 1.2.1 PTX-3测量患者进入急诊科抢救室后利用枸橼酸钠抗凝管抽血,-80℃冰箱中保存待测。采用酶联免疫吸附试验(ELISA)检测PTX-3浓度。PTX-3试剂盒购自美国R & D公司上海代理分公司。为避免标本反复冻融而影响检测数据结果及检测过程中的批次间误差和测量误差,以上检测均在全部标本收集后一次性解冻,成批检测。严格按照说明书流程操作。
1.2.2 其他临床数据收集记录患者入室后生命体征,完善SOFA、APACHE Ⅱ评分及血常规,生化全项,血气的数据记录。
1.2.3 两组基线资料以及预后指标的比较患者年龄、平均动脉压、体质量指数、白细胞总数、中性粒细胞绝对值、淋巴细胞绝对值、血清尿素氮(BUN)、活化部分凝血活酶时间(APTT)、谷丙转氨酶(ALT)、总胆红素(TBIL);APACHE Ⅱ评分及SOFA评分;统计患者7 d病死率。
1.3 统计学方法运用SPSS 21.0软件进行数据处理。正态分布的计量资料以均数±标准差(Mean±SD)表示,组间比较采用成组t检验;计数资料组间比较采用χ2检验。变量间的相关性采用Pearson相关分析。绘制各指标对预后评价的受试者工作特征曲线(ROC),比较ROC曲线下面积(AUC)。以P < 0.05为差异有统计学意义。
2 结果 2.1 入选脓毒症患者的临床特征和基本资料入组的100例患者中存活组患者75例,死亡组患者25例。存活组患者与死亡组患者两组之间年龄比较差异无统计学意义(P > 0.05),存活组与死亡组患者的其他基线资料及临床特征可从表 1中生化指标间接反映。其中体质量指数(BMI)、平均动脉压(MAP)、APTT、TBIL、ALT、白细胞总数(WBC),中性粒细胞绝对值(N#)、血小板计数(PLT)均差异无统计学意义(P > 0.05)。两组患者基线资料表明存活组与死亡组患者在入选早期其凝血功能、肝功能、血液系统功能均差异无统计学意义。两组患者之间的数据具有一定的可比性。
| 指标 | 存活组(n=75) | 死亡组(n=25) | P值 |
| 年龄(岁) | 71.27±14.49 | 74.90±15.09 | 0.283 |
| BMI(kg/cm2) | 24.06±2.04 | 23.28±3.14 | 0.254 |
| MAP(mmHg) | 81.06±16.22 | 80.92±20.77 | 0.972 |
| ALT (U/L) | 46.52±112.83 | 44.24±95.20 | 0.928 |
| APTT(s) | 36.25±16.19 | 36.16±11.09 | 0.981 |
| Lac (mmol/mL) | 1.34±0.806 | 3.03±2.91 | 0.008 |
| WBC(×109/L) | 10.87±6.59 | 12.72±6.91 | 0.234 |
| N#(×109/L) | 9.41±6.41 | 11.52±6.52 | 0.159 |
| LY(×109/L) | 0.98±0.85 | 0.64±0.34 | 0.050 |
| PLT(×109/L) | 162.90±112.83 | 191.60±123.77 | 0.285 |
| TBIL(μmon/L) | 16.65±16.99 | 15.48±9.36 | 0.774 |
| BUN(mmon/L) | 10.82±10.60 | 16.16±13.32 | 0.044 |
| SOFA(分) | 5.31±2.93 | 8.08±4.46 | 0.008 |
| APACHE Ⅱ(分) | 19.44±6.34 | 26.29±7.10 | < 0.01 |
| PTX-3(ng/mL) | 17.25±15.45 | 36.59±14.77 | < 0.01 |
| NLR | 13.99±14.80 | 21.14±15.04 | 0.040 |
| 注:BMI为体质量指数;MAP为平均动脉压;ALT为谷丙转氨酶;APTT为活化部分凝血活酶时间;Lac为血乳酸;WBC为白细胞;N#为中性粒细胞绝对值;LY为淋巴细胞绝对值;PLT为血小板计数;TBIL为总胆红素;BUN为血清尿素氮;SOFA为序贯器官衰竭评分;APACHE Ⅱ为急性生理学与慢性健康状况评分系统Ⅱ;PTX-3为正五聚蛋白-3;NLR为中性粒细胞与淋巴细胞比值 | |||
但存活组患者BUN水平(10.82±10.60)mmol/L与死亡组(16.16±13.32)mmol/L、存活组NLR(13.99±14.80)和死亡组(21.14±15.04)差异有统计学意义(P < 0.05)。
生存组SOFA评分(5.31±2.93分)和死亡组SOFA评分(8.08±4.46分)、生存组APACHE Ⅱ评分(19.44±6.34分)和死亡组APACHE Ⅱ评分(26.29±7.10分)、生存组血浆中PTX-3浓度(17.25±15.45)ng/mL与死亡组(36.59±14.77)ng/mL,以及生存组血浆乳酸水平(1.34±0.806)mmol/mL与死亡组(3.03±2.91)mmol/mL,差异均有统计学意义(P < 0.05)。
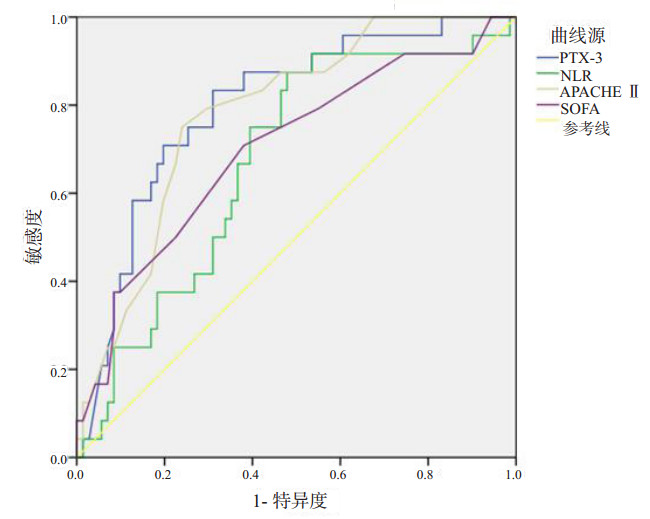
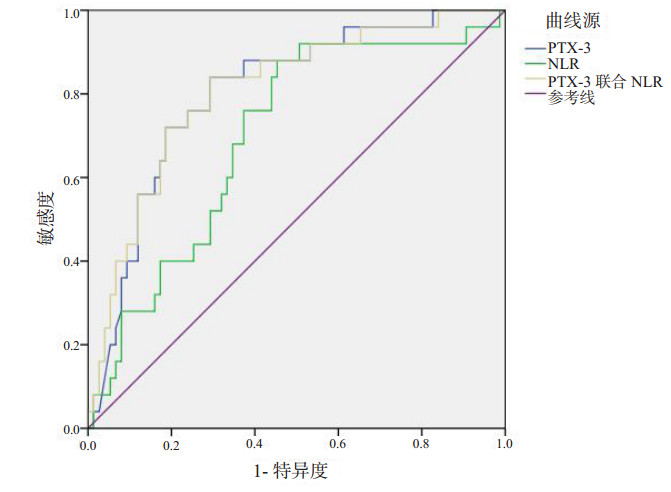
2.2 不同指标对脓毒症患者预后的评估通过比较,可以得出不同生物标志物对脓毒症患者7 d病死率预测的评估能力。PTX-3 ROC曲线下面积(AUC)最大,为0.803,就其单独作为预测指标表明PTX-3对脓毒症患者7 d的病死率预测能力高于同期的SOFA评分(AUC=0.701)及APACHE Ⅱ评分(AUC=0.782)。然而NLR作为独立指标对脓毒症患者7 d病死率预测的敏感度较高(88%)而特异度(54.7%)较低。其中PTX-3联合NLR AUC=0.807,两个指标联合可以明显提高对脓毒症患者7 d病死率预测的特异度(P < 0.01)。见表 2和图 1~2。
| 指标 | AUC | P值 | 95% CI | 截断值 | 敏感度(%) | 特异度(%) |
| PTX-3 (ng/mL) | 0.803 | < 0.01 | 0.707~0.899 | 20.11 | 0.840 | 0.710 |
| NLR | 0.698 | 0.003 | 0.582~0.813 | 9.48 | 0.880 | 0.547 |
| SOFA评分 | 0.701 | 0.003 | 0.576~0.826 | 5.5 | 0.708 | 0.620 |
| APACHE Ⅱ评分 | 0.782 | < 0.01 | 0.684~0.880 | 22.5 | 0.750 | 0.761 |
| PTX-3联合NLR | 0.807 | < 0.01 | 0.709~0.904 | 0.832 | 0.707 | 0.840 |
| 注:PTX-3为正五聚蛋白3;NLR为中性粒细胞与淋巴细胞比值;AUC为曲线下面积;95%CI为95%可信区间;APACHE Ⅱ为急性生理学与慢性健康状况评分系统Ⅱ;SOFA为序贯器官衰竭评分 | ||||||
|
| 图 1 PTX-3、NLR、APACHE Ⅱ、SOFA评分预测脓毒症病死率预测的ROC曲线 |
|
|
|
| 图 2 PTX-3、NLR、PTX-3联合NLR对脓毒症病死率预测的ROC曲线 |
|
|
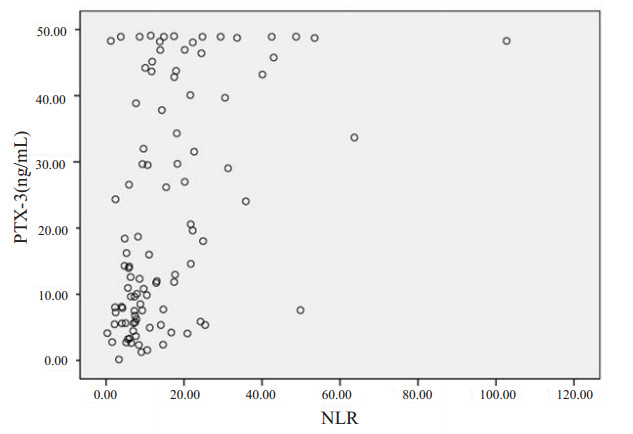
图 1及图 2分别表明了不同研究指标所绘制的受试者工作特征曲线图。图 1为不同指标所绘制的ROC曲线间。综合上述4项单一指标间的比较可以看出PTX-3对脓毒症患者预后的评估有着良好的优势。PTX-3与传统的APACHE Ⅱ评分存在着一定的可比性。间接说明PTX-3在预测脓毒症患者病情的严重程度上有一定的可靠性。图 3为PTX-3与NLR的相关性分析,其Pearson相关系数r=0.455(中度相关),P < 0.01,说明PTX-3血浆浓度和NLR存在着一定的相关性。
|
| 图 3 PTX-3与NLR相关性 |
|
|
到目前为止没有诊断脓毒症的金标准,没有可靠的方法对脓毒症进行风险预测与评估[3]。而生物标志物是个性化治疗的关键[4],其在脓毒症的整个诊断及治疗过程中起着至关重要的作用。PTX-3是由Breviario等[5]发现的一类炎症因子,为五聚体结构蛋白。缺乏PTX-3可能促进中性粒细胞的聚集、细胞死亡和炎症反应。PTX-3在正常人血浆中浓度 < 2 ng/mL,炎症刺激后血浆中6~8 h可达到PTX-3峰值。在内毒素休克时可明显增高至200~800 ng/mL[6]。PTX-3可由IL-1β、肿瘤坏死因子-α(TNF-α)、脂多糖(LPS)、膜蛋白A(OmpA)刺激多种细胞产生并释放。临床上常见的可释放PTX-3细胞包括:单核巨噬细胞、树突细胞、纤维母细胞和内皮细胞。其中树突状细胞是产生PTX-3的主要来源[7]。一项研究显示PTX-3基因缺陷的小鼠更容易受到曲霉菌的感染而外源性补充PTX-3后此种现象可消失。在离体细胞试验中PTX-3可以使猪链球菌复制峰值延迟,同时增加猪肺泡巨噬细胞对链球菌的摄取率以及可降低细菌的粘附性。实验结果提示PTX-3随着浓度的增加,其对大肠埃希菌、沙门菌、霍乱弧菌复制的抑制作用明显增强,该研究同时证明PTX-3可以降低流感病毒感染后受试动物体内的病毒载量,可以减少感染小鼠组织器官(肺、脑等组织)的细菌载量,可以显著降低脑部链球菌感染后小鼠的病死率[8]。上述实验结果及离体细胞结果间接证实PTX-3存在着一定的生物学活性,且其生物学活性随着浓度的增加可出现对病原体的抑制作用增强,由此说明炎症反应及感染的早期PTX-3存在着一定的抑制炎症反应及清除病原体的生物学作用。
本研究中脓毒症患者血浆中PTX-3浓度的结果表明,初诊时患者血浆PTX-3浓度越高,其7 d病死率越高。截断值为20.11 ng/mL,预测7 d病死率的敏感度为84%,特异度为71%,死亡组患者PTX-3水平与存活组PTX-3浓度差异有统计学意义(P < 0.01)。就PTX-3单一指标而言其ROC曲线下面积均大于同期SOFA评分及APACHE Ⅱ评分。且其敏感度与特异度均高于同期SOFA评分与APACHE Ⅱ评分,这也提示早期PTX-3浓度与传统的病理生理学系统评分相比较,具有较高的准确性及一定的可靠性,这在某种程度上间接反映了PTX-3对脓毒症患者的近期预后及患者病情的严重程度有研究潜力。同时此项结果与临床等多项研究结果相仿[9-11],均提示在感染患者中,感染程度越重其血浆中PTX-3浓度越高,而PTX-3浓度越高其病死率越高,住院时间越长,花费越大,预后越差[12]。
大量研究表明NLR在临床治疗中是一种简单、理想的炎症标志物。其具有速效,廉价特点,而且相对容易评估、预测和判断,获取容易无需额外的临床检查。NLR增高预示着较高的感染风险[13-15],在预测住院期间生存率和病死率具有极大的优势[16]。中性粒细胞可以反映机体的炎症情况,淋巴细胞可以反映机体的免疫状态,中性粒细胞过度激活可引起实质器官破坏导致多器官功能失调。淋巴细胞计数的降低表明机体免疫状态失衡及下降,无法有效调控特异性免疫反应以抵抗病原体感染,使宿主更容易受到外源性病原体感染。不同种族之间中性粒细胞与淋巴细胞比值各不相同。一项研究显示亚洲人种NLR平均值为1.65,较其他人种低,男性平均值为1.63,女性平均值为1.66[17]。其水平升高意味着中性粒细胞绝对值的升高或淋巴细胞绝对值的相对减少,前者可反映出炎症反应增加,后者反映机体免疫功能下降。
脓毒症患者中存在着淋巴细胞的耗竭与免疫麻痹[18],监测脓毒症患者的NLR对感染患者的预后有较大意义[19]。本研究结果显示,生存组与死亡组两者的中性粒细胞绝对值差异无统计学意义(P=0.159),NLR差异有统计学意义(P < 0.05),表明此种差异源于淋巴细胞绝对值的下降,进一步表明脓毒症感染患者早期出现机体的免疫功能下降及机体的特异性免疫反应减弱而导致感染加重,从而导致病死率增加。故NLR出现增高现象可以作为早期风险预警标志物,NLR越高其炎症反应越重。
本研究结果显示单独应用NLR预测脓毒症患者7 d的病死率截断值为9.48。其敏感度为88%,特异度为54.7%,其ROC曲线下面积为0.698,提示其在预测脓毒症患者7 d病死率存在一定的意义,但特异性较低。为了弥补NLR对脓毒症患者预后评估所存在的缺陷,笔者将临床上两个存在一定相关性指标相联合,从而探寻多个临床指标的结合是否可以更好地预测疾病的状态及预后。由图 3可看出,NLR与PTX-3存在着一定的相关性。故本研究进一步将PTX-3血浆浓度和NLR联合对脓毒症患者7 d病死率分析得出ROC曲线下面积为0.807,其结果敏感度为70.7%,特异度为84%。与单独应用PTX-3血浆浓度或NLR比较,两个指标的联合可以提高其对脓毒症患者7 d病死率预测的特异度。临床上PTX-3的血浆浓度比较容易获得且较为准确及客观,同时NLR可从血常规获得,两者结合可提高对脓毒症患者7 d病死率的预测特异度。这也为脓毒症患者早期病情严重程度的判断提供了新的思路。
由此可见PTX-3作为早期炎症介质及其在脓毒症预后的判断中存在着一定的价值[20],得进一步发掘。PTX-3血浆浓度可较好地预测脓毒症患者7 d病死率,而PTX-3联合NLR可明显提高对脓毒症患者7 d病死率预测的特异度。
| [1] | Seymour CW, Liu VX, Iwashyna TJ, et al. Assessment of clinical criteria for sepsis:for the third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 762-774. DOI:10.1001/jama.2016.0288 |
| [2] | 中华医学会急诊医学分会, 中国医师协会急诊医师分会, 中国人民解放军急救医学专业委员会, 等. 脓毒症液体治疗急诊专家共识[J]. 中华急诊医学杂志, 2018, 27(1): 30-38. DOI:10.3760/cma.j.issn.1671-0282.2018.01.007 |
| [3] | Cohen J, Vincent JL, Adhikari NKJ, et al. Sepsis:a roadmap for future research[J]. Lancet Infect Dis, 2015, 15(5): 581-614. DOI:10.1016/s1473-3099(15)70112-x |
| [4] | Perner A, Rhodes A, Venkatesh B, et al. Sepsis:frontiers in supportive care, organisation and research[J]. Intensive Care Med, 2017, 43(4): 496-508. DOI:10.1007/s00134-017-4677-4 |
| [5] | Breviario F, d' Aniello EM, Golay J, et al. Interleukin-1-inducible genes in endothelial cells. Cloning of anew gene related to C-reactive protein and serumamyloid P component[J]. J Biol Chem, 1992, 267(31): 22190-22197. DOI:10.1016/S0022-5193(05)80771-4 |
| [6] | Lee YT, Gong MQ, Chau A, et al. Pentraxin-3 as a marker of sepsis severity and predictor of mortality outcomes:A systematic review and meta-analysis[J]. J Infect, 2018, 76(1): 1-10. DOI:10.1016/j.jinf.2017.10.016 |
| [7] | Kunes P, Holubcova Z, Kolackova M, et al. Pentraxin 3(PTX 3):an endogenous modulator of the inflammatory response[J]. Mediators Inflamm, 2012, 2012: 920517. DOI:10.1155/2012/920517 |
| [8] | Xu JQ, Mu YJ, Zhang Y, et al. Antibacterial effect of porcine PTX3 against Streptococcus suis type 2 infection[J]. Microb Pathog, 2015, 89: 128-139. DOI:10.1016/j.micpath.2015.09.011 |
| [9] | Hu CG, Zhou YF, Liu C, et al. Pentraxin-3, procalcitonin and lactate as prognostic markers in patients with sepsis and septic shock[J]. Oncotarget, 2018, 9(4): 5125-5136. DOI:10.18632/oncotarget.23701 |
| [10] | Kim SB, Lee KH, Lee JU, et al. Long pentraxin 3 as a predictive marker of mortality in severe septic patients who received successful early goal-directed therapy[J]. Yonsei Med J, 2017, 58(2): 370-379. DOI:10.3349/ymj.2017.58.2.370 |
| [11] | Hansen MB, Rasmussen LS, Garred P, et al. Pentraxin-3 as a marker of disease severity and risk of death in patients with necrotizing soft tissue infections:a nationwide, prospective, observational study[J]. Crit Care, 2016, 20(1): 40. DOI:10.1186/s13054-016-1210-z |
| [12] | Simsek O, Kocael A, Kocael P, et al. Inflammatory mediators in the diagnosis and treatment of acute pancreatitis:pentraxin-3, procalcitonin and myeloperoxidase[J]. Arch Med Sci, 2018, 14(2): 288-296. DOI:10.5114/aoms.2016.57886 |
| [13] | Nam KW, Kim T J, Lee JS, et al. High neutrophil-to-lymphocyte ratio predicts stroke-associated pneumonia[J]. Stroke, 2018, 49(8): 1886-1892. DOI:10.1161/strokeaha.118.023078 |
| [14] | Beliaev AM, Booth M, Rowbotham D, et al. Diagnostic inflammatory markers in acute cholangitis[J]. J Surgi Res, 2018, 228: 35-41. DOI:10.1016/j.jss.2018.02.048 |
| [15] | O' Connell RM, Boland MR, O' Driscoll J, et al. Red cell distribution width and neutrophil to lymphocyte ratio as predictors of outcomes in acute pancreatitis:A retrospective cohort study[J]. Int J Surg, 2018, 55: 124-127. DOI:10.1016/j.ijsu.2018.05.028 |
| [16] | Taylan M, Demir M, Kaya H, et al. Alterations of the neutrophil-lymphocyte ratio during the period of stable and acute exacerbation of chronic obstructive pulmonary disease patients[J]. Clin Respir J, 2017, 11(3): 311-317. DOI:10.1111/crj.12336 |
| [17] | Lee JS, Kim NY, Na SH, et al. Reference values of neutrophil-lymphocyte ratio, lymphocyte-monocyte ratio, platelet-lymphocyte ratio, and mean platelet volume in healthy adults in South Korea[J]. Medicine, 2018, 97(26): e11138. DOI:10.1097/md.0000000000011138 |
| [18] | 马帅, 郭树彬. 脓毒症免疫麻痹与细胞免疫调理治疗研究进展[J]. 中华急诊医学杂志, 2016, 25(7): 969-973. DOI:10.3760/cma.j.issn.1671-0282.2016.07.027 |
| [19] | 杨萌, 李丽娟, 苏楠, 等. 动态监测外周血中性粒细胞/淋巴细胞比值能够预测血流感染患者的预后[J]. 中华危重病急救医学, 2015, 27(6): 471-476. DOI:10.3760/cma.j.issn.2095-4352.2015.06.011 |
| [20] | Hamed S, Behnes M, Pauly D, et al. Diagnostic value of Pentraxin-3 in patients with sepsis and septic shock in accordance with latest sepsis-3 definitions[J]. BMC Infect Dis, 2017, 17(1): 554. DOI:10.1186/s12879-017-2606-3 |
 2019, Vol. 28
2019, Vol. 28




