2 福建省立医院急诊内科,福州 350001;
3 福建省急诊医学研究所,福州 350001;
4 中山大学药学院,广州 510006
2 Department of Emergency Medicine, Fujian Provincial Hospital, Fuzhou 350001, China;
3 Fujian Institute of Emergency Medicine, Fuzhou 350001, China;
4 School of Pharmaceutical Sciences, Sun Yat-Sen University, Guangzhou 510006, China
心脏骤停(cardiac arrest, CA)是常见的严重临床事件,但心脏骤停患者的出院存活率一直很低,2017年在美国仅约为10.6%[1]。复苏后心功能不全(post-resuscitation myocardial dysfunction, PRMD)为初期自主循环恢复(restoration of spontaneous circulation, ROSC)后早期死亡的主要原因之一,是指ROSC后全心缺血-再灌注损伤引起的左心室收缩和舒张功能不全的病理状态,占复苏后患者45%~60% [2-3]。大鼠心肺复苏后心功能不全动态模型中发现,复苏后3 d大鼠的心脏彩超提示仍存在舒张功能障碍为主的心功能不全,且该舒张性心功能不全严重程度与生存时间成负相关[4]。HE染色进一步发现复苏后3 d存在心室壁内层间质增生,提示出现有心肌纤维增殖[5]。
心肌纤维化是导致心脏顺应性降低,舒张性心力衰竭的重要病理机制之一。血小板源性生长因子(platelet-derived growth factor, PDGF)通过活化血小板源性生长因子受体(platelet-derived growth factor receptor, PDGFR),进而激活细胞内一系列信号转导通路,在多器官纤维化的过程中起重要作用[6],但其在复苏后心肌间质增生中的作用仍不明确。因此本研究,拟通过大鼠室颤法心肺复苏模型,探讨PDGF-D/PDGFR-β信号在复苏后心肌纤维增殖形成中的可能作用。
1 材料与方法 1.1 腺病毒及抑制剂的制备携带绿色荧光蛋白基因的重组腺病毒(Ad-GFP)和携带PDGFR-β基因的重组腺病毒(Ad-PDGFR-β)均购置于山东维真生物科技公司,产品编号VH877053。伊马替尼(Imatinib,MCE,美国),经二甲基亚砜溶解为30 mg/ml的溶液备用。
1.2 实验动物及分组健康雄性Sprague-Dawley(SD)大鼠,8~11月龄。体质量550~650 g,均由中山大学实验动物中心提供,许可证号SYXK(粤)2017-0081。在到达实验室后清洁级饲养1周以稳定生理参数。本实验得到福建医科大学伦理委员会批准。手术操作前,接随机数字法将90只SD大鼠随机分为5组:分别是假手术组(Sham)、模型组(Control)、伊马替尼组(Imatinib)、Ad-GFP组及Ad-PDGFR组,在复苏后4 h和72 h取材,即分为复苏后4 h和72 h两个亚组。其中Sham组每个亚组各5只,其余各亚组每组各10只。复苏失败或复苏成功未存活至预设时间点者,不计入组。大鼠构建复苏模型前24 h,Imatinib组予30 mg/(kg·d)的伊马替尼灌胃。Control组予相同体积及浓度的二甲基亚砜灌胃。Ad-GFP组、Ad-PDGFR组予复苏前3 d经左颈静脉置管入右房分别注射1×109 pfu AdGFP或1×1010 pfu AdPDGFR。腺病毒稀释最终剂量为1 ml注射使用。
1.3 室颤法心肺复苏模型的构建 1.3.1 动物准备SD大鼠手术前晚禁食不禁水,戊巴比妥钠(Sigma-Aldrich,美国)45 mg/kg腹腔内注射麻醉,备皮,仰卧位固定,经口直视插入14号气管鞘管(Abbocath-T,美国),外接红外线呼气末二氧化碳监测仪(金脑人光电仪器,合肥,中国)检测呼气末二氧化碳分压(end-tidal carbon dioxide partial pressure, ETCO2)。左股动脉置入23号PE50聚乙烯管(Becton-Dickinson,美国)监测主动脉压力;肛门内置入一根热电偶微探头监测直肠温度;右颈外静脉置4 F鞘管(Cook Critical Care,美国)至右心房,鞘管前端弯曲的指引钢丝(正极)触及右心室内膜,皮下插入针头(负极),正负极形成回路,准备诱发室颤。持续记录肢体Ⅱ导联心电图,维持核心温度在(36.8±0.2)℃。所有的导管均充满5 U/ml肝素生理盐水并连接压力传感器,通过数据采集卡(Windaq Acquisition System,美国)实时记录数据并电脑存盘。
1.3.2 电刺激诱导室颤与心肺复苏以最大递增至3 mA交流电诱导心室颤动,持续刺激3 min以防止大鼠自动复律,撤除电刺激后维持未处理的室颤8 min。采用心肺复苏机械装置[中山大学心肺脑复苏研究所(专利号:ZL2006 20063261.9)]进行频率为200次/min的胸外按压和100次/min的同步机械通气,按压和呼吸比例为2 : 1,吸入氧体积分数为100%。持续胸外按压8 min后,给予连续最多3次4 J双相波除颤。如未出现ROSC,继续按压30 s后,再次判断,如仍为室颤,则再次连续最多3次相同能量的除颤,直至出现ROSC。重复3个循环,仍未ROSC视为复苏失败。ROSC定义为恢复室上性心律,平均动脉压(mean arterial pressure, MAP)≥60 mmHg(1 mmHg=0.133 kPa),并持续5 min以上。
1.3.3 术后处理与取材监测ETCO2至心肺复苏后4 h。各组分别于PR 4 h或PR 72 h采血后即安乐死,取部分左室心肌放入液氮中保存备行Western blot。剩余部分左室心肌置于冰生理盐水中,去除残血,用10 %甲醛溶液固定,石蜡包埋切片,备行苏木精-伊红(HE)染色染色和天狼猩红染色。常规解剖了解总体损伤情况,包括有无存在感染,或继发于导管置入、机械通气以及按压引起的损伤。
1.4 观察心肌组织病理改变左心室心肌取材,10 %甲醛溶液固定,脱水,透明,浸蜡,石蜡包埋,制作成4 μm的石蜡切片。HE染色观察心肌组织病理变化。
1.5 心肌纤维化检测左心室心肌取材,10 %甲醛溶液固定,制作成6 μm的石蜡切片。石蜡切片按照苦味酸-天狼星红胶原染色法染色,采用Leica显微镜照相系统拍照,利用Image J 1.8.0图像分析软件测量大鼠心肌间质胶原容积分数(Collagen volume fraction,CVF)即心肌间质胶原面积/视野总面积比值。
1.6 ELISA检测血清PDGF-DD使用ELISA试剂盒(CUSABIO,武汉,中国)检测血浆PDGF-DD,具体步骤根据产品说明书。
1.7 Western blot检测心肌组织中各蛋白含量蛋白提取后Bradford法定量,上样,湿转法转膜,5 %脱脂牛奶封闭,加入兔抗鼠α-SMA(1:1 000,Bioworld,美国)、小鼠抗大鼠波形蛋白(Vimintin,1:1 000,索莱宝,北京,中国)、PDGFR-β(1:5 000,Abcam,英国)、CollagenⅠ(1:1 000,Abcam,英国)4 ℃孵育过夜,HRP标记的山羊抗小鼠(1:20 000,索莱宝,北京,中国)或山羊抗兔二抗(1:20 000,索莱宝,北京,中国)37 ℃孵育60 min,以β微管蛋白(β-tubulin,索莱宝,北京,中国)作为内参,增强型化学发光试剂盒发光显影。Bio-Rad成像分析系统扫描,以Image J 1.8.0软件分析各样本灰度值。同时进行内参照β-tubulin蛋白的免疫印迹检测,以目的蛋白条带与β-tubulin条带灰度值的比值作为该样本目的蛋白的相对量。
1.8 统计学方法用SPSS22.0软件进行统计学分析。计量资料以均数±标准差(Mean±SD)表示,均通过正态性检验。多组间参数比较用二因素方差分析(two-way ANOVA),组间两两比较用Bonferroni检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组基线数据和复苏结果除Sham组10只外,80只大鼠进行复苏实验,复苏未成功13只,ROSC率为83.8 %(67/80)。各组大鼠体质量、心率、MAP、ETCO2、肛温的基线值差异无统计学意义(P > 0.05,表 1)。除Sham组,各组复苏过程中血流动力学及ROSC率的差异无统计学意义(P > 0.05,表 2)。各组复苏的时间及除颤次数的差异无统计学意义。至观察时间点共有14只大鼠死亡,均死于复苏后心功能不全。
| 组别 | 动物(只) | 体质量(g) | 心率(次/min) | MAP(mmHg) | ETCO2(mmHg) | 肛温(℃) |
| sham 4 h组 | 5 | 616±31 | 375±16 | 143±11 | 41±3 | 37.0±0.3 |
| control 4 h组 | 10 | 622±29 | 382±11 | 140±12 | 43±2 | 36.8±0.2 |
| Imatinib 4 h组 | 10 | 628±31 | 370±14 | 136±10 | 43±3 | 36.9±0.3 |
| Ad-GFP 4 h组 | 10 | 619±20 | 378±13 | 143±14 | 42±3 | 36.9±0.2 |
| Ad-PDGFR 4 h组 | 10 | 606±25 | 368±13 | 138±13 | 45±2 | 36.7±0.2 |
| sham 72 h组 | 5 | 620±33 | 377±17 | 137±15 | 40±3 | 36.7±0.3 |
| control 72 h组 | 10 | 613±34 | 371±15 | 141±11 | 43±3 | 36.8±0.2 |
| Imatinib 72 h组 | 10 | 627±28 | 372±14 | 144±14 | 45±3 | 37.1±0.3 |
| Ad-GFP 72 h组 | 10 | 625±39 | 366±12 | 139±15 | 42±3 | 36.9±0.2 |
| Ad-PDGFR 72 h组 | 10 | 621±27 | 369±11 | 137±12 | 42±3 | 36.8±0.2 |
| 注:MAP为平均动脉压;ETCO2为呼吸末二氧化碳分压 | ||||||
| 组别 | 动物(只) | 2 min ETCO2(mmHg) | 4 min ETCO2(mmHg) | 6 min ETCO2(mmHg) | 8 min ETCO2(mmHg) | ROSC率 | 存活至观察时间(只) |
| sham 4 h组 | 5 | 41±3 | 42±3 | 40±3 | 40±2 | 5/5 | 5 |
| control 4 h组 | 10 | 19±2 | 16±1 | 15±2 | 14±2 | 8/10 | 8 |
| Imatinib 4 h组 | 10 | 18±1 | 15±2 | 14±3 | 14±3 | 8/10 | 8 |
| Ad-GFP 4 h组 | 10 | 17±2 | 15±1 | 14±2 | 14±2 | 9/10 | 9 |
| Ad-PDGFR 4 h组 | 10 | 19±3 | 16±4 | 15±2 | 13±3 | 7/10 | 7 |
| sham 72 h组 | 5 | 40±3 | 42±3 | 42±2 | 41±3 | 5/5 | 5 |
| control 72 h组 | 10 | 18±2 | 15±3 | 15±3 | 14±1 | 9/10 | 6 |
| Imatinib 72 h组 | 10 | 17±3 | 14±2 | 13±3 | 13±4 | 9/10 | 6 |
| Ad-GFP 72 h组 | 10 | 18±3 | 15±2 | 15±3 | 13±3 | 8/10 | 6 |
| Ad-PDGFR 72 h组 | 10 | 19±2 | 15±3 | 14±3 | 14±1 | 9/10 | 3 |
| 注:MAP为平均动脉压;ETCO2为呼吸末二氧化碳分压 | |||||||
Sham组心肌细胞排列规则,细胞核完整。各4 h组可见心肌细胞肿胀、部分肌溶解,心肌间质出现少量炎性细胞浸润;各72 h组细胞可见心肌细胞排列紊乱,各组均有不同程度间质增生,Ad-PDGFR 72 h组增生更显著(图 1A)。
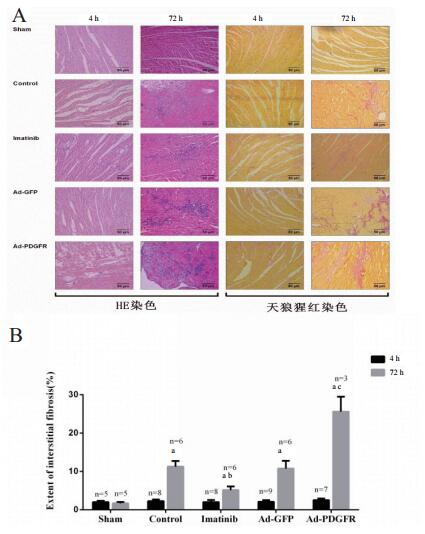
|
| (A)各组HE染色、天狼猩红染色比较;(B)各组CVF值比较,与Sham 72h组比较,aP < 0.05;与Control 72 h组比较,bP < 0.05;与Ad-GFP 72h组比较,cP < 0.05 图 1 各组大鼠心肌组织HE染色和天狼猩红染色(×200) Fig 1 Comparison of HE staining and Sirius red staining of myocardial tissue among the groups(×200) |
|
|
天狼星红染色使心肌间质内胶原纤维呈现红色,余心肌组织呈黄色。复苏后4 h,各组间CVF值差异无统计学意义(均P > 0.05);复苏后72 h,Control组CVF值显著高于Sham组[(11.24 ± 0.31) vs (1.65 ± 0.19),t = 10.81, P < 0.05],Ad-PDGFR组显著高于Ad-GFP组[(25.60 ± 4.09) vs (10.73 ± 2.42),t = 16.77, P < 0.05],Imatinib组显著低于Contol组[(5.11 ± 0.29) vs (11.24 ± 0.31),t = 3.892, P < 0.05], 见图 1B。
2.4 ELISA结果复苏后4 h,Control组、Imatinib组、Ad-GFP组及Ad-PDGFR组血浆PDGF-D显著高于Sham组[(373.51 ± 31.10) pg/mL、(370.68 ± 36.92) pg/mL、(392.83 ± 25.31) pg/mL、(386.87 ± 42.11) pg/mLvs (88.94 ± 19.11) pg/mL,均P < 0.05]。复苏后72 h,Control组、Imatinib组及Ad-GFP组PDGF-D与Sham组的差异无统计学意义(均P > 0.05);Ad-PDGFR组PDGF-D仍高于Sham组[(296.46 ± 30.82) pg/mL vs (93.74 ± 5.43) pg/mL,t =7.755, P < 0.05]。见图 2。
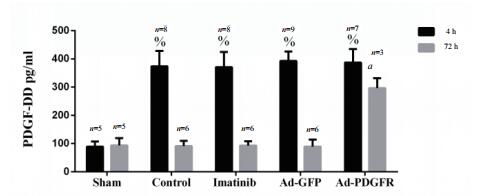
|
| 与Sham 4h组比较,P < 0.05;与Sham 72 h组比较,aP < 0.05 图 2 各组血清PDGF-DD比较 Fig 2 Comparison of serum PDGF-DD levels among the groups |
|
|
复苏后4 h,Control组、Imatinib组、Ad-GFP组和Ad-PDGFR组心肌组织Collagen Ⅰ、α-SMA、Vimentin蛋白表达与Sham组的差异均无统计学意义(均P > 0.05);其中Ad-PDGFR组PDGFR-β表达较Ad-GFP组显著增加[(1.076 ± 0.163) vs (0.496 ± 0.091),t = 9.063, P < 0.05],见图 3。
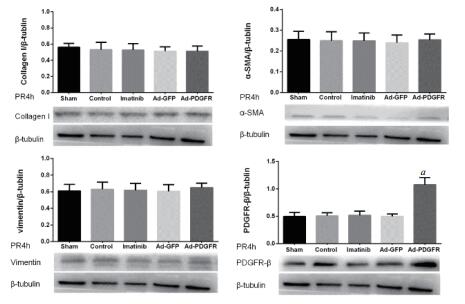
|
| 与Ad-GFP 4 h组比较,aP < 0.05 图 3 4 h各组大鼠心肌组织中CollagenⅠ、α-SMA、Vimentin和PDGFR-β表达 Fig 3 Expression of collagen Ⅰ, α-SMA, Vimentin and PDGFR-β in rat myocardial tissues in the different groups at 4 h.、 |
|
|
复苏后72 h,Control组心肌组织CollagenⅠ、α-SMA、Vimentin、PDGFR-β表达高于Sham组[(1.297 ± 0.263) vs (0.467 ± 0.078),(0.843 ± 0.182) vs (0.329± 0.006),(2.004 ± 0.434) vs (0.897 ± 0.017),(0.897 ± 0.030) vs (0.688 ± 0.083),均P < 0.05]。;Ad-PDGFR组上述蛋白均高于Ad-GFP组[(3.026 ± 0.707) vs (1.380 ± 0.029),(1.509 ± 0.353) vs (0.781 ± 0.016),(2.692 ± 0.629) vs (2.140 ± 0.044),(1.855 ± 0.434) vs (0.870 ± 0.030),均P < 0.05];Imatinib组上述蛋白低于Control组[(0.946 ± 0.055) vs (1.297 ± 0.263),(0.436 ± 0.072) vs (0.843 ± 0.182),(1.181 ± 0.196) vs (2.004 ± 0.434),(0.681 ± 0.032) vs (0.897 ± 0.030),均P < 0.05],见图 4。
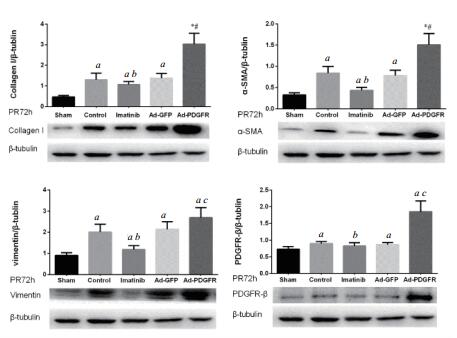
|
| 与sham 72 h组比较,aP < 0.05;与control 72 h组比较,bP < 0.05;与Ad-GFP 72 h组比较,cP < 0.05 图 4 72 h各组大鼠心肌组织中CollagenⅠ、α-SMA、Vimentin和PDGFR-β表达 Fig 4 Expression of collagenⅠ, α-SMA, Vimentin and PDGFR-β in rat myocardial tisses in the different groups at 72 h |
|
|
心肌纤维化发生在多种临床心血管疾病中,为心脏重构的主要表现。关于心肌纤维化发生机制的理论较多,研究显示血小板源性生长因子与慢性心肌纤维化相关。但复苏过程血小板源性生长因子致心肌间质增生的确切分子机制仍不十分清楚。本研究利用SD大鼠构建的室颤法心肺复苏模型,并以Imatinib进行抑制和腺病毒转染过表达PDGFR-β的干预,探讨PDGF-D/PDGFR-β信号通路在大鼠心肺复苏后心肌间质纤维增殖过程中的作用。结果显示Imatinib可显著减轻室颤法心肺复苏后诱导的大鼠心肌胶原增殖的程度;过表达PDGFR-β大鼠的心肌胶原增殖显著增加。因此,PDGF-D/PDGFR-β信号途径可能是复苏后心肌纤维增生的潜在分子机制。
PDGF-D为血小板源性生长因子家族的一个亚型,其只能与PDGFR-β结合[6]。腺病毒介导的肝组织中编码PDGF-D基因高表达,可促进肝星状细胞增殖和纤维化发生[7]。缺血-再灌注损伤后造成的肾间质纤维化,在PDGF-D缺陷的小鼠体内得到缓解[8]。给予外源性的PDGF-D,可以促进肌成纤维细胞的增殖和活化[9],腺病毒介导PDGF-D在心脏中表达上调,可明显上调纤维化的水平、TGF-β mRNA水平、加速心肌纤维化和动脉硬化进程[10]。注射中和性PDGFR特异性抗体可减轻压力过载心脏模型小鼠的心房纤维化和房颤诱导[11]。多种器官组织纤维化发生过程中均可发现间质炎症反应及单核巨噬细胞等炎症细胞过度分泌PDGF,并且伴随成纤维细胞表面PDGFR表达增高[12]。本研究中PR72 h,Ad-PDGFR组大鼠的纤维化程度明显高于Ad-GFP组,可能是由于血清中PDGF-D持续高表达,PDGF-D/PDGFR信号被持续激活,介导心肌间质纤维化发生。
研究表明Imatinib可抑制成纤维细胞表面PDGFR受体,从而预防纤维化的发生[13]。本研究发现复苏后72 h Imatinib组心肌纤维化相关蛋白CollagenⅠ、α-SMA和Vimentin表达下调,天狼猩红染色CVF明显减轻,这与李谦等[14]和Jang等[15]用Imatinib减轻自发性高血压大鼠模型的心室重构结果类似。在一项给予外源性PDGF-D诱导细胞纤维化的实验中发现,肌成纤维细胞的增殖和活化可在导入siRNA TGF-β后被抵消[9],该实验提示PDGF可能通过上调TGF-β的水平来促进纤维化。PDGF也能激活JAK/STAT信号通路向细胞内传递信号,激活靶基因转录,促进纤维细胞的增殖[16]。本研究表明Imatinib阻止心肌纤维化发生与其抑制PDGFR表达量上调有明确关系,但Imatinib是否同时抑制其他因子的酪氨酸激酶受体活性,从而减轻心肌纤维化仍不清楚,有待进一步的深入研究。
| [1] | Mozaffarian D, Benjamin EJ, Go AS, et al. Heart Disease and Stroke Statistics-2016 Update: A Report From the American Heart Association[J]. Circulation, 2016, 133(4): e38. |
| [2] | Hasselqvist-Ax I, Riva G, Herlitz J, et al. Early cardiopulmonary resuscitation in out-of-hospital cardiac arrest[J]. N Engl J Med, 2015, 372(24): 2307-2315. DOI:10.1056/nejmoa1405796 |
| [3] | 高渝峰, 胡春林, 廖晓星, 等. 亚低温治疗对心肺复苏后Wistar大鼠心肌氧化应激损伤的影响[J]. 中华急诊医学杂志, 2017, 26(10): 1139-1143. DOI:10.3760/cma.j.issn.1671-0282.2017.10.009 |
| [4] | Zhao S, Qian J, Wang JG, et al. Effects of oxygen concentrations on postresuscitation myocardial oxidative stress and myocardial function in a rat model of cardiopulmonary resuscitation[J]. Crit Care Med, 2015, 43(12): e560-566. DOI:10.1097/ccm.0000000000001297 |
| [5] | 赵燊, 何宇敏, 许冰, 等. 大鼠心肺复苏后心功能不全动态评价模型的研究[J]. 中华急诊医学杂志, 2017, 26(1): 44-50. DOI:10.3760/cma.j.issn.1671-0282.2017.01.009 |
| [6] | Klinkhammer BM, Floege J, Boor P. PDGF in organ fibrosis[J]. Mol Aspect Med, 2018, 62: 44-62. DOI:10.1016/j.mam.2017.11.008 |
| [7] | Hudkins KL. Exogenous PDGF-d is a potent mesangial cell mitogen and causes a severe mesangial proliferative glomerulopathy[J]. Nephrology, 2004, 15(2): 286-298. DOI:10.1097/01.asn.0000108522.79652.63 |
| [8] | Buhl EM, Djudjaj S, Babickova J, et al. The role of PDGF-D in healthy and fibrotic kidneys[J]. Kidney International, 2016, 89(4): 848-861. DOI:10.1016/j.kint.2015.12.037 |
| [9] | Zhao T, Zhao W, Chen Y, et al. Platelet-derived growth factor-D promotes fibrogenesis of cardiac fibroblasts[J]. Am J Physiol Heart Circ Physiol, 2013, 304(12): H1719-1726. DOI:10.1152/ajpheart.00130.2013 |
| [10] | Tuuminen R, Nyk Nen A, Krebs R, et al. PDGF-A, -C, and -D but not PDGF-B increase TGF-beta1 and chronic rejection in rat cardiac allografts[J]. Arterioscler Thromb Vasc Biol, 2009, 29(5): 691-698. DOI:10.1161/ATVBAHA.108.178558 |
| [11] | Liao CH, Akazawa H, Tamagawa M, et al. Cardiac mast cells cause atrial fibrillation through PDGF-A–mediated fibrosis in pressure-overloaded mouse hearts[J]. J Clin Invest, 2010, 120(1): 242-253. DOI:10.1172/jci39942 |
| [12] | 何立峰, 马礼坤. 阿托伐他汀对实验性大鼠心肌纤维化的干预作用及可能机制[J]. 中国病理生理杂志, 2010, 26(2): 227-232. |
| [13] | Leipner C, Grün K, Müller A, et al. Imatinib mesylate attenuates fibrosis in coxsackievirus b3-induced chronic myocarditis[J]. Cardiovas Res, 2008, 79(1): 118-126. DOI:10.1093/cvr/cvn063 |
| [14] | 李谦, 马礼坤, 何立峰, 等. 伊马替尼对醋酸去氧皮质酮诱导的盐敏感性高血压大鼠心肌纤维化的干预作用[J]. 中国病理生理杂志, 2012, 28(1): 53-58. DOI:10.3969/j.issn.1000-4718.2012.01.010 |
| [15] | Jang SW, Ihm SH, Choo EH, et al. Imatinib mesylate attenuates myocardial remodeling through inhibition of platelet-derived growth factor and transforming growth factor activation in a rat model of hypertension[J]. Hypertension, 2014, 63(6): 1228-34. DOI:10.1161/HYPERTENSIONAHA.113.01866 |
| [16] | Ogata H, Chinen T, Yoshida T, et al. Loss of SOCS3 in the liver promotes fibrosis by enhancing STAT3-mediated TGF-β1 production[J]. Oncogene, 2006, 25(17): 2520-2530. DOI:10.1038/sj.onc.1209281 |
 2019, Vol. 29
2019, Vol. 29




