2 郑州大学第一附属医院综合ICU 450052
2 General ICU, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
在严重创伤、烧伤、大手术、重症感染等应激原的打击下,机体表现出全身性非特异性应激反应,并处于高分解代谢状态,营养状况下降[1]。在应激反应初期给予患者肠内营养,不仅能提供营养底物,还能改善肠黏膜屏障和免疫功能,维护肠道微生态,预防菌群失调[2]。常规的营养支持不能完全减轻严重应激后机体高分解代谢、炎症反应加强及免疫功能损害。此外,机体因创伤应激反应产生胰岛素拮抗作用[3],出现应激性高血糖是营养支持过程中的另一大难题。研究证明,免疫营养素如谷氨酰胺、精氨酸、ω-3脂肪酸等可改变代谢反应,改善免疫功能和负氮平衡,降低机体感染发生率,改善预后[4]。因此,本研究旨在观察添加免疫营养素的肠内营养对应激状态患者营养状况、免疫功能、炎症反应、血糖、感染控制等方面的影响。
1 资料与方法 1.1 一般资料纳入2014年12月至2015年9月存在营养风险的急性应激患者,随机(随机数字法)分为对照组和试验组。两组患者均对来源科室、病情严重程度进行1:1匹配。共有132例患者进入观察,最终有120例患者(每组60例)完成观察,12例患者没有完成本研究。男性79例,女性41例。年龄21~89岁(55.35±15.1)岁。病例来源:ICU 24例,呼吸重症16例,神经外科68例,其他12例。病种组成:外伤/术后72例,重症感染40例,其他8例。对照组采用常规营养支持(每天20~25 kcal/kg,1 kcal = 4.184 kJ, 郑州大学第一附属医院营养科配制),试验组蛋白采用鱼胶原蛋白(每天1 g/kg,浙江海力生生物科技有限公司),并在常规营养支持基础上加用免疫营养素谷氨酰胺(每天0.5 mg/kg,杭州纽曲星生物科技有限公司)和精氨酸(每天0.3 g/kg,浙江海力生生物科技有限公司)。试验为期8 d。本研究通过郑州大学第一附属医院伦理委员会批准[2014年科研第(10)号]。
1.2 纳入标准及排除标准纳入标准:①急性应激患者, 创伤、感染、手术后等处于应激状态患者[1];②年龄18岁以上;③不伴甲状腺功能异常等影响能量和蛋白质代谢的疾病;④在试验期限内能够接受肠内营养基本能满足患者能量和其他营养素需要。
排除标准:①拒绝参加本研究者;②不能进行相关指标监测的患者;③合并有严重心、肝、肾及造血系统功能异常者。
1.3 观察指标(1) 一般指标 记录患者年龄、性别、营养风险评分(采用营养风险筛查2002,评分≥3分的患者存在营养风险,需要营养支持[5])、营养评估(采用主观全面评定法,患者评分≥4分评定为营养不良[6])结果。
(2) 营养状态指标 干预前后检测血常规及肝肾功能、血浆总蛋白、白蛋白、前白蛋白、血脂、电解质等。
(3) 免疫及炎症指标 干预前后测定白细胞计数(white blood cell,WBC)、淋巴细胞总数(lymphocytes, LY)、急性反应蛋白(C-reactive protein, CRP),进行比较分析。
(4) 血糖 对存在高血糖患者进行血糖监测,比较两组患者的血糖控制情况。
(5) 临床指标及治疗结局 观察患者肠道耐受性、感染并发症、住院时间、病死率等,对两组患者的临床指标进行比较分析。
1.4 统计学方法采用SPSS19.0统计软件进行统计分析。计量资料以均数±标准差(x±s)表示,计量资料的比较采用配对t检验。计数资料以百分比表示,组间差异采用卡方检验。两组患者的累积存活率采用Kaplan-Meier生存曲线分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况两组患者干预前在年龄、性别、营养风险筛查评分、营养评估结果差异无统计学意义(P > 0.05),两组患者一般情况具有可比性,见表 1。
| 组别 | 年龄(岁) | 性别(例) | 营养风险筛查评分 | 主观全面评定法(例) | ||
| 男 | 女 | 营养正常 | 营养不良 | |||
| 试验组 | 53.27±13.295 | 39 | 18 | 4.23±0.935 | 1 | 29 |
| 对照组 | 57.08±16.50 | 40 | 23 | 3.75±0.806 | 3 | 33 |
| 统计值 | 1.006a | 0.953b | 0.028a | 0.719b | ||
| P值 | 0.320 | 0.329 | 0.867 | 0.397 | ||
| 注:a为F值,b为卡方值 | ||||||
干预前两组患者营养状况差异无统计学意义(P > 0.05),具有可比性。干预后两组患者总蛋白、白蛋白水平均升高,但差异无统计学意义(P > 0.05),试验组患者前白蛋白显著高于对照组(P < 0.05)。见表 2。
| 组别 | 干预前 | 干预后 | |||||||
| HGB(g/L) | TP(g/L) | ALB(g/L) | PA(mg/L) | HGB(g/L) | TP(g/L) | ALB(g/L) | PA(mg/L) | ||
| 试验组 | 116.80±18.2 | 59.9±9.2 | 31.6±6.8 | 105.2±13.5 | 109.8±17.8 | 63.9±6.2 | 33.9±5.2 | 162.5±29.7 | |
| 对照组 | 113.76±27.8 | 59.2±10.9 | 32.7±6.7 | 102.4±16.7 | 106.7±25.3 | 61.9±8.4 | 34.8±4.9 | 136.6±15.1 | |
| t值 | 0.684 | 0.365 | -0.877 | 1.094 | 1.658 | 1.635 | 1.276 | 2.349 | |
| P值 | 0.495 | 0.715 | 0.382 | 0.276 | 0.101 | 0.105 | 0.204 | 0.021 | |
干预前两组患者白细胞、淋巴细胞计数、急性反应蛋白差异无统计学意义(P > 0.05),具有可比性。干预后试验组患者淋巴细胞计数高于对照组,急性反应蛋白低于对照组,差异有统计学意义(P < 0.05),见表 3。
| 组别 | 干预前 | 干预后 | |||||
| WBC (×109/L) | LY (×109/L) | CRP (mg/L) | WBC (×109/L) | LY (×109/L) | CRP(mg/L) | ||
| 试验组 | 8.23±3.81 | 1.66±0.56 | 171.5±38.2 | 6.59±2.64 | 1.86±0.9 | 47.2±22.1 | |
| 对照组 | 8.08±2.57 | 1.54±0.42 | 173.6±35.3 | 8.03±2.85 | 1.45±0.7 | 82.6±13.4 | |
| t值 | 1.342 | 1.402 | -0.150 | -1.898 | 2.562 | 2.044 | |
| P值 | 0.182 | 0.164 | 0.881 | 0.060 | 0.012 | 0.043 | |
干预前两组患者的空腹血糖差异无统计学意义(F = 0.955,P = 0.332),干预后试验组患者血糖较对照组有明显下降,差异有统计学意义(F = 7.239,P = 0.009),见表 6。
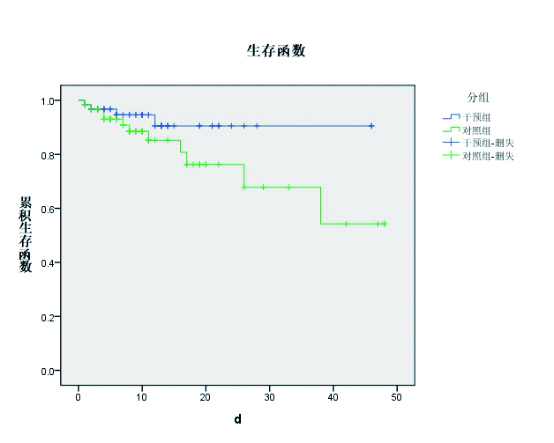
2.5 免疫营养对患者临床指标的影响对急性应激患者,试验组肠道耐受性好,发生腹泻、呕吐等并发症少;试验组患者的死亡率低于对照组,差异有统计学意义(P < 0.05)。试验组患者的感染并发症、住院时间、住院费用均低于对照组,但差异无统计学意义,见表 5。两组患者进行Kaplan-Meier生存曲线分析发现,试验组患者的50d累积存活率高于对照组,但差异无统计学意义(P = 0.138),见图 1。
| 组别 | 干预前 | 干预后 |
| 试验组 | 7.4±2.9 | 5.4±1.7 |
| 对照组 | 7.6±3.7 | 6.6±3.5 |
| 组别 | 腹泻、呕吐(例,%) | 感染(例,%) | 死亡(例,%) | 住院时间(d) | 住院费用(元) |
| 试验组 | 5(8.3) | 12(20) | 4(6.7) | 10.9±9.2 | 73 909.6±52 284.8 |
| 对照组 | 15(25) | 18(30) | 12(20) | 13.5±11.8 | 87 432.8±65 287.3 |
| 统计值 | 6.000a | 1.600a | 4.615a | 1.332b | 0.330b |
| P值 | 0.014 | 0.206 | 0.032 | 0.185 | 0.742 |
| 注:a统计值为χ2值,b统计值为t值 | |||||
|
| 图 1 两组患者的50 d累积生存曲线 Fig 1 The 50-day cumulative survival curve of the two groups |
|
|
近年来,随着临床营养学的发展以及对机体代谢过程认识的不断加深,免疫营养对调理应激分解代谢和促进合成代谢的作用在临床上得到越来越多肯定,并已经成为危重症患者抢救过程中一项不可或缺的重要治疗措施[7]。免疫营养是将精氨酸、谷氨酰胺、核苷酸、ω-3脂肪酸等特异性营养物,添加于标准肠内营养或肠外营养中,起到增强免疫和调节炎性反应,保护胃肠黏膜屏障功能等作用。在本研究中,在给予急性应激患者的常规肠内营养治疗中,额外添加复合免疫营养素(鱼胶原蛋白肽、谷氨酰胺、精氨酸等)8 d后,发现免疫肠内营养能明显提高患者的快速反应蛋白水平(前白蛋白),改善了患者的营养状态;明显降低了患者的应激性高血糖,改善患者预后状态;提高患者的淋巴细胞计数、降低C反应蛋白水平,降低了患者的炎症反应;减少患者腹泻、呕吐等并发症的发生,提高了患者的肠道耐受性;降低患者病死率,从而可能有利于急性应激患者的康复。这与文献[8]报道一致,对应激状态患者进行合理的营养支持,能够缓解患者机体的应激反应,预防细胞的氧化损伤以及调节机体的免疫反应,促进危重患者的康复,缩短住院时间和费用以及降低并发症和住院病死率。
乔世刚等[9]报道机体在应激状态下出现一系列代谢紊乱,包括热能需求增加、组织分解、负氮平衡等问题,患者普遍存在体重丢失、机体营养状况迅速下降及发生营养不良的现象,并成为独立因素影响危重症预后。本研究中两组患者血清总蛋白、白蛋白及前白蛋白水平均较正常人有不同程度的降低,这与患者机体处于应激状态、蛋白质需求量大,机体处于负氮平衡有关。经过8 d的营养支持后,两组血清总蛋白、白蛋白及前白蛋白水平均有上升趋势,说明合理的营养支持(能量每天20~25 kcal/kg,蛋白质每天1 g/kg)可增加能量和蛋白质供给,减少机体蛋白分解并增加合成,可能改善负氮平衡,改善应激患者潜在和已发生的营养不良状态[10],而免疫肠内营养可以进一步提高急性应激患者的前白蛋白水平,改善患者的近期营养状况;但是遗憾的是,本研究在8 d的干预期内,并未发现两组患者的总蛋白、白蛋白水平差异有统计学意义,可能跟试验期较短、急性应激患者机体长期处于高分解代谢有关,延长观察期限可能会得到更有利的证据。
研究显示,添加谷氨酰胺可减轻机体蛋白降解和瘦组织丢失,有利于维护肠黏膜屏障,维持机体免疫功能,减少肠源性感染,能降低患者感染并发症[11-12];精氨酸是人体必需氨基酸,补充精氨酸能够促进蛋白质合成和伤口愈合,改善创伤宿主的免疫功能[13]。
机体在应激打击下表现出全身性非特异性应激反应。CRP和淋巴细胞计数是应激反应中与免疫和炎症反应相关的指标[14-15]。本研究结果显示免疫肠内营养干预后,试验组患者淋巴细胞计数高于对照组,急性反应蛋白低于对照组,差异均有统计学意义(P < 0.05),说明添加免疫营养素可以降低机体炎症反应,改善免疫功能。这可能与创伤、严重感染等应激状态下,谷氨酰胺与精氨酸的消耗增加,而内源性合成远远不能满足机体需要,通过补充谷氨酰胺与精氨酸,能发挥其维持肠道黏膜屏障,减少炎症介质释放,有助于机体正常代谢及免疫功能调节[16]。但本次研究中关于炎症和免疫功能的指标,仅能从一定程度上说明我们所要阐述的问题,在今后的研究中将会增加IgG、IgM、CD4、CD8、降钙素原、炎症因子等指标,以便更好地反映免疫功能和炎症反应的变化。
机体在应激打击下还表现为血糖代谢异常,高血糖和血糖波动过大与危重患者的病死率过高有关[17]。本研究发现,添加免疫营养素后患者血糖较对照组有明显下降,表明合理的能量摄入与联合应用免疫营养素可以较好改善患者应激高血糖。其可能机制与补充谷氨酰胺与精氨酸可减少炎症介质释放和感染的发生,从而改善患者的炎症反应有关。
此外,患者在应激状态下肠蠕动功能减慢、门静脉系统的血液循环障碍、胃肠道激素的分泌减少,肠粘膜细胞能量供应不足,从而肠黏膜的免疫屏障被破坏,患者呕吐、腹泻及感染发生率升高。本研究发现,在常规肠内营养治疗的基础上,添加免疫营养素后患者腹泻、呕吐等并发症发生率减少,肠道耐受性好,这可能与免疫营养支持可以增加肠道能量与营养素供给、维持肠黏膜的免疫屏障有关。
综上所述,笔者认为在常规肠内营养治疗的基础上,免疫肠内营养可降低急性应激患者的血糖水平和机体炎症反应,提高肠道耐受性,改善免疫功能和营养状况,降低病死率,从而有助于改善急性应激患者的临床结局。
| [1] | 黎介寿. 应激患者的代谢与营养支持[J]. 外科理论与实践, 2000, 5(2): 70-72. DOI:10.3969/j.issn.1007-9610.2000.02.004 |
| [2] | 孙仁华, 江荣林, 黄曼, 等. 重症患者早期肠内营养临床实践专家共识[J]. 中华危重病急救医学, 2018, 30(8): 715-721. DOI:10.3760/cma.j.issn.2095-4352.2018.08.001 |
| [3] | 张斌杰, 周丽娜. 重度烧伤患者早期应激性高血糖的危险因素及其对预后的影响[J]. 中华损伤与修复杂志(电子版), 2018, 13(3): 189-194. DOI:10.3877/cma.j.issn.1673-9450.2018.03.007 |
| [4] | 宋歌, 吕月涛, 狄林林, 等. 免疫肠内营养对重症肺炎患者肠黏膜屏障及免疫功能的影响[J]. 肠外与肠内营养, 2017, 24(2): 86-93. DOI:10.16151/j.1007-810x.2017.02.007 |
| [5] | Kondrup J, Allison SP, Elia M, et al. ESPEN guidelines for nutrition screening 2002[J]. Clin Nutr, 2003, 22(4): 415-421. DOI:10.1016/S0261-5614(03)00098-0 |
| [6] | Singer P, Blaser AR, Berger MM, et al. ESPEN guideline on clinical nutrition in the intensive care unit[J]. Clin Nutr, 2019, 38(1): 48-79. DOI:10.1016/j.clnu.2018.08.037 |
| [7] | Issa JP. Epigenetic changes in the myelodysplastic syndrome[J]. Hematol Oncol Clin North Am, 2010, 24(2): 317-330. DOI:10.1016/j.hoc.2010.02.007 |
| [8] | 戚建巨, 叶立刚, 徐善祥, 等. 浙江省危重症患者入ICU第一周营养治疗实施状况[J]. 中华急诊医学杂志, 2017, 26(10): 1180-1183. DOI:10.3760/cma.j.issn.1671-0282.2017.10.017 |
| [9] | 乔世刚, 方理超, 安堃, 等. 早期肠内滋养对重症创伤患者肠黏膜屏障的改善作用研究[J]. 中华急诊医学杂志, 2017, 26(9): 1050-1053. DOI:10.3760/cma.j.issn.1671-0282.2017.09.014 |
| [10] | Weijs PJ, Cynober L, DeLegge M, et al. Proteins and amino acids are fundamental to optimal nutrition support in critically ill patients[J]. Crit Care, 2014, 18(6): 591. DOI:10.1186/s13054-014-0591-0 |
| [11] | 中国营养学会临床营养分会. 谷氨酰胺在危重症患者中临床应用的专家推荐意见(节录)[J]. 营养学报, 2016, 38(5): 421-426. |
| [12] | 龚露, 胡兰. 谷氨酰胺强化的营养支持治疗在危重患儿中的研究进展[J]. 中华急诊医学杂志, 2016, 25(5): 690-694. DOI:10.3760/cma.j.issn.1671-0282.2016.05.032 |
| [13] | Karolina W, Tessy C, Merel H, et al. Arginine and citrulline and the immune response in sepsis[J]. Nutrients, 2015, 7(3): 1426-1463. DOI:10.3390/nu7031426 |
| [14] | 宋亚男, 赵艳, 郭向阳, 等. 围术期应激反应监测指标的研究现状[J]. 中国微创外科杂志, 2017, 17(12): 1129-1132. DOI:10.3969/j.issn.1009-6604.2017.12.021 |
| [15] | Ortiz-Reyes LA, Chang Y, Quraishi SA, et al. Early enteral nutrition adequacy mitigates the neutrophil-lymphocyte ratio improving clinical outcomes in critically ill surgical patients[J]. Nutr Clin Pract, 2019, 34(1): 148-155. DOI:10.1002/ncp.10177 |
| [16] | Zanten ARHV, François Sztark, Kaisers UX, et al. High-protein enteral nutrition enriched with immune-modulating nutrients vs standard high-protein enteral nutrition and nosocomial infections in the icu: a randomized clinical trial[J]. JAMA, 2014, 312(5): 514-524. DOI:10.1001/jama.2014.7698 |
| [17] | Doola R, Greer RM, Hurford R, et al. Glycaemic variability and its association with enteral and parenteral nutrition in critically ill ventilated patients[J]. Clin Nutr, 2018 Aug 16. pii: S0261-5614 (18)31343-8. DOI: 1016/j.clnu.2018.08.001. |
 2019, Vol. 28
2019, Vol. 28




