控制颅内压(intracranial pressure,ICP)是救治颅脑创伤(traumatic brain injury,TBI)患者的核心[1-2],而镇静是控制颅内高压极为重要的治疗方法[3]。临床上镇静程度的评估主要依靠镇静评分等主观评估,由于主观性太强等原因很难明确TBI患者在降颅压治疗过程中是否已经达到有效镇静以控制ICP。
脑电双频指数(bispectral index,BIS)是近年来提出的脑电信号监测患者镇静深度的方法。它将脑电功率和频率经过分析后形成0~100之间的数字,数字越小表明患者镇静程度越深,是评估患者镇静深度较为准确的客观指标[4]。研究显示,脑损伤患者的BIS值与格拉斯哥昏迷评分(Glasgow Coma Scale,GCS)及预后有一定相关性[5],但BIS值与GCS评分密切相关并不代表BIS值与ICP值之间也具有良好的相关性。目前还不明确TBI患者的BIS值与ICP值之间是否有直接的相关性以及是否可以依据BIS值来进行镇静治疗,以达到控制ICP的目的。本研究希望通过前瞻性收集复旦大学附属华山医院神经外科急救中心收治的同时接受BIS监测和ICP监测的TBI患者资料,以进一步评估TBI患者的BIS与ICP的相关性,为利用BIS监测控制TBI患者的ICP提供依据。
1 资料与方法 1.1 一般资料本研究前瞻性收集华山医院神经外科急救中心2016年1月至2017年4月期间收治的TBI患者43例。其中男性31例(72.1%),女性12例(27.9%),年龄(50.63±14.05)岁,入院时GCS评分(6.0±2.1)分。纳入标准:①年龄≥18岁; ②根据病史及头颅CT提示TBI; ③入院后给予急诊手术放置ICP监测。排除标准:①GCS评分3分伴双侧瞳孔散大固定; ②存在不能存活的损伤或预期生存时间 < 1个月; ③开放性颅脑损伤。
1.2 方法 1.2.1 BIS监测患者术后进入神经外科重症监护病房立即进行BIS监测。BIS测量仪(Covidien Ⅱc,新加坡)包括一个电缆接口,一个监测仪与一个BIS模块。监测方法:75%乙醇擦拭患者前额皮肤后待干,正电极放置在鼻根中间上方约5 mm前额处,参考电极放在前额的右眉上方。阴极放置在右侧太阳穴平眼角处。电极连接监测仪即可随时读取数值。
1.2.2 ICP监测患者均在急诊手术术中放置脑室ICP监测导管(Codman & Shurtleff Inc,美国),术后进入NICU病房后ICP监测导管连接ICP监测仪进行连续ICP监测并可随时读取数值。
1.2.3 研究方法由专人采集纳入患者的基本临床资料。包括年龄、性别、受伤机制、受伤到入院时间、瞳孔、损伤类型、头颅CT表现、GCS评分等。GCS评分分为睁眼反应(1~4分)、语言反应(1~5分)和肢体运动(1~6分)3个方面,3个方面的得分数相加即为昏迷指数。术后患者进入NICU后,以患者术后充分复苏后的即刻值作为初始值,记录患者术后初始、6、12、24、36、48、60、72、84、96、108、120、132、144 h各时间点ICP值、BIS指数和GCS评分。
1.3 统计学方法采用SPSS 22.0统计分析软件进行统计分析。连续变量用均数±标准差(Mean±SD)表示,分类变量用百分比表示。BIS指数与ICP之间的相关性采用Spearman相关性检验。首先计算每例患者BIS指数与ICP之间的相关性,根据BIS指数与ICP之间的相关性将患者分为BIS与ICP正相关组和BIS与ICP负相关或无相关组。不同组别之间的变量比较计量变量采用t检验、计数变量采用卡方检验。以P < 0.05为差异有统计学意义。
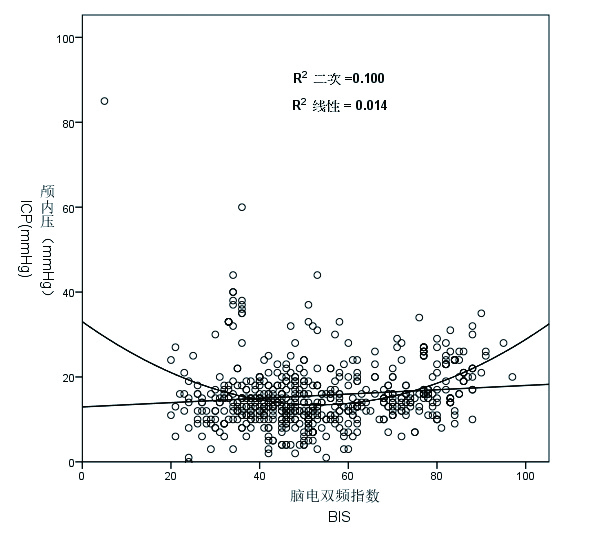
2 结果本研究共纳入TBI患者43例,其中25例患者给予ICP监测+血肿清除伴或不伴去骨瓣减压术; 18例患者仅施以ICP监测术。对所有患者而言,BIS值与ICP值之间无相关性(Pearson相关系数r=-0.052,P=0.204)。但在建立BIS值与ICP值二次项曲线模型后发现,当BIS值在55左右时ICP值最低,且模型拟合度也显著高于线性模型(R2=0.1)。提示将TBI患者的BIS值控制在55左右对ICP的控制可能最为有利(图 1)。
|
| 二次项曲线模型显示当BIS值在55左右时ICP值最低,且模型拟合度也显著高于线性模型(R2=0.1),这提示将TBI患者的BIS值控制在55左右对ICP的控制可能最为有利 图 1 BIS指数与ICP值的线性相关与曲线相关散点图 |
|
|
将每例患者的BIS值与ICP值进行相关性分析,结果显示有21例患者BIS与ICP呈正相关,Spearman相关系数r为0.517±0.246;有22例患者BIS与ICP呈负相关或无相关,Spearman相关系数r为-0.300±0.340。BIS值与ICP值呈正相关组患者的初始BIS值显著高于呈负相关或无相关组患者(78.95±9.43 vs 54.23±12.11,P < 0.01)。根据患者初始BIS值将患者分为初始BIS值< 55组和≥55组,结果显示BIS值与ICP值呈正相关组患者的初始BIS值≥55比例显著高于呈负相关或无相关组(95.2% vs 50.0%,P=0.001)。BIS值与ICP值呈正相关组患者BIS均值也显著高于呈负相关或无相关组。BIS值与ICP值呈正相关组患者初始ICP值和ICP均值与呈负相关或无相关组差异无统计学意义。BIS值与ICP值呈正相关组患者初始GCS评分≥7分的比例也显著高于呈负相关或无相关组(52.4% vs 22.7%,P=0.044)。BIS值与ICP值呈正相关组患者的GCS评分均值显著高于呈负相关或无相关组患者[(6.34±2.04 vs 5.98±1.81,P=0.020)](表 1)。
| 参数 | BIS与ICP值正相关 (n=21) |
BIS与ICP值负相关或无相关 (n=22) |
χ2值/t值 | P值 |
| 初始BIS值 | 78.95±9.43 | 54.23±12.11 | 7.443 | < 0.001 |
| 初始BIS值< 55(例,%) | 1(4.8) | 11(50.0) | 10.929a | 0.001 |
| 初始BIS值≥55(例,%) | 20(95.2) | 11(50.0) | ||
| 初始ICP值(mmHg) | 22.19±6.74 | 16.32±11.66 | 2.009 | 0.051 |
| BIS均值 | 57.26±19.28 | 50.48±15.76 | 4.730 | < 0.001 |
| ICP均值(mmHg) | 15.93±7.83 | 16.47±8.43 | -0.826 | 0.409 |
| 初始GCS值 | 6.67±2.18 | 5.41±1.99 | 1.978 | 0.055 |
| 初始GCS < 7分(例,%) | 10(47.6) | 17(77.3) | 4.044a | 0.044 |
| 初始GCS≥7分(例,%) | 11(52.4) | 5(22.7) | ||
| GCS均值 | 6.34±2.04 | 5.98±1.81 | 2.353 | 0.020 |
| 注:a为χ2 值,其余为t值 | ||||
另外,初始GCS评分≥7分的患者初始BIS值也显著高于初始GCS评分 < 7分的患者,提示BIS值可以反映大脑功能状态(表 2)。而初始BIS值≥55与 < 55的患者之间的初始ICP值和ICP均值差异均无统计学意义(表 3)。
| 参数 | 初始GCS < 7分 (n=27) |
初始GCS≥7分 (n=16) |
t值 | P值 |
| 初始BIS值 | 61.78±16.75 | 73.94±13.29 | -2.475 | 0.018 |
| 初始ICP值(mmHg) | 17.96±9.67 | 21.25±10.31 | -1.052 | 0.299 |
| BIS均值 | 53.76±17.26 | 53.84±18.91 | -0.050 | 0.961 |
| ICP均值(mmHg) | 16.29±8.31 | 16.07±7.87 | 0.322 | 0.747 |
| 参数 | 初始BIS < 55 (n=12) |
初始BIS≥55 (n=31) |
t值 | P值 |
| 初始BIS值 | 45.50±6.25 | 74.35±11.25 | -10.656 | < 0.001 |
| 初始ICP值(mmHg) | 20.58±14.07 | 18.65±8.00 | 0.450 | 0.660 |
| BIS均值 | 44.85±12.39 | 57.26±18.47 | -9.517 | < 0.001 |
| ICP均值(mmHg) | 16.20±7.12 | 16.21±8.51 | -0.007 | 0.994 |
BIS监测能够直接反映大脑皮质的生理活动,判断中枢神经处于兴奋或抑制状态。研究发现,BIS与脑损伤患者的神经功能状态存在相关性[6],BIS监测在评价心肺复苏后患者昏迷程度及神经学预后上优于主观指标GCS评分[7]。陈晨等[8]研究还显示BIS监测可准确预测急性脑出血患者的预后。越来越多的研究表明,BIS监测在评估TBI患者脑损伤程度和预后也有重要临床价值。Deogaonkar等[5]对TBI患者进行研究,结果显示BIS值与GCS评分密切相关,但这并不代表BIS与ICP之间也具有良好的相关性。有些TBI患者虽然GCS评分低,但ICP并不升高,比如部分弥散性轴索损伤或脑干伤患者; 而有些患者虽然GCS评分较高,却已经存在显著ICP升高[9]。为此,本研究希望通过评估TBI患者BIS值与ICP之间的相关性,为利用BIS监测控制TBI患者的ICP提供依据。
本研究结果发现当BIS指数在55左右时ICP值最低,且模型拟合度也显著高于线性模型(R2=0.1)。提示将TBI患者的BIS值控制在55左右对ICP的控制可能最为有利。这也提示BIS值与ICP值之间并不是一味的线性关系。对于初始BIS值≥55的患者来说,BIS值与ICP值呈正相关的比例较高; 而对于初始BIS值< 55的患者来说,BIS与ICP值呈负相关或无相关性的比例较高。这提示我们在临床诊疗过程中,因根据每位患者的具体情况而给予不同的诊疗和护理策略。
本研究结果还显示对于初始GCS评分≥7分的患者,如果存在颅内高压,在临床治疗过程中给予适当的镇静治疗往往可以有效降低BIS指数以及控制ICP。对于这类患者,BIS监测则可以作为一项可靠的指标用于镇静控制ICP的依据。对于不同损伤或昏迷严重程度的TBI患者,BIS监测均有其特定的临床意义,但却不尽相同。
本研究发现TBI后患者BIS值与ICP值之间的非单一相关性,为临床的护理策略提出了挑战。这要求我们在对TBI患者的临床护理过程中根据BIS和ICP情况做出不同救治和护理策略,以达到精准护理的要求,提高患者预后。对于初始BIS值≥55或是BIS值与ICP值呈正相关的患者来说,当患者出现了ICP增高或烦躁不安的情况时,护士首先应排除护理上导致ICP增高的相关因素,包括翻身拍背、吸痰、体位不当、脑室外引流管、导尿管等是否通畅,有无扭曲、受压、梗阻等所导致的引流不畅情况,然后遵医嘱给予加深镇静,避免因患者镇静不足而导致ICP增高; 再根据实时的BIS值来评估深度和调整镇静药物的用量,以BIS值不低于55为宜。对于初始BIS值< 55或是BIS值与ICP值呈负相关或无相关的患者来说,此时如果因为ICP增高而盲目地加大镇静剂使用剂量是不合适的,护士应暂缓镇静,进行镇静深度评估判断是否存在镇静过度的情况,遵医嘱给予充分复苏,保持呼吸道通畅,避免因患者镇静过度而导致呼吸道梗阻或呼吸抑制CO2潴留而导致ICP进行性增高。如果没有上述情况,可能提示患者脑功能受损严重,预后不良。此时的BIS值可能并不能作为镇静深度的评估手段,而只是提示预后和脑功能受损的预测因素。
综上所述,在TBI患者的监测和护理过程中,BIS监测可以更加全面和详细的评估患者的镇静状态与神经功能状态,BIS监测指导下的ICP控制以及神经功能评估,可能对于患者的预后恢复更加有利[10]。但是对于不同损伤程度和昏迷程度的TBI患者BIS与ICP之间的相关性不同。临床中应根据患者的不同状态利用BIS监测进行评估。
| [1] | Cheng P, Yin P, Ning P, et al. Trends in traumatic brain injury mortality in china, 2006-2013: A population-based longitudinal study[J]. PLoS Med, 2017, 14(7): e1002332. DOI:10.1371/journal.pmed.1002332 |
| [2] | Yanagawa Y, Ishikawa K, Jitsuiki K, et al. Fibrinogen degradation product levels on arrival for trauma patients requiring a transfusion even without head injury[J]. World J Emerg Med, 2017, 8(2): 106-109. DOI:10.5847/wjem.j.1920-8642.2017.02.004 |
| [3] | Carney N, Totten AM, O' Reilly C, et al. Guidelines for the management of severe traumatic brain injury, fourth edition[J]. Neurosurgery, 2017, 80(1): 6-15. DOI:10.1227/NEU.0000000000001432 |
| [4] | Singh H. Bispectral index (bis) monitoring during propofol-induced sedation and anaesthesia[J]. Eur J Anaesthesiol, 1999, 16(1): 31-36. DOI:10.1046/j.1365-2346.1999.00420.x |
| [5] | Mahmood S, Mahmood O, El-Menyar A, et al. Predisposing factors, clinical assessment, management and outcomes of agitation in the trauma intensive care unit[J]. World J Emerg Med, 2018, 9(2): 105-112. DOI:10.5847/wjem.j.1920-8642.2018.02.004 |
| [6] | 书国伟, 张珏, 费智敏, 等. 成人急性脑损伤脑电双频指数和格拉斯哥昏迷评分相关性研究[J]. 上海交通大学学报:医学版, 2013, 33(7): 1010-1013. DOI:10.3969/j.issn.1674-8115.2013.07.024 |
| [7] | 张明, 钱俊英, 徐拥庆, 等. 脑电双频指数在评估心肺复苏术后患者脑功能及预后中的价值[J]. 中华急诊医学杂志, 2015, 24(1): 38-42. DOI:10.3760/cma.j.issn.1671-0282.2015.01.011 |
| [8] | 陈晨, 于泳浩, 李清. 脑电双频谱指数预测急性脑出血患者预后的准确性[J]. 中华麻醉学杂志, 2017, 37(5): 606-608. DOI:10.3760/cma.j.issn.0254-1416.2017.05.025 |
| [9] | Dong L, Chen L, Shi T, et al. Combined monitoring of intracranial pressure and bispectral index in patients with severe craniocerebral trauma post-operatively[J]. Clin Neurol Neurosurg, 2016, 148(1): 42-44. DOI:10.1016/j.clineuro.2016.06.004 |
| [10] | Oddo M, Crippa IA, Mehta S, et al. Optimizing sedation in patients with acute brain injury[J]. Crit Care, 2016, 20(1): 128. DOI:10.1186/s13054-016-1294-5 |
 2019, Vol. 28
2019, Vol. 28




