2 宁波市医疗中心李惠利医院重症医学科 315040;
3 郑州大学附属郑州中心医院呼吸重症医学科,450007;
4 金华市中心医院呼吸科 321000;
5 浙江大学医学院附属第二医院微生物室,杭州 310009;
6 浙江大学医学院附属第二医院心内科,杭州 310009
2 Department of Critical Care Medicine, Ningbo Medical Center, Lihuili Hospital, Ningbo University, Ningbo 315041, China;
3 Respiratory Intensive Care Unit, Zhengzhou Central Hospital Affliated to Zhengzhou University, Zhengzhou 450007, China;
4 Department of Respiratory Medicine, Jinhua Municipal Central Hospital, Jinhua 321000, China;
5 Microbiology Laboratory, The Second Affliated Hospital, Zhejiang University School of Medicine, Hangzhou 310009, China;
6 Department of Cardiology.The Second Affliated Hospital, Zhejiang University School of Medicine, Hangzhou, 310009, China
念珠菌血症(candidaemia)是临床常见的血行感染之一。随着广谱抗生素的使用、患者老龄化、免疫抑制治疗及各种侵入性操作的广泛开展,在过去的十几年里其全球发病率不断增长。其中,混合性念珠菌/细菌血症(混合性念珠菌血症)的感染较为特殊,念珠菌和细菌之间可存在拮抗或协同作用[1],使诊断和治疗难度增加,影响预后。目前国内外关于混合性念珠菌血症的临床研究不多,本研究回顾性分析本院混合性念珠菌血症和单一念珠菌血症患者的临床特征及预后,并探讨相关危险因素,旨在提高临床医生对此特殊类型感染的认识和诊治能力。
1 资料与方法 1.1 一般资料收集2012年1月至2015年6月期间浙江大学附属第二医院微生物实验室血培养念珠菌阳性患者的临床资料。同一患者、同一次住院期间内多次培养到相同菌株者按1例处理,药敏结果采用首次分离菌株的结果。根据是否合并细菌血流感染分为混合性念珠菌血症组和单一念珠菌血症组。
纳入标准:①年龄≥18岁;②血培养念珠菌阳性伴有发热、休克等感染表现者;③临床资料完整。排除标准:①年龄<18岁;②无伴随发热、休克等感染表现,无炎症指标变化,考虑定植[2];③临床资料不完整。
1.2 研究方法 1.2.1 相关定义(1) 念珠菌血症:指血培养分离到念珠菌生长同时伴有发热畏寒或低血压等相应的临床症状和体征,并排除标本污染[2]。(2)混合性念珠菌血症:指同一培养瓶中分离出念珠菌和细菌,或在分离出念珠菌的48 h内,在其他血标本中分离出细菌[3]。若培养出芽孢杆菌属(炭疽杆菌除外)、丙酸痤疮杆菌及棒状杆菌属则考虑皮肤定植菌污染可能性大,除非有临床感染证据支持;而凝固酶阴性葡萄球菌属和链球菌属,则需要2个不同部位阳性为感染[4]。
1.2.2 血培养及菌株鉴定采用美国Bact/Alert 3D全自动血培养仪及配套的Bact/Alert培养瓶进行血培养,若培养5 d无微生物生长,则判定为阴性。用VITEK2 compact全自动微生物鉴定仪鉴定菌种,ATB-Fungus药敏试剂盒进行药敏试验(以上仪器及试剂均为法国生物梅里埃公司)。念珠菌药敏试验采用纸片扩散法,结果按照2009年美国临床试验室标准化委员会(NCCLS)M27-A真菌药敏试验标准判定。
1.3 统计学方法使用SPSS 20.0统计学软件。正态分布计量资料用均数±标准差(Mean±SD)表达,两组间比较采用独立样本t检验;偏态分布计量资料用中位数(M)表达,两组间比较采用Mann-Whitney U检验;计数资料用频数及百分比表示,两组间比较采用χ2检验或Fisher确切检验;将单因素分析P < 0.10的资料,采用逐步前进法纳入非条件Logistic回归模型进行多因素分析。采用Kaplan-Meier生存分析法描绘两组的生存曲线并用log-rank检验差别。以P < 0.05为差异有统计学意义。
2 结果 2.1 研究流程和一般资料本研究共136例纳入最终分析,其中男性88例(64.7%),共40例(29.4%)为混合性念珠菌血症。两组一般资料比较显示,在年龄、性别、基础疾病等方面比较差异无统计学意义;与单一念珠菌血症相比,混合性念珠菌血症组其SOFA评分更高,感染前住院天数更长,感染时入住ICU比例更高,更多患者行输血和机械通气治疗,使用更多白蛋白以及利奈唑胺抗生素治疗(均P﹤0.05),见表 1。
| 指标 | 单一念珠菌血症组(n=96) | 混合性念珠血症组(n=40) | 统计量 | P值 |
| 年龄(岁)a | 64±17 | 64 ±18 | -0.055 | 0.894 |
| 男性(例, %) | 60(62.5) | 28(70.0) | 0.695 | 0.404 |
| SOFA评分[M(P25,P75)] | 7.0(3.0-10.0) | 8.0(5.5-15.0) | -2.724 | 0.010 |
| 感染前住院天数[M(P25,P75)] | 17.0(9.0-30.0) | 21.0(10.0-109.0) | -2.080 | 0.031 |
| 感染时入住ICU(例, %) | 48(50.0) | 29(72.5) | 5.820 | 0.016 |
| 院内获得性感染(例, %) | 89(92.7) | 38(95.0) | 0.021 | 0.911 |
| 基础疾病(例, %) | ||||
| 糖尿病 | 17(17.7) | 9(22.5) | 0.419 | 0.517 |
| 慢性肾脏疾病 | 6(6.2) | 1(2.5) | 0.227 | 0.634 |
| 实体肿瘤 | 15(15.6) | 6(15.0) | 0.008 | 0.927 |
| 血液肿瘤 | 2(2.1) | 1(2.5) | 1.000 | |
| 颅脑损伤 | 31(32.3) | 18(45.0) | 1.978 | 0.160 |
| COPDb或严重哮喘 | 6(6.2) | 5(12.5) | 0.762 | 0.383 |
| 高危因素(念珠菌血症发生30 d内)(例, %) | ||||
| 免疫抑制 | 18(18.8) | 8(20.0) | 0.029 | 0.866 |
| 低蛋白血症 | 60(62.1) | 28(70.0) | 0.695 | 0.404 |
| 输血 | 34(35.4) | 23(57.5) | 5.656 | 0.017 |
| 输注白蛋白 | 65(67.7) | 34(85.0) | 4.263 | 0.039 |
| 机械通气 | 47(49.0) | 28(70.0) | 5.054 | 0.025 |
| 留置深静脉导管 | 79(82.3) | 37(92.5) | 2.346 | 0.126 |
| 留置导尿 | 76(79.2) | 37(92.5) | 3.572 | 0.059 |
| 血液透析 | 12(12.5) | 9(22.5) | 2.162 | 0.141 |
| 全胃肠外营养 | 19(19.8) | 6(15.0) | 0.432 | 0.511 |
| 腹腔手术 | 11(11.5) | 4(10.0) | 0.000 | 1.000 |
| 初始抗生素暴露 | 89(92.7) | 38(95.0) | 0.012 | 0.911 |
| 头孢菌素类 | 13(13.5) | 5(12.5) | 0.027 | 0.870 |
| 碳青酶烯类 | 59(61.5) | 25(62.5) | 0.013 | 0.909 |
| β-内酰胺类 | 49(51.0) | 24(60.0) | 0.911 | 0.340 |
| 糖肽类 | 37(38.5) | 11(27.5) | 1.507 | 0.220 |
| 青霉素类 | 8(8.3) | 1(2.5) | 0.754 | 0.385 |
| 喹诺酮类 | 9(9.4) | 5(12.5) | 0.056 | 0.813 |
| 阿米卡星 | 9(9.4) | 3(7.5) | 0.000 | 0.984 |
| 利奈唑胺 | 13(13.5) | 12(30.0) | 5.098 | 0.024 |
| 唑类药物 | 1(1.0) | 1(2.5) | 1.000 | |
| 注:aMean±SD;bCOPD为慢性阻塞性肺病 | ||||
两组在体温、血常规、肝肾功能、凝血功能、C反应蛋白及前降钙素等指标方面均差异无统计学意义(均P > 0.05)。
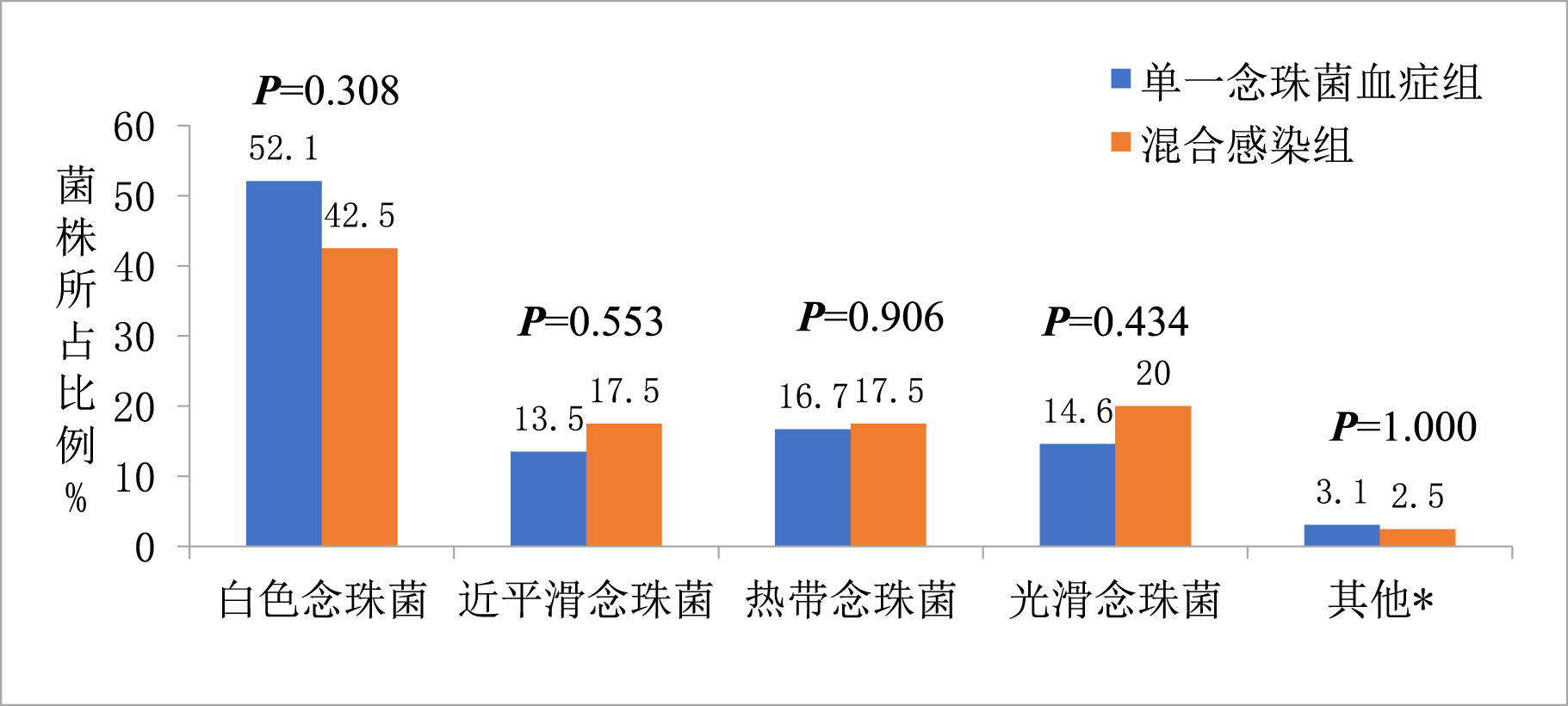
2.3 血微生物培养结果在念珠菌菌种分布上,最常分离到的仍为白色念珠菌67例(49.3%),但非白色念珠菌(50.7%)超过白色念珠菌,具体为近平滑念珠菌20例(14.7%),其次为热带念珠菌(23例, 16.9%)以及光滑念珠菌(22例, 16.2%),两组在念珠菌菌株分布上差异无统计学意义(见图 1)。40例混合性念珠菌血症细菌培养结果显示:以革兰阳性球菌为主(62.5%,25/40),分别为凝固酶阴性葡萄球菌10例、肠球菌8例,金黄色葡萄球菌和头状葡萄球菌各3例;而革兰阴性菌则为鲍曼不动杆菌7例,肺炎克雷伯菌4例,铜绿假单胞菌2例,大肠埃希菌和阴沟肠杆菌各1例。有1例患者同时合并鲍曼不动杆菌和金黄色葡萄球菌感染。
|
| 其他*为克柔念珠菌1例、季也蒙念珠菌1例、皱褶念珠菌1例、无名假丝酵母菌1例 图 1 混合性念珠菌血症组与单一念珠菌血症组的念珠菌种类分布图 Fig 1 Comparison of the distribution of Candida species isolated from mixed Candida/bacterial BSIs and candidaemia |
|
|
两组中近平滑念珠菌的药物敏感性最好,对常用抗真菌药如氟康唑及伊曲康唑均无耐药菌株,而白色念珠菌、热带念珠菌和光滑念珠菌均有不同程度耐药(对氟康唑的敏感率分别为88.1%、60.9%、61.1%;对伊曲康唑的敏感率分别为91.0%、56.5%、61.1%;对两性霉素B的敏感率分别为97.1%、100%、94.4%;对伏立康唑的敏感率分别为97.1%、73.9%、83.3%);各类念珠菌对克霉唑和酮康唑的耐药性较高,对两性霉素B的敏感性最好(94.1%~100%),但两组整体药物敏感结果差异无统计学意义(均P﹥0.05)。因微生物室所购药敏试剂盒未包含棘白菌素类,故无法得知棘白菌素类药敏结果。
2.5 混合性念珠菌血症的危险因素分析单因素分析显示,感染前住院天数越长、感染时入住ICU、输血、输注白蛋白、行机械通气、利奈唑胺使用以及SOFA评分高与混合性念珠菌血症发生相关(均P﹤0.05)。见表 1。取P < 0.10的各参数进行Logistic回归分析,发现仅SOFA评分一项,两组比较差异有统计学意义(P=0.003)。
2.6 两组临床治疗比较两组经验性抗真菌治疗比例相当(P﹥0.05),而选用的抗真菌药物也相似(P﹥0.05);两组经验性抗真菌正确治疗的比例均高达80%以上(P﹥0.05)。两组各有5例患者在血培养采血后3 d内死亡,未予任何抗真菌治疗。在血培养阳性后,两组目标治疗在抗真菌药物选择上无区别(P﹥0.05),但混合性念珠菌血症组抗真菌疗程比单一念珠菌血症组长5 d(P=0.027)(表 2)。在抗细菌治疗上,混合性念珠菌血症与单一念珠菌血症患者大部分均行经验性抗细菌血症治疗,比例分别为(95.0% vs 92.7%, P﹥0.05)。在混合性念珠菌血症中,经验性治疗正确比例为55.2%,当调整为目标治疗后,其正确治疗比例为87.5%(仅有5例患者未接受正确抗菌治疗,3例为泛耐药鲍曼不动杆菌,1例为耐碳青霉烯类肺炎克雷伯菌,1例为耐万古霉素肠球菌);而在单一念珠菌血症中,62.5%的患者在真菌血培养阳性后继续经验性抗细菌治疗。两组在感染灶控制上无区别(P﹥0.05)。
| 治疗指标 | 单一念珠菌血症组(n=96) | 混合感染组(n=40) | 统计量 | P值 |
| 感染灶控制(例,%) | 0.405 | |||
| 未控制 | 26(27.1) | 13(32.5) | ||
| 48 h内控制 | 68(70.8) | 27(67.5) | ||
| 48 h后控制 | 2(2.1) | 0 | ||
| 经验性治疗 | ||||
| 例数(例,%) | 38(39.6) | 16(40.0) | 0.002 | 0.964 |
| 抗真菌药物 | 0.201 | |||
| 氟康唑 | 22(57.9) | 5(31.3) | ||
| 伏立康唑 | 7(18.4) | 5(31.3) | ||
| 卡泊芬净 | 9(23.7) | 6(37.5) | ||
| 正确抗真菌治疗a | 25(25/29) | 8(8/10) | 0.636 | |
| 目标性治疗 | ||||
| 例数 | n=91 | n=35 | ||
| 抗真菌药物(例,%) | 0.364 | |||
| 氟康唑 | 44(48.4) | 13(37.1) | ||
| 伊曲康唑 | 1(1.1) | 1(2.9) | ||
| 伏立康唑 | 18(19.8) | 9(25.7) | ||
| 卡泊芬净 | 28(30.8) | 12(34.3) | ||
| 抗真菌药物疗程[d,M(P25, P75)] | 7.0(3.0-13.5) | 12.0(4.0-25.0) | -2.382 | 0.027 |
| 注:a剔除经验性使用卡泊芬净治疗的病例 | ||||
与单一念珠菌血症组相比,混合性念珠菌血症组并发脓毒性休克比例较高,但差异无统计学意义(P=0.075);其总入住ICU时间和总住院时间均较长(P均﹤0.05),但两组30 d总病死率和90 d总病死率差异无统计学意义(P > 0.05)。见表 3。Kaplan-Meier生存曲线提示:发病至死亡的平均时间,单一念珠菌血症组为63 d,混合性念珠菌血症组为58 d,差异也无统计学意义(P=0.306)。
| 预后指标 | 单一念珠菌血症组(n=96) | 混合感染组(n=40) | 统计量 | P值 |
| 总入住ICU时间[d,M(P25, P75)] | 17.0(9.0-30.0) | 20.5(10.0-109.0) | -1.800 | 0.031 |
| 总住院时间[d,M(P25, P75)] | 31.0(16.0-60.8) | 43.0(21.5-109.0) | -1.841 | 0.021 |
| 并发脓毒性休克(例, %) | 22(22.9) | 15(37.5) | 3.032 | 0.082 |
| 30 d总病死率(例, %) | 31(32.3) | 16(40.0) | 0.742 | 0.389 |
| 90 d总病死率(例, %) | 35(36.5) | 18(45.0) | 0.866 | 0.352 |
本研究结果显示混合性念珠菌血症占念珠菌血症的29.4%,这与近年来国内外文献报道结果基本一致[3, 5, 6]。与单一念珠菌血症相比,混合性念珠菌血症组其SOFA评分高,感染前住院天数更长,感染时入住ICU比例更高,更多患者行输血和机械通气治疗,输注更多白蛋白以及使用利奈唑胺抗生素治疗。而多因素分析发现,SOFA评分是混合性念珠菌血症感染的唯一独立危险因素。混合性念珠菌血症组并发的细菌感染以革兰阳性球菌为主,革兰阴性菌相对较少,尽管其抗真菌治疗疗程较长,但两者的30 d和90 d病死率差异无统计学意义。这些结果提示,与单一念珠菌血症相比,混合性念珠菌血症组尽管病情相对重,但不会增加病死率。
混合性念珠菌血症作为一种特殊的血流感染,对其认识和研究较少,目前尚无统一的定义。有研究将1周内血培养先后或同时分离出念珠菌和细菌定义为混合感染[7],而有些研究将其时间定义为48 h[3, 5]。本研究采用了48 h的时间定义,是因为考虑到在现有的血培养技术条件下共生的细菌可能会阻碍真菌的检出[8],从而低估混合感染的发生率。本研究发现念珠菌血症中有29.4%合并细菌血流感染,可见,在念珠菌血症中合并细菌血症的比例较高。这可能是因为细菌和念珠菌大多共生于人体内,当发生侵袭性念珠菌血症时,机体免疫屏障被破坏,共生的多种细菌可通过黏膜和植入装置(如静脉导管、尿管等)随之入侵机体,导致混合性念珠菌血症的发生[9]。因为目前血培养技术的敏感性较低,其阳性率多在50%~70%之间,在粒缺患者中可能更低[10]。同时,血培养技术判断真菌和细菌混合感染的能力不足[11],临床实际工作中混合性念珠菌血症比例还要高,当培养到单一念珠菌血症时,需要警惕混合性念珠菌血症的存在。
念珠菌血症的危险因素主要有腹部手术、全肠外营养、严重脓毒症或脓毒性休克、念珠菌多部位定植、糖尿病、各种侵入性导管留置、长期入住ICU、免疫抑制状态、使用广谱抗生素等[12-13],但关于混合性念珠菌血症的危险因素却极少报道。本研究结果显示,与单一念珠菌血症相比,混合性念珠菌血症组其SOFA评分高、感染前住院天数更长、感染时入住ICU比例更高、更多患者行输血和机械通气治疗、输注更多白蛋白以及使用利奈唑胺抗生素治疗,而感染前的住院天数、入住ICU的比例以及需要输血和机械通气治疗等,均提示病情严重;进一步的多因素回归分析显示SOFA评分高是其独立危险因素,SOFA评分高、多脏器功能衰竭与病死率增加相关,能反映疾病严重程度[14]。本研究结果与既往研究相似[3, 6-7]。另外,Benson等[15]报道输注红细胞悬液及血小板与医院获得性感染发生相关,而Nacionales等[16]进一步研究发现输血可导致脓毒症患者免疫调节紊乱,这间接部分解释本研究中发现输血和输注更多白蛋白是混合性念珠菌血症的易感因素。
本研究发现混合性念珠菌血症中细菌感染以革兰阳性菌为主,这与国内外研究相一致[3, 5-7]。细菌和念珠菌间的相互作用导致了细菌谱分布的差异,多项研究提示念珠菌与金黄色葡萄球菌或表皮葡萄球间通过混合性生物被膜的形成产生共生和协同关系[17-20];而大量研究提示革兰阴性菌与念珠菌之间多存在拮抗作用[21-25]。针对念珠菌与细菌之间的相互作用以及机制,不仅有助于提高对混合性念珠菌血症的认识和诊治水平,更可能为今后研究新型抗感染药物提供新的途径和靶点。
动物模型和体外研究表明,与单一念珠菌血症相比,混合性念珠菌血症感染更易形成生物被膜,诱导耐药性,增强念珠菌的侵袭力和破坏性,增加诊断和治疗的难度,导致病死率增加[17, 20, 26]。Kim等[3]发现混合性念珠菌血症组早期念珠菌清除率不及单一念珠菌血症组。本研究发现混合性念珠菌血症组较单一念珠菌血症组需要更长的抗真菌治疗疗程,具有更长的入住ICU时间和住院时间,考虑与念珠菌、细菌的协同作用有关,导致治疗难度增加和治疗时间延长。但与单一念珠菌血症相比,混合性念珠菌血症并不增加30 d病死率和90 d的病死率,与文献[3, 6-7]报道结果一致,这可能与以下因素相关:(1)样本量少;(2)两组患者在年龄、性别、基础疾病、生化特征、念珠菌菌株分布及药敏结果、经验性抗真菌治疗比例及正确性、目标性抗真菌治疗、感染灶及时控制等方面没有区别(均P﹥0.05),可能是两组病死率相当的因素之一;(3)本研究中的混合性念珠菌血症患者有较高的经验性抗细菌治疗比例(95.0%)。
本研究有以下不足之处:①为单中心回顾性分析研究;②诊断方法采用的是标准的血培养技术,在细菌和真菌混合感染时不利于真菌的识别[11],可能低估了真菌血症及混合感染的发生比例;③本研究样本量较少(共136例)。
综上所述,混合性念珠菌血症并不少见,并发细菌感染以革兰阳性球菌为主;SOFA评分高,病情严重,是发生混合性念珠菌血症的独立危险因素。尽管不增加病死率,但是混合性念珠菌血症,需要更长的抗真菌治疗疗程,具有更长的入住ICU时间和住院时间,治疗难度大,应引起足够的重视。
志谢: 胡信雷博士(浙江大学医学院附属第二医院骨科)和董长征副教授(宁波大学医学院预防医学系)在本研究数据统计中做出贡献| [1] | Allison DL, Willems HME, Jayatilake JAMS, et al. Candida-Bacteria interactions: their impact on human disease[J]. Microbiol Spectr, 2016, 4(3): 1-26. DOI:10.1128/microbiolspec.VMBF-0030-2016 |
| [2] | Ascioglu S, Rex JH, de Pauw B, et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus[J]. Clin Infect Dis, 2002, 34(1): 7-14. DOI:10.1086/323335 |
| [3] | Kim SH, Yoon YK, Kim MJ, et al. Risk factors for and clinical implications of mixed Candida/bacterial bloodstream infections[J]. Clin Microbiol Infect, 2013, 19(1): 62-68. DOI:10.1111/j.1469-0691.2012.03906.x |
| [4] | Schifman RB, Strand CL, Meier FA, et al. Blood culture contamination: a College of American Pathologists Q-Probes study involving 640 institutions and 497134 specimens from adult patients[J]. Arch Pathol Lab Med, 1998, 122(3): 216-221. |
| [5] | Klotz SA, Chasin BS, Powell B, et al. Polymicrobial bloodstream infections involving Candida species: analysis of patients and review of the literature[J]. Diagn Microbiol Infect Dis, 2007, 59(4): 401-406. DOI:10.1016/j.diagmicrobio.2007.07.001 |
| [6] | 刘涌, 孙永昌, 卓婕, 等. 念珠菌血症合并细菌血流感染的临床与危险因素分析[J]. 中华结核和呼吸杂志, 2014, 37(2): 99-103. DOI:10.3760/cma.j.issn.1001-0939.2014.02.007 |
| [7] | Bouza, E, Burillo A, Munoz P, et al. Mixed bloodstream infections involving bacteria and Candida spp[J]. J Antimicrob Chemother, 2013, 68(8): 1881-1888. DOI:10.1093/jac/dkt099 |
| [8] | Kaleli I, Cevahir N, Demir M, et al. Anticandidal activity of Pseudomonas aeruginosa strains isolated from clinical specimens[J]. Mycoses, 2007, 50(1): 74-78. DOI:10.1111/j.1439-0507.2006.01322.x |
| [9] | Peters BM, Jabra-Rizk MA, O'May GA, et al. Polymicrobial interactions: impact on pathogenesis and human disease[J]. Clin Microbiol Rev, 2012, 25(1): 193-213. DOI:10.1128/CMR.00013-11 |
| [10] | Cuenca-Estrella M, Verweij PE, Arendrup MC, et al. ESCMID* guideline for the diagnosis and management of Candida diseases 2012: diagnostic procedures[J]. Clin Microbiol Infect, 2012, 18(Suppl. 7): 9-18. DOI:10.1111/1469-0691.12038 |
| [11] | Hockey LJ, Fujita NK, Gibson TR, et al. Detection of fungemia obscured by concomitant bacteremia: in vitro and in vivo studies[J]. J Clin Microbiol, 1982, 16(6): 1080-1085. |
| [12] | Falcone M, Tiseo G, Tascini C, et al. Assessment of risk factors for candidemia in non-neutropenic patients hospitalized in Internal Medicine wards: A multicenter study[J]. Eur J Intern Med, 2017, 41(6): 33-38. DOI:10.1016/j.ejim.2017.03.005 |
| [13] | 唐洪影, 岳娜, 田彬, 等. 降钙素原在念珠菌血流感染中的辅助诊断价值[J]. 中华急诊医学杂志, 2018, 27(3): 254-258. DOI:10.3760/cma.j.issn.1671-0282.2018.03.006 |
| [14] | Vincent JL, de Mendonca A, Cantraine F, et al. Working group on "sepsis-related problems"of the European society of intensive care medicine. Use of the SOFA score to assess the incidence of organ dysfunction/failure in intensive care units: results of a multicenter, prospective study[J]. Crit Care Med, 1998, 26(11): 1793-1800. DOI:10.1097/00003246-199811000-00016 |
| [15] | Benson AB, Burton JR Jr, Austin GL, et al. Differential effect of plasma and red blood cell transfusion on acute lung injury and infection risk following liver transplantation[J]. Liver Transpl, 2011, 17(2): 149-158. DOI:10.1002/lt.22212 |
| [16] | Nacionales DC, Cuenca AG, Ungaro R, et al. The acute immunological response to blood transfusion is influenced by polymicrobial sepsis[J]. Shock, 2012, 38(6): 598-606. DOI:10.1097/SHK.0b013e318273621a |
| [17] | Harriott MM, Noverr MC. Candida albicans and Staphylococcus aureus form polymicrobial biofilms: effects on antimicrobial resistance[J]. Antimicrob Agents Chemother, 2009, 53(9): 3914-3922. DOI:10.1128/AAC.00657-09 |
| [18] | Adam B, Baillie GS, Douglas LJ. Mixed species biofilms of Candida albicans and Staphylococcus epidermidis[J]. J Med Microbiol, 2002, 51(4): 344-349. DOI:10.1099/0022-1317-51-4-344 |
| [19] | Archer NK, Harro JM, Shirtliff ME. Clearance of Staphylococcus aureus nasal carriage is T cell dependent and mediated through interleukin-17A expression and neutrophil influx[J]. Infect Immun, 2013, 81(6): 2070-2075. DOI:10.1128/IAI.00084-13 |
| [20] | Carlson E. Enhancement by Candida albicans of Staphylococcus aureus, Serratia marcescens, and Streptococcus faecalis in the establishment of infection in mice[J]. Infect Immun, 1983, 39(1): 193-197. |
| [21] | Bandara HM, Lam OL, Watt RM, et al. Bacterial lipopolysaccharides variably modulate in vitro biofilm formation of Candida species[J]. J Med Microbiol, 2010, 59(10): 1225-1234. DOI:10.1099/jmm.0.021832-0 |
| [22] | Brand A, Barnes JD, Mackenzie KS, et al. Cell wall glycans and soluble factors determine the interactions between the hyphae of Candida albicans and Pseudomonas aeruginosa[J]. FEMS Microbiol Lett, 2008, 287(1): 48-55. DOI:10.1111/j.1574-6968.2008.01301.x |
| [23] | Cugini C, Calfee MW, Farrow JM, et al. Farnesol, a common sesquiterpene, inhibits PQS production in Pseudomonas aeruginosa[J]. Mol Microbiol, 2007, 65(4): 896-906. DOI:10.1111/j.1365-2958.2007.05840.x |
| [24] | Boon C, Deng Y, Wang LH, et al. A novel DSF-like signal from Burkholderia cenocepacia interferes with Candida albicans morphological transition[J]. ISME J, 2008, 2(1): 27-36. DOI:10.1038/ismej.2007.76 |
| [25] | Gaddy JA, Tomaras AP, Actis LA. The Acinetobacter baumannⅡ 19606 OmpA protein plays a role in biofilm formation on abiotic surfaces and in the interaction of this pathogen with eukaryotic cells[J]. Infect Immun, 2009, 77(8): 3150-3160. DOI:10.1128/IAI.00096-09 |
| [26] | 杨卫明, 吴春荣, 许群欢, 等. 共同感染对白色念珠菌感染状态的影响研究[J]. 中华急诊医学杂志, 2016, 25(4): 423-428. DOI:10.3760/cma.j.issn.1671-0282.2016.04.006 |
 2019, Vol. 28
2019, Vol. 28




