毒蘑菇又称为毒菌或毒蕈,属大型真菌类。误采、误食毒蘑菇可引起急性中毒,呈现地域性、季节性发病,常有家庭聚集和群体性发病的特点,社会危害大。部分品种中毒病死率高,其中具有肝毒性的鹅膏菌属品种中毒病死率高达80%[1],蘑菇中毒已成为我国食源性疾病中病死率最高的一类急症。其临床表现复杂多样,多数患者以恶心、呕吐、腹痛、腹泻等胃肠道症状为中毒始发表现,随后可因摄入毒蘑菇所含毒素不同,产生不同的靶器官损害,甚至衰竭而死亡。因此,如何早期识别致死性蘑菇中毒并及时规范救治是当前医护人员面临的巨大挑战[2]。
目前,科学界对毒蘑菇种类及其毒素认知尚不完全,缺乏快速区分有毒与可食用蘑菇的有效办法,对蘑菇毒素的认识及检测方法都存在一定问题。此外,目前还没有蘑菇中毒诊治的相关共识或指南,各级医院医护人员对蘑菇中毒诊治缺乏统一认识和应有的规范。为此,中国医师协会急诊医师分会、中国急诊专科医联体、中国医师协会急救复苏和灾难医学专业委员会、北京急诊医学学会组织专家在复习大量相关文献基础上,依据他们的学术和临床经验起草,并提交共识委员会讨论通过,就蘑菇中毒的临床诊治规范达成共识,旨在帮助临床医护人员对蘑菇中毒患者做出审慎与适时的评估与治疗。
1 共识的制定方法学中国医师协会急诊医师分会、中国急诊专科医联体、中国医师协会急救复苏和灾难医学专业委员会、北京急诊医学学会组织来自全国各地有着扎实理论知识和丰富临床经验的多位专家共同组成了中国蘑菇中毒诊治临床专家共识制定小组,检索了Pubmed、Emabase、Springer、Interscience Wiley及万方数据库、维普数据库及中国学术期刊网络出版总库中发表的文献,在专家组成员审阅文献的基础上,结合自身临床经验,制定本共识,并经过反复讨论修改,最终制定本共识。
2 流行病学迄今,全球有大型真菌约14万种,每年约有5-10/10万人因蘑菇中毒而死亡,主要集中在欧洲、美国、日本、中国、伊朗等国家[3-4]。常见毒蘑菇种类多分布在鹅膏菌属、环柄菇属、盔孢伞属、牛肝菌科、红菇属、青褶伞属、类脐菇属、粉褶菌属、裸盖菇属、鹿花菌属等[5-6]。北美真菌协会(NAMA)蘑菇中毒年度报告显示,2007-2014年共有690例,死亡率为2.17%[7]。日本2001-2010年共有1920例蘑菇中毒,病死率为0.52%[8]。目前,我国已知有毒蘑菇435种,分布广泛,引发的中毒事件呈现季节性和地域性分布特点[9]。6~9月是蘑菇中毒高发期,以云南、贵州、四川、湖北、湖南、广西、广东为中毒高发地域。误将毒蘑菇当作食用蘑菇是引发中毒的主要原因[1]。其中灰花纹鹅膏、致命鹅膏、裂皮鹅膏、淡红鹅膏、假淡红鹅膏、条盖盔孢伞、肉褐鳞环柄菇和亚稀褶红菇等是我国最常见导致患者死亡的蘑菇种类,95%以上的死亡病例为含鹅膏毒肽蘑菇中毒[10]。据报道,我国蘑菇中毒总体病死率11.69%~42.30%,明显高于欧美及日本等国[1, 7]。
3 毒素分类及毒理机制毒蘑菇种类繁多,所含毒素复杂。一种毒蘑菇多含有多种毒素,同一种毒素也可出现在不同种、属蘑菇中。目前,已知毒素种类有限,根据毒素结构和毒性可分为环肽类、奥来毒素、毒蕈碱类、裸盖菇素、异恶衍生物、鹿花菌素、鬼伞素等[11]。
3.1 环肽类及其机制(cyclopeptides)为最主要致死毒素,常存在于鹅膏属、环柄菇属、盔孢伞属的部分品种中,主要包括鹅膏毒肽(amatoxins)、鬼笔毒肽(phallotoxins)及毒伞肽(virotoxins)。(1)鹅膏毒肽,分子量约900道尔顿,水溶性,热稳定、耐酸碱。小鼠LD50为0.2~0.5 mg/kg[12-13]。可经胃肠道快速吸收,2 h血中浓度即可达峰,48 h内经OATP1B3转运体或牛磺胆酸钠协同转运蛋白多肽快速分布到肝脏,毒素不能经过胎盘[14-16]。毒素经过肾脏排泄。肝肾为主要靶器官,鹅膏毒肽主要通过抑制RNA聚合酶Ⅱ活性,阻止mRNA转录和蛋白质合成[5, 17],造成细胞损伤,也可通过氧化应激,产生内源性因子,造成细胞凋亡[18-19]。(2)鬼笔毒肽,为速效毒素,动物腹腔注射2~5 h可致死,小鼠LD50为1.5~2.0 mg/kg[20],主要机制为干扰丝状肌动蛋白与球状肌动蛋白转化平衡,阻止细胞骨架形成[21]。(3)毒伞肽与鬼笔毒肽中毒机理相似[21]。
3.2 奥来毒素及其机制(orellanine)为致死毒素,存在于有丝膜菌属。毒素能抑制DNA、RNA、蛋白质大分子合成,造成细胞氧化应激损伤[22]。肾脏为主要靶器官,急性肾功能衰竭可出现在摄入后3-14 d,病死率达11%[23-25]。
3.3 2-氨基-4, 5-己二烯酸(2-amino-4, 5-hexadienoic acid)为致死毒素,存在于造成急性肾衰竭型的鹅膏属中。有关中毒机制尚不清楚[7]。
3.4 环丙-2-烯羧酸(cycloprop-2-ene carboxylic acid)为致死毒素,存在于造成横纹肌溶解型的亚稀褶红菇中。有关中毒机制尚不清楚[7]。
3.5 鹿花菌素及其机制(gyromitrin)见于鹿花菌及马鞍菌,其水解产物甲基肼(MMH)可抑制谷氨酸脱羧酶的辅助因子吡哆醛,减少γ氨基丁酸合成而产生毒性[26-27],同时诱导溶血。中毒表现为呕吐,腹泻,眩晕,谵妄,共济失调,眼球震颤,抽搐,溶血,肾功能衰竭,严重导致患者死亡等[28]。
3.6 其他毒素及其机制多为非致死毒素。(1)毒蕈碱类(muscarine),主要发现于丝盖伞属(Inocybe)和杯伞属(Clitocybe)中,粉褶菌(Entoloma)和小菇属(Mycena)也有少数品种包含该类毒素,具有胆碱能促进作用,不能通过血脑屏障,中毒后可表现为副交感神经兴奋症状[29]。(2)裸盖菇素(psilocybin),存在于裸盖菇属(Psilocybe)、斑褶伞属(Panaeolus)、裸伞属(Gymnopilus)、锥盖伞属(Conocybe)、丝盖伞属(Inocybe)以及光柄菇属(Pluteus)中的一些种类,为一类色胺衍生物,激动5羟色胺受体,可产生精神错乱、幻视、烦躁、意识障碍等中毒症状。(3)异噁唑衍生物(isoxazoles),见于鹅膏属鹅膏组(Amanita sect. Amanita)的一些种类和毒蝇口蘑(Tricholoma muscarium),可刺激NMDA受体和γ氨基丁酸产生神经精神症状。(4)鬼伞素(coprine),见于墨汁鬼伞,可诱发机体双硫仑样反应[30-31]。
4 临床表现及分型蘑菇中毒临床表现复杂多样,与摄入蘑菇类型及所含毒素密切相关。超过90%的蘑菇中毒首先出现恶心、呕吐、腹痛、腹泻等胃肠道表现,继而根据蘑菇种类不同可累及不同器官及系统,可分为以下临床类型:急性肝损型、急性肾衰竭型、溶血型、横纹肌溶解型、胃肠炎型、神经精神型、光过敏皮炎型,其他损伤类型[4, 32-37],见下表。
| 临床分型 | 种类 | 临床特点 | 预后 |
| 急性肝损型 | 鹅膏菌属、盔孢菌属、环柄菇属等 | 潜伏期通常大于6 h,一般10~14 h,初期表现为胃肠道症状,消化道症状可一过性缓解消失,即假愈期,36~48 h后出现黄疸,出血,凝血酶原时间延长,胆酶分离,急性肝衰竭,多脏器功能衰竭,甚至死亡 | 高致死 |
| 急性肾衰竭型 | 鹅膏菌属、丝膜菌属等 | 潜伏期通常大于6 h,表现少尿,血肌酐、尿素氮升高,急性肾功能衰竭 | 可致死 |
| 溶血型 | 桩菇属、红角肉棒菌等 | 潜伏期0.5~3 h,表现为少尿、无尿、血红蛋白尿、贫血、急性肾功能衰竭,休克、弥散性血管内凝血,严重时导致死亡 | 可致死 |
| 横纹肌溶解型 | 亚稀褶红菇、油黄口蘑等 | 潜伏期10 min至2 h,表现为乏力,四肢酸痛,恶心呕吐,色深尿,胸闷等,后期可致急性肾功能衰竭,因呼吸循环衰竭而死亡 | 高致死 |
| 胃肠炎型 | 青褶伞属、乳菇属、红菇属、牛肝菌科等 | 潜伏期绝大多数小于2 h,表现为胃肠道症状,重度可出现电解质紊乱,休克 | 良好 |
| 神经精神型 | 鹅膏菌属、丝盖伞属、小菇属、裸盖菇属、裸伞属等 | 潜伏期小于2 h,表现为出汗、流涎、流泪、谵妄、幻觉、共济失调,癫痫、妄想等 | 良好 |
| 光过敏性皮炎型 | 污胶鼓菌、叶状耳盘菌等 | 潜伏期最短3 h,通常为1~2 d,表现为日晒后在颜面,四肢出现突发皮疹,自觉瘙痒 | 良好 |
以上七种临床型仅为临床观察病例较多、能够形成共识的分类,但蘑菇所含毒素复杂,几乎可对所有组织器官造成伤害,器官损伤常交叉存在,有待不断总结与补充。如平菇、毒沟褶菌等有报道具有心脏毒性,可导致猝死,但其毒性尚需进一步证实[34-35];部分马勃菌可导致过敏性肺炎[36];杯伞菌中毒可引起红斑性肢痛[37]等。
推荐意见1 蘑菇中毒临床表现多样,缺乏特异性,应避免仅依据患者中毒始发表现判断临床类型和预后。对蘑菇种类不明确尤其是潜伏期超过6 h的中毒患者应警惕致死性蘑菇中毒可能。
5 实验室及辅助检查 5.1 一般检查蘑菇中毒缺乏特异性效应标志物,实验室一般检查可反映毒素损害的靶器官和受累程度。轻度中毒患者实验室检查可正常,重度中毒常逐渐出现多器官功能损害,需要严密监测。肝功能损害,包括胆红素、ALT、AST升高,凝血功能异常,甚至胆酶分离等[38];肾功能损害,包括血肌酐、血尿素氮升高;凝血功能改变,包括PT、APTT延长,纤维蛋白原下降,甚至DIC等;心脏功能损害,包括CK、CK-MB及肌钙蛋白升高等。超声检查可见肝脏在中毒早期增大、回声不均匀,后期可缩小;脾脏增大;肾脏增大、肾皮质增厚;肝周、胸腔、腹腔、盆腔积液等[39]。心电图可见窦性心动过速、ST-T倒置、QT延长、室性心动过速等[40]。超声心动图可见左室功能收缩功能降低等[41]。
5.2 毒物检测留取患者呕吐物、血液、尿液或蘑菇等样本尽早进行毒物检测。目前,国内外对蘑菇毒素的检测技术主要有化学显色检测法、薄层层析法、放射免疫法、酶联免疫法、高效液相色谱法及液相色谱-质谱法等。其中应用高效液相色谱法及液相色谱-质谱法检测鹅膏毒肽的方法较为成熟[42-43]。奥来毒素可用2%三价铁氯化物和盐酸反应显色实验进行定性检测[44]。毒物检测为蘑菇中毒的诊断及预后评估提供重要信息。需要注意的是,鹅膏毒肽在血液里存留时间一般不超过24~48 h,而尿液持续阳性的时间可达96 h[27, 45]。
5.3 蘑菇形态学分类鉴定是最常用的毒蘑菇鉴别方法,通过对蘑菇子实体宏观和微观特征点的观察、测量、比对来进行鉴定。中毒现场可通过对蘑菇照片的识别作出初步判断。
5.4 蘑菇分子鉴定近年,随着基因测序技术的发展和真菌分子鉴定数据库的完善,应用内转录间隔区(internal transcribed spacer,ITS)片段测序与比对,为毒蘑菇鉴定提供可靠手段[46-47]。
推荐意见2 蘑菇中毒患者应动态监测肝、肾功能及出凝血变化,有条件应尽早进行蘑菇物种鉴定和毒素检测。
6 诊断与鉴别诊断一般依据蘑菇的摄入史、临床表现及其靶器官损害证据,可作出蘑菇中毒的临床诊断。时间窗内的血、尿、呕吐物、体液等样本中检测到相应的蘑菇毒素可确立诊断。
6.1 诊断(1)病史:明确的蘑菇食用史,最好能提供蘑菇实物或照片等直接证据。(2)同食者出现相似症状。(3)临床表现:依据蘑菇种类,蘑菇中毒潜伏期从数分钟到十余天,初始表现可以是恶心、呕吐、腹痛、腹泻等消化道症状,也可以是幻听等精神症状,以及肝、肾、凝血等器官功能损害的表现。(4)辅助检查:提示肝、肾、凝血等器官功能损害。血、尿、呕吐物、体液标本中检测到蘑菇毒素可确诊。
6.2 鉴别诊断蘑菇中毒需与急性胃肠炎、细菌性痢疾、霍乱等鉴别。出现毒蕈碱样症状需与有机磷中毒鉴别。意识障碍需与脑血管疾病、低血糖、糖尿病高渗性昏迷、肝性脑病、肺性脑病、一氧化碳中毒、酒精中毒等鉴别。以肝损为突出表现的蘑菇中毒应与引起急性肝功能衰竭的其他常见病因如病毒性肝炎、药物性肝炎、热射病等相鉴别。以肾损害为突出表现的蘑菇中毒应常规排查引起肾功能损害的肾前、肾后性等病因。
7 病情分级蘑菇中毒患者早期病情的评估关系到患者能否得以正确的处置。尽管现有的临床分型对患者预后判断具有一定的指导意义,但并不适用于蘑菇中毒的早期诊治。本共识在参考国内外文献基础上,结合专家临床经验,总结HOPE6评分和TALK评分对拟诊蘑菇中毒患者进行初步评估和再评估,将蘑菇中毒病情分为致死性和非致死性两类。
7.1 致死性蘑菇中毒存在下列情形,应考虑致死性蘑菇中毒:(1)初次评估HOPE6评分≥2分;(2)初次评估HOPE6评分<2分,而后续再评估TALK评分≥1分;(3)蘑菇样本经实验室鉴定明确为致死性蘑菇种类,或送检样本中检测到鹅膏毒肽等致死性毒素。
7.2 非致死性蘑菇中毒若初次评估HOPE6评分<2分且后续再评估TALK评分持续<1分,考虑非致死性蘑菇中毒。
推荐意见3 推荐对蘑菇中毒患者进行病情分级,可采用HOPE6评分和TALK评分识别致死性蘑菇中毒。
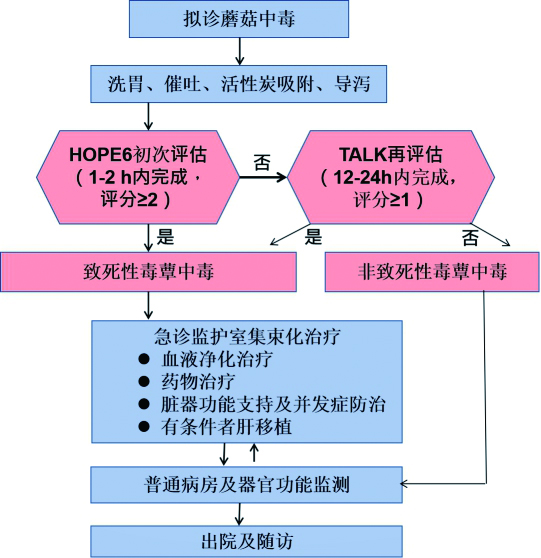
8 诊治流程早期识别致死性蘑菇中毒患者,并及早开展集束化治疗。蘑菇中毒诊治流程如下(图 1)。
|
| 图 1 蘑菇中毒诊治流程 |
|
|
应第一时间对蘑菇中毒患者采取胃肠道净化治疗,阻止毒物吸收。(1)洗胃:尽早、彻底洗胃是减少毒物吸收的关键措施。国外文献报道,中毒暴露后1 h内洗胃最为有效[48-49]。目前没有针对蘑菇中毒洗胃疗效的临床研究。基于我国中毒现状及专家组经验,对于暴露后6 h内的蘑菇中毒患者应常规洗胃,而暴露时间超过6 h可酌情考虑洗胃。(2)活性炭:可吸附胃肠道内鹅膏毒肽。推荐第一个24 h内以20~50 g的活性炭灌胃治疗,可根据病情重复应用[50-52]。(3)导泻:对于腹泻不明显的患者,可以予硫酸镁、甘露醇等药物导泻,促进毒素排出。(4)胆汁引流:基于鹅膏毒肽代谢肠肝循环理论,有学者提出胆汁引流减少鹅膏毒肽的再吸收,包括胆囊穿刺引流、ERCP置管引流、经鼻空肠管引流等,但其临床疗效有待确认。近期动物实验研究发现,口服染毒后鹅膏毒肽经胆汁排泄比例约占20%,胆汁引流可以明显减少肠道鹅膏毒肽的吸收[53]。
推荐意见4 对于时间窗内的蘑菇中毒患者应常规进行彻底洗胃,并给予吸附导泻治疗。
8.2 初次评估蘑菇中毒患者绝大多数以恶心、呕吐、腹痛、腹泻等胃肠道症状起病。轻症中毒仅表现为胃肠道症状,而致死性蘑菇中毒除胃肠道症状外,可逐渐出现多器官功能不全。临床上常因病史采集不全,误诊为急性胃肠炎或其他食物中毒。因此,对拟诊为蘑菇中毒的患者,接诊医师在患者入院后1~2 h内完成HOPE6评分,做好初次评估。
HOPE6评分 内容包含:(1)病史(history,H):明确有蘑菇食用史。接诊医师应快速明确有无食用蘑菇史;共同进食者是否发病;起病症状及进食至发病时间;食用一种还是多种蘑菇;有无留存蘑菇实物或照片;有无饮酒等。(2)器官功能损害(organ damage,O):中毒患者存在呼吸、血压、意识等生命体征不稳定,或出现下列器官功能损害的一种或多种:包括肝、肾、凝血功能[54-55]。(3)识图及形态辨认(picture identification, P):根据图片或实物对比识别鉴定为致死性蘑菇种类。接诊医师应让患者提供采食蘑菇照片或实物,进行初步形态学识别,或者让患者以识图方式辨认食用的蘑菇种类(我国各地区常见毒蘑菇图片见附件1),判断是否为致死性蘑菇中毒。需要注意的是,临床医生往往难以正确识别患者提供的蘑菇实物、图片,常常需要咨询蘑菇分类专家或其他有经验的专家[5, 56-57]。(4)症状出现时间(eruption of symptom>6 h, E6):食用蘑菇后发病潜伏期超过6 h[36, 58]。以上四项内容,每项赋值为1分(见表 2)。
| 项目 | 描述 | 得分 |
| 病史 (history,H) |
明确有蘑菇食用史 | 1 |
| 器官功能损害 (organ damage, O) |
生命体征不稳定或出现肝、肾、凝血等器官功能损害中的一项或多项 | 1 |
| 识图及形态辨别 (picture identification, P) |
实物或图片对比、鉴定为致死性蘑菇种类 | 1 |
| 症状出现时间 (eruption of symptom>6 h, E6) |
进食蘑菇后发病潜伏期超过6 h | 1 |
若HOPE6评分≥2分,则考虑致死性蘑菇中毒,患者需立即转入急诊监护室启动集束化治疗;若HOPE6评分<2分,则需要对患者进行是否为致死性蘑菇中毒的再评估。
8.3 再评估临床上常存在病史不清、无法提供或提供的蘑菇实物或照片难以辨别等情况,因此有相当一部分患者经HOPE6评分初次评估,难以判定是否为致死性蘑菇中毒(HOPE6评分<2分)。对这些患者应在首诊后12~24 h内尽早完成TALK评估,根据评估结果判断是否为致死性蘑菇中毒,一旦判定为致死性蘑菇中毒,也应立即启动集束化救治。
TALK评分 内容包括:(1)毒物检测(toxicant identification, T):留取样本尽早进行毒物检测,识别是否存在致死性蘑菇毒素,例如鹅膏毒肽等[5, 59]。(2)凝血功能障碍(APTT extension,A):表现为PT、TT、APTT延长,PTA下降[38, 60]。(3)肝功能损害(liver dysfunction,L):出现AST、ALT增高,胆红素升高,胆酶分离等表现。(4)肾功能损害(kidney dysfunction,K):血肌酐、血尿素氮升高。再评估过程中,应注意动态观察患者总体病情变化,是否符合致死性蘑菇中毒病情变化特点,即胃肠道症状起病,消化道症状可一过性的缓解,即假愈期,暴露后36~48 h进展为肝肾及其他多个脏器功能损害表现[50, 54, 60-62]。以上四项内容,每项赋值为1分(见表 3)。
| 项目 | 描述 | 得分 |
| 毒物检测 (toxicant identification, T) |
毒物检测明确为致死性毒素类型,如鹅膏毒肽 | 1 |
| 出凝血障碍 (APTT extension, A) |
出凝血障碍,尤其APTT、PT、TT延长 | 1 |
| 肝功能损害 (liver dysfunction, L) |
肝功能损害,AST、ALT升高,PTA下降 | 1 |
| 肾功能损害 (kdiney dysfunction, K) |
血肌酐、尿素氮进行性升高 | 1 |
若患者摄入蘑菇病史明确,且TALK评分≥1分,则考虑致死性蘑菇中毒,应立即转入急诊监护室启动集束化治疗;若TALK评分持续<1分,考虑非致死性蘑菇中毒,可转入留观病区,并动态评估肝、肾功能及凝血变化,持续48~72 h。
推荐意见5 蘑菇中毒患者应常规予以留院治疗,并快速完成HOPE6初次评估和TALK再评估,期间根据需要咨询蘑菇分类专家,尽早识别致死性蘑菇中毒。
8.4 集束化治疗对判定为致死性蘑菇中毒患者,需立即转入EICU,生命监护,集束化治疗。致死性蘑菇中毒无特效解毒剂,95%致死性蘑菇中毒源于鹅膏毒肽。集束化治疗包括:血液净化治疗,药物应用,全身及脏器功能支持治疗,有条件者进行肝脏移植。
8.4.1 血液净化治疗血液净化治疗可以增加毒物清除,同时也起到脏器功能支持的作用,已在蘑菇中毒救治中广泛应用。常用的血液净化治疗技术主要包括传统血液净化技术(血浆置换、血液灌流、血液透析)和人工肝技术(分子吸附循环系统MARS、普罗米修斯人工肝PrometheusTM)[63-64]。尽管目前缺乏血液净化治疗蘑菇中毒的前瞻性随机对照临床研究[64-65],但一些临床观察显示血液净化治疗可提高蘑菇中毒患者生存率[65-68]。刘海光等[69]报道早期血液灌流能减少蘑菇中毒肝炎患者多器官功能障碍的发生,降低病死率。甘卫敏等研究发现中毒后72 h内开展血浆置换能明显改善重度肝损型毒蕈中毒患者总胆红素、凝血酶原时间、INR等指标,提高患者存活率[70]。贾乐文等[71]报道对22例急性毒蕈中毒患者应用血液透析联合血液灌流治疗,改善患者器官功能,降低病死率,疗效优于单一血液净化方式。张聪等[72]应用MARS单独或者联合血浆置换对33例急性重度肝炎型毒蕈中毒患者的救治,显示应用MARS其疗效优于单独血浆置换及常规药物治疗。国外也有一些临床案例报道各种血液净化治疗方式均可改善蘑菇中毒患者预后。由于鹅膏毒肽分子量小,蛋白结合率低,在血浆中的存留时间短,通常在暴露后24~48 h后难以检测到。因此,本专家组认为以清除毒素为目的的血液净化治疗应尽早进行,推荐对致死性蘑菇中毒患者尽早血浆置换或血液灌流治疗,血浆置换应作为首选治疗方式。当患者合并肝肾功能损害或多脏器功能不全,应联合应用血浆置换、血液灌流、血液透析及CRRT等技术,进行毒物及代谢产物清除和器官功能支持,并充分根据患者脏器功能情况实施个体化治疗。分子吸附循环系统MARS及普罗米修斯人工肝技术可有良好效果,但尚需更多研究支持。
推荐意见6 对致死性蘑菇中毒患者应尽早行血液净化治疗,优选血浆置换治疗,不具备条件者可选择血液灌流治疗;对合并存在肝肾功能损害或多器官功能不全患者,建议尽早联合应用多种血液净化方式并实施个体化治疗。
8.4.2 解毒药物应用蘑菇中毒患者,尤其是鹅膏毒肽相关的蘑菇中毒,应尽早选择应用青霉素G、水飞蓟素、N-乙酰半胱氨(NAC)、灵芝煎剂、巯基化合物等解毒药物,见表 4。
| 药物 | 推荐剂量 |
| 青霉素G | 30~100万U/(kg·d),连续应用2~3 d |
| 水飞蓟素 | 20~50 mg/(kg·d),连续应用2~4 d |
| N-乙酰半胱氨酸(NAC) | 静脉制剂:先以150 mg/kg剂量NAC加入5%葡萄糖200ml,静脉滴注大于15 min,随后以50 mg/kg剂量NAC加入5%葡萄糖500 mL,静脉滴注大于4 h,然后以100 mg/kg剂量NAC加入5%葡萄糖1 000 mL,静脉滴注大于16 h 口服制剂:2 g/次,每8 h口服一次,直至症状消失 |
| 灵芝煎剂(GGD) | 200 g灵芝加水煎至600 mL,200 mL/次,3次/d,连续7~14 d |
| 巯基类药物 | 二巯丙磺钠注射液0.125~0.25 g肌内注射,每6 h一次,症状缓解后改为每12 h注射一次,至5~7 d为一疗程 |
| 二巯丁二钠注射液0.125~0.25 g肌内注射,3~4次/d,连续5~7 d |
(1)大剂量青霉素G:青霉素G可通过抑制OATP1B3受体,阻止毒素转运。青霉素G还可与血浆蛋白结合,置换已结合的毒素,加速毒素排出。虽然有文献指出单用青霉素G对鹅膏毒肽类中毒患者没有作用[73],但更多文献报道应用青霉素G对中毒患者有一定益处[74-75]。推荐用法:青霉素G 30~100万U/(kg·d),连续应用2~3 d,应综合病情轻重及个体化,应用过程中密切监测患有无过敏反应、肝肾功能与电解质变化,警惕青霉素脑病的发生。
(2)水飞蓟素:水飞蓟提取物,可与肝细胞运输蛋白结合,阻断毒素经肝细胞再摄取,降低肝肠循环,拮抗鹅膏毒肽对RNA聚合酶Ⅱ的抑制作用,还有抗炎,抗氧化及抗凋亡作用[76]。虽然有研究显示应用水飞蓟素没有明确降低中毒死亡率及肝移植需求率[77-78],但对于出现肝功能损害的蘑菇中毒,特别是鹅膏毒肽相关中毒患者,应用水飞蓟素十分必要[79-80]。推荐用法:水飞蓟素注射液20~50 mg/(kg·d),连续应用2~4 d。水飞蓟素胶囊:35 mg/(kg·d),分3次口服。
(3)N-乙酰半胱氨酸(NAC):能降低α鹅膏毒肽诱导的人肝脏细胞氧化应激和细胞凋亡水平,并能清除活性氧及恢复肝内谷胱甘肽(GSH)活性[73, 81-82]。推荐用法:先以150 mg/kg剂量NAC加入5%葡萄糖200 mL,静脉滴注大于15 min。随后,50 mg/kg剂量NAC加入5%葡萄糖500 mL,静脉滴注大于4 h。然后,100 mg/kg剂量NAC加入5%葡萄糖1 000 mL,静脉滴注大于16 h[83]。亦可应用口服制剂:2 g/次,每8 h口服一次,直至症状消失。注意观察过敏反应及凝血功能异常。
(4)灵芝煎剂(GGD):灵芝中含有三萜类化合物,有护肝、减轻氧化应激及细胞凋亡作用[84]。国内有报道应用灵芝煎剂治疗鹅膏菌中毒取得显著疗效[85]。推荐用法:200 g灵芝加水煎至600 mL,200 mL/次,3次/d,连续7~14 d。
(5)巯基类药物:可与某些毒素结合,降低毒素毒力。推荐:①二巯丙磺钠注射液0.125~0.25 g肌内注射,每6 h一次,症状缓解后改为每12 h注射一次,5~7 d为一疗程。②二巯丁二钠注射液0.125~0.25 g肌内注射,3~4次/d,连续5~7 d。
推荐意见7 急性鹅膏毒肽相关中毒患者可尽早选用青霉素G、水飞蓟素、N-乙酰半胱氨酸、灵芝煎剂及二巯基类等药物治疗,根据病情需要合理联合应用。
8.4.3 脏器功能支持治疗积极补液,维持循环稳定,呼吸支持、护胃、保肝、护肾,防治脑水肿及DIC,预防感染,营养支持,维持水电解质和酸解平衡,其他对症支持治疗。避免肝肾毒性药物的使用。
8.4.4 肝移植肝移植是蘑菇中毒致肝功能衰竭的最后治疗手段,但目前尚无统一标准。国内有关报道很少,国外文献报道肝移植标准主要有Ganzert标准、Clichy标准、Escudie标准及国王学院标准[86-89]。其中,国王学院标准应用最为广泛,主要包括以下5项中的3项:凝血酶原时间>100 s,年龄<11岁或>40岁,血肌酐>300 μmol/L,黄疸开始至出现昏迷时间>7 d,INR>3.5。
推荐意见8 蘑菇中毒患者并发严重肝功能衰竭,在条件允许的情况下可进行肝移植治疗。
8.5 非致死性蘑菇中毒治疗非致死性蘑菇中毒患者主要以支持对症治疗为主,动态监测器官功能。胃肠炎症状者予补液对症,维持内环境等治疗;胆碱能亢进表现中毒者应用阿托品,神经精神症状可应用东莨菪碱,适当镇静对症处理等。
推荐意见9 非致死性蘑菇中毒予支持对症治疗为主,并注意监测病情变化。
9 预后明确种类为致死性蘑菇中毒(见表 5)或毒素检测为致死性毒素,胃肠道症状出现潜伏期长(>6 h),早期表现为肝肾功能不全,如转氨酶升高,胆红素,凝血功能异常增高,合并多个脏器功能不全往往提示患者预后差[50, 60-62]。
| 种类 | 中文名称 | 拉丁名 |
| 鹅膏菌 | 致命鹅膏 | Amanita exitialis |
| 灰花纹鹅膏 | Amanita fuliginea | |
| 拟灰花纹鹅膏 | Amanita fuligineoides | |
| 灰盖粉褶鹅膏 | Amanita griseorosea | |
| 淡红鹅膏 | Amanita pallidorosea | |
| 裂皮鹅膏 | Amanita rimosa | |
| 黄盖鹅膏原变种 | Amanita subjunquillea | |
| 黄盖鹅膏白色变种 | Amanita subjunquillea var | |
| 假淡红鹅膏 | Amanita subpallidorosea | |
| 鳞柄白鹅膏 | Amanita virosa | |
| 软托鹅膏 | Amanita molliuscula | |
| 小致命鹅膏 | Amanita parviexitialis | |
| 盔孢菌 | 沟条盔孢菌 | Galerina vittiformis |
| 丛生盔孢菌 | Galerina fasciculata | |
| 细条盔孢菌 | Galerina filiformis | |
| 黄盖盔孢菌 | Galerina helvoliceps | |
| 异囊盔孢菌 | Galerina heterocystis | |
| 苔藓盔孢菌 | Galerina hypnorum | |
| 纹缘盔孢菌 | Galerina marginata | |
| 俄勒冈盔孢菌 | Galerina oregonensis | |
| 条盖盔孢菌 | Galerina sulciceps | |
| 环柄菇 | 褐鳞环柄菇 | Lepiota helveola |
| 肉褐鳞环柄菇 | Lepiota brunneo-incarnata | |
| 毒环柄菇 | Lepiota venenata | |
| 亚毒环柄菇 | Lepiota subvenenata | |
| 红菇属 | 亚稀褶红菇 | Russula subnigricans |
| 丝膜菌 | 毒丝膜菌 | Cortinarius orellanus |
| 尖顶丝膜菌 | Cortinarius gentilis | |
| 其他 | 毒沟褶菌 | Trogia venenata |
由于毒蘑菇外貌难以与食用菌鉴别,加强宣传教育对预防蘑菇中毒尤为重要。普及毒蘑菇典型图谱(见附件1),让民众识别有毒野生蘑菇常有特点:菌盖呈扁半球形到扁平,菌柄近端附白色菌环,根部有球形菌托,通俗判别为头上戴帽,腰间系裙,脚上穿鞋。避免蘑菇中毒的最有效方法是不采摘食用野生蘑菇[90]。
本共识主要基于大量文献复习及各专家临床实践经验,并经过反复讨论与修改后制定,旨在为我国蘑菇中毒的诊治提供一个可遵循的初步规范。由于蘑菇种类繁多,对蘑菇毒素及毒理机制认识尚不够深入,有关蘑菇中毒诊治研究的临床证据也明显不足,因此,本共识难免存在不足,有待后续更新与完善。





执笔人:卢中秋、洪广亮、孙承业、陈潇荣、李海蛟
专家组(按姓氏拼音排序):
陈凤英(内蒙古医科大学附属医院)、蔡卫东(山东省千佛山医院)、陈晓辉(广州医科大学附属第二医院)、曹小平(川北医学院附属医院)、曹钰(四川大学华西医院)、柴艳芬(天津医科大学总医院)、董士民(河北医科大学第三医院)、邓颖(哈尔滨医科大学附属第二医院)、邓扬(吉林省人民医院)、方邦江(上海中医药大学附属龙华医院)、樊毫军(天津大学灾难医学研究院)、黄亮(南昌大学第一附属医院)、黄子通(中山大学孙逸仙纪念医院)、康健(大连医科大学附属第一医院)、兰超(郑州大学第一附属医院)、李超乾(广西医科大学附属第一医院)、李彩霞(山西省人民医院)、刘净(大庆油田总医院)、李培武(兰州大学第二医院)、李小刚(中南大学湘雅医院)、李毅(北京协和医院)、李湘民(中南大学湘雅医院)、刘志(中国医科大学附属第一医院)、卢中秋(温州医科大学附属第一医院)、孟新科(深圳市第二人民医院)、聂时南(中国人民解放军东部战区总医院)、欧阳军(石河子大学医学院第一附属医院)、裴红红(西安交通大学第二附属医院)、曲爱君(聊城市人民医院)、钱传云(昆明医科大学第一附属医院)、孙承业(中国疾病预防控制中心)、宋德彪(吉林大学第二医院)、沈开金(新疆军区总医院)、孙明伟(四川省人民医院)、宋维(海南省人民医院)、田英平(河北医科大学第二医院)、王伯良(空军军医大学第二附属医院)、吴彩军(北京中医药大学东直门医院)、魏捷(武汉大学人民医院)、吴利东(南昌大学第二附属医院)、王瑞兰(上海市第一人民医院)、王维展(河北医科大学哈励逊国际和平医院)、王旭东(航天中心医院)、邢吉红(吉林大学第一医院)、许硕贵(上海长海医院)、余成敏(云南省楚雄彝族自治州人民医院)、杨立山(宁夏医科大学总医院)、杨蓉佳(甘肃省人民医院)、尹文(空军军医大学第一附属医院)、于学忠(北京协和医院)、赵斌(北京积水潭医院)、张斌(青海省人民医院)、朱长举(郑州大学第一附属医院)、周发春(重庆医科大学附属第一医院)、张国秀(河南科技大学一附院急诊科)、张泓(安徽医科大学第一附属医院)、张慧(天津市儿童医院)、朱华栋(北京协和医院)、曾红科(广东省人民医院)、张剑锋(广西医科大学第二附属医院)、张劲松(南京医科大学第一附属医院)、赵敏(中国医科大学附属盛京医院)、褚沛(兰州大学第一医院)、周荣斌(中国人民解放军总医院第七医学中心)、周人杰(陆军军医大学新桥医院急诊部)、钟武(西南医科大学附属医院)、张文武(深圳市宝安区人民医院)、张新超(北京医院)、赵晓东(中国人民解放军总医院第四医学中心)、张锡刚(中国人民解放军总医院第四医学中心)
| [1] | 周静, 袁媛, 郎楠, 等. 中国大陆地区蘑菇中毒事件及危害分析[J]. 中华急诊医学杂志, 2016, 25(6): 724-728. DOI:10.3760/cma.j.issn.1671-0282.2016.06.008 |
| [2] | 孙承业. 蘑菇中毒防治工作亟需加强[J]. 中华急诊医学杂志, 2016, 25(8): 981-984. DOI:10.3760/cma.j.issn.1671-0282.2016.08.001 |
| [3] | Diaz JH. Evolving global epidemiology, syndromic classification, general management, and prevention of unknown mushroom poisonings[J]. Crit Care Med, 2005, 33(2): 419-426. DOI:10.1097/01.ccm.0000153530.32162.b7 |
| [4] | Chen ZH, Zhang P, Zhang ZG. Investigation and analysis of 102 mushroom poisoning cases in Southern China from 1994 to 2012[J]. Fungal Divers, 2014, 64(1): 123-131. DOI:10.1007/s13225-013-0260-7 |
| [5] | Schenk-Jaeger KM, Rauber-Lüthy C, Bodmer M, et al. Mushroom poisoning: A study on circumstances of exposure and patterns of toxicity[J]. Eur J Intern Med, 2012, 23(4): e85-e91. DOI:10.1016/j.ejim.2012.03.014 |
| [6] | Brandenburg WE, Ward KJ. Mushroom poisoning epidemiology in the United States[J]. Mycologia, 2018, 110(4): 637-641. DOI:10.1080/00275514.2018.1479561 |
| [7] | 陈作红, 杨祝良, 图力古尔. 毒蘑菇识别与中毒防治[M]. 北京: 科学出版社, 2016. |
| [8] | Yamaura Y. Recent trends of mushroom poisoning in Japan[M]. Chudoku Kenkyu, 2013. |
| [9] | 图力古尔, 包海鹰, 李玉. 中国毒蘑菇名录[J]. 菌物学报, 2014, 33(3): 517-548. DOI:10.13346/j.mycosystema.130256 |
| [10] | Litten W. The most poisonous mushrooms[J]. Sci Am, 1975, 232(3): 90-101. DOI:10.1038/scientificamerican0375-90 |
| [11] | Graeme KA. Mycetism: A review of the recent literature[J]. J Med Toxicol, 2014, 10(2): 173-189. DOI:10.1007/s13181-013-0355-2 |
| [12] | Frimmer M. What we have learned from phalloidin[J]. Toxicol Lett, 1987, 35(2/3): 169-182. DOI:10.1016/0378-4274(87)90204-9 |
| [13] | Deshpande S. Handbook of food toxicology[M]. CRC Press, 2002. |
| [14] | Letschert K, Faulstich H, Keller D, et al. Molecular characterization and inhibition of amanitin uptake into human hepatocytes[J]. Toxicol Sci, 2006, 91(1): 140-149. DOI:10.1093/toxsci/kfj141 |
| [15] | Gundala S, Wells LD, Milliano MT, et al. The hepatocellular bile acid transporter Ntcp facilitates uptake of the lethal mushroom toxin?-amanitin[J]. Archives Toxicology, 2004, 78(2): 68-73. DOI:10.1007/s00204-003-0527-y |
| [16] | Belliardo F, Massano G. Determination of α-amanitin in serum by HPLC[J]. J Liq Chromatogr, 1983, 6(3): 551-558. DOI:10.1080/01483918308076067 |
| [17] | Vaisius AC, Wieland T. Formation of a single phosphodiester bond by RNA polymerase B from calf Thymus is not inhibited by.alpha.-amanitin[J]. Biochemistry, 1982, 21(13): 3097-3101. DOI:10.1021/bi00256a010 |
| [18] | Ergin M, Dundar ZD, Kilinc I, et al. Alpha-amanitin poisoning, nephrotoxicity and oxidative stress: an experimental mouse model[J]. Iran Red Crescent Med J, 2015, 17(8): e28068. DOI:10.5812/ircmj.28068 |
| [19] | Santi LC, Maggioli C, Mastroroberto M, et al. Acute liver failure caused byamanita phalloidespoisoning[J]. Int J Hepatol, 2012, 2012: 1-6. DOI:10.1155/2012/487480 |
| [20] | Wieland T. The toxic peptides from Amanita mushrooms[J]. Int J Pept Protein Res, 2009, 22(3): 257-276. DOI:10.1111/j.1399-3011.1983.tb02093.x |
| [21] | Wieland T. Interaction of phallotoxins with actin[J]. Adv Enzym Regul, 1977, 15: 285-299. DOI:10.1016/0065-2571(77)90021-8 |
| [22] | Nilsson UA, Nyström J, Buvall L, et al. The fungal nephrotoxin orellanine simultaneously increases oxidative stress and down-regulates cellular defenses[J]. Free Radic Biol Med, 2008, 44(8): 1562-1569. DOI:10.1016/j.freeradbiomed.2008.01.017 |
| [23] | Anantharam P, Shao DH, Imerman P, et al. Improved tissue-based analytical test methods for orellanine, a biomarker of cortinarius mushroom intoxication[J]. Toxins, 2016, 8(5): 158. DOI:10.3390/toxins8050158 |
| [24] | Dinis-Oliveira RJ, Soares M, Rocha-Pereira C, et al. Human and experimental toxicology of orellanine[J]. Hum Exp Toxicol, 2016, 35(9): 1016-1029. DOI:10.1177/0960327115613845 |
| [25] | Grzymala S. Clinical picture of poisoning with Cortinarius orellanus Fr[J]. Prz. Epidemiol, 1965, 19(2): 269-271. |
| [26] | Michelot D, Toth B. Poisoning by Gyromitra esculenta-a review[J]. J Appl Toxicol, 1991, 11(4): 235-243. DOI:10.1002/jat.2550110403 |
| [27] | Berger KJ, Guss DA. Mycotoxins revisited: part Ⅰ[J]. J Emerg Med, 2005, 28(1): 53-62. DOI:10.1016/j.jemermed.2004.08.013 |
| [28] | Karlson-Stiber C, Persson H. Cytotoxic fungi: an overview[J]. Toxicon, 2003, 42(4): 339-349. DOI:10.1016/s0041-0101(03)00238-1 |
| [29] | De Haro L, Prost N, David JM, et al. Muscarine syndrome. Experience at the Marseille Antipoison Center[J]. Presse Med, 1999, 28(20): 1069-1070. |
| [30] | Hatfield GM, Schaumberg JP. Isolation and structural studies of coprine, the disulfiram-like constituent of Coprinus atramentarius[J]. LIoydia, 1975, 38(6): 489. |
| [31] | Anthony S. Encyclopedia of toxicology[M]. Oxford Toxicology and Pharmaceutial Science, 2005: 167-168. |
| [32] | Cho JT, Han JH. A case of mushroom poisoning with russula subnigricans: development of rhabdomyolysis, acute kidney injury, cardiogenic shock, and death[J]. J Korean Med Sci, 2016, 31(7): 1164. DOI:10.3346/jkms.2016.31.7.1164 |
| [33] | Bedry R, Baudrimont I, Deffieux G, et al. Wild-mushroom intoxication as a cause of rhabdomyolysis[J]. N Engl J Med, 2001, 345(11): 798-802. DOI:10.1056/nejmoa010581 |
| [34] | Tepetam FM, Dağdevİren B, Bulut İ, et al. A patient with mushroom allergy; a new etiological agent of Kounis syndrome[J]. Tuberk Toraks, 2016, 64(2): 171-174. DOI:10.5578/tt.9411 |
| [35] | 赵溯, 杨林, 王跃兵, 等. 两起可能与采食毒沟褶菌相关的云南不明原因猝死事件报道[J]. 中华急诊医学杂志, 2017, 26(11): 1256-1259. DOI:10.3760/cma.j.issn.1671-0282.2017.11.007 |
| [36] | Alenghat T, Pillitteri CA, Bemis DA, et al. Lycoperdonosis in two dogs[J]. J VET Diagn Invest, 2010, 22(6): 1002-1005. DOI:10.1177/104063871002200629 |
| [37] | Nakajima N, Ueda M, Higashi N, et al. Erythromelalgia associated withClitocybe acromelalgaintoxication[J]. Clin Toxicol, 2013, 51(5): 451-454. DOI:10.3109/15563650.2013.792933 |
| [38] | 陈潇荣, 赵光举, 洪广亮, 等. 急性毒蕈中毒八例报告[J]. 中华劳动卫生职业病杂志, 2016, 11(34): 859-860. DOI:10.3760/cma.j.issn.1001-9391.2016.11.022 |
| [39] | 刁东英, 刘薇薇. 急性毒蕈中毒的超声显像特征和临床观察[J]. 中华劳动卫生职业病杂志, 2005, 23(6): 459-460. DOI:10.3760/cma.j.issn.1001-9391.2005.06.020 |
| [40] | 黄亮, 雷兆文. 以恶性心律失常为主要表现的毒蕈中毒[J]. 中华急诊医学杂志, 2002, 11(4): 274-280. DOI:10.3760/j.issn:1671-0282.2002.04.026 |
| [41] | Altintepe L, Yazici R, Yazici M, et al. Temporary left ventricular dysfunction in mushroom poisoning: report of three cases[J]. Ren Fail, 2014, 36(8): 1337-1339. DOI:10.3109/0886022x.2014.930649 |
| [42] | Schmutz M, Carron PN, Yersin B, et al. Mushroom poisoning: a retrospective study concerning 11-years of admissions in a Swiss Emergency Department[J]. Intern Emerg Med, 2018, 13(1): 59-67. DOI:10.1007/s11739-016-1585-5 |
| [43] | Tomková J, Ondra P, Válka I. Simultaneous determination of mushroom toxins α-amanitin, β-amanitin and muscarine in human urine by solid-phase extraction and ultra-high-performance liquid chromatography coupled with ultra-high-resolution TOF mass spectrometry[J]. Forensic Sci Int, 2015, 251: 209-213. DOI:10.1016/j.forsciint.2015.04.007 |
| [44] | Kirchmair M, Pöder R. Fatal renal failure caused by Cortinarius mushrooms[J]. Pediatr Nephrol, 2011, 26(3): 487-488. DOI:10.1007/s00467-010-1664-1 |
| [45] | Jaeger A, Jehl F, Flesch F, et al. Kinetics of amatoxins in human poisoning: therapeutic implications[J]. J Toxicol Clin Toxicol, 1993, 31(1): 63-80. DOI:10.3109/15563659309000374 |
| [46] | Cai Q, Cui YY, Yang ZL. Lethal amanita species in China[J]. Mycologia, 2016, 108(5): 993-1009. DOI:10.3852/16-008 |
| [47] | Parnmen S, Sikaphan S, Leudang S, et al. Molecular identification of poisonous mushrooms using nuclear ITS region and peptide toxins: a retrospective study on fatal cases in Thailand[J]. J Toxicol Sci, 2016, 41(1): 65-76. DOI:10.2131/jts.41.65 |
| [48] | Vale JA. Position statement: gastric lavage. American Academy of Clinical oxicology; European Association of Poisons Centres and Clinical Toxicologists[J]. J Toxicol Clin Toxicol, 1997, 35(7): 711-719. DOI:10.3109/15563659709162569 |
| [49] | Benson BE, Hoppu K, Troutman WG, et al. Position paper update: gastric lavage for gastrointestinal decontamination[J]. Clin Toxicol, 2013, 51(3): 140-146. DOI:10.3109/15563650.2013.770154 |
| [50] | Trabulus S, Altiparmak MR. Clinical features and outcome of patients with amatoxin-containing mushroom poisoning[J]. Clin Toxicol, 2011, 49(4): 303-310. DOI:10.3109/15563650.2011.565772 |
| [51] | TOXBASE. Clinical toxicology database of the United Kingdom national poisons information service: Amanita phalloides-features and management[J]. TOXBASE, 2008, www.toxibase.org. |
| [52] | CIAV. Centro de informação antivenenos: Protocolo terapêutico preconizado pelo CIAV nos casos de intoxicação por Amanita Phalloides[C]. CIAV, 2014. |
| [53] | Sun J, Zhang YT, Niu YM, et al. Effect of biliary drainage on the toxicity and toxicokinetics of amanita exitialis in beagles[J]. Toxins, 2018, 10(6): 215. DOI:10.3390/toxins10060215 |
| [54] | Trakulsrichai S, Sriapha C, Tongpoo A, et al. Clinical characteristics and outcome of toxicity from Amanita mushroom poisoning[J]. IJGM, 2017, Volume 10: 395-400. DOI:10.2147/ijgm.s141111 |
| [55] | Erguven M, Yilmaz O, Deveci M, et al. Mushroom poisoning[J]. Indian J Pediatr, 2007, 74(9): 847-852. DOI:10.1007/s12098-007-0151-6 |
| [56] | Cassidy N, Duggan E, Tracey JA. Mushroom poisoning in Ireland: the collaboration between the national poisons information centre and expert mycologists[J]. Clin Toxicol, 2011, 49(3): 171-176. DOI:10.3109/15563650.2011.560854 |
| [57] | Cervellin G, Comelli I, Rastelli G, et al. Epidemiology and clinics of mushroom poisoning in Northern Italy: A 21-year retrospective analysis[J]. Hum Exp Toxicol, 2018, 37(7): 697-703. DOI:10.1177/0960327117730882 |
| [58] | Diaz JH. Syndromic diagnosis and management of confirmed mushroom poisonings[J]. Crit Care Med, 2005, 33(2): 427-436. DOI:10.1097/01.ccm.0000153531.69448.49 |
| [59] | Escoda O, Reverter E, To-Figueras J, et al. Potential value of urinary amatoxin quantification in patients with hepatotoxic mushroom poisoning[J]. Liver Int, 2019, 39(6): 1128-1135. DOI:10.1111/liv.14028 |
| [60] | Bonacini M, Shetler K, Yu I, et al. Features of patients with severe hepatitis due to mushroom poisoning and factors associated with outcome[J]. Clin Gastroenterol Hepatol, 2017, 15(5): 776-779. DOI:10.1016/j.cgh.2016.11.039 |
| [61] | 文莉, 吴蔚桦, 李丽, 等. 210例急性毒蕈中毒患者的临床特征及死亡危险因素分析[J]. 中华危重病急救医学, 2018, 30(1): 72-77. DOI:10.3760/cma.j.issn.2095-4352.2018.01.014 |
| [62] | Brandão JL, Pinheiro J, Pinho D, et al. Mushroom poisoning in Portugal[J]. Acta Med Port, 2011, 24(S2): 269-278. |
| [63] | Pillukat MH, Schomacher T, Baier P, et al. Early initiation of MARS® dialysis in Amanita phalloides-induced acute liver injury prevents liver transplantation[J]. Ann Hepatol, 2016, 15(5): 775-787. |
| [64] | Bergis P, Betz C, Bojunga J, et al. 911 effective treatment of amanita phalloides intoxication by fractioned plasma separation and adsorption (prometheus)[J]. Journal Hepatology, 2011, 54: S364. DOI:10.1016/s0168-8278(11)60913-6 |
| [65] | Ibáñez-Samaniego L, Bañares R. Acute liver failure caused by mushroom poisoning: still a fork in the road[J]. Liver Int, 2016, 36(7): 952-953. DOI:10.1111/liv.13127 |
| [66] | 卢中秋, 洪广亮. 高度重视, 提高毒蕈中毒的临床救治水平[J]. 中华急诊医学杂志, 2018, 27(3): 245-247. DOI:10.3760/cma.j.issn.1671-0282.2018.03.004 |
| [67] | Schutt RC, Ronco C, Rosner MH. The role of therapeutic plasma exchange in poisonings and intoxications[J]. Semin Dial, 2012, 25(2): 201-206. DOI:10.1111/j.1525-139x.2011.01033.x |
| [68] | Zhang JC, Zhang Y, Peng ZY, et al. Experience of treatments of amanita phalloides-induced fulminant liver failure with molecular adsorbent recirculating system and therapeutic plasma exchange[J]. Asaio J, 2014, 60(4): 407-412. DOI:10.1097/mat.0000000000000083 |
| [69] | 刘海光, 菅向东, 徐勤亮, 等. 血液灌流治疗毒蕈致中毒性肝炎三例[J]. 中华劳动卫生职业病杂志, 2016, 34(9): 696-697. DOI:10.3760/cma.j.issn.1001-9391.2016.09.018 |
| [70] | 甘卫敏, 张锡刚. 血浆置换治疗重度肝损型毒蕈中毒的疗效与时机[J]. 中国急救复苏与灾害医学杂志, 2012, 7(5): 453-455. DOI:10.3969/j.issn.1673-6966.2012.05.019 |
| [71] | 贾乐文, 杭宏东, 秦风琦, 等. 血液透析、血液灌流治疗急性毒蕈中毒并发多脏器衰竭疗效分析[J]. 中国血液净化, 2005, 4(2): 104-105. DOI:10.3969/j.issn.1671-4091.2005.02.017 |
| [72] | 张聪, 黄昌保, 白丽娜, 等. 分子吸附再循环系统(MARS)对急性重度肝炎型毒蕈中毒的疗效评价[J]. 中国急救复苏与灾害医学杂志, 2017, 12(5): 430-433. DOI:10.3969/j.issn.1673-6966.2017.05.009 |
| [73] | Poucheret P, Fons F, Doré JC, et al. Amatoxin poisoning treatment decision-making: Pharmaco-therapeutic clinical strategy assessment using multidimensional multivariate statistic analysis[J]. Toxicon, 2010, 55(7): 1338-1345. DOI:10.1016/j.toxicon.2010.02.005 |
| [74] | Floersheim GL, Schneeberger J, Bucher K. Curative potencies of penicillin in experimental amanita phalloides poisoning[J]. Agents Actions, 1971, 2(3): 138-141. DOI:10.1007/bf01966752 |
| [75] | Giannini L, Vannacci A, Missanelli A, et al. Amatoxin poisoning: A 15-year retrospective analysis and follow-up evaluation of 105 patients[J]. Clin Toxicol, 2007, 45(5): 539-542. DOI:10.1080/15563650701365834 |
| [76] | Vogel G, Tuchweber B, Trost W, et al. Protection by silibinin against Amanita phalloides intoxication in beagles[J]. Toxicol Appl Pharmacol, 1984, 73(3): 355-362. DOI:10.1016/0041-008x(84)90087-5 |
| [77] | Carley SD. Towards evidence based emergency medicine: best BETs from the manchester royal infirmary:[J]. Emerg Med J, 2016, 33(2): 159.1-159. DOI:10.1136/emermed-2016-205681 |
| [78] | Ganzert M, Felgenhauer N, Schuster T, et al. Amanita poisoning——comparison of silibinin with a combination of silibinin and penicillin[J]. Dtsch Med Wochenschr, 2008, 133(44): 2261-2267. DOI:10.1055/s-0028-1091268 |
| [79] | Saller R, Brignoli R, Melzer J, et al. An updated systematic review with meta-analysis for the clinical evidence of silymarin[J]. Forsch Komplementärmed, 2008, 15(1): 9-20. DOI:10.1159/000113648 |
| [80] | Pengilley AJ, Kelly PM. Amanita phalloides poisoning and treatment with silibinin in the Australian capital territory and new south wales[J]. Med J Aust, 2013, 199(10): 659-660. DOI:10.5694/mja13.10418 |
| [81] | Magdalan J, Piotrowska A, Gomukiewicz A, et al. Influence of commonly used clinical antidotes on antioxidant systems in human hepatocyte culture intoxicated with α-amanitin[J]. Hum Exp Toxicol, 2011, 30(1): 38-43. DOI:10.1177/0960327110368418 |
| [82] | Magdalan J, Piotrowska A, Gomukiewicz A, et al. Benzylpenicyllin and acetylcysteine protection from α-amanitin-induced apoptosis in human hepatocyte cultures[J]. Exp Toxicol Pathol, 2011, 63(4): 311-315. DOI:10.1016/j.etp.2010.02.004 |
| [83] | Toxinz, National Poisons Centre, New Zealand: Amanita phalloides. 2013, www. Toxinz. com.d treatment with silibinin in the Australian capital territory and new south wales[J]. Med J Aust, 2013, 199(10): 659-660. DOI:10.5694/mja13.10418 |
| [84] | Magdalan J, Piotrowska A, Gomu kiewicz A, et al. Influence of commonly used clinical antidotes on antioxidant systems in human hepatocyte culture intoxicated with α-amanitin[J]. Hum Exp Toxicol, 2011, 30(1): 38-43. DOI:10.1177/0960327110368418 |
| [85] | Magdalan J, Piotrowska A, Gomukiewicz A, et al. Benzylpenicyllin and acetylcysteine protection from α-amanitin-induced apoptosis in human hepatocyte cultures[J]. Exp Toxicol Pathol, 2011, 63(4): 311-315. DOI:10.1016/j.etp.2010.02.004 |
| [86] | Toxinz, National Poisons Centre, New Zealand: Amanita phalloides.2013, www.Toxinz.com. |
| [87] | Wu HH, Tang SS, Huang ZQ, et al. Hepatoprotective effects and mechanisms of action of triterpenoids from lingzhi or reishi medicinal mushroom ganoderma lucidum (agaricomycetes) on α-amanitin-induced liver injury in mice[J]. Int J Med Mushrooms, 2016, 18(9): 841-850. DOI:10.1615/intjmedmushrooms.v18.i9.80 |
| [88] | Xiao GL, Zhang CH, Liu FY, et al. Clinical experience in treatment of Amanita mushroom poisoning with Glossy Ganoderma Decoction and routine Western medicines[J]. Chin J Integ Med, 2007, 13(2): 145-147. DOI:10.1007/s11655-007-0145-2 |
| [89] | Ganzert M, Felgenhauer N, Zilker T. Indication of liver transplantation following amatoxin intoxication[J]. J Hepatol, 2005, 42(2): 202-209. DOI:10.1016/j.jhep.2004.10.023 |
| [90] | Bernuau J. Selection for emergency liver transplantation[J]. J Hepatol, 1993, 19(3): 486-487. DOI:10.1016/s0168-8278(05)80563-x |
| [91] | Escudié L, Francoz C, Vinel JP, et al. Amanita phalloides poisoning: Reassessment of prognostic factors and indications for emergency liver transplantation[J]. J Hepatol, 2007, 46(3): 466-473. DOI:10.1016/j.jhep.2006.10.013 |
| [92] | O'Grady JG, Alexander GJM, Hayllar KM, et al. Early indicators of prognosis in fulminant hepatic failure[J]. Gastroenterology, 1989, 97(2): 439-445. DOI:10.1016/0016-5085(89)90081-4 |
| [93] | Vo KT, Montgomery ME, Mitchell ST, et al. Amanita phalloides mushroom poisonings: northern California, December 2016[J]. MMWR Morb Mortal Wkly Rep, 2017, 66(21): 549-553. DOI:10.15585/mmwr.mm6621a1 |
 2019, Vol. 28
2019, Vol. 28




