感染性休克又称脓毒性休克,关键发病机制是微循环功能障碍,主要表现为促炎/抗炎反应失衡[1-2]、血流分布异常、微循环障碍、毛细血管通透性增加和低白蛋白血症等[3-4]。作为临床重症加强护理病房(intensive care unit, ICU)患者的常见疾病,其病死率高达40%~50%;如不及时救治,病情可急剧恶化,引发急性肺损伤、心功能障碍、肝功能障碍、肾功能衰竭和胃肠道功能紊乱等并发症[5]。本研究在前期探索阿片肽——U50488H对感染性休克大鼠血流动力学和细胞因子影响的基础上,继续深入观察其对感染性休克心、肺、肝和肾等脏器的保护作用,以探讨U50488H对感染性休克脏器保护的关键途径与分子机制。
1 材料与方法 1.1 材料 1.1.1 实验动物健康雄性清洁级SD大鼠40只,体质量220~280 g,由空军军医大学动物实验中心提供,动物批号:SCXK(陕)2014-002。实验前适应性饲养1周,室温(24±1)℃,相对湿度40%~80%,光照模拟12 h昼夜循环,喂食标准饲料,自由摄食水。
1.1.2 试剂仪器水合氯醛、肝素购于Biosiune Life Sciences公司(美国),U50488H、Nor-BNI购于Tocrics公司(美国),白蛋白测定试剂盒、心肌肌钙蛋白I(cardiac troponin I, cTnI)检测试剂盒和氨基末端脑钠肽前体(N terminal pro B type natriuretic peptide, NT-proBNP)ELISA测试盒购于Sigma-Aldrich公司(美国)。透射电子显微镜(JEM-1230)购于日本电子(日本),扫描电子显微镜(S4800)购于日立公司(日本)。
1.2 模型制备与动物分组 1.2.1 感染性休克模型制备采用Chaudry等[6]提出的盲肠结扎穿孔术(cecal ligation puncture, CLP)制备严重腹腔感染致感染性休克模型。实验大鼠腹腔注射10%水合氯醛(35 mg/kg)麻醉,行右侧颈动脉置管接压力传感器监测血压,右侧股静脉置管持续输液。在大鼠腹壁做一正中切口,轻轻拉出盲肠,避免碰伤肠系膜血管,并轻轻地挤压盲肠上端粪便,使盲肠末梢充盈,分离肠系膜表面血管;用无菌4号丝线在盲瓣与盲肠中点进行结扎,并用21 G无菌针头在结扎部位与盲肠顶端的中点处贯通穿刺盲肠壁,造成穿孔;轻轻挤压盲肠,挤出少许内容物以确保穿孔通畅,将挤出的内容物擦净,然后把盲肠推回腹腔,关闭腹腔,逐层缝合。当MAP降至基础水平的50%以下,认定为感染性休克制备成功(根据前期预实验结果,此过程约需4 h)。术后经股静脉插管持续输注生理盐水[(37℃,4 mL/(kg·h)]维持循环,术后1 h起用微量泵管向腹腔持续泵入10%水合氯醛[(1.5 mL/(kg·h)]维持镇静状态。当MAP降至基础水平的50%以下,认定为感染性休克制备成功。
1.2.2 动物分组假手术组仅行腹腔正中切开、腹腔探查、翻动盲肠后关腹。感染性休克组采用盲肠结扎穿孔术(CLP)建立大鼠感染性休克模型(具体制备方法见1.2.1)。U50488H+感染性休克组大鼠在休克即刻静脉注射U50488H 1.5 mg/kg;nor-BNI+U50488H+感染性休克组在关闭腹腔后3.5 h静脉注射κ-阿片受体特异性拮抗剂nor-BNI 2 mg/kg,余同U50488H+感染性休克组;nor-BNI+感染性休克组除了不静脉注射U50488H,余同nor-BNI+U50488H+感染性休克组。
1.2.3 检测指标各组动物分别于关闭腹腔时、术后3 h、6 h、12 h留取血样1.5 mL,加入肝素预处理过的抗凝管,4 ℃、3000 r/min离心15 min后,取上清液-80 ℃保存。ELISA试剂盒分别检测血清中白蛋白、cTnI和NT-proBNP的水平。术后12 h时留取大鼠肺、心、肝和肾组织,冻存备用。
1.2.4 组织病理学观察①将组织置于4%多聚甲醛中固定24 h;②应用不同浓度乙醇(80%、90%、95%、100%)溶液对组织做脱水处理,各1次,每次10 min;③将组织浸入石蜡,凝固成块后切成3 μm薄片,烘干备用;④脱蜡,应用苏木精室温染色,15 min后水洗;⑤盐酸酒精浸泡3 s,返蓝染色30 min,反复洗涤;⑥伊红染色5 min,水洗;⑦脱水并封片,显微镜下观察并拍照。
1.2.5 透射电镜观察①将组织切成1 mm3的小块,置于2%戊二醛固定24 h;②0.1 mol/L的磷酸盐缓冲液(PBS,pH 7.2)洗涤;③1%四氧化饿液固定1 h;④1%醋酸双氧铀和50%乙醇染色30 min;⑤应用不同浓度丙酮(50%×1、70%×1、90%×1、100%×2)溶液对组织做脱水处理,每次10 min;⑥环氧树脂包埋;⑦超薄切片机将组织切成80 nm厚度,切片以醋酸双氧铀和柠檬酸铅染色;⑧由透射电镜观察制备的铜网,加压为80 kV,拍照。
1.2.6 扫描电镜观察①取材:将组织切成5 mm×5 mm×3 mm的小块,置于4%戊二醛固定大于4 h;②固定:1%四氧化饿液固定1 h;③漂洗:0.1 mol/L的磷酸盐缓冲液(PBS)冲洗4次,每次20 min;④漂洗:应用梯度酒精水(30%×2、50%×2、70%×1、90%×1、100%×2)溶液进行脱水处理,每次10 min;⑤置换:浸泡于100%醋酸异戊酯15 min;⑥干燥:二氧化碳临界干燥仪;⑦喷镀金属:离子溅射仪进行溅射镀膜,装台拍照。
1.3 统计学方法计量资料以均数±标准差(Mean±SD)表示,应用SPSS 19.0统计学软件对数据进行分析,多组间数据比较用ANOVA方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果 2.1 U50488H对大鼠血清白蛋白的影响与假手术组相比,感染性休克组大鼠血清白蛋白含量在术后6 h和12 h均显著下降(P<0.01)。与感染性休克组相比,U50488H+感染性休克组大鼠血清白蛋白含量在术后12 h显著回升(P<0.05),即U50488H可延缓大鼠因感染性休克所致血清白蛋白含量下降;U50488H的这一效应可被κ-阿片受体拮抗剂nor-BNI所阻断(P<0.01)。见表 1。
| 组别 | 关腹时baseline | 术后3 h | 术后6 h | 术后12 h |
| 假手术组 | 43.98±3.9 | 41.52±3.6 | 40.03±3.6 | 36.04±4.7 |
| 感染性休克组 | 43.12±4.9 | 39.88±5.3 | 32.23±3.9a | 26.30±3.8a |
| U50488H+感染性休克组 | 44.39±5.0 | 39.87±4.2 | 34.07±3.9 | 31.34±3.6b |
| nor-BNI+U50488H+感染性休克组 | 43.63±4.7 | 37.26±4.7 | 31.83±3.9 | 25.36±3.4c |
| nor-BNI+感染性休克组 | 45.18±3.7 | 38.37±3.7 | 31.96±3.7 | 27.73±4.1 |
| 注:与假手术组比较,aP<0.01;与感染性休克组比较,bP<0.05;与U50488H+感染性休克组比较,cP<0.01 | ||||
与假手术组相比,感染性休克组大鼠血清cTnI和NT-pro BNP含量在术后3 h、6 h和12 h均显著升高(P<0.01)。与感染性休克组相比,U50488H+感染性休克组大鼠血清cTnI含量在术后3 h、6 h和12 h均显著降低(P<0.05)(P<0.01);血清NT-pro BNP含量在术后6 h和12 h均显著升高(P<0.01)。U50488H的上述效应可被κ-阿片受体拮抗剂nor-BNI所阻断(P<0.01)。见表 2-3。
| 组别 | 关腹时baseline | 术后3 h | 术后6 h | 术后12 h |
| 假手术组 | 3.93±0.3 | 4.06±0.4 | 4.12±0.5 | 4.60±0.4 |
| 感染性休克组 | 3.91±0.6 | 6.65±0.8** | 10.45±0.7a | 14.78±0.7a |
| U50488H+感染性休克组 | 3.84±0.2 | 5.80±0.6b | 8.67±0.8c | 11.70±0.8c |
| nor-BNI+U50488H+感染性休克组 | 3.83±0.5 | 6.89±0.4d | 10.41±0.5d | 15.31±0.6d |
| nor-BNI+感染性休克组 | 4.07±0.8 | 6.71±0.8 | 10.64±0.6 | 15.01±0.7 |
| 注:与假手术组比较,aP<0.01;与感染性休克组比较,bP<0.05,cP<0.01;与U50488H+感染性休克组比较,dP<0.01 | ||||
| 组别 | 关腹时baseline | 术后3 h | 术后6 h | 术后12 h |
| 假手术组 | 438.3±36.8 | 449.0±47.6 | 456.9±43.8 | 498.0±59.3 |
| 感染性休克组 | 468.4±68.6 | 1521.0±107.9a | 1896.0±103.6a | 2012.0±103.7a |
| U50488H+感染性休克组 | 430.5±42.2 | 1395.0±119.0 | 1630.0±121.6b | 1777.0±100.3b |
| nor-BNI+U50488H+感染性休克组 | 520.5±50.8 | 1482.0±102.8 | 1835.0±106.3c | 2025.0±110.8c |
| nor-BNI+感染性休克组 | 488.4±68.2 | 1526.0±103.7 | 1830.0±133.7 | 1945.0±123.7 |
| 注:与假手术组比较,aP<0.01;与感染性休克组比较,bP<0.01;与U50488H+感染性休克组比较,cP<0.01 | ||||
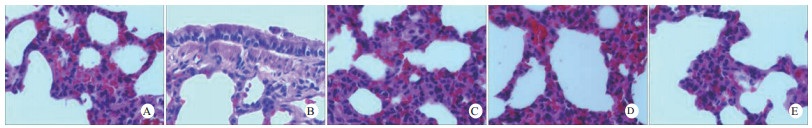
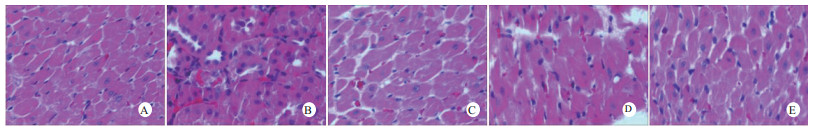
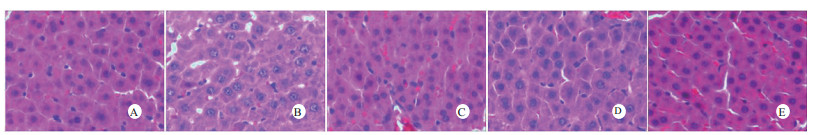
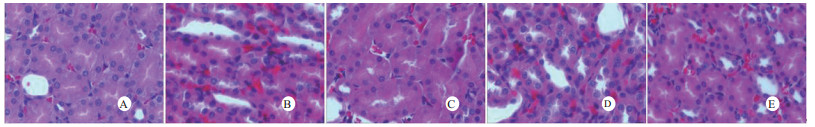
光镜下可见,假手术组肺泡大小形态均匀,结构清晰,肺泡腔内无出血和白细胞浸润;感染性休克组肺泡壁破坏严重,血管壁和肺泡间隔明显增厚;U50488H+感染性休克组大部分肺泡腔均匀一致,肺间隔略增厚,肺泡壁轻度水肿,但出血和白细胞浸润情况比感染性休克组明显减轻(图 1)。假手术组心肌细胞大小一致,排列整齐,核浆比正常,心肌细胞核呈椭圆型,胞浆均匀红染;感染性休克组心肌细胞肿胀,体积明显增大,细胞核大而异型,核内染色质固缩、边集,白细胞浸润明显增加;U50488H+感染性休克组多数心肌细胞形态相对正常,少数心肌细胞呈现脂肪变性(图 2)。假手术组肝细胞结构完整,肝小叶形态正常;感染性休克组肝细胞显著肿胀、呈空泡样和点状/小片状坏死;U50488H+感染性休克组肝细胞轻度肿胀,未见明显坏死灶、肝血窦扩张和炎性细胞浸润(图 3)。假手术组肾组织结构大致正常;感染性休克组肾小管细胞轻度水肿、空泡变性;U50488H+感染性休克组肾小管形态大致正常,间质无明显出血水肿(图 4)。
|
| A:假手术组,B:感染性休克组,C:U50488H+感染性休克组,D:nor-BNI+U50488H+感染性休克组,E:nor-BNI+感染性休克组 图 1 各组光镜下肺组织病理学改变(HE×400) Fig 1 Histopathological features of lung(HE×400) |
|
|
|
| A:假手术组,B:感染性休克组,C:U50488H+感染性休克组,D:nor-BNI+U50488H+感染性休克组,E:nor-BNI+感染性休克组 图 2 各组光镜下心肌组织病理学改变(HE×400) Fig 2 Histopathological features of myocardium(HE×400) |
|
|
|
| A:假手术组,B:感染性休克组,C:U50488H+感染性休克组,D:nor-BNI+U50488H+感染性休克组,E:nor-BNI+感染性休克组 图 3 各组光镜下肝组织病理学改变(HE×400) Fig 3 Histopathological features of liver(HE×400) |
|
|
|
| A:假手术组,B:感染性休克组,C:U50488H+感染性休克组,D:nor-BNI+U50488H+感染性休克组,E:nor-BNI+感染性休克组 图 4 U50488H对感染性休克肾组织形态的影响(HE×400) Fig 4 Histopathological features of kidney(HE×400) |
|
|
扫描电镜下可见,假手术组肺泡形态完整,肺泡壁光滑;感染性休克组肺泡明显压缩畸形,肺泡隔肿胀、扭曲、隆起;U50488H+感染性休克组肺泡形态大致完整,少数肺泡壁肿胀受损(图 5)。透射电镜下可见,假手术组心肌细胞形态正常;感染性休克组心肌细胞溶解、坏死、肌纤维断裂;U50488H+感染性休克组心肌细胞大致正常,无明显坏死(图 6)。假手术组肝细胞形态正常,毛细胆管未见扩张;感染性休克组肝细胞大片坏死,毛细胆管明显扩张;U50488H+感染性休克组肝细胞形态大致正常,毛细胆管略扩张(图 7)。假手术组肾小管上皮细胞形态狭长,核卵圆形,位于基底部;感染性休克组肾小管上皮断裂,微绒毛缺失;U50488H+感染性休克组肾小管上皮细胞大致正常,微绒毛不平滑,但无明显坏死(图 8)。
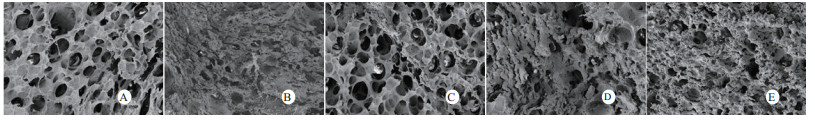
|
| A:假手术组,B:感染性休克组,C:U50488H+感染性休克组,D:nor-BNI+U50488H+感染性休克组,E:nor-BNI+感染性休克组 图 5 肺组织扫描电镜观察(×200) Fig 5 Scanning electronic microscopic photos of lung(×200) |
|
|
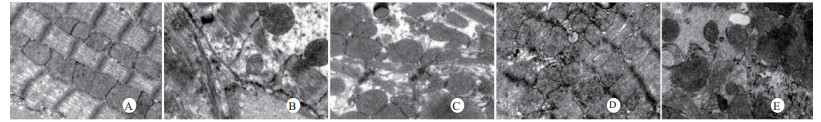
|
| A:假手术组,B:感染性休克组,C:U50488H+感染性休克组,D:nor-BNI+U50488H+感染性休克组,E:nor-BNI+感染性休克组 图 6 心肌细胞透射电镜检查(×10 000) Fig 6 Transmission electronic microscopic photos of myocardial cell(×10 000) |
|
|
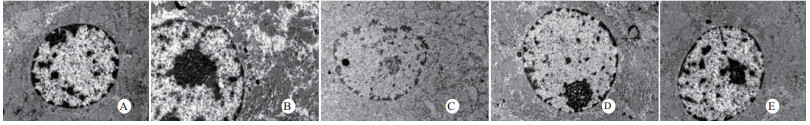
|
| A:假手术组,B:感染性休克组,C:U50488H+感染性休克组,D:nor-BNI+U50488H+感染性休克组,E:nor-BNI+感染性休克组 图 7 肝细胞透射电镜检查(×10 000) Fig 7 Transmission electronic microscopic photos of liver(×10 000) |
|
|
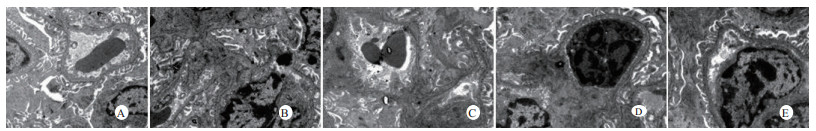
|
| A:假手术组,B:感染性休克组,C:U50488H+感染性休克组,D:nor-BNI+U50488H+感染性休克组,E:nor-BNI+感染性休克组 图 8 肾组织透射电镜检查(×15 000) Fig 8 Transmission electronic microscopic photos of kidney(×15 000) |
|
|
近年来临床实践认为,低蛋白血症可提示机体处于炎症状态[7],监测血清白蛋白水平可辅助判断感染性休克患者病情及预后[8]。因此国内外学者将白蛋白应用于休克、烧伤、大出血等的治疗中[9-10]。本研究验证了感染性休克时血清白蛋白含量逐渐下降,同时发现,预先给予U50488H可减轻感染性休克大鼠血清白蛋白下降,而该效应可被κ-阿片受体拮抗剂nor-BNI所阻断。
严重脓毒症和感染性休克患者常出现心功能障碍,心肌细胞受损时,心肌肌钙蛋白I(cTnI)释放入血,可反映心肌细胞受损及心功能障碍的危重程度。心衰时脑钠肽(BNP)常大量释放入血,被认为是心室功能障碍的特异性指标。NT-pro BNP是BNP激素原分裂后的N-末端片段,比BNP半衰期更长,更加稳定,故常用于临床试验监测[11]。本研究发现感染性休克大鼠血清cTnI和NT-pro BNP含量随休克时间延长而不断升高,提示感染性休克时心肌细胞不断受损,预先给予U50488H可减轻感染性休克大鼠心功能障碍程度,该效应可被κ-阿片受体拮抗剂nor-BNI所阻断。
本研究还进一步观察了感染性休克大鼠重要脏器的病理学变化与超微结构。结果发现,感染性休克时,肺泡壁破坏严重,血管壁和肺泡间隔明显增厚,炎症细胞浸润较多,肺泡明显压缩畸形,肺泡隔肿胀,扭曲,隆起。该结果与潘景业等的报道一致。同时实验发现,U50488H可减轻感染性休克肺泡壁出血水肿与肺组织炎性细胞浸润,抑制肺间隔增厚。实验还观察到感染性休克大鼠心肌纤维肿胀、扭曲、断裂、溶解,并由此导致心功能障碍。U50488H亦可减轻线粒体肿胀崩解和心肌细胞溶解与坏死,可能与U50488H减轻心肌抑制有关[12],具体机制与分子通路尚需进一步实验验证。本研究还观察到感染性休克大鼠肝细胞出现肿胀、空泡样脂肪变性和点状/小片状坏死,毛细胆管明显增多、扩张;肾小管细胞轻度水肿、空泡变性,肾小管上皮细胞微绒毛缺失,细胞崩解,肾小管上皮断裂。预先给予U50488H可显著减轻感染性休克肝细胞浊肿、肝血窦扩张和炎性细胞浸润;抑制肾小管上皮细胞核变形、微绒毛坏死和间质出血水肿。nor-BNI可阻断这一效应。上述结果均提示U50488H可通过激动κ-阿片受体,改善肝脏和肾脏血流量保护感染性休克肝脏和肾脏功能,具体机制可能和细胞凋亡等相关。
| [1] | 孔夏, 张新超. 血清可溶性ST2对脓毒症预后的判断价值研究[J]. 中华急诊医学杂志, 2018, 27(4): 394-398. DOI:10.3760/cma.j.issn.1671-0282.2018.04.012 |
| [2] | 王明, 李霞, 赵丽萍, 等. 炎症因子相关基因在创伤失血性休克中的研究进展[J]. 现代生物医学进展, 2018, 18(4): 787-790. DOI:10.13241/j.cnki.pmb.2018.04.042 |
| [3] | 宋琦, 徐志鹏, 王振杰, 等. 醋酸钠林格液对休克大鼠肺炎性介质及其信号通路的影响[J]. 中华急诊医学杂志, 2018, 27(6): 638-644. DOI:10.3760/cma.j.issn.1671-0282.2018.06.014 |
| [4] | 李敏, 郝东, 王涛, 等. 多糖包被在感染性休克中的变化及临床意义[J]. 中华危重病急救医学, 2016, 28(8): 699-703. DOI:10.3760/cma.j.issn.2095-4352.2016.08.006 |
| [5] | 高戈, 冯喆. 外科脓毒症及脓毒性休克现状与展望[J]. 中华实验外科杂志, 2015, 32(2): 232-234. DOI:10.3760/cma.j.issn.1001-9030.2015.02.006 |
| [6] | Chaudry IH, Wichterman KA, Baue AE. Effect of sepsis on tissue adenine nucleotide levels[J]. Surgery, 1979, 85(2): 205-211. |
| [7] | 潘田君, 杨玲飞. 感染性休克伴急性肾损伤的危险因素及其预后相关因素分析[J]. 中国现代医学杂志, 2017, 27(17): 98-102. DOI:10.3969/j.issn.1005-8982.2017.17.021 |
| [8] | 孙荣青, 孙小鸽, 杨宏富, 等. 血清C-反应蛋白/白蛋白比值评估成人脓毒症患者预后的回顾性研究[J]. 中华危重病急救医学, 2016, 28(5): 413-417. DOI:10.3760/cma.j.issn.2095-4352.2016.05.007 |
| [9] | 金茂.血清白蛋白在腔内碎石术致脓毒血症中的变化规律及其临床意义[D].杭州: 浙江大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10335-1016283133.htm |
| [10] | 宋琦, 王振杰. MAPK信号转导通路与失血性休克相关性的研究进展[J]. 中国急救医学, 2018, 38(8): 684-689. DOI:10.3969/j.issn.1002-1949.2018.08.009 |
| [11] | 曾举浩, 刘新强, 江稳强, 等. 重组人脑利钠肽对感染性休克患者心功能的动态影响[J]. 中华急诊医学杂志, 2016, 25(10): 1263-1267. DOI:10.3760/cma.j.issn.1671-0282.2016.10.010 |
| [12] | 王力军, 寿松涛, 柴艳芬, 等. 胞外组蛋白在脓毒症及其心肌抑制机制研究进展[J]. 中华急诊医学杂志, 2018, 27(1): 111-114. DOI:10.3760/cma.j.issn.1671-0282.2018.01.023 |
 2019, Vol. 28
2019, Vol. 28




