急性肾损伤(acute kidney injury, AKI)是危重症患者最常见的并发症之一,导致住院病死率增加、住院时间延长和慢性肾脏病风险增加[1-3]。目前临床上尚缺乏对AKI预后进行早期风险评估和准确预测的可靠指标,导致精准化预防措施和干预策略的延迟,不利于改善AKI患者的预后。以往研究结果提示,血清肌酐(serum creatinine, sCr)水平增加可导致AKI患者病死率明显增加,且与sCr增加程度相关[4-5]。本研究探讨不同时刻sCr水平对ICU危重症患者AKI临床预后的影响,期望为预测和改善AKI预后提供临床依据。
1 资料与方法 1.1 一般资料回顾性收集2015年3月至2016年1月入住南方医科大学附属小榄医院ICU进行监护治疗的AKI患者临床资料。AKI诊断标准参考2012年《KDIGO急性肾损伤临床实践指南》[6],即48 h内血清肌酐水平升高≥0.3 mg/dL(≥26.5 μmol/L)或超过基础值的1.5倍,且明确或经推断上述情况发生在7 d之内; 或持续6 h尿量 < 0.5 mL/(kg·h)。
排除标准:慢性肾脏病终末期; 入ICU前透析史; 近一年内接受器官移植; 怀孕; 年龄 < 18岁; 入住时间 < 24 h; 相关资料不全者。
收集入选患者的性别、年龄等人口学特征资料和基础疾病(包括高血压、糖尿病等),记录入ICU 24 h的急性生理与慢性健康评分Ⅱ(APACHEⅡ)、每小时尿量、肾脏替代治疗及机械通气等临床资料。追踪此次住院的转归,随访28 d肾功能情况。所有患者治疗前均得到患者或家属签署知情同意书。
1.2 sCr的收集方法收集和记录不同时刻点的sCr检测值,包括基线sCr(b-sCr)、入ICU时sCr(a-sCr)、出ICU时sCr(o-sCr)和住ICU期间sCr峰值(p-sCr)。sCr由本院检验科采用酶法进行检测。
1.3 观察指标包括住院死亡、住院期间肾脏替代治疗以及28 d肾功能情况。28 d肾功能情况指入ICU后开始第28天的肾功能情况,包括:28 d肾功能恢复(定义为sCr下降至发生AKI前的基础水平或较基础水平升高 < 26.4 mmol/L,或上升幅度 < 50%)和28 d肾功能丢失(定义为sCr较基础水平上升 > 26.4 mmol/L,或上升幅度 > 50%,或需要维持性血液透析、腹膜透析或肾移植)[7]。
1.4 统计学方法应用SPSS 17.0和Medical统计软件进行统计分析。正态分布的计量资料用均数±标准差(Mean±SD)表示,非正态分布的计量资料以中位数(四分位数)[M(P25, P75)]表示,两组间比较比较采用Mann-Whitney U检验。计数资料以频数(百分率)表示,组间比较采用Fisher精确检验或χ2检验。使用ROC曲线比较不同时刻sCr水平预测AKI患者预后的能力。以P < 0.05为差异有统计学意义。
2 结果 2.1 基本情况共入选危重症AKI患者85例,其中男性68例,女性17例,年龄66(48, 78)岁,合并高血压病49例(57.6%),合并糖尿病17例(20.0%),APACHEⅡ评分为25(20, 32)分。b-sCr、a-sCr、o-sCr和p-sCr分别为72(67, 91.5) μmol/L、99(85, 127) μmol/L、88(68, 145) μmol/L和136(113, 208) μmol/L。整个AKI人群的住院病死率为20.0%,肾脏替代治疗率为15.3%,28 d肾功能丢失率为31.8%。
2.2 组间不同时刻sCr水平比较肾脏替代治疗组o-sCr和p-sCr明显高于非肾脏替代治疗组(P < 0.01),但两组间b-sCr和a-sCr差异无统计学意义(P > 0.05)。28 d肾功能丢失组的b-sCr、a-sCr、o-sCr和p-sCr均明显高于28 d肾功能恢复组(P < 0.05)。死亡组的o-sCr和p-sCr明显高于住院存活者(P < 0.05),但两组间b-sCr和a-sCr差异无统计学意义(P > 0.05),见表 1~3。
| 指标 | 肾脏替代治疗组(n=13) | 非肾脏替代治疗组(n=72) | 统计值 | P值 |
| 年龄(岁)a | 73(64, 82) | 63(46, 76.8) | -1.163 | 0.103 |
| 男性(例, %) | 11(84.6) | 57(79.2) | - | 1.000b |
| 糖尿病(例, %) | 2(15.4) | 15 (20.8) | - | 1.000b |
| 高血压病(例, %) | 6(46.2) | 43(59.7) | 0.830 | 0.362 |
| b-sCr(μmol/L)a | 80(69.0, 95.5) | 72(66.0, 91.5) | -0.824 | 0.410 |
| a-sCr(μmol/L)a | 114(93.5, 206.0) | 97.5(81.5, 125.0) | -1.667 | 0.096 |
| o-sCr(μmol/L)a | 186 (116.0, 275.0) | 81(66.3, 117.0) | -3.493 | < 0.01 |
| p-sCr(μmol/L)a | 275(162.5, 488.0) | 133.5(107.3, 196.3) | -3.804 | < 0.01 |
| APACHEⅡ评分a | 35(28, 38) | 25(18, 30) | -3.406 | 0.001 |
| 注:a为M(P25, P75); b代表用Fisher精确检验 | ||||
| 指标 | 肾功能丢失组(n=27) | 肾功能恢复组(n=58) | 统计值 | P值 |
| 年龄(岁)a | 66(46, 80) | 65.5(49.5, 77.5) | -0.113 | 0.910 |
| 男性(例, %) | 23(85.2) | 45(77.6) | 0.665 | 0.415 |
| 糖尿病(例, %) | 8(29.6) | 9 (15.5) | - | 0.130b |
| 高血压病(例, %) | 18(66.7) | 31(53.4) | 1.318 | 0.251 |
| b-sCr(μmol/L)a | 87(71, 108) | 69.5(65.8, 79.8) | -3.461 | 0.001 |
| a-sCr(μmol/L)a | 125(108, 236) | 93(79.5, 109.3) | -3.833 | < 0.01 |
| o-sCr(μmol/L)a | 159(108, 262) | 72.5(64.5, 100.0) | -5.174 | < 0.01 |
| p-sCr(μmol/L)a | 203(139, 331) | 122(106.3, 160.3) | -4.178 | < 0.01 |
| APACHEⅡ评分a | 28(24, 37) | 25(19, 29) | -2.297 | 0.022 |
| 注:a为M(P25, P75); b代表用Fisher精确检验 | ||||
| 指标 | 死亡组(n=17) | 存活组(n=68) | 统计值 | P值 |
| 年龄(岁)a | 74(53, 85) | 63(46.5, 76.8) | -1.802 | 0.071 |
| 男性(例, %) | 14(82.4) | 54(79.4) | - | 1.000b |
| 糖尿病(例, %) | 4(23.5) | 13 (19.1) | - | 0.738b |
| 高血压病(例, %) | 11(64.7) | 38(55.9) | 0.434 | 0.510 |
| b-sCr(μmol/L)a | 83(68.5, 98.7) | 71.5(66.3, 87.0) | -1.209 | 0.227 |
| a-sCr(μmol/L)a | 103(87.0, 126.5) | 98(85.0, 132.5) | -0.418 | 0.676 |
| o-sCr(μmol/L)a | 158(114.5, 238) | 77.5(66.3, 110.3) | -3.769 | < 0.01 |
| p-sCr(μmol/L)a | 179(138.5, 241.5) | 133.5(107.3, 202.5) | -2.209 | 0.027 |
| APACHEⅡ评分a | 31(28.0, 37.5) | 24(18, 29) | -3.747 | < 0.01 |
| 注:a为M(P25, P75); b代表用Fisher精确检验 | ||||
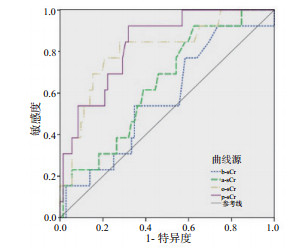
o-sCr和p-sCr均具有较好的预测AKI患者住院期间肾脏替代治疗的效能,AUC分别为0.806(95%CI:0.705~0.883)和0.833(95%CI:0.736~0.905),敏感度分别为0.846和0.923, 特异度分别为0.722和0.681。而b-sCr和a-sCr预测肾脏替代治疗的效能较差,AUC均 < 0.7,见图 1和表 4。
|
| 图 1 不同时刻血肌酐值预测AKI患者住院肾脏替代治疗的ROC曲线 Fig 1 ROC curves for predicting in-hospital RRT by sCr at different time-points |
|
|
| 指标 | AUC(95%CI) | 截断值(μmol/L) | 敏感度 | 特异度 |
| 预测住院RRT | ||||
| b-sCr | 0.572 (0.460~0.679) | 79 | 0.538 | 0.653 |
| a-sCr | 0.646(0.535~0.747) | 90 | 0.923 | 0.375 |
| o-sCr | 0.806(0.705~0.883) | 107 | 0.846 | 0.722 |
| p-sCr | 0.833 (0.736~0.905) | 149 | 0.923 | 0.681 |
| 预测28 d肾功能丢失 | ||||
| b-sCr | 0.734 (0.627~0.824) | 77 | 0.704 | 0.741 |
| a-sCr | 0.759(0.654~0.845) | 115 | 0.741 | 0.828 |
| o-sCr | 0.850(0.756~0.918) | 119 | 0.741 | 0.879 |
| p-sCr | 0.783 (0.680~0.865) | 123 | 0.963 | 0.517 |
| 预测住院死亡 | ||||
| b-sCr | 0.595 (0.483~0.700) | 79 | 0.704 | 0.741 |
| a-sCr | 0.533(0.421~0.642) | 94 | 0.741 | 0.828 |
| o-sCr | 0.797(0.696~0.876) | 97 | 0.741 | 0.879 |
| p-sCr | 0.674 (0.564~0.772) | 136 | 0.824 | 0.588 |
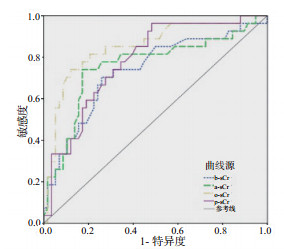
与b-sCr、a-sCr及p-sCr相比,o-sCr具有最佳的预测28 d肾功能丢失的效能,AUC为0.850,95%CI:0.756~0.918,截断值为119 μmol/L,敏感度为0.741,特异度为0.879,见图 2和表 4。
|
| 图 2 不同时刻血肌酐值预测AKI患者28 d肾功能丢失的ROC曲线 Fig 2 ROC curves for predicting renal loss at 28 days by sCr at different time-points |
|
|
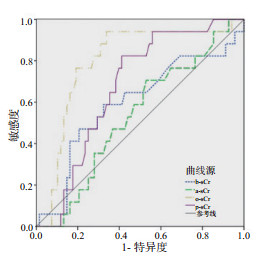
o-sCr具有最佳的预测AKI患者住院死亡的效能,AUC为0.797,95%CI:0.696~0.876,截断值为97 μmol/L,敏感度为0.941,特异度为0.662;而b-sCr、a-sCr、p-sCr预测住院死亡的效能均较差,AUC均 < 0.7,见图 3和表 4。
|
| 图 3 不同时刻血肌酐值预测AKI患者住院死亡的ROC曲线 Fig 3 ROC curves for predicting in-hospital mortality by sCr at different time-points |
|
|
AKI是指肾功能在短时间内急剧下降[8],危重症患者并发AKI后将导致不良结局[1-3]。尽管AKI相关的基础和临床研究取得了一定进展,肾脏替代治疗技术得以推广,但AKI的病死率仍然居高不下[9-12],发生慢性肾脏病甚至终末期肾病的风险较高[7, 13-15]。早期对AKI患者预后进行风险评估和预测,尽早采取精准化的预防措施或干预策略,将有助于改善AKI患者的预后。本研究结果显示,动态检测不同时刻sCr水平对危重症AKI患者住院肾脏替代治疗、住院死亡和28 d肾功能丢失等临床预后具有较好的预测价值。
新型标志物用于预测AKI临床预后的研究日渐增多,但研究结论报道不一[16-17]。例如,Bell等[18]研究提示,血清胱抑素C具有较好预测AKI肾脏替代治疗和住院病死率的能力,而且是预测住院死亡的独立危险因子。但是,Royakkers等[19]、Bagshaw和Bellomo[20]的研究结论却相反,认为血清胱抑素C对住院死亡及肾脏替代的预测能力十分有限。在其他标志物如中性粒细胞明胶酶相关脂质运载蛋白、白介素-18(IL-18)及肾损伤因子1(KIM-1)等的研究中也出现类似不一致的研究结果。此外,目前多数新型标志物仍处于实验室阶段,或因半衰期较短、检测难度较大、费用较高等原因,未能在临床中真正开展检测和推广应用[21]。
在评估AKI患者肾脏转归方面,一些临床常规检测指标如碳酸氢根离子(HCO3-)[7]、C反应蛋白[22]等, 显示出较好的预测效能。sCr作为评估和判断肾小球滤过功能的主要生物学指标一直被临床使用,sCr的动态变化是AKI诊断的主要依据,而且sCr是AKI预后的基本指标,sCr水平下降,AKI逐渐恢复[23]。本研究发现,危重症AKI患者的o-sCr和p-sCr具有较好的预测AKI患者肾脏预后能力(包括肾脏替代治疗和28 d肾功能恢复情况)。肾脏替代治疗组和28 d肾功能丢失组的o-sCr和p-sCr明显高于非肾脏替代治疗组和28 d肾功能恢复组。进一步的ROC曲线分析结果显示,o-sCr和p-sCr对AKI患者住院期间肾脏替代治疗和28 d肾功能丧失均具有良好的预测作用,提示在危重症患者AKI中应当重视和严密监测sCr的动态变化,尤其是急性期sCr峰值和恢复期sCr水平,而降低这两者水平能否改善肾脏预后,有待进一步研究。
多年前Levy等[24]的研究提示,肌酐的改变可以作为临床上预测术后长期并发症的一个信号。随后Tian等[25]和Engoren等[26]的研究结果显示,肌酐水平的变化与心脏旁路手术后病死率密切相关。进一步的研究发现,sCr水平上升增加可导致AKI患者病死率明显增加,且与肌酐上升程度相关[4-5]。杨艳丽等[27]的研究结果表明,术后肌酐微小升高使体外循环心脏手术患者病死率增加。本研究结果与国内外研究结果[24-27]基本一致,发现死亡组的o-sCr和p-sCr均明显高于存活组(P < 0.05),用ROC曲线检验两者预测效能时,o-sCr具有更好的预测AKI患者住院死亡的效能(AUC为0.797); 而b-sCr、a-sCr的预测效能较差(AUC均 < 0.6)。在多个sCr监测时点中,o-sCr具有最佳的预测AKI患者住院期间死亡的能力,其预测住院死亡的AUC明显高于p-sCr。其可能原因:p-sCr是反映ICU期间AKI的最严重状态,而o-sCr是反映AKI经过液体管理、血液净化等监护治疗后,机体脏器功能趋于稳定时肾功能的真实状态,后者对AKI住院死亡的影响更加直接或接近。
综上所述,动态监测不同时刻sCr水平对预测危重症AKI患者的住院期间肾脏替代治疗、28 d肾功能丢失情况和住院死亡等临床预后具不可忽视的临床价值。由于本研究为单中心研究,样本量较小,具有一定的局限性,有待多中心、大样本的随机对照试验进一步验证。
| [1] | Yang X, Chen C, Tian J, et al. Urinary angiotensinogen level predicts aki in acute decompensated heart failure: a prospective, two-stage study[J]. J Am Soc Nephrol, 2015, 26(8): 2032-2041. DOI:10.1681/asn.2014040408 |
| [2] | Coca SG, Singanamala S, Parikh CR. Chronic kidney disease after acute kidney injury: a systematic review and meta-analysis[J]. Kidney Int, 2012, 81(5): 442-448. DOI:10.1038/ki.2011.379 |
| [3] | 许华, 王兵, 王勇强. 急性肾损伤的早期诊断和治疗热点及新进展[J]. 中华急诊医学杂志, 2017, 26(9): 992-994. DOI:10.3760/cma.j.issn.1671-0282.2017.09.003 |
| [4] | Howell NJ, Freemantle N, Bonser RS, et al. Subtle changes in renal function are associated with differences in late survival following adult cardiac surgery[J]. Eur J Cardiothorac Surg, 2012, 41(4): e38-42. DOI:10.1093/ejcts/ezr329 |
| [5] | Tolpin DA, Collard CD, Lee VV, et al. Subclinical changes in serum creatinine and mortality after coronary artery bypass grafting[J]. Thorac Cardiovasc Surg, 2012, 143(3): 682-688. DOI:10.1016/j.jtcvs.2011.09.044 |
| [6] | McCullough PA, Shaw AD, Haase M, et al. Diagnosis of acute kidney injury using functional and injury biomarkers: workgroup statements from the tenth Acute Dialysis Quality Initiative Consensus Conference[J]. Contrib Nephrol, 2013, 182: 13-29. DOI:10.1159/000349963 |
| [7] | 王春林, 谢园园, 王琴, 等. 血HCO3-浓度预测急性肾损伤后肾脏的长期预后[J]. 中华肾脏病杂志, 2014, 30(10): 732-738. DOI:10.3760/cma.j.issn.1001-7097.2014.10.002 |
| [8] | 黄曼, 耿婷婷. 急性肾损伤的研究进展[J]. 中华急诊医学杂志, 2017, 26(9): 986-991. DOI:10.3760/cma.j.issn.1671-0282.2017.09.002 |
| [9] | Uchino S, Kellum JA, Bellomo R, et al. Acute renal failure in critically ill patients: a multinational, multicenter study[J]. JAMA, 2005, 294(7): 813-818. DOI:10.1001/jama.294.7.813 |
| [10] | Lins RL, Elseviers M, Daelemans R, et al. Prognostic value of a new scoring system for hospital mortality in acute renal failure[J]. Clin Nephrol, 2010, 53: 10-17. DOI:10.1159/000060049 |
| [11] | 池锐彬, 梁美华, 邹启明, 等. 血清胱抑素C联合APACHEⅡ评分预测脓毒症急性肾损伤的临床研究[J]. 中华急诊医学杂志, 2018, 27(10): 1136-1141. DOI:10.3760/cma.j.issn.1671-0282.2018.10.015 |
| [12] | 朱建刚, 张茂. 严重创伤后发生急性肾损伤并接受肾脏替代治疗患者的临床特点分析[J]. 中华危重病急救医学, 2015, 27(5): 349-353. DOI:10.3760/cma.j.issn.2095-4352.2015.05.006 |
| [13] | Ponte B, Felipe C, Muriel A, et al. Long-term functional evolution after an acute kidney injury: a 10-year study[J]. Nephrol Dial Trauspl, 2008, 23(12): 3859-3866. DOI:10.1093/ndt/gfn398 |
| [14] | Swaminathan M, Shaw AD, Phillips-Bute BG, et al. Trends in acute renal failure associated with coronary artery bypass graft surgery in the United States[J]. Crit Care Med, 2007, 35(10): 2286-2291. DOI:10.1097/01.ccm.0000282079.05994.57 |
| [15] | Coca SG, Yusuf B, Shlipak MG, et al. Long-term risk of mortality and other adverse outcomes after acute kidney injury: a systematic review and meta-analysis[J]. Am J Kidney Dis, 2009, 53(6): 961-973. DOI:10.1053/j.ajkd.2008.11.034 |
| [16] | 吴晓玉, 陈云霞, 何新华. 急性肾损伤的新型生物标记物[J]. 中华急诊医学杂志, 2014, 23(5): 587-591. DOI:10.3760/cma.j.issn.1671-0282.2014.05.031 |
| [17] | Siew E, Ware L, Bian A, et al. Distinct injury markers for the early detection and prognosis of incident acute kidney injury in critically ill adults with preserved kidney function[J]. Kidney Int, 2013, 84(4): 786-794. DOI:10.1038/ki.2013.174 |
| [18] | Bell M, Granath F, Martensson J, et al. Cystatin C is correlated with mortality in patients with and without acute kidney injury[J]. Nephrol Dial Transplant, 2009, 24(10): 3096-3102. DOI:10.1093/ndt/gfp196 |
| [19] | Royakkers AA, Korevaar JC, van Zuijlen JD, et al. Serum and urine cystatin C are poor biomarkers for acute kidney injury and renal replacement therapy[J]. Intensive Care Med, 2011, 37(3): 493-501. DOI:10.1007/s00134-010-2087-y |
| [20] | Bagshaw SM, Bellomo R. Cystatin C in acute kidney injury[J]. Curr Opin Crit Care, 2010, 16(6): 533-539. DOI:10.1097/mcc.0b013e32833e8412 |
| [21] | Bonventre JV. Kidney injury molecule-1(KIM-1):a urinary biomarker and much more[J]. Nephrol Dial Transpl, 2009, 24(11): 3265-3268. DOI:10.1093/ndt/gfp010 |
| [22] | Xie Q, Zhou Y, Xu Z, et al. The ratio of CRP to prealbumin levels predict mortality in patients with hospital-acquired acute kidney injury[J]. BMC Nephrol, 2011, 12: 30. DOI:10.1186/1471-2369-12-30 |
| [23] | 刘颖, 陈红. 急性肾损伤预后相关指标的研究进展[J]. 医学综述, 2012, 18(2): 253-255. DOI:10.3969/j.issn.1006-2084.2012.02.033 |
| [24] | Levy EM, Viscoli CM, Horwitz RI. The effect of acute renal failure on mortality-A cohort analysis[J]. JAMA, 1996, 275(19): 1489-1494. DOI:10.1001/jama.1996.03530430033035 |
| [25] | Tian J, Barrantes F, Amoateng-Adjepong Y, et al. Rapid reversal of acute kidney injury and hospital outcomes:a retrospective cohort study[J]. Am J Kidney Dis, 2009, 53(6): 974-981. DOI:10.1053/j.ajkd.2009.02.007 |
| [26] | Engoren M, Habib RH, Arslanian-Engoren C, et al. The effect of acute kidney injury and discharge creatinine level on mortality following cardiac surgery[J]. Crit Care Med, 2014, 42(9): 2069-2074. DOI:10.1097/CCM.0000000000000409 |
| [27] | 杨艳丽, 马骏, 卿恩明, 等. 术后肌酐微小升高对体外循环下心脏手术患者预后的影响[J]. 中华麻醉学杂志, 2016, 36(3): 263-266. DOI:10.3760/cma.j.issn.0254-1416.2016.03.003 |
 2019, Vol. 28
2019, Vol. 28




